六倍体小麦TaHKT2;2基因的克隆与多样性分析
2018-01-27李孟军李亚青张士昌史占良
李孟军,李亚青,张士昌,张 楠,史占良
(石家庄市农林科学研究院/河北省小麦工程技术中心,河北 石家庄 050041)
土壤盐渍化是一个全球性问题,能引起作物大幅减产。盐害的主要形式之一是高Na+胁迫。因此,植物维持体内Na+/K+平衡的能力与其耐盐性密切相关。高亲和性钾转运蛋白(HKT)基因家族中的一些成员是已确证的植物Na+转运蛋白。因此,植物HKT基因家族成员在维持植物体内Na+/K+平衡方面扮演着极其重要的角色。
Schachtman等[1]利用酵母突变菌株(CY162)首次从六倍体小麦根cDNA文库中克隆了HKT1(HKT2;1),该基因编码一个高亲和性钾转运蛋白。后续工作证明,TaHKT1在酵母和爪蟾卵母细胞中具有高亲和性 K+/Na+协同转运蛋白特征;在高浓度外源Na+情况下,TaHKT1也具有低亲和性Na+转运蛋白特性[2-3]。
根据小麦TaHKT2;1 cDNA序列,Uozumi等[4]从拟南芥中克隆了HKT1(AtHKT1;1)。爪蟾卵母细胞、酵母和大肠杆菌中的分析数据显示,AtHKT1;1介导Na+的转运,同时,在一定程度上介导K+的转运。在过量表达AtHKT1;1的拟南芥中,Na+在根中大量积累,同时Na+向地上部的转运减少,从而提高了拟南芥的耐盐性。大量研究表明,AtHKT1;1在植物体内的主要作用是避免过量Na+在拟南芥地上部的积累[5-8]。
利用TaHKT2;1 cDNA和Ni-OsHKT2;1 cDNA 做探针,从水稻中克隆了3个HKT2;1同源基因,包括Ni-OsHKT2;1、Po-OsHKT2;1、Po-OsHKT2;2。在氨基酸序列水平上,Ni-OsHKT2;1与 Po-OsHKT2;1序列相同,而与Po-OsHKT2;2的序列一致性为91%[9]。 在水稻日本晴基因组中发现了7个HKT基因和2个假基因,其中,有功能的基因均由3个外显子和2个内含子组成[10]。Ren等[11]利用图位克隆技术从水稻抗盐品种(Nona Bokra)克隆了SKC1。SKC1是决定水稻地上部K+含量的主效QTL,与OsHKT1;5对应。SKC1在水稻抗盐品种(Nona Bokra) 和盐敏感品种(Koshihikari) 之间仅有4个氨基酸差异。OsHKT2;1 属于类型Ⅱ HKT 转运蛋白,但是其Na+转运能力与 类型Ⅰ成员类似。根据外源Na+和K+浓度高低,OsHKT2;1表现出不同的通透性:Na+/K+同向运输、Na+单向运输和抑制状态[12]。OsHKT2;2在植物细胞中介导Na+-K+同向运输[13]。No-OsHKT2;2/1 5′端与OsHKT2;2 5′端对应,而其3′端与OsHKT2;1 3′端对应。No-OsHKT2;2/1对Na+和K+表现出强通透性,这与OsHKT2;2类似,但与OsHKT2;1相反[14]。
硬粒小麦(T.turgidumL.subsp.durumDesf.)品系149基因组中具有2个重要耐盐相关基因(Nax1和Nax2),其作用是从叶片中排出Na+。含有Nax1和Nax2的小麦品系表现出从根部到地上部的低水平的Na+转运能力和高水平的K+转运能力。含Nax1小麦株系Na+积聚在叶的基部。Nax2仅在根部发挥作用,其方式类似于普通小麦中的Kna1[15]。TmHKT1;4-A2是1个假定的类OsHKT1;4的Na+转运蛋白基因,该基因是Nax1的候选基因,位于小麦第2染色体的长臂上[16]。Nax2在硬粒小麦5A染色体长臂上的位置与Kna1在普通小麦4D染色体长臂上的位置具有高度共线性。Nax2和Kna1与HKT 基因家族HKT1;5对应[17]。TmHKT1;5-A编码位于质膜上的高亲和性Na+特异性转运蛋白,负责由Nax2位点控制的地上部Na+排斥表型。盐土地上的田间试验表明,TmHKT1;5-A显著降低叶中Na+浓度,将硬粒小麦的产量提高25%[18]。利用品系间常规杂交和分子标记辅助选择技术将Nax1和Nax2转入了六倍体小麦。Nax1和Nax2分别将叶片中Na+降低了50%和30%,而Nax1和Nax2共同作用将叶片中Na+降低了60%。Nax1和Nax2基因具有提高普通小麦的耐盐性的潜力[19]。
Garciadeblás等[10]根据水稻HKT基因家族推测六倍体小麦可能含有18个甚至更多HKT基因,其中6个或者更多HKT序列与HKT2;1类似。但是,普通小麦HKT基因家族除TaHKT2;1和TaHKT1;5外,少见对有关其他成员的报道。为此,在深入分析普通小麦TaHKT2;1和TaHKT1;5的基础上[20-21],克隆了六倍体小麦TaHKT2;2,并对不同来源、不同遗传背景的六倍体小麦TaHKT2;2 基因多样性进行了分析,探讨了TaHKT2;2在小麦人工驯化过程中的演化进程。对TaHKT2;2的研究不仅有助于探讨TaHKT2;2在六倍体小麦耐盐机制中的作用,而且为筛选对Na+耐受性强的TaHKT2;2奠定了基础。
1 材料和方法
1.1 供试材料
矮败中国春基因组BAC文库由1×106个克隆组成,插入片段118 kb,覆盖小麦基因组6.5 倍。粗山羊草(Aegilopstauschii)AL8/78 基因组BAC 文库包含6.5×104个克隆,覆盖粗山羊草基因组1.7 倍。12个普通小麦材料分别为:中国春、小白麦、百农3217、赤小麦、苏麦3号、红袖子、茶淀红、莱州953、内乡188、品春16、偃展1号、Opta 85。
1.2 小麦BAC文库的筛选
根据TaHKT2;1 cDNA序列 (Genbank No.U16709)设计引物筛选矮败中国春和粗山羊草AL8/78基因组BAC文库。以BAC混合池质粒为模板,用引物TaHKT1F/TaHKT1R进行PCR扩增。引物上链: 5′-ATGGGCCGGGTGAAAAGAT-3′;下链:5′-AGGGGACATGAGCGAGCAG-3′。PCR反应程序:94 ℃ 3 min;94 ℃ 45 s,57 ℃ 45 s,72 ℃ 90 s,35个循环。
1.3 TaHKT2;1和 HKT2;2全长cDNA和基因组序列克隆
以含有TaHKT2;2的BAC单克隆质粒为模板,根据TaHKT2;2已克隆片段序列设计测序引物,使用ABI 3730XL DNA Analyzer测序获取TaHKT2;2的5′和 3′末端。重复上述步骤,直至获得TaHKT2;2-B、TaHKT2;2-D、AeHKT2;2基因组序列,包括其5′ 侧翼序列。以普通小麦基因组DNA和cDNA为模板,根据含有TaHKT2;2 基因单克隆BAC质粒测序数据设计引物,扩增TaHKT2;2全长基因组序列和cDNA序列。以普通小麦基因组DNA和cDNA为模板,根据TaHKT2;1 cDNA序列(GenBank No.U16709)设计引物,扩增TaHKT2;1全长基因组序列和cDNA序列。所用引物见表1。
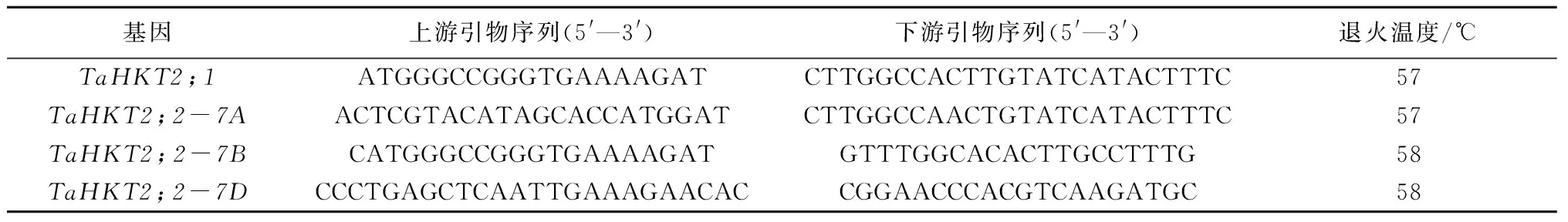
表1 HKT2;1和 HKT2;2扩增引物
1.4 序列分析
使用高纯度小量质粒提取试剂盒(百泰克,北京)提取质粒。测序使用BigDye Terminator v3.1 Cycle Sequencing Kit (ABI) 在 ABI 3730XL DNA Analyzer上进行。核酸序列组装、拼接和比对使用软件Lasergene SeqMan Ⅱ Module(DNAStar;http:/www.DNAStar.com)。多序列比对使用软件 ClustalW1.83 software(http://www.ch.embnet.org/ software/ClustalW.html)。系统发育分析使用软件MEGA3.1。序列着色使用软件BoxShade program (http://www.ch.embnet.org/software/ BOX_form.html)。
2 结果与分析
2.1 小麦基因组BAC文库中HKT阳性克隆的PCR筛选
以矮败中国春499个BAC混合池质粒为模板,通过3轮PCR扩增,从矮败中国春BAC文库中鉴定出7个TaHKT阳性混合池。通过PCR产物克隆测序,在7个混合池中鉴定出3个TaHKT基因组序列,分别命名为TaHKT2;1、TaHKT2;2-7B(Genbank No.KF646595)和TaHKT2;2-7D(Genbank No.KF646596)(表2)。在此基础上,分别从pool-14、pool-88、pool-296中分离了含有TaHKT2;2-7B、TaHKT2;2-7D、TaHKT2;1的BAC单克隆。与预期一致,在粗山羊草Ae.tauschiiAL8/78 BAC 文库中,仅从plate-69上鉴定出1个TaHKT阳性单克隆,命名为AeHKT2;2。
2.2 TaHKT2;1和TaHKT2;2的克隆与序列分析
为了分析六倍体小麦莱州953TaHKT2;2-7D的等位变异,PCR产物TA克隆后,随机挑取了12个克隆进行测序,其中1个克隆插入了2 874 bp的DNA片段。该克隆测序结果表明,插入的DNA片段中含有TaHKT2;2-7A(Genbank No.KF646594)。通过生物信息学分析,预测出TaHKT2;2-D的编码区序列,但通过RT-PCR 技术未能在15个六倍体小麦中克隆该基因的cDNA。通过比较基因组序列与其相应的cDNA序列,揭示了TaHKT2;1和TaHKT2;2的基因结构。TaHKT2;1和TaHKT2;2基因结构相同,均由3个外显子和2个内含子组成,这与水稻的HKT家族研究结果一致[10]。除TaHKT2;2-7D的第2外显子外,TaHKT2;1和TaHKT2;2的3个外显子碱基序列长度相同,4条基因组序列长度不同主要是由内含子的长度差异造成的(图 1)。在推导蛋白的氨基酸序列水平上,TaHKT2;2-7A、TaHKT2;2-7B、TaHKT2;2-7D与TaHKT2;1序列一致性分别为94.2%、92.3%、91.1%,而在核苷酸序列水平上,序列一致性分别89.6%、90.1%、87.9%。在核苷酸序列水平上,TaHKT2;2-7A、TaHKT2;2-7B、TaHKT2;2-7D三者之间的序列一致性在92.5%~94.9%。AeHKT2;2与TaHKT2;2-7D的核苷酸序列一致性为99.8%,而其编码的蛋白氨基酸序列没有差异。

图1 TaHKT2;1和TaHKT2;2结构
对来自短柄草、水稻、六倍体小麦、一粒小麦的18个禾本科HKT基因家族成员的系统进化分析表明,22个HKT序列分为2组(亚族1和亚族2),分别与 HKT命名系统中的类型Ⅰ和类型Ⅱ对应[22](图 2)。HKT2;3/HKT2;4和HKT2;1/HKT2;2两对HKT组成了亚族2,其中HKT2;1/HKT2;2形成了1个进化枝(图 2A)。P-loop结构域和 M2D螺旋对于HKT发挥功能具有重要作用[23],多序列比对结果也表明,禾本科HKT2;1和HKT2;2的P-loop和M2D螺旋高度保守(图 2B)。
Bd.Brachypodium distachyon;Os.Oryza sativa;Ta.T.aestivum;Tm.T.monococcum
2.3 TaHKT2;2的5′侧翼序列克隆与染色体定位
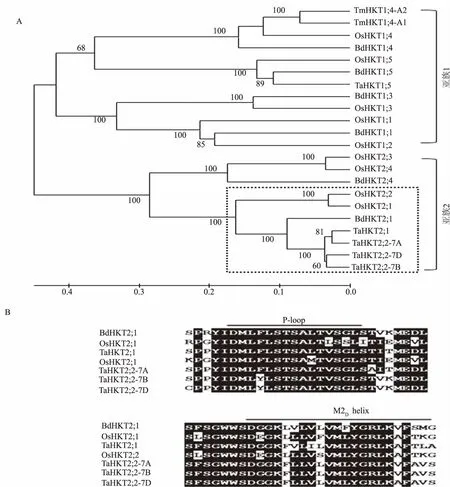
以含有HKT2;2的BAC单克隆质粒为模板,采用引物步行测序方法克隆了TaHKT2;2 的5′侧翼序列。HKT2;1和HKT2;2的5′侧翼序列的差异明显高于其编码区序列。TaHKT2;2-7A与TaHKT2;2-7B的5′侧翼序列的核苷酸序列一致性为84.1%,二者与TaHKT2;2-7D的核苷酸序列一致性分别为44.6%和41.1%(图 3)。 转基因拟南芥GUS染色表明,TaHKT2;2-7A、TaHKT2;2-7B和TaHKT2;2-7D的5′侧翼序列均能启动GUS基因的表达,盐胁迫均能提高GUS基因的表达量。根据TaHKT2;1和TaHKT2;2 5′侧翼序列设计特异引物,可以非常有效地将4条序列区分开。以中国春小麦缺四体为模板,采用PCR方法将TaHKT2;2定位在普通小麦第7同源群上(图4)。

FS1.TaHKT2;1;FS2.TaHKT2;2-7A;FS3.TaHKT2;2-7B;FS4.TaHKT2;2-7D图3 TaHKT2;1和TaHKT2;2 5′侧翼序列比较
1.NT7A7B;2.NT7A7D;3.NT7B7A;4.NT7B7D;5.NT7D7A;6.NT7D7B;7.中国春;8.阴性对照;M.DNA Marker;NT.中国春缺四体图4 TaHKT2;2染色体定位
2.4 TaHKT2;2多样性分析
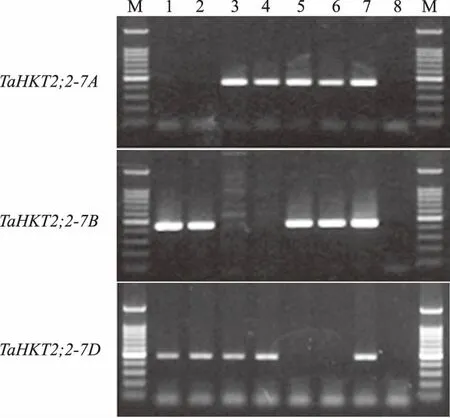
为了研究普通小麦中TaHKT2;2的自然多样性,首先对3个TaHKT2;2序列引物特异性进行了分析。以中国春小麦基因组DNA为模板,仅扩增出1条主带,PCR产物克隆测序表明,TaHKT2;2引物特异扩增目标基因(图5)。以普通小麦基因组DNA为模板,使用高保真Taq酶进行PCR扩增。扩增产物经凝胶电泳分离纯化后,使用载体pGEM-T easy 进行克隆,每个普通小麦PCR 产物随机挑取6个克隆进行测序。测序结果表明,TaHKT2;2引物在12个六倍体小麦基因组DNA中均能特异扩增目标基因,能够用来分析普通小麦TaHKT2;2的多样性。
在12个六倍体小麦中,TaHKT2;2-7A、HKT2;2-7B和TaHKT2;2-7D分别有5、3、2个等位基因,三者各有1个等位基因占主导地位(表 3)。在TaHKT2;2-7A5个等位基因中有4个碱基转换和1个碱基颠换,导致2个带正电荷氨基酸(Y131H、G501R)、1个带负电荷氨基酸(G2D)和1个非极性氨基酸(I27V)的改变。在TaHKT2;2-7B3个等位基因中有5个碱基转换,引起3个氨基酸改变,其中1个为带负电荷氨基酸(G528D)。在TaHKT2;2-7D2个等位基因中检测出1个碱基颠换(G763C)和1个碱基缺失(A640),这些碱基变化破坏了其编码区序列。HKT转运蛋白的P-loop-like结构域高度保守,决定着其底物特异性[23]。在12个普通小麦的TaHKT2;2所有等位基因中,其编码蛋白的P-loop结构域均未发生氨基酸变异。以上结果表明,在驯化过程中TaHKT2;2高度保守,其编码蛋白的P-loop结构域在其功能中占据重要地位。
M.DL2000 plus;1.中国春DNA;2.ddH2O图5 TaHKT2;1和TaHKT2;2 PCR引物特异性分析
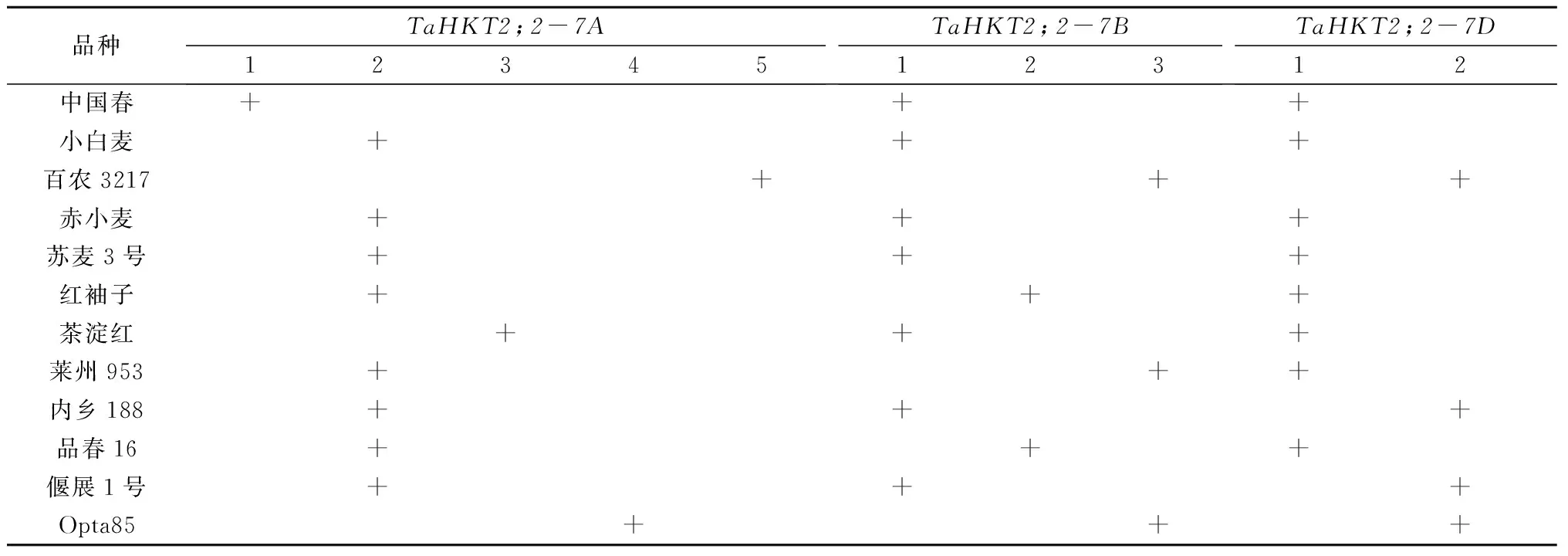
表3 TaHKT2;2 多样性分析
3 结论与讨论
水稻基因组中发现的9个 HKT 基因可分为2个亚族,其中OsHKT2;1、OsHKT2;2、OsHKT2;3和OsHKT2;4在系统进化树上形成1个进化枝(亚族2)。Garciadeblás等[10]推测六倍体小麦基因组中可能含有18个甚至更多HKT基因,其中6个甚至更多的HKT基因与HKT2;1类似。根据TaHKT2;1 cDNA序列,克隆了六倍体小麦的3个TaHKT2;2 序列,TaHKT2;2定位于普通小麦第7同源群。李孟军等[21]利用中国春小麦缺四体和W7984×Opata85将TaHKT2;1定位于7B染色体长臂,因此,该基因应命名为TaHKT2;1-7A(Genbank No.U16709)。到目前为止,利用HKT2;1-7A序列未能在Genbank数据库中检索到其位于7B和7D染色体上的同源序列。如果以上结果得到验证,在六倍体小麦基因组中可能仅有4个与HKT2;1序列相同或类似的HKT序列。
TaHKT2;2与TaHKT2;1具有很高的同源性,但二者存在着不同的表达模式。利用RT-PCR技术,无论盐处理与否,均在中国春、茶淀红、苏麦3号、品春16、红袖子、百农3217、冀麦26和早穗30的根部和叶片中检测到TaHKT2;1的表达,仅在品春16和百农3217的根部和叶片中检测到TaHKT2;2-7A和TaHKT2;2-7B的表达,在所有普通小麦中均未扩增出TaHKT2-7DcDNA。在水稻和拟南芥中的有功能的HKT基因均由3个外显子和2个内含子组成[10]。六倍体小麦HKT基因家族TaHKT2;1、TaHKT2;2、TaHKT1;5 3个成员,与水稻和拟南芥HKT家族成员具有相同的基因结构。在一粒小麦基因组中,HKT1;4有2个拷贝,TmHKT1;4-A1含有2个内含子,但TmHKT1;4-A2仅含有1个内含子。DNA凝胶印迹分析表明,六倍体小麦A、B和 D 亚基因组中可能均含有2个类TmHKT1;4拷贝[16]。这些结果提示,普通小麦HKT家族成员基因结构可能存在着差别。
在分析六倍体小麦TaHKT2;1-7A自然变异的基础上,选取了部分外来种、地方品种和育成种进行TaHKT2;2的等位变异分析[21]。TaHKT2;2在A、B和D基因组上的等位变异数量不同,其中在A基因组上最多,但在3个基因组中均仅有1个等位变异占主导地位,该结果与TaHKT2;1-7A的等位变异分布不同[21]。TaHKT2;2在3个基因组上虽然发生了等位变异,但仅少数几个碱基发生突变,由此导致的氨基酸改变更少。在所有TaHKT2;2等位变异中,均未发生在HKT转运蛋白P-loop结构域中。以上结果表明,TaHKT2;2在小麦驯化过程中高度保守,瓶颈效应明显,属于驯化基因[24]。
[1] Schachtman D P,Schroeder J I.Structure and transport mechanism of a high-affinity potassium uptake transporter from higher plants[J].Nature,1994,370(6491):655-658.
[2] Rubio F,Gassmann W,Schroeder J I.Sodium-driven potassium uptake by the plant potassium transporter HKT1 and mutations conferring salt tolerance[J].Science,1995,270:1660-1663.
[3] Gassman W,Rubio F,Schroeder J I.Alkali cation selectivity of the wheat root high-affinity potassium transporter HKT1[J].The Plant Journal,1996,10(5):869-882.
[4] Uozumi N,Kim E J,Rubio F,etal.TheArabidopsisHKT1 gene homolog mediates inward Na+currents inXenopuslaevisoocytes and Na+uptake inSaccharomycescerevisiae[J].Plant Physiology,2000,122:1249-1259.
[5] Møller I S,Gilliham M,Jha D,etal.Shoot Na+exclusion and increased salinity tolerance engineered by cell type-specific alteration of Na+transport inArabidopsis[J].The Plant Cell,2009,21(7):2163-2178.
[6] Berthomieu P,Conéjéro G,Nublat A,etal.Functional analysis ofAtHKT1 inArabidopsisshows that Na+recirculation by the phloem is crucial for salt tolerance[J].The EMBO Journal,2003,22(9):2004-2014.
[7] Plett D,Safwat G,Gilliham M,etal.Improved salinity tolerance of rice through cell type-specific expression ofAtHKT1;1[J].PLoS One,2010,5(9):e12571.
[8] Sunarpi,Horie T,Motoda J,etal.Enhanced salt tolerance mediated by AtHKT1 transporter-induced Na+unloading from xylem vessels to xylem parenchyma cells[J].The Plant Journal,2005,44(6):928-938.
[9] Horie T,Yoshida K,Nakayama H,etal.Two types of HKT transporters with different properties of Na+and K+transport inOryzasativa[J].The Plant Journal,2001,27(2):129-138.
[10] Garciadeblás B,Senn M E,Bauelos M A,etal.Sodium transport and HKT transporters:The rice model[J].The Plant Journal,2003,34(6):788-801.
[11] Ren Z H,Gao J P,Li L G,etal.A rice quantitative trait locus for salt tolerance encodes a sodium transporter[J].Nature Genetics,2005,37(10):1141-1146.
[12] Jabnoune M,Espeout S,Mieulet D,etal.Diversity in expression patterns and functional properties in the rice HKT transporter family[J].Plant Physiology,2009,150(4):1955-1971.
[13] Yao X,Horie T,Xue S,etal.Differential sodium and potassium transport selectivities of the rice OsHKT2;1 and OsHKT2;2 transporters in plant cells[J].Plant Physiology,2010,152(1):341-355.
[14] Oomen R J,Benito B,Sentenac H,etal.HKT2;2/1,a K+-permeable transporter identified in a salt-tolerant rice cultivar through surveys of natural genetic polymorphism [J].The Plant Journal,2012,71(5):750-762.
[15] James R A,Davenport R J,Munns R.Physiological characterization of two genes for Na+exclusion in durum wheat,Nax1 andNax2[J].Plant Physiology,2006,142(4):1537-1547.
[16] Huang S,Spielmeyer W,Lagudah E S,etal.A sodium transporter(HKT7) is a candidate forNax1,a gene for salt tolerance in durum wheat[J].Plant Physiology,2006,142(4):1718-1727.
[17] Byrt C S,Platten J D,Spielmeyer W,etal.HKT1;5-like cation transporters linked to Na+exclusion loci in wheat,Nax2 andKna1[J].Plant Physiology,2007,143:1918-1928.
[18] Munns R,James R A,Xu B,etal.Wheat grain yield on saline soils is improved by an ancestral Na+transporter gene [J].Nature Biotechnology,2012,30(4):360-364.
[19] James R A,Blake C,Byrt C S,etal.Major genes for Na+exclusion,Nax1 andNax2(wheatHKT1;4 andHKT1;5),decrease Na+accumulation in bread wheat leaves under saline and waterlogged conditions[J].Journal of Experimental Botany,2011,62:2939-2947.
[20] 李孟军,高欣娜,史占良,等.小麦SKC1-like基因的克隆及多样性研究[J].麦类作物学报,2012,32(4):597-602.
[21] 李孟军,李亚青,张磊.小麦高亲和性钾转运蛋白基因(HKT1)多样性分析与染色体定位[J].华北农学报,2015,30(5):1-6.
[22] Platten J D,Cotsaftis O,Berthomieu P,etal.Nomenclature for HKT transporters,key determinants of plant salinity tolerance[J].Trends in Plant Science,2006,11(18):372-374.
[23] Mäser P,Hosoo Y,Goshima S,etal.Glycine residues in potassium channel-like selectivity filters determine potassium selectivity in four-loop-per-subunit HKT transporters from plants[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(9):6428-6433.
[24] Yamasaki M,Tenaillon M I,Bi I V,etal.A large-scale screen for artificial selection in maize identifies candidate agronomic loci for domestication and crop improvement[J].The Plant Cell,2005,17(11):2859-2872.
