羊栖菜褐藻糖胶CSFP2的结构研究
2018-01-26肖保衡陈培超严阳蕾吴明江
肖保衡,张 旭,陈培超,于 萍,刘 剑,严阳蕾,吴明江
(温州大学生命与环境科学学院,浙江温州 325035)
羊栖菜Sargassum fusiforme又名海大麦、鹿角菜、海菜芽等,属于褐藻门,圆子纲,墨角藻目,马尾藻科,马尾藻属,是一种多年生的大型海藻,在我国沿海均有生长,尤其以浙江省温州市洞头县最多,同时还分布于日本和朝鲜沿海地区。该海藻在《本草纲目》草部水草类海草条中记载有软坚散结,利水泄热等功效[1],而从羊栖菜中提取的羊栖菜褐藻糖胶(岩藻聚糖硫酸酯)更具有多种生理活性:研究表明其具有抗氧化、抗凝血、降血脂、降血糖等功能,此外还具有抗炎[2]、抗病毒[3]、促进血管生成[4]、减少组织损伤[5]、神经保护、抗突变、抗辐射、吸附金属离子、吸湿保湿等作用[6-8]。因而成为近年来海洋药物研究和开发的热点。
褐藻糖胶具有的多种生理活性与其分子量大小、硫酸根含量及位置等结构因素密切相关。本文通过对羊栖菜褐藻糖胶酸水解后产物的结构解析,可以进一步的了解褐藻糖胶的结构信息,为羊栖菜褐藻糖胶的结构分析提供一个参考。
1 材料与方法
1.1 实验材料和仪器
羊栖菜,采集于浙江省温州市洞头县。
实验试剂:三氟乙酸(分析纯)、L-鼠李糖和D-半乳糖醛酸、高碘酸钠、732阳离子交换树脂购自国药集团化学试剂有限公司;右旋糖酐标样、D-甘露糖和D-木糖均购自中国药物生物制品鉴定所;D-葡萄糖醛酸购自SIGMA;D-葡萄糖购自TCI;D-半乳糖购自Dr.Ehrenstorfer GmbH;L-岩藻糖购自Fluka Bio-Chemika。溴化钾购自天津市科器高新技术公司。重水购自Cambridge Isotope Laboratories,Inc。
实验仪器:TENSOR27红外光谱仪,Bruker光谱仪器公司;离子色谱ICS-1000,戴安公司;高效液相色谱仪1525,Waters科技有限公司;色谱柱TSK-G5000 PWxl、TSK-G3000 PWxl、TSK-G2500 PWxl,日本TOSOH公司;C18色谱柱ODS-2 HYPERSIL,Thermo SCIENTIFIC;核磁共振仪,瑞士Bruker BioSpin公司。气相色谱-质谱联用仪,美国安捷伦科技公司。
1.2 实验方法
1.2.1 羊栖菜褐藻糖胶的制备
1.2.1.1 冷水浸提褐藻糖胶
经过清洗的羊栖菜于烘箱50℃下烘干,粉碎,然后进行提取。(1)脱脂:称取上述羊栖菜粉末500 g,加入95%乙醇,80℃冷凝回流,充分脱去其中醇溶性脂质和色素。(2)冷水浸提:按照料液比1:20向上述滤渣中加入蒸馏水,磁力搅拌器搅拌8 h后四层纱布过滤,滤渣再重复冷水浸提7次,合并浸提液,50℃下减压浓缩至约1 L。(3)第一次醇沉:向浓缩好的浸提液加入95%乙醇至乙醇终浓度为80%,常温静置过夜。然后4 000 r/min离心10 min得到沉淀,再将沉淀依次经95%乙醇、无水乙醇和丙酮洗涤,减压干燥,得水溶性羊栖菜粗多糖。(4)除褐藻胶:将第一次醇沉的总糖按照料液比1:20加入蒸馏水进行复溶,缓慢加入4 mol/L氯化钙,边加边搅拌至不再产生沉淀,离心后取上清液。(5)将上述上清液再次浓缩醇沉,方法同第一次醇沉,即可获得羊栖菜粗褐藻糖胶。
1.2.1.2 粗多糖脱色
采用500 mL的D101型大孔吸附树脂层析柱来进行脱色,得脱色冷提羊栖菜褐藻糖胶(CSFP)。
1.2.1.3 脱色褐藻糖胶的水解与超滤分级
向CSFP中加入三氟乙酸(TFA)在一定的条件下反应后用NaOH进行中和。然后将水解液放入1 kDa的透析袋中流水透析过夜,蒸馏水透析16 h后,用截流量为10 kDa的超滤系统对袋内液进行分级,可获得Mw>10 kDa和Mw<10 kDa的多糖溶液。将Mw>10 kDa的多糖溶液浓缩冻干后得到CSFP1(Mw>10 kDa)。将Mw<10 kDa的多糖溶液转入3.5 kDa的透析袋中,蒸馏水透析16 h,袋内袋外液体分别浓缩冻干,获得袋内和袋外两个不同级分 CSFP2(10 kDa>Mw>3.5 kDa)、CSFP3(3.5 kDa>Mw>1 kDa)。
1.2.2 羊栖菜褐藻糖胶的性质测定
1.2.2.1 总糖、糖醛酸和蛋白质含量测定
以岩藻糖为标准单糖,应用苯酚-硫酸法[9]测总糖含量;以0.1 g/L的D-半乳糖醛酸为标准溶液,通过间羟基联苯法[10]测定糖醛酸的含量;以5 mg/mL牛血清白蛋白为蛋白质标准溶液,考马斯亮蓝法[11]测定蛋白质含量。
1.2.2.2 羊栖菜褐藻糖胶中硫酸根含量的测定
用ISC-1000离子色谱仪测定硫酸根含量,选用Shodex IC SI-52 4E柱(4.0×250 mm),以3.6 mmol/L碳酸钠/碳酸氢钠缓冲液为流动相,流速为1 mL/min测定[12]。
1.2.2.3 单糖组成的测定
采用PMP衍生化及HPLC测定所得样品单糖组成[13]。
1.2.2.4 多糖的分子量测定
采用高效尺寸排阻色谱(HPSEC)测定所得样品分子量,以右旋糖酐为标准品,选择TSK-G5000 PWxl、TSK-G3000 PWXL、TSK-G2500 PWXL凝胶色谱柱。流动相为0.1 mol/L Na2SO4溶液,流速为0.6 mL/min,进样量为20 μL来测定样品的分子量及其分布[14]。
1.2.2.5 多糖的红外光谱分析
取干燥的CSFP1、CSFP2、CSFP3多糖样品,加入KBr研磨压片,在4 000 cm-1~400 cm-1的范围内进行红外光谱扫描,记录红外光谱图[14]。
1.2.3 CSFP2结构的进一步解析
1.2.3.1 CSFP2多糖的高碘酸氧化与Smith降解
采用文献[15]中的方法进行测定。
1.2.3.2 CSFP2的脱硫
CSFP2的脱硫:实验采用Nagasawa法脱硫酸根[16-18]。
1.2.3.3 CSFP2与脱硫后样品的甲基化
采用文献中的方法进行测定[19-20]。
1.2.3.4 CSFP2的核磁共振分析
称取50 mg多糖CSFP2,充分溶解于重水中,然后12 000 r/min 10 min。取上清液,在Bruker AV 600 MHz spectrometer上测定其13C NMR谱。
2 实验结果和分析
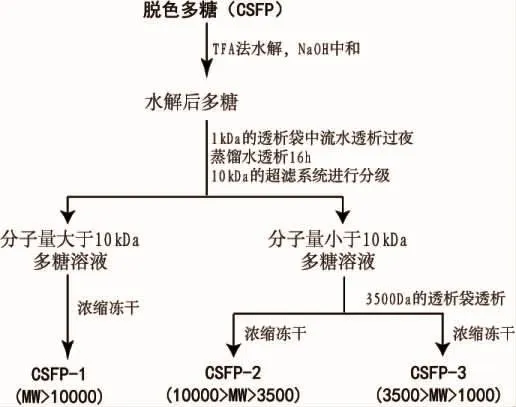
图1 CSFP的水解及分级的流程图Fig.1 Flow chart of hydrolysis and fractionation of CSFP
2.1 羊栖菜多糖的提取、脱色与多糖的水解
羊栖菜经过冷水浸提其总多糖的得率为16.4%,经氯化钙沉淀去除褐藻胶后得到的羊栖菜褐藻糖胶得率为3.0%。再经过大孔树脂脱色,最终获得冷提脱色羊栖菜褐藻糖胶CSFP,其脱色产率为76.7%。
羊栖菜褐藻糖胶CSFP经过TFA水解、中和、透析及初步分级(具体流程如图1)后的总回收率是82.84%。其中CSFP1的得率最多为33.51%,CSFP2和CSFP3的得率分别为25.87%和23.46%,相对较少。
2.2 CSFP、CSFP1、CSFP2、CSFP3 的性质
各样品的糖含量、糖醛酸含量、蛋白质和硫酸根含量列于表1。CSFP1、CSFP2和CSFP中糖含量都较高(分别为84.2%、72.2%和76.13%),前两者蛋白质含量较低(均小于2%),而CSFP蛋白质含量稍高(3.55%)。CSFP1中糖醛酸含量稍高(14.3%),硫酸根含量稍低(10.0%),而CSFP2中糖醛酸含量稍低(9.8%),硫酸根含量最高(18.7%),CSFP的糖醛酸含量最低(1.06%),硫酸根含量(17.96%)仅次于CSFP2。CSFP3中糖、糖醛酸和蛋白质的含量都非常低,具体成分有待于进一步分析。
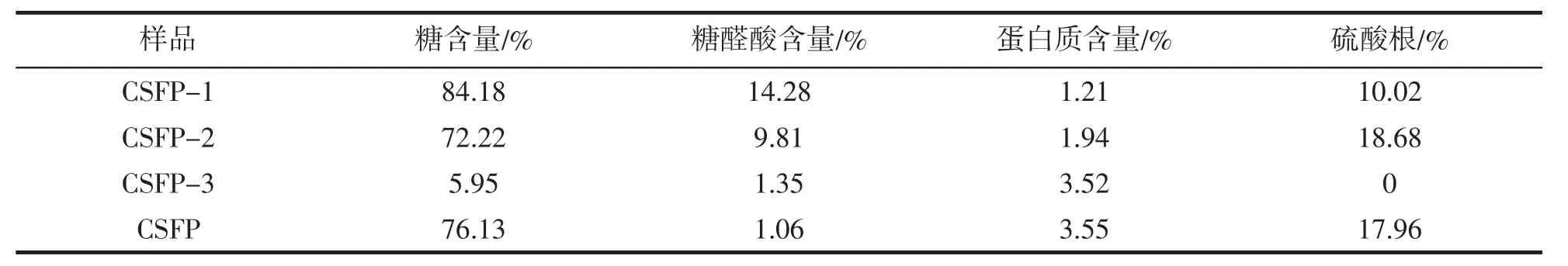
表1 水解多糖片段中糖含量、糖醛酸含量、蛋白质含量及硫酸根含量Tab.1 The content(%)of sugar,uronic acid,protein and sulfate of CSFP and its hydrolysates
2.3 各级分的单糖组成
表2中列出了CSFP及其水解产物的分子量和单糖组成。冷提羊栖菜褐藻糖胶CSFP主要由岩藻糖与半乳糖组成,其次是葡萄糖和木糖,还包含少量的半乳糖醛酸、葡萄糖醛酸、鼠李糖和甘露糖。水解后的3个级分中分子量最大的CSFP1主要由半乳糖、岩藻糖、甘露糖、葡萄糖醛酸和木糖组成,其组成非常类似陆生植物中的半纤维素成分,值得注意的是其中甘露糖含量丰富(18.8%)。中等分子量的CSFP2中半乳糖含量显著增加到41.1%,其次还有岩藻糖、葡萄糖、葡萄糖醛酸和甘露糖,推测是典型的褐藻糖胶成分中的岩藻半乳聚糖。分子量最低的CSFP3单糖组成以葡萄糖为主(57.7%),其次是岩藻糖和半乳糖,推测其可能是褐藻淀粉类似物。
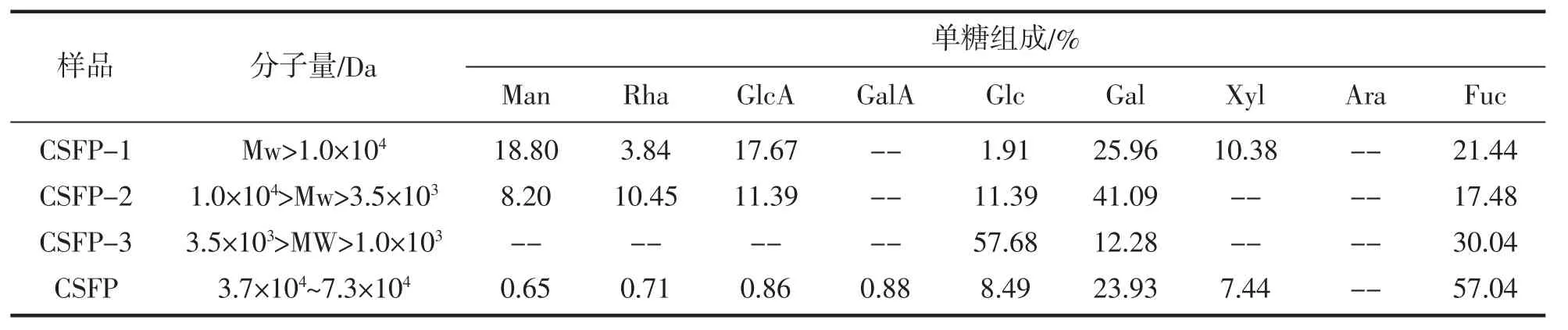
表2 多糖中的单糖组成情况Tab.2 Molecular weight and monosaccharide composition of CSFP and its hydrolysates
2.4 多糖的分子量测定结果
图2为羊栖菜多糖的高效尺寸排阻色谱分析图。各多糖级分经TSK-G3000分析后的洗脱曲线如图2b所示:CSFP大部分集中在外水体积洗脱出来的位置,说明其分子量大部分大于TSK-G3000的排阻限;水解获得的级分CSFP1和CSFP2的分子量分布则是前者在大于10 kDa的范围内,而后者则在3.5 kDa与10 kDa之间;CSFP3洗脱体积明显小于内水体积,说明其分子量已经小于TSK-G3000的分析范围。随后应用TSK-G5000和TSK-G2500分别分析CSFP和CSFP3的分子量,结果显示CSFP的分子量集中分布在37 kDa和73 kDa之间(图2a),CSFP3的分子量集中分布在1.0 kDa和3.5 kDa之间(图2c)。
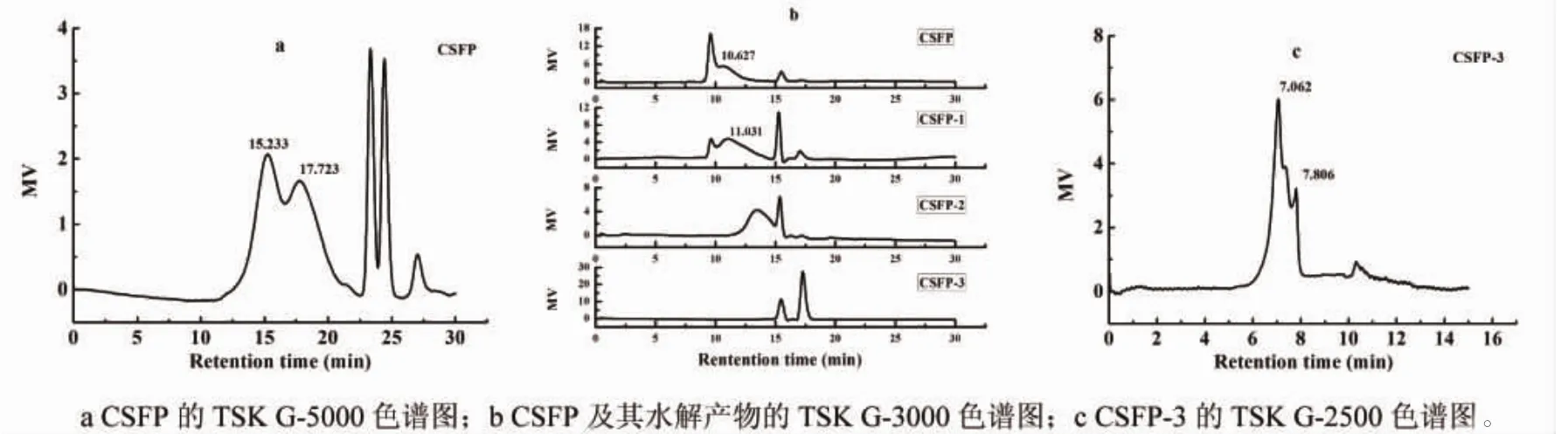
图2 羊栖菜水解多糖的高效尺寸排阻色谱分析图Fig.2 High performance size exclusion chromatographic analysis of polysaccharides from S.fusiforme
2.5 多糖的红外光谱结果
从红外光谱图(图3)中可得,CSFP及三个水解羊栖菜多糖级分是明显的多糖物质,在3400 cm-1~3500 cm-1处有很宽的O-H伸缩振动吸收峰,在2 800 cm-1~2 912.34 cm-1处有吡喃环的C-H弯曲伸缩振动峰及岩藻糖和半乳糖基C-6,1 430 cm-1~1450 cm-1处为半乳糖和木糖CH2的剪切震动,岩藻糖和O-乙酰基CH3的非对称弯曲振动,1 384 cm-1为岩藻糖和O-乙酰基CH3的对称弯曲振动;CSFP、CSFP1和CSFP2在1 630 cm-1附近出现羰基非对称伸缩振动,在1 425 cm-1前后是与糖醛酸相关的振动峰,1 230 cm-1~1 250 cm-1处表现出硫酸酯中O=S=O的非对称伸缩振动,CSFP2多糖与CSFP多糖的硫酸根含量相近且峰值都最高、CSFP-1硫酸根含量次之,CSFP3不含硫酸根,与前面硫酸根含量的测定相符;CSFP3在1 683 cm-1处具有糖的水化峰,在1 049 cm-1~1 141 cm-1处有吡喃环的特征吸收峰,在879 cm-1处具有β-糖苷键的典型振动峰,但具体结构特征还有待进一步分析验证。
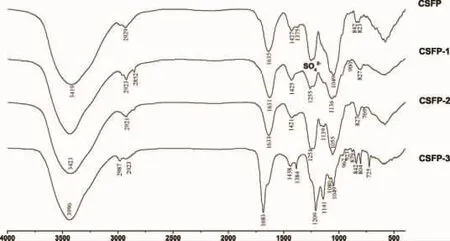
图3 羊栖菜水解多糖的红外光谱图Fig.3 IR spectra of polysaccharides fractions from S.fusiforme
2.6 CSFP2的高碘酸氧化与Smith降解结果
CSFP2样品经过高碘酸氧化后,经过测定:CSPF2样品在反应中总共消耗0.107 0 mmol的高碘酸钠。甲酸的生成量为0.041 7 mmol。CSFP2单糖残基的平均分子量为159,故50 mg样品中有约0.31 mmol糖基,经过计算CSFP2每个单糖基分子消耗0.35个高碘酸钠分子;平均每个糖基生成0.13个甲酸分子。我们通过比较高碘酸钠消耗量与甲酸生成量可知,CSFP2中有1→6糖苷键的存在或是含有非还原性末端,同时还存在1→2或1→4糖苷键。从消耗高碘酸钠的量分析可知,CSFP2中含有大量的1→3,1→2,3,1→3,6和1→3,4等不能被高碘酸氧化的糖苷键。
CSFP2的高碘酸氧化产物经Smith降解,产物用HPLC分析,分析结果列于表3。通过分析数据中氧化后产物YCSFP2 a中单糖的组成与之前未氧化的CSFP2的单糖组成可知,高碘酸氧化前后样品中Gal都为主要的单糖,并且氧化后Gal、Fuc的含量增加,Man、Rha、GlcA、Glc的含量减少说明Gal和Fuc含有不易被氧化的1→3,1→2,3,1→3,6和1→3,4糖苷键,而Man、Rha、GlcA、Glc含有易被氧化的1→2或1→4、1→6糖苷键,YCSFP2 b中的单糖以Gal为主表明多糖的主链很可能以Gal为主。YCSFP c的单糖中Man、Rha、GlcA、Glc、Fuc相比较b中的单糖都增加很多,说明这些多糖更多的分布在多糖的外边缘的支链上。
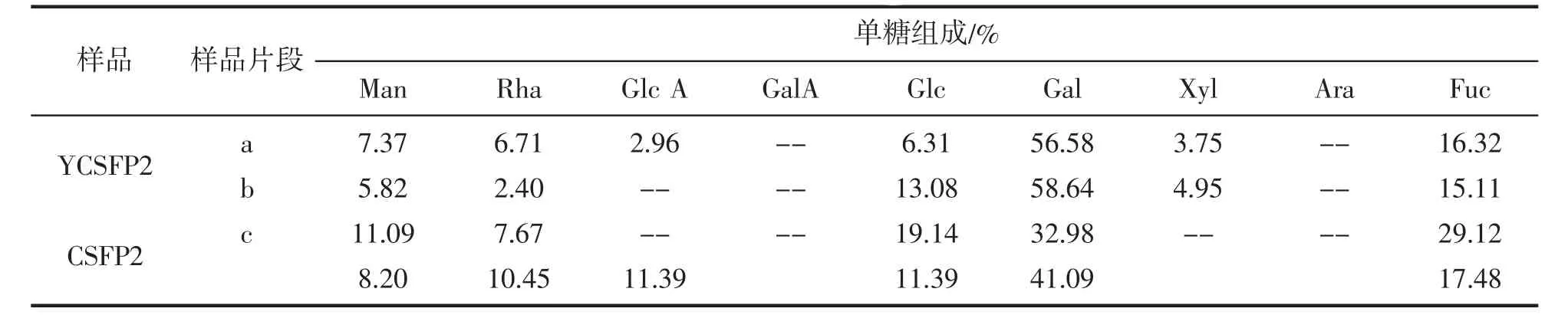
表3 CSFP2与高碘酸氧化后YCSFP2及Smith降解后的产物的单糖组成Tab.3 Monosaccharide components of CSFP2 and products of YCSFP2 after periodate oxidation and Smith degradation
2.7 CSFP2的脱硫结果
如图4所示为CSFP2、TCSFP2的红外光谱图,多糖样品CSFP2经过732强酸型阳离子交换树脂(H+型)脱硫后,经过红外光谱检测,我们可以明显的发现在硫酸根出峰处1 253 cm-1没有检测出相应的峰值,与脱硫之前的样品CSFP2相比TCSFP2脱硫效果十分明显。
2.8 CSFP2的核磁共振分析结果(ppm单位在核磁共振中表示化学位移)
13C-NMR谱图中(图5)102.7~103.2 ppm处出现糖基异头碳的特征峰,显示CSFP2中的糖基位β构型,15.46~15.09 ppm处显示的岩藻糖C-6的甲基特征峰,由此可知在CSFP2中岩藻糖存在多种链接形式。20.0 ppm处可能是乙酰基中甲基碳。而80.14~60.74 ppm范围内位糖基C-2~C-4的特征峰,因为糖基链接复杂,出峰位置密集,难以归属。
2.9 CSFP2、TCSFP2的甲基化结果
表4和表5为CSFP2经过脱硫前后甲基化后的结果。由表4可知,CSFP2具有相对复杂的结构,峰面积比最高的为1,3,6-linked Gal,说明主链很可能是以Gal为主,通过1→3或1→6糖苷键连接,另外除了1,3,6-linked Gal的外,还存在1,2,3-linked Gal,1,2-linked Fuc,1,2,4-linked Man,1,3,6-linked Man,说明可能在半乳糖的C2、C3、C6位置上连接有甘露糖或是岩藻糖。而由表5可知经过脱硫后的TCSFP2中,峰面积比最高的依然为1,3,6-linked Gal,且经过脱硫前后甲基化结果对比后发现1,2-linked Fuc没变,说明Fuc糖上不含有硫酸根,而作为主链的1,3,6-linked Gal,变成了1,6-linked Gal,说明硫酸根很可能是连接在Gal的C3位上,结合Smith降解的结果,可知岩藻糖和甘露糖可能都处于支链上,故CSFP2的结构可能是以Gal为主链,通过1→6糖苷键连接,在C3位上含有硫酸根基团,在C2、C3、C6位置上连接有甘露糖或是岩藻糖。
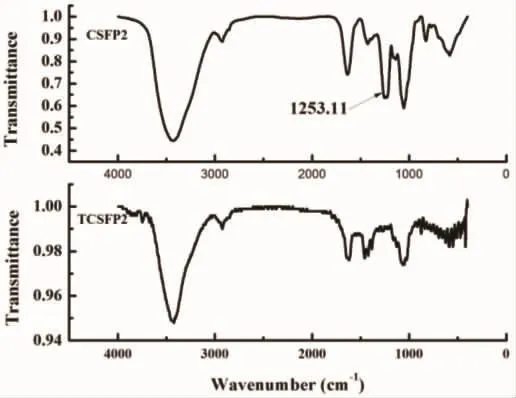
图4 CSFP2、TCSFP2的红外光谱图Fig.4 The IR spectrum of CSFP2,TCSFP2
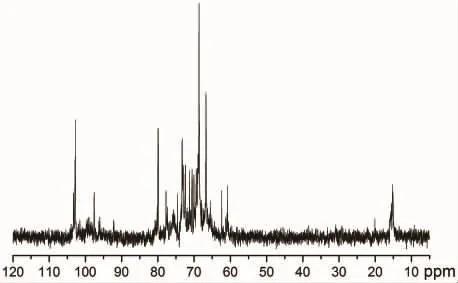
图5 CSFP2的13C NMR谱图Fig.5 The13C NMR spectrum of CSFP2
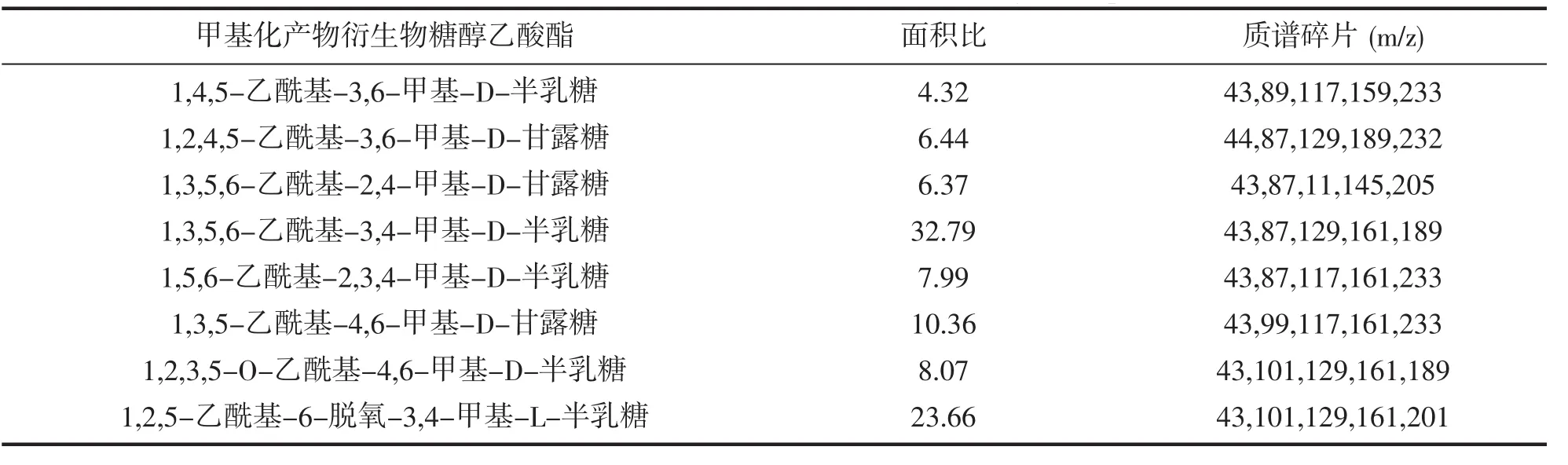
表4 CSFP2甲基化产物衍生物糖醇乙酸酯的GC-MS分析Tab.4 GC-MS of alditol acetate derivatives from the methylated product of CSFP2
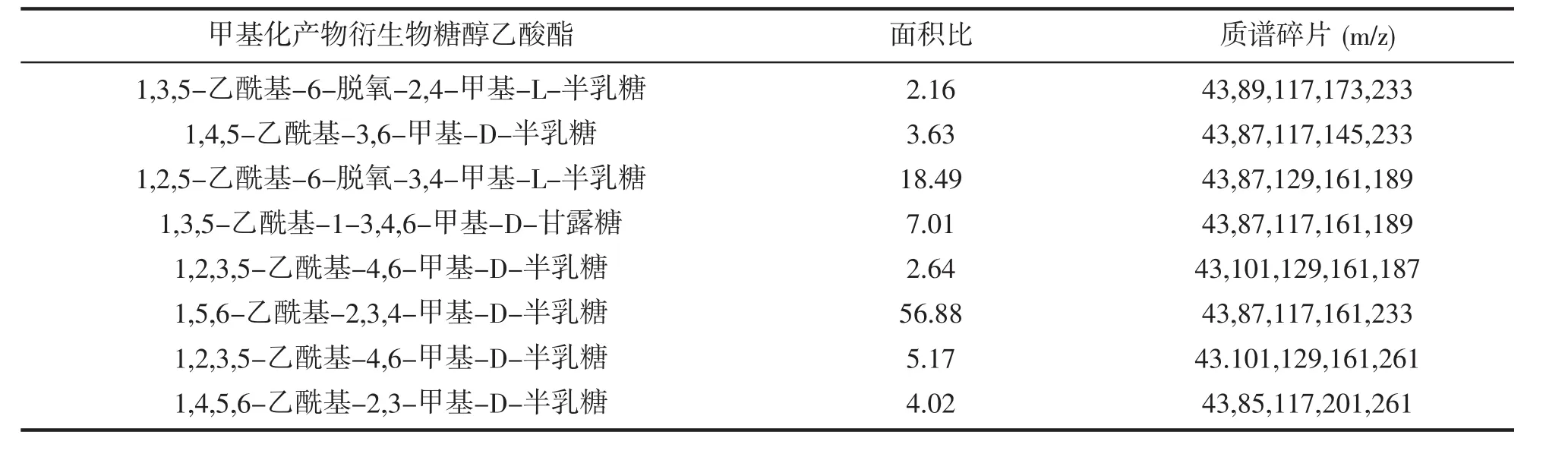
表5 TCSFP2甲基化产物衍生物糖醇乙酸酯的GC-MS分析Tab.5 GC-MS of alditol acetate derivatives from the methylated product of TCSFP2
3 结论与展望
本文通过酸水解CSFP获得不同阶段分子量的多糖:CSPF1、CSFP2、CSFP3,并对这三种多糖进行了结构表征的测定,发现经过超滤截留直接获得的多糖CSFP2本身分子量均一,经过测定其分子量为6.2 kDa,分子量大小也比较适中且硫酸根含量最高,故在CSFP1、CSFP2、CSFP3中CSFP2是一种相对理化性质比较优秀的级分,且经过测定CSFP2的结构可能是以Gal为主链,通过1→6糖苷键连接,在C3位上含有硫酸根基团,在C2、C3、C6位置上连接有甘露糖或是岩藻糖。CSFP2结构解析可以为以后其活性研究提供结构基础,便于分析多糖的构效关系,同时也为褐藻糖胶的的结构分析提供参考,另一方面实验探索的制备不同分子量多糖的过程也可以为制备低分子量多糖提供参考,而且其中经过超滤截留可直接获得单峰级分CSFP2的现象表明在特定的水解条件下可以产生量比较多的特定多糖片段,这就为实验中获得特定的稳定的足够多的多糖级分提供了可能。
[1]许忠能,王朝晖,孙 立.羊栖菜药用价值的研究进展[J].中草药,2000,31(11):876-878
[2]ZHANG X W,LIU Q,THORLACIUS H.Inhibition of selectin function and leukocyte rolling protects against dextran sodium sulfateinduced murine colitis[J].Scandinavian Journal of Gastroenterology,2001,36(3):270-275.
[3]辛现良,耿美玉,李桂玲,等.海洋硫酸多糖911体外对HIV-1作用的研究[J].中国海洋药物,2000,19(3):8-11.
[4]CHABUT D,FISCHER A M,COLLIEC-JOUAULT S,et al.Low molecular weight fucoidan and heparin enhance the basic fibroblast growth factor-induced tube formation of endothelial cells through heparan sulfate-dependent α-6 over expression[J].Molecular Pharmacology,2003,64(3):696-702.
[5]ZEMANI F,BENISVY D,GALY-FAUROUX I,et al.Low-molecular-weight fucoidan enhances the proangiogenic phenotype of endothelial progenitor cells[J].Biochemical Pharmacology,2005,70(8):1 167-1 175.
[6]胡佩红,张淑平.褐藻糖胶吸湿、保湿性能的研究[J].精细与专用化学品,2006,14(3):23-25.
[7]王 晶,张全斌,张忠山,等.乙酰化海带褐藻多糖硫酸酯的制备及其抗氧化活性研究[J].中国海洋药物杂志,2008,27(1):50-54.
[8]WANG Jing,WANG Feng,ZHANG Quanbin,et al.Synthesized different derivatives of low molecular fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro[J].International Journal of Biological Macromolecules,2009,44(5):379-384.
[9]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[10]BLUMENKARNTZ N,ASBOE-HANSEN G.New method for quantitative determination of uronic acid[J].Analytical Biochemistry,1973,54(2):484-489.
[11]TSAFFRIR Z,ZVI S.Linearization of the Bradford Protein Assay Increases Its Sensitivity:Theoretical and Experimental Studies[J].Analytical Biochemistry,1996,236(2):302-308.
[12]张丽萍,王月秋,姜世成,等.离子色谱法测定高山红景天多糖硫酸酯中硫酸根含量的研究[J].分子科学学报,2000(3):161-164.
[13]STRYDOM D J.Chromatographic separation of 1-phenyl-3-methyl-5-pyrazolone-derivatized neutral,acidic and basic aldoses[J].Journal of Chromatography A,1994,678(1):17-23.
[14]JIN Weihua,ZHANG Wenjing,WANG Jing,et al.Characterization of laminaran and a highly sulfated polysaccharide from Sargassum fusiforme[J].Carbohydrate Research,2014,385(224):58-64.
[15]张惟杰.糖复合物生化研究技术[M].第2版.杭州:浙江大学出版社,1999.
[16]USOV A I,ADAMYANTS K S,MIROSHNIKOVA L I,et al.Solvolytic desulphation of sulphated carbohydrates[J].Carbohydrate Research,1971,18(2):336-338
[17]STEVENSON T T,FURNEAUX R H.Chemical methods for the analysis of sulphated galactans from red algae[J].Carbohydrate Research,1991,210:277-298
[18]NAGASAWA K,INOUE Y,KAMATA K.Solvolytic desulfation of glycosaminoglycuronan sulfates with dimethyl sulfoxide containing water or methanol[J].Carbohydrate Research,1977,58(1):47-55
[19]HAWORTH W N.III.A new method of preparing alkylated sugars[J].Journal of the Chemical Society,Transactions,1915,107:8-16.
[20]徐 杰,李八方,薛长湖,等.羊栖菜岩藻聚糖硫酸酯的甲基化分析[J].中国海洋大学学报:自然科学版,2004,34(6):959-963.
