藜麦淀粉理化特性研究
2018-01-22,,,,,,*
,, ,,,,*
(1.郑州轻工业学院食品与生物工程学院,河南郑州 450002; 2.食品生产与安全河南省协同创新中心,河南郑州 450002)
藜麦(ChenopodiumquinoaWilld.)又称南美藜,属于自花授粉类藜属作物,原产于南美洲的安第斯山区,是当地的主要粮食作物之一,被誉为“粮食之母”。1987年我国西藏农牧学院和西藏农科院开始藜麦的引种研究,目前在陕西、山西、青海、四川、浙江等地实现了小范围适应性的种植。藜麦蛋白富含各种氨基酸,且氨基酸比例适当,并含有丰富的膳食纤维、碳水化合物和维生素,脂肪酸中约70%为不饱和脂肪酸[1]。因其丰富的营养价值,2008年藜麦成为世界十大营养食品之一。此外,藜麦还具有抗肿瘤[2]、抗氧化[3-4]、抗菌、增强免疫[5-6]、防治糖尿病[7-8]和心血管疾病[9-10]等多种生理活性功能。
我国是联合国在全球对藜麦宣传的5个站点之一,将大力推动藜麦在食品行业的应用,藜麦作为一种“健康食品”具有十分广阔的市场前景。藜麦面粉具有良好的凝胶性、吸水性、乳化性和稳定性[11],可与多种谷物面粉混合制作饼干、面包及其他加工食品。藜麦淀粉占藜麦营养物质的50%以上,其晶体特性、膨胀能力和冻融稳定性等理化特性对于藜麦相关食品的加工至关重要。藜麦淀粉颗粒在外胚乳中以单独形式和球形聚合物形式存在,平均分子量为11.3×106g/mol,支链淀粉含量较多。不同品种不同生长环境下的藜麦,其淀粉的颗粒形态及部分理化特性都存在着不同程度的差异。针对目前国内外对藜麦的研究大部分集中在分子育种、营养评价等领域的现状,对特定藜麦淀粉的提取工艺及理化性质的研究必不可少。本文以产自山西的白色藜麦为研究对象,研究了以不同方法提取的藜麦淀粉的结构特点及理化性质,以期为今后藜麦的全面运用以及相应产品的研发提供科学根据。
1 材料与方法
1.1 材料与仪器
藜麦粉 山西稼祺藜麦开发有限公司;马铃薯淀粉和玉米淀粉 无锡圣伦特国际贸易有限公司;纤维素酶和中性蛋白酶 上海科丰实业有限公司;无水乙醇、氯化钠、氢氧化钠、碘和碘化钾 天津市恒兴化学试剂制造有限公司。
XQ200型多功能高速粉碎机 上海广沙工贸有限公司;TU-1810型紫外可见分光光度计 北京莱伯泰科仪器有限公司;DZKW型电热恒温水浴锅 北京市永光明医疗仪器厂;BSA224S-CW型电子天平 赛多利斯科学仪器(北京)有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;扫描电子显微镜 日本日立公司;X-射线衍射仪 荷兰帕纳科公司;差示扫描量热仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 酶法提取藜麦淀粉 将藜麦粉与60%乙醇按1∶7的比例混合,50 ℃浸提3 h,去除可溶性物质。将浸提后的样品在4000 r/min的转速下离心10 min,取下层沉淀物,并用适量蒸馏水混合过100目筛,去除筛上的残渣。将筛后样品再次4000 r/min离心10 min,沉淀用适量质量分数为0.75%的NaCl溶液浸泡45 min,蒸馏水分别清洗4次,最后离心取其沉淀。在脱脂后的样品中加入20 U/g纤维素酶,于45 ℃恒温搅拌酶解3 h,将酶解后样品再次以4000 r/min的转速离心10 min。取离心后的最下层固体再次溶于水,将pH调到7,加入中性蛋白酶100 U/g,在45 ℃下搅拌酶解40 min。酶解后的样品以4000 r/min的转速离心20 min,取最下层白色物质并放入培养皿中在40 ℃的烘箱里烘干,得到粗淀粉。
1.2.2 碱法提取藜麦淀粉 将藜麦淀粉与质量分数为0.2%的NaOH溶液按照料液比为1∶3混合并浸泡24 h,然后过100目筛,去除筛上物。将过筛后的样品在4000 r/min的转速下离心20 min,刮去上层灰色物质,将底层白色物质分别用质量分数为5%的NaCl溶液洗涤5次,水洗5次,最后离心取其沉淀物上层,置于培养皿中放入40 ℃烘箱中热风干燥,得到粗淀粉。
1.2.3 颗粒形态观察 将双面胶固定在样品台上,取少量淀粉均匀地洒在双面胶上,随后进行喷金处理。将样品干燥一段时间,用扫描电子显微镜放大到适合的倍数察看,并拍摄具备代表性的淀粉颗粒形貌[12-13]。
1.2.4 晶体特性测定 利用X-射线衍射仪测定样品的晶体特性。测定条件[14]:射线CuKa,石墨单色器滤色片,管压40 kV,管流30 mA,发散狭缝1°,接受狭缝0.15 mm,散射狭缝1°,扫描速度2°/min,步宽(2θ)0.02°,扫描范围5~40°。
1.2.5 溶解度与膨胀度测定 将淀粉配制成2%的悬浊液,分别在50、60、70、80、90 ℃的水浴中加热15 min,并不断摇晃,快速冷却后,4000 r/min离心15 min,分离上清液至培养皿中,放入105 ℃烘箱中烘干称重。烘干后的上清液质量即为水溶淀粉的质量A1,剩余下层部分则为膨胀淀粉的质量A2。溶解度(S)和膨胀度(B)分别按如下两个公式计算[15]。
式(1)
式(2)
式中,m为淀粉样品干重,g。
1.2.6 凝沉性测定 称取1 g样品配制成质量分数为1%的乳液,在95 ℃水浴中加热糊化30 min并且不断搅拌,经过快速冷却后,将淀粉糊倒入15 mL的具塞试管中,观测淀粉糊的分层情况及界面下降的高度,并记录静置1、2、3、4、5、6、7、8、9、10、11、12 h时上层液体积,上层液体积占淀粉糊总体积的百分比即体现淀粉的凝沉性[16]。
1.2.7 冻融稳定性测定 配制质量分数为6%的乳液,在95 ℃下加热糊化30 min,然后分装到15 mL的离心管中,经快速冷却后,将样品在-20 ℃条件下冷冻24 h或48 h,取出样品,在自然条件下解冻6 h,4000 r/min离心15 min,倒掉上清液,称取沉淀物质量,利用下式分别计算冻融24、48 h后的析水率。

式(3)
式中,m1为淀粉糊的质量,g;m2为沉淀物的质量,g。
1.2.8 透光度测定 将质量分数为1%的淀粉乳,置于沸水浴中不断搅拌加热糊化30 min,冷却至室温后,以蒸馏水做空白,在波长为650 nm处测定其吸光度,按下式计算透光度[17]。
透光度(%)=10(2-吸光度)
式(4)
1.2.9 老化值测定 配制质量分数为2%乳液,于沸水浴中加热搅拌20 min,并注意调整保持淀粉糊浓度恒定。取10 g淀粉糊放入4 ℃冰箱内冷藏,24 h后取出,在4000 r/min转速下离心15 min,分离出的水量占淀粉糊总体积的百分比即体现淀粉的老化值[18]。
1.2.10 碘蓝值测定 称取1 mg淀粉,加入1 mL水调成淀粉乳,在70 ℃下水浴10 min。在淀粉乳中加入1 mL碘液(2 mg/mL碘,20 mg/mL碘化钾),并用蒸馏水定容至100 mL。室温静置 20 min,在波长680 nm下测其吸光率[19],按下式计算碘蓝值。
碘蓝值=吸光率×54.2+5
式(5)
1.2.11 热特性测定 将淀粉与去离子水按1∶2的比例混合并置于铝盒中,密封后平衡24 h。测定条件为:温度范围30~100 ℃;升温速率10 ℃/min。将空盘作为对照,分别记录起始温度(To)、峰值温度(Tp)、终止温度(Tc)和热焓值(ΔH)参数的大小[20]。
2 结果与分析
2.1 藜麦淀粉颗粒形态
由图1可知,藜麦淀粉颗粒的形状为多边形,颗粒形状均匀,但颗粒较小。其中碱提法淀粉的粒径范围在1.16~1.42 μm之间,且表面有破损痕迹,说明碱液提取法对藜麦淀粉颗粒造成一定程度的破坏。而酶法提取的藜麦淀粉颗粒外表相对光滑,粒径范围在1.15~1.97 μm之间。与藜麦淀粉相比,玉米淀粉颗粒的形状大多为多边形,粒径范围为7.32~18.65 μm,马铃薯淀粉颗粒的形状大多为圆形或椭球形,粒径范围在6.53~21.87 μm之间。玉米淀粉和马铃薯淀粉的颗粒形状大小不均一,晶体表面均有凹坑,颗粒表面还有丰富的针孔。由此可知,淀粉的颗粒大小和形态应与植物的品种有关,并且存在着较大差异。
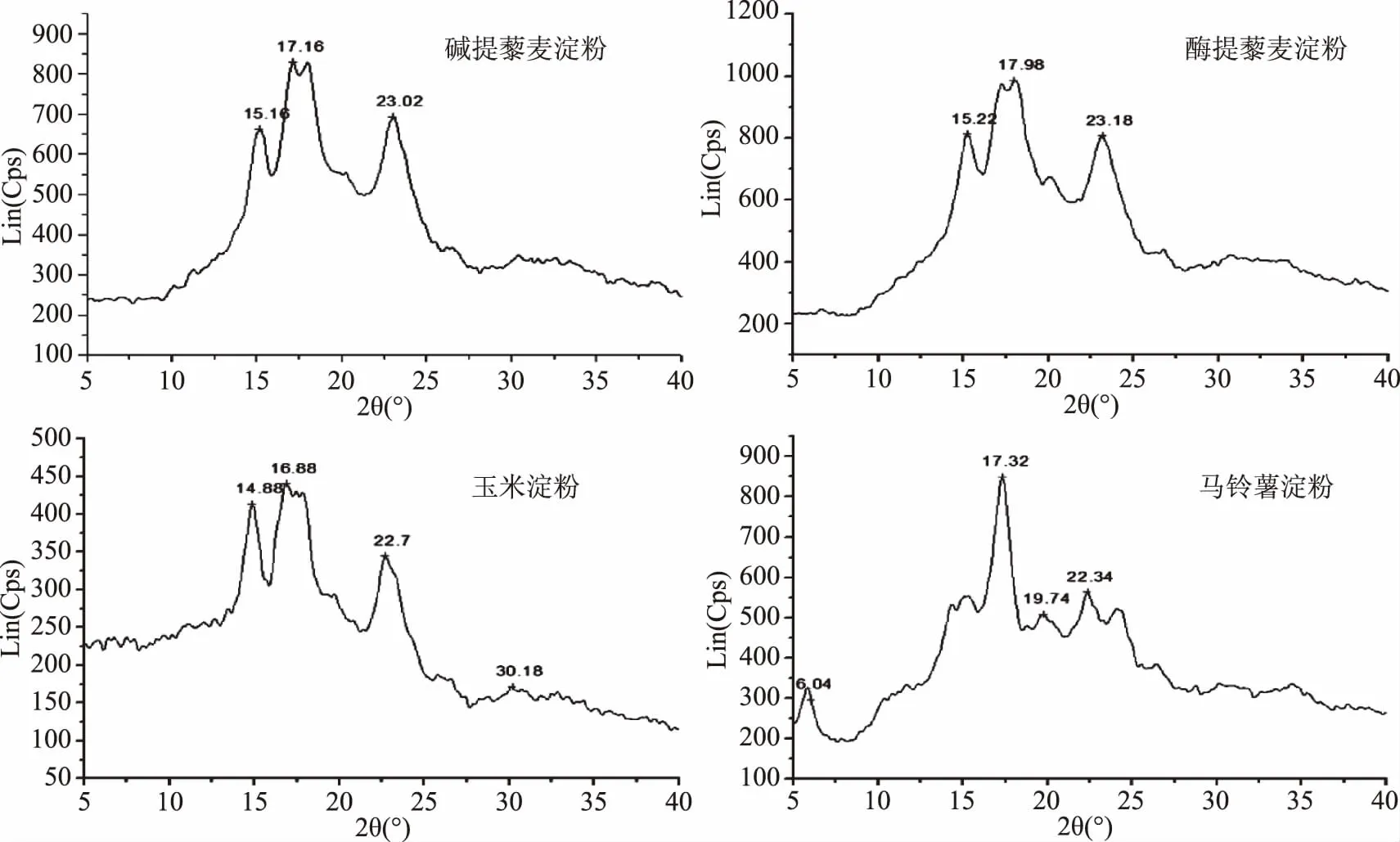
图2 藜麦淀粉、玉米淀粉和马铃薯淀粉的X-射线衍射图Fig.2 X-ray diffraction spectrogram of quinoa starch,corn starch and potato starch

图1 藜麦淀粉、玉米淀粉和马铃薯淀粉的扫描电子显微镜照片Fig.1 Scanning electron microscope(SEM)results of quinoa starch,corn starch and potato starch
2.2 藜麦淀粉的晶体特性
天然淀粉的晶型主要被划分为A型、B型和C型三种类型。对碱提法藜麦淀粉、酶提法藜麦淀粉、玉米淀粉和马铃薯淀粉的晶体结构进行测定,其结果见图2。由图2可知,玉米淀粉的强衍射峰出现时,其2θ大约为17°,同时在15°和23°也会出现较强衍射峰,说明玉米淀粉晶体结构为A型。马铃薯淀粉在2θ分别6°、17°、20°和22°时均会出现强吸收峰,说明马铃薯淀粉晶体结构为B型。碱提法藜麦淀粉和酶提法藜麦淀粉在2θ为15°、17°和23°处有强吸收峰,说明藜麦淀粉与玉米淀粉的衍射峰非常相似,属于A型结构。经计算,玉米淀粉、马铃薯淀粉、碱提法藜麦淀粉和酶提法藜麦淀粉的结晶度分别为39.96%、36.56%、39.60%、37.31%。说明同一植物不同的提取方法不会对淀粉的晶体特性造成影响。
2.3 藜麦淀粉的溶解度与膨胀度
溶解度和膨胀度可以反映以淀粉为原料的制品(如粉条、粉丝)在蒸煮过程中的糊汤和膨胀情况,对其蒸煮特性显得尤为重要。淀粉糊的溶解度表示淀粉样品在水中溶解程度的大小,膨胀度则是其糊化过程中的吸水特性和持水能力的体现。由图3和图4可以看出,四种淀粉的溶解度和膨胀度与温度有明显的关系。随着温度的升高,藜麦淀粉、玉米淀粉、马铃薯淀粉的溶解度不断增加;酶提法藜麦淀粉和马铃薯淀粉的溶解度和膨胀度从60 ℃之后开始增加,而玉米淀粉的溶解度和膨胀度均在大于70 ℃时开始提升,说明溶解度和膨胀度可能与淀粉的糊化温度有关。
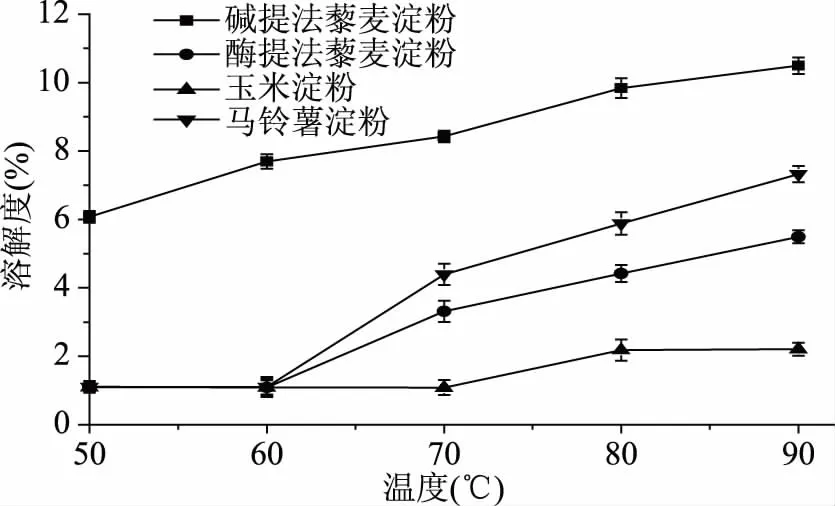
图3 藜麦淀粉、玉米淀粉和马铃薯淀粉的溶解度Fig.3 The solubility of quinoa starch, corn starch and potato starch
2.3.1 藜麦淀粉的溶解度 随着温度的升高,淀粉颗粒逐渐受热而胀大,其溶解度也随之增加。碱提法提取的藜麦淀粉含有纤维残留物,使淀粉纯度较低,其溶解度较大。马铃薯淀粉磷酸基的含量在主要糖料作物中最高[21],高浓度的磷酸基团使马铃薯淀粉与水分子具有更大的亲和力,溶解度更高。酶提法藜麦淀粉的溶解度小于马铃薯淀粉的溶解度而高于玉米淀粉的溶解度。淀粉悬浊液的热水合行为与多种因素有关,如热稳定性、温度、颗粒分布、油脂含量以及直链、支链淀粉含量。与玉米淀粉相比,藜麦淀粉的膨胀度明显较高,这是因为藜麦淀粉颗粒较小,更容易和水分子作用。
2.3.2 藜麦淀粉的膨胀度 由图4可知,在60 ℃以下,淀粉几乎不发生膨胀,变化差异很小,从70 ℃膨胀开始增加。这是因为一旦加热温度接近淀粉的糊化温度,淀粉的微晶束结构逐渐变得疏松,淀粉的极性基团很容易与水充分结合,淀粉颗粒会快速吸收周围的水分,从而膨胀度得以提高。淀粉的膨胀和溶解与直链淀粉和支链淀粉的比例、分子大小、颗粒形态和磷脂化合物含量有一定关系,正是由于这些因素,使藜麦淀粉的溶解度和膨胀度虽然不如马铃薯淀粉,但优于玉米淀粉。
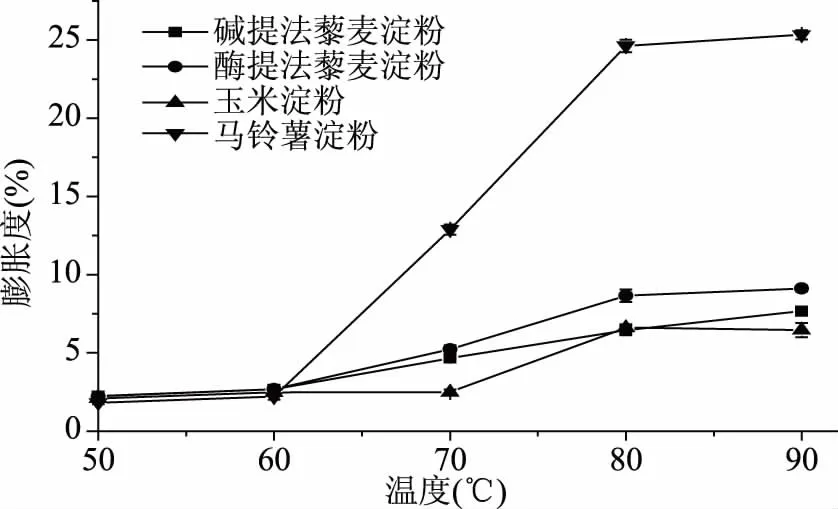
图4 藜麦淀粉、玉米淀粉、马铃薯淀粉的膨胀度Fig.4 Swelling power of quinoa starch, corn starch and potato starch
2.4 藜麦淀粉的凝沉性
淀粉糊在室温下放置一段时间后会逐渐浑浊,并逐渐发生分层现象,这是由于淀粉分子链展开后,一旦羟基暴露出来便很容易重新结合,形成的分子微晶束不溶于水,使得溶解度降低。如图5所示,在整个凝沉过程中,玉米淀粉最先开始发生凝沉,凝沉速度几乎呈线性增长,藜麦淀粉次之,从9 h后才开始发生凝沉,而马铃薯淀粉糊很稳定,几乎不发生凝沉。碱提法藜麦淀粉与酶提法藜麦淀粉的凝沉速度基本一致,说明提取方法不会对淀粉的凝沉特性造成影响。淀粉的凝沉特性与淀粉分子的结构有一定的关系。直链淀粉含量越高则发生凝沉,支链淀粉中分支结构会使淀粉发生凝沉的难度增加。玉米淀粉含有较多的直链淀粉,发生凝沉较快。马铃薯和藜麦淀粉中均含有较多的支链淀粉,但凝沉速度有所区别,可能与淀粉分子链长短有关。

图5 藜麦淀粉、玉米淀粉、马铃薯淀粉的凝沉性Fig.5 The retrogradation properties of quinoa starch,corn starch and potato starch
2.5 藜麦淀粉的冻融稳定性
四种淀粉冻融2次后的析水状况如图6所示,淀粉的品种不同,则冻融析水率表现出较大的差异,析水率越大,冻融稳定性越差。经过一次冻融,马铃薯淀粉冻胶形状基本完好,可以倒出少量的水,说明马铃薯淀粉的冻融稳定性较好。而玉米淀粉经过冻融后,其冻胶呈现出海绵状,倾之有较多水析出,经过反复2次仍有少量水析出,碱提法藜麦淀粉的析水率和玉米淀粉基本相同,且玉米淀粉和碱提法藜麦淀粉的冻融稳定性最差。酶提法藜麦淀粉的冻融稳定性介于玉米和马铃薯淀粉之间。
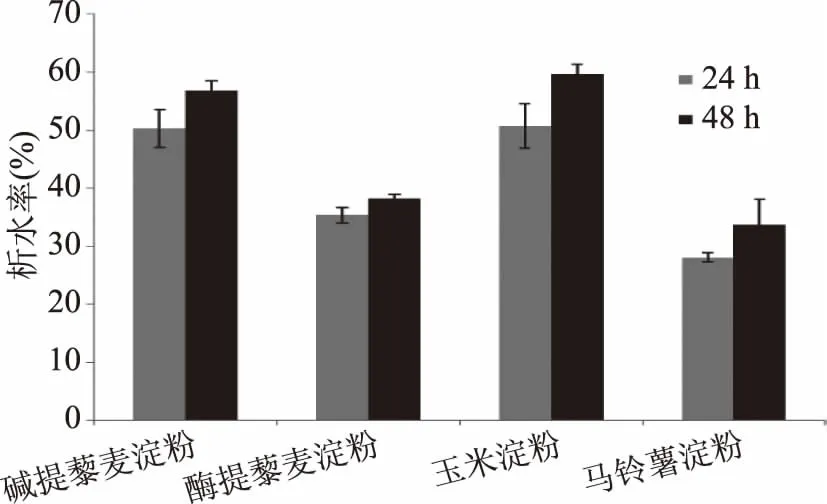
图6 藜麦淀粉、玉米淀粉、马铃薯淀粉的冻融稳定性Fig.6 The freezing thaw stabilities of quinoa starch,corn starch and potato starch
2.6 藜麦淀粉的透光度
当光线穿过糊化的淀粉乳时会发生一些光学现象,如反射、折射和穿透,如果淀粉的品种和性质不同,则光线照射在淀粉糊上产生的反射、折射和穿透强度也不尽相同,透光率越大,说明淀粉的透明程度越高。碱提法藜麦淀粉、酶提法藜麦淀粉、玉米淀粉和马铃薯淀粉的透光率如表1所示。马铃薯淀粉的透光率最好,相对来说比较透明。淀粉糊的透光率与淀粉的溶解度有关,马铃薯的淀粉颗粒较大,造成结构较为松散,且在热水中糊化度高,使光线发生折射的淀粉颗粒较少。而藜麦淀粉的颗粒较小,淀粉受热糊化后,分子重排缔合程度较高,使得透明度降低[22]。
2.7 藜麦淀粉老化值

表1 藜麦淀粉、玉米淀粉、马铃薯淀粉的透光度、老化值和碘蓝值Table 1 The light transmittance,retrogradation value and iodine blue values of quinoa starch,corn starch and potato starch
淀粉老化的发生与时间相关联,一开始老化程度较快,随着时间的增加老化速率逐渐减小。由表1可以看出,藜麦淀粉和玉米淀粉的老化值都明显超过马铃薯淀粉。这可能是由于玉米淀粉中直链淀粉含量较高和藜麦淀粉的支链淀粉外侧重结晶造成的,马铃薯淀粉中含有较多的磷酸酯,磷酸酯对淀粉老化起到了延缓作用。碱提法藜麦淀粉与酶提法藜麦淀粉的老化值有所差别,可能与淀粉的聚合度有关。
2.8 藜麦淀粉的碘蓝值
碘蓝值代表淀粉结合碘的能力,直链淀粉与支链淀粉的含量、侧链长度或分子大小都会影响碘蓝值的大小。如果直链淀粉能高度线性聚合,则会导致碘蓝值增大。由表1可知,相比于玉米淀粉和马铃薯淀粉,藜麦淀粉的碘蓝值最小,这说明藜麦淀粉的支链淀粉含量多。此外,酶提法藜麦淀粉的碘蓝值比碱提法藜麦淀粉的大,这也说明了碱液有可能会影响直链淀粉和支链淀粉的含量。
2.9 藜麦淀粉的热性能
淀粉颗粒的紧密程度、分子大小、直链淀粉与支链淀粉比例能影响淀粉热力学性能。由表2可知,马铃薯淀粉的糊化温度低于玉米淀粉。其主要原因在于马铃薯的淀粉颗粒大,结构十分松散,很容易吸水胀大,不需要很高的温度就可以形成糊状。两种不同方法提取的藜麦淀粉与马铃薯淀粉糊化温度接近,酶提法藜麦淀粉的热焓值比碱提法藜麦淀粉低,说明酶提法藜麦淀粉所需的热量低。
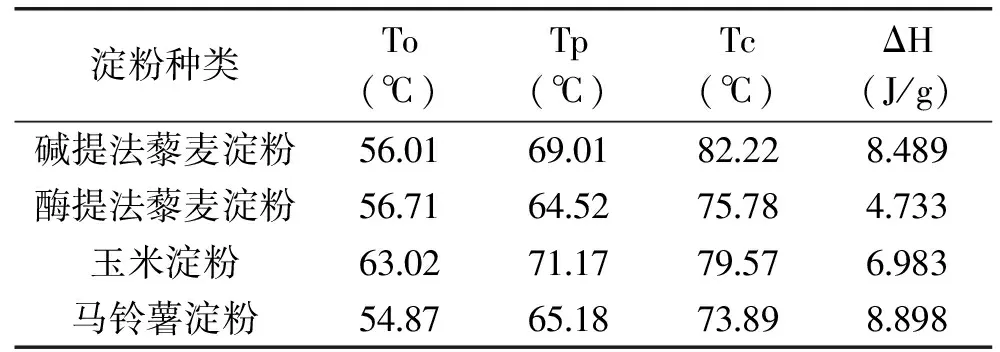
表2 藜麦淀粉、玉米淀粉、马铃薯淀粉的DSC曲线热力学参数Table 2 DSC curve parameters of quinoa starch, corn starch and potato starch
3 结论
藜麦淀粉作为一种尚未完全开发利用的植物淀粉,具备较高的开发利用价值。本文研究结果表明,藜麦淀粉颗粒较小,为多边形,晶体结构为A型,支链淀粉含量较高;碱法和酶法提取的藜麦淀粉在理化性质方面存在一些差异,并与玉米淀粉和马铃薯淀粉在溶解度、膨胀度、冻融稳定性、凝沉特性、透光度、老化值、碘蓝值和DSC曲线热力学参数等方面存在不同程度的差别;这些差别均与每种淀粉的结构特征相关。虽然酶法提取的藜麦淀粉部分性质较碱法提取的要好,但仍需在不影响藜麦淀粉理化性质的基础上进一步改进提取方法以降低成本。本文的研究为藜麦淀粉在食品行业中的应用奠定了理论基础。
[1]Kuljanabhagavad T,Wink M. Biological activities and chemistry of saponins from Chenopodium quinoa Willd[J]. Phytochemistry Reviews,2009,8(2):473-490.
[2]Capriotti A L,Cavaliere C,Piovesana S,et al. Characterization of quinoa seed proteome combining different protein precipitation techniques:Improvement of knowledge of nonmodel plant proteomics[J]. Journal of Separation Science,2015,38(6):1017-1025.
[3]Tang Y,Li X,Zhang B,et al. Characterisation of phenolics,betanins and antioxidant activities in seeds of threeChenopodiumquinoaWilld. genotypes[J]. Food Chemistry,2015,166(166C):380-388.
[4]Kumpun S,Maria A,Crouzet S,et al. Ecdysteroids fromChenopodiumquinoaWilld.,an ancient Andean crop of high nutritional value[J]. Food Chemistry,2011,125(4):1226-1234.
[5]Oshodi A A,Ogungbenle H N,Oladimeji M O. Chemical composition,nutritionally valuable minerals and functional properties of benniseed(Sesamumradiatum),pearl millet(Pennisetumtyphoides)and quinoa(Chenopodiumquinoa)flours[J]. International Journal of Food Sciences & Nutrition,1999,50(5):325.
[6]Graf B L,Poulev A,Kuhn P,et al. Quinoa seeds leach phytoecdysteroids and other compounds with anti-diabetic properties[J]. Food Chemistry,2014,163(3):178-185.
[7]Mastebroek H D,Limburg H,Gilles T,et al. Occurrence of sapogenins in leaves and seeds of quinoa(ChenopodiumquinoaWilld)[J]. Journal of the Science of Food & Agriculture,2000,80(1):152-156.

[9]Nsimba R Y,Kikuzaki H,Konishi Y. Antioxidant activity of various extracts and fractions ofChenopodiumquinoaandAmaranthusspp. seeds[J]. Food Chemistry,2008,106(2):760-766.
[10]Lamothe L M,Srichuwong S,Reuhs B L,et al. Quinoa(ChenopodiumquinoaW.)and amaranth(AmaranthuscaudatusL.)provide dietary fibres high in pectic substances and
xyloglucans[J]. Food Chemistry,2015,167:490-496.
[11]Oshodi A,Ogungbenle H,Oladimeji M. Chemical composition,nutritionally valuable minerals and functional properties of benniseed,pearl millet and quinoa flours[J]. International Journal of Food Science and Nutrition,1999,50(5):325-331.
[12]王绍清,范文浩,王琳琳,等. 扫描电子显微镜原位观察可食用淀粉颗粒的超微形貌[J]. 食品科学,2013,34(1):61-64.
[13]刘闪,刘良忠,李小娜,等. 白鲢鱼骨胶原多肽螯合钙的工艺优化[J]. 食品科学,2014,35(10):76-81.
[14]杜双奎,王华,聂丽洁. 芸豆淀粉理化特性研究[J]. 中国粮油学报,2012,27(8):31-35.
[15]Saragusti A C,Ortega M G,Cabrera J L,et al. Inhibitory effect of quercetin on matrix metalloproteinase 9 activity molecular mechanism and structure-activity relationship of the flavonoid-enzyme interaction[J]. European Journal of Pharmacology,2010,644(1-3):138-145.
[16]郑学玲,张玉玉,张杰. 青稞淀粉和小麦淀粉的理化性质比较研究[J]. 中国粮油学报,2010,25(10):52-56.
[17]于淑艳,吴琼,陈星,等. 油莎豆淀粉理化性质的研究[J].食品科技,2011,36(3):245-248.
[18]Li W,Li C,Gu Z,et al. Relationship between structure and retrogradation properties of corn starch treated with 1,4-α-glucan branching enzyme[J]. Food Hydrocolloids,2016,52:868-875.
[19]杨斌,张喜文,张国权,等. 山西不同品种谷子淀粉的理化特性研究[J]. 现代食品科技,2013,29(12):2901-2908.
[20]田斌强,邓乾春,谢笔钧. 发芽燕麦淀粉的热特性[J]. 现代食品科技,2014,30(5):98-103.
[21]田晓敏,吴茜茜,蔡敬民,等. 马铃薯淀粉磷酸寡糖研究进展[J]. 食品工业科技,2010,75(1):406-411.
[22]Karim A A,Norziah M H,Seow C C. Methods for the Study of Starch Retrogradation[J]. Food Chemistry,2000,71(1):9-36.
