人参锈腐病生防用菌剂制作及效果检测
2018-01-22屈俊廷李熙英
边 雪, 王 伟, 崔 凡, 屈俊廷, 李熙英,2*
(1.延边大学农学院;2.延边大学长白山生物资源与功能分子教育部重点实验室:吉林 延吉 133002)
人参锈腐病[Cylindrocarpondestructans(Zinss) Scholten]为人参根部最主要的病害之一,一般发病率20%~30%,个别严重地块可达70%以上[1]。人参锈腐病因厚垣孢子在土壤中以休眠的方式可在无寄主的条件下长期存活,使土壤带菌,直接影响下一茬人参的种植,造成人参连作障碍[2-3]。目前,人参锈腐病的防治主要采用农业防治、化学防治和生物防治等。韩润亭等[4]利用氯化苦进行人参锈腐病田间防病试验,对人参锈腐病防治效果达54.78%~70.07%,明显优于多菌灵的防治效果。马凤茹等[5]、王丽华等[6]用50%棉隆可湿性粉剂处理土壤防治锈腐病防效显著,用棉隆处理土壤的参根重量比用多菌灵处理土壤的参根重量高出近1倍, 且不影响人参皂贰的含量。但植物病害化学防治常导致“3R”问题以及环境污染、药害、人畜中毒、农田生态平衡与生物多样性的破坏等一系列的社会问题[7]。
人参锈腐病生物防治方面[8-14],主要围绕人参地土壤微生物多样性调查,拮抗菌的分离、鉴定及田间防病试验,拮抗菌发酵条件研究,现有微生物菌剂应用于人参锈腐病防治中等方面进行,但未见人参锈腐病生防用的菌剂开发及效果方面的研究报道。
该试验以杨树上分离到的内生解淀粉芽孢杆菌菌株Y-S-Y12以及参地土壤分离到的YBN13和YBN18[15]等拮抗菌菌株制作菌剂并检测菌剂有效性,以期为人参锈腐病生防菌剂开发提供借鉴。
1 材料与方法
1.1 供试菌
人参锈腐病菌(Cylindrocarpondestructans(Zins.));供试拮抗菌有Y-S-Y12菌株、YBN13菌株和YBN18菌株。Y-S-Y12菌株为解淀粉芽孢杆菌(Bacillusamyloliquefaciens);YBN13和YBN18菌株为芽孢杆菌属的细菌Bacillssp,登录号分别为JX156418和JX156419。上述病原菌和拮抗菌均由延边大学农学院植物病理研究室保存。
1.2 拮抗菌剂制作
拮抗菌菌株Y-S-Y12、YBN13、YBN18进行活化后,在无菌操作台上用接种环将拮抗菌接入已灭好菌的装200 mL KB培养液的三角瓶中(菌量为1接菌环),在28 ℃、120 r/min 恒温双层摇床中振荡培养5 d后,经4 000 r/min离心25 min,得到细菌菌体。将离心所得的细菌菌体与100 g的A、B、C 3种营养载体相互混合,每种营养载体混合200 mL菌液中的细菌菌体。搅拌均匀后,置于室内阴暗干燥处,自然风干,防止阳光直射。
A、B、C 3种不同的营养载体,配方如下。
A:滑石粉100 g,葡萄糖2 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,蛋白胨3 g,拮抗菌培养液200 mL中培养的细菌量。
B:高岭土100 g,葡萄糖2 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,蛋白胨3 g,拮抗菌培养液200 mL中培养的细菌量。
C:活性炭100 g,葡萄糖2 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,蛋白胨3 g,拮抗菌培养液200 mL中培养的细菌量。
1.3 菌剂中拮抗菌活菌数的检测
不同菌剂中拮抗菌存活数的检测,采用平板计数法。
具体方法如下:分别在制作菌剂后1、10、20、30、40、50、75和100 d时取菌剂样品1.00 g,采用梯度稀释法得到10-4、10-5和10-6浓度的菌剂稀释液,用移液器分别吸取不同稀释浓度的稀释液0.02 mL,滴在预先备好的KB固体培养基平板上,分别用无菌涂布棒均匀涂于琼脂平板表面。每一稀释度重复5个培养皿。将做好的平板倒置放于25 ℃的恒温培养箱中培养,48 h后调查长出的菌落数目,计算活菌数目。
1.4 保存100 d后菌剂对人参锈腐病菌的抑菌作用
制作的不同菌剂保存100 d后,取菌剂样品1.00 g,加入装有39 mL无菌水的锥形瓶中,充分振荡10 min,备用。人参锈腐病菌在PDA平板上活化7 d。用打孔器打出直径8 mm的人参锈腐病菌菌碟,放入PDA平板中间,人参锈腐病菌菌碟两边15 mm处放置已灭菌的滤纸片(d=5 mm),滤纸片上滴上述菌剂悬浮液0.1 mL,每个处理重复5个培养皿,只接人参锈腐病菌菌碟为对照。20 ℃恒温箱培养4 d,测人参锈腐病菌菌落直径,计算抑菌率。抑菌率计算公式如下:

1.5 拮抗菌菌剂田间防病试验
试验设Y-S-Y12、YBN13、YBN18、Y-S-Y12+YBN13、Y-S-Y12 +YBN18、YBN13+YBN18等6种菌剂处理,其中,混剂为2种菌剂的1∶1混合物。
试验在吉林省安图县大荒沟林场人参地中进行。试验用人参苗为2年生苗,选择大小基本相同,无病菌感染的参苗。移栽时,于40倍液菌剂中浸泡人参苗20 min后捞出,进行移栽。
试验地设14个小区,每小区面积30 m2,试验采用随机区组设计,第1区组为滑石粉制作的菌剂(A剂型),第2区组为高岭土制作的菌剂(B剂型)。清水中浸泡的苗为对照。种植人参苗的株距10 cm,行距30 cm。进行正常管理。
10月中旬,取出参根调查人参成活株数、病株数、参根地径、根长、根重等(调查4行,标准株数为60株)。
2 结果与分析
2.1 不同拮抗菌剂室内保存效果
2.1.1 菌剂中拮抗菌活菌数目检测
菌剂在100 d内活菌数目变化见图1~3。
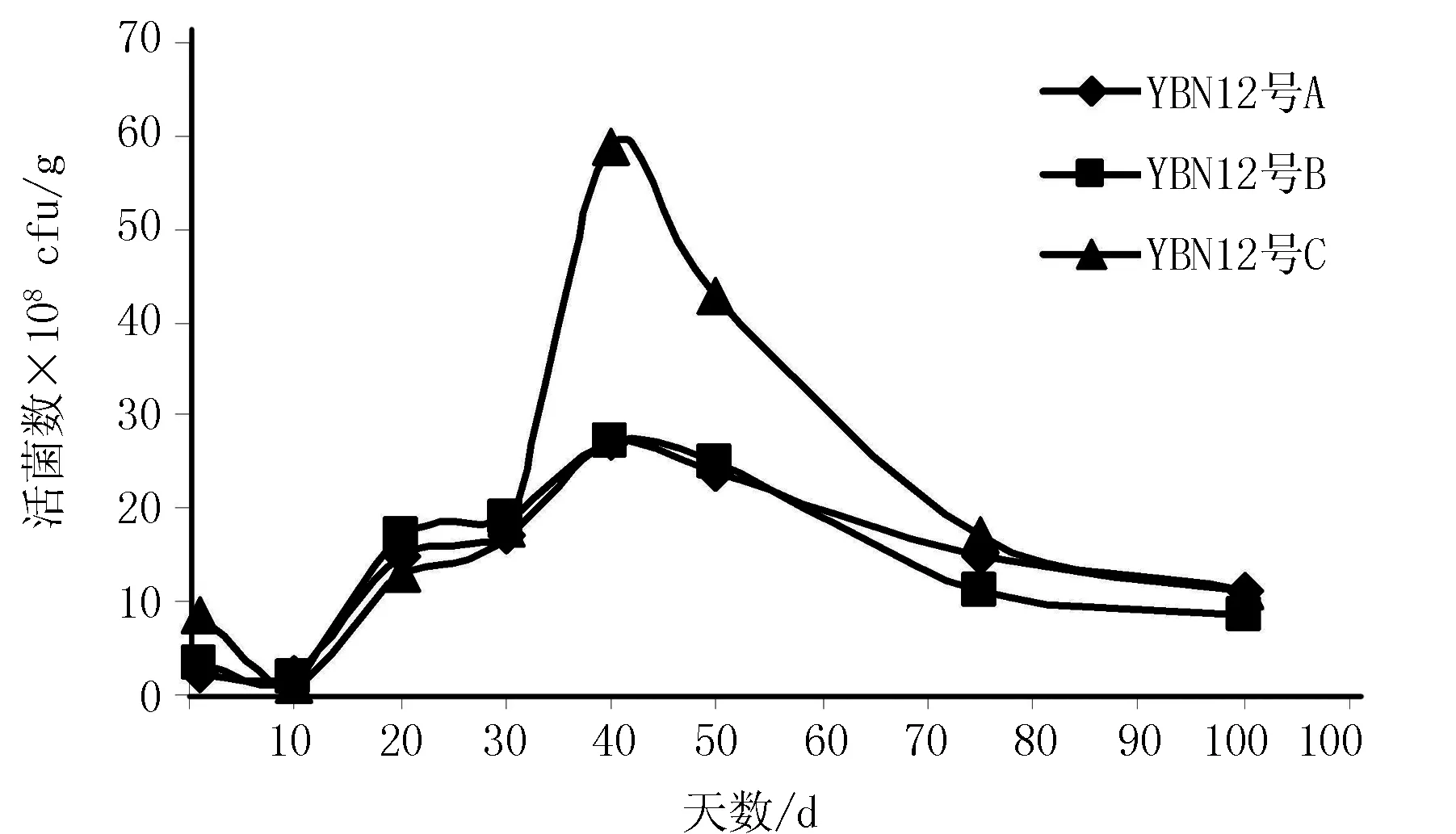
图1 Y-S-Y12菌剂中拮抗菌活菌数的变化趋势Fig.1 The change trend of viable bacteria count of the Y-S-Y12
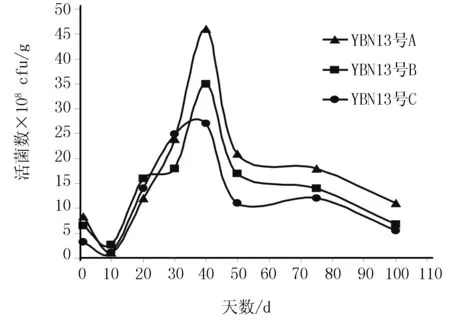
图2 YBN13菌剂中拮抗菌活菌数的变化趋势Fig.2 The change trend of viable bacteria count of the YBN13

图3 YBN18菌剂中拮抗菌活菌数的变化趋势Fig.3 The change trend of viable bacteria count of the YBN18
由图1~3可知,用滑石粉、高岭土、活性炭制作的Y-S-Y12、YBN13和YBN18菌剂中的活菌数目从第10天开始有不同程度的上升,在第40天达到顶峰,50 d以后活菌数目开始缓慢下降。在40 d时,用活性炭制作Y-S-Y12和YBN18菌剂的活菌数最多,用滑石粉制作的YBN13菌株菌剂活菌数最多。到100 d时不同菌剂中活菌数目基本趋于稳定,并多于GB20287-2006CHB农用微生物菌剂中要求微生物菌剂有效活菌数目应大于2×108cfu/g的标准[16]。
2.1.2 不同菌剂对人参锈腐病菌的抑菌活性
由表1可知, Y-S-Y12 3种菌剂的抑菌率比原菌株培养液有下降趋势,但Y-S-Y12 A、Y-S-Y12 B菌剂与对照之间没有显著性差异, Y-S-Y12 C菌剂的抑菌率显著低于对照。YBN13 3种菌剂对人参锈腐病菌的抑菌率比原菌株有显著下降趋势,下降率达到了10%左右,但3种菌剂间抑菌率没有显著性差异。YBN18 B菌剂抑菌率显著高于对照,YBN 18 A菌剂的抑菌率和对照之间没有显著性差异,YBN18 C菌剂的抑菌率显著低于对照。
综上所述,Y-S-Y12和YBN18 2种菌剂在活菌数目上基本达标,并相差不大;在抑菌率上C菌剂与对照之间有显著性差异,故Y-S-Y12菌剂和YBN18菌剂可选材料为滑石粉和高岭土。YBN13 3种菌剂在活菌数目和抑菌效果上相差不大,故YBN13菌剂可选材料为滑石粉、高岭土和活性炭。
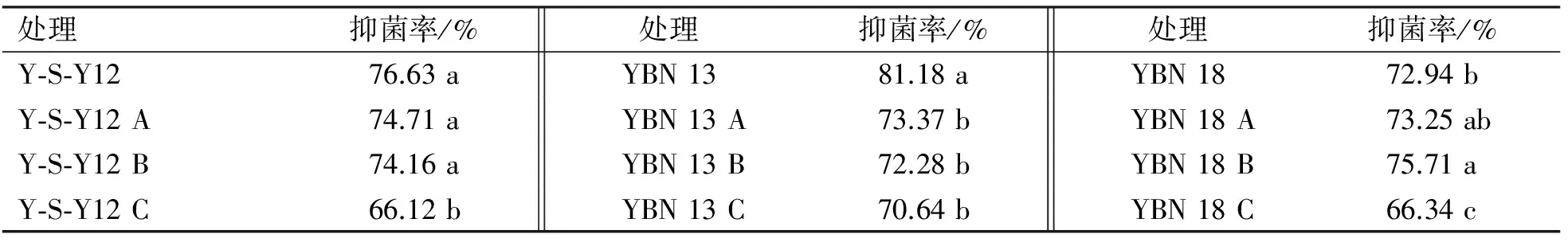
表1 不同菌剂对人参锈腐病菌的抑菌活性
2.2 高效拮抗菌菌剂的田间防病试验
2.2.1 不同拮抗菌菌剂处理对人参锈腐病病情指标的影响
田间病情调查结果见表2。

表2 不同拮抗菌菌剂对人参锈腐病的病情指标的影响
对表2中的人参苗成活株数和锈腐病病株数进行方差分析的结果表明,成活株数和病株数在区组间没有显著性差异,说明用滑石粉和高岭土制作的菌剂对人参苗成活率和人参锈腐病发病率没有影响。不同处理间成活株数和病株数之间差异均达到极显著水平[F成活株数=107.428 6>F0.01(2,6)=10.92;F病株率=107.428 6>F0.01(2,6)=10.92]。对人参苗成活株数进行多重比较的结果表明,Y-S-Y12、YBN13、YBN18、Y-S-Y12+ YBN13、Y-S-Y12+ YBN18菌剂处理的人参平均成活数显著高于对照,且它们之间没有显著性差异,用YBN13+YBN18菌剂处理的人参的平均成活株数较少,且与对照之间没有显著性差异。
不同拮抗菌菌剂处理人参锈腐病病株数显著低于对照,其中,用Y-S-Y12、Y-S-Y12+YBN13、Y-S-Y12+YBN18菌剂处理的人参锈腐病病株数最少,平均防效均达到了70%以上;其次为YBN13菌剂处理的人参锈腐病病株数,其平均防效为69.89%;再次为YBN 18菌剂;用YBN13+YBN18菌剂处理的人参锈腐病病株数最多,其平均防效仅为49.96%。
2.2.2 不同拮抗菌菌剂处理对人参产量指标的影响
秋季测得的人参产量指标见表3。
对表3中的人参根径、根长和根重进行方差分析的结果,人参平均根径、平均根长和人参小区产量在区组间无显著性差异,说明用高岭土和滑石粉制作的菌剂对人参苗生长指标没有显著性影响。人参根茎、根长及人参小区产量在不同处理间差异均达到了极显著水平[F根径=21.17>F0.01(2,6)=10.92;F根长=147.63>F0.01(2,6)=42.16;F产量=109.42>F0.01(2,6)=10.92]。

表3 不同拮抗菌菌剂处理对人参产量指标的影响
不同菌剂处理对人参根径的影响进行多重比较的结果表明,用高效拮抗菌菌株Y-S-Y12、Y-S-Y12+YBN13、YBN12+YBN18、YBN13菌剂处理的人参平均根径显著大于对照,且它们之间没有显著性差异;YBN13+YBN18菌剂和YBN18菌剂对人参根茎的影响不大,且与对照没有显著性差异。
不同菌剂处理对人参根长的影响进行多重比较结果,用菌剂Y-S-Y12、Y-S-Y12+YBN13、Y-S-Y12+YBN18、YBN13+YBN18菌剂处理的人参平均根长显著长于对照,并且无显著性差异; YBN13、YBN18菌剂对人参根长的影响不大,并与对照之间无显著性差异。
不同菌剂处理对人参产量的影响进行多重比较结果,不同菌剂处理的人参产量显著高于对照,其中用Y-S-Y12菌剂和Y-S-Y12+YBN13混合菌剂处理的人参产量最高,并且它们之间没有显著性差异;其次为YBN13、Y-S-Y12+YBN18、YBN13+YBN18菌剂,并它们之间也没有显著性差异。
从人参单根重上看,用菌剂YBN18菌剂处理的人参单根重少于对照外其他处理的人参单根重均高于对照,其中用菌剂Y-S-Y12、Y-S-Y12+YBN13、YBN13+YBN18菌剂处理的人参单根重大于对照,其人参单根重比对照多于115%左右。说明这几种菌剂处理对人参根的生长有一定的促进作用。
3 讨论与结论
微生物菌剂具有无副作用、无残留、不产生抗性等优点,但其在生产、运输、使用和保存过程中容易失活,从而降低生物活性。因此,如何保持菌体的活菌数和生物活性成为微生物制剂研究的主要难题。本文中采用滑石粉、高岭土、活性炭等3种材料进行了拮抗菌(Y-S-Y12、YBN13、YBN18)剂型化,结果菌剂中拮抗菌活菌数目100 d内超过了GB 20287-2006(农用微生物菌剂)[15]标准中的活菌数目要求。抑菌试验结果,拮抗菌菌剂制作100 d后抑菌效果并没有显著变化。
微生物菌剂有效性与田间防病试验结果有密切相关。不同菌剂处理对人参锈腐病病情指标影响的研究结果表明,Y-S-Y12、Y-S-Y12+YBN13和Y-S-Y12+YBN18菌剂对人参锈腐病有较高的防治效果,达到了72.04%~77.42%。本试验中不同菌剂处理的人参产量指标显著高于对照,其中,用Y-S-Y12菌剂和Y-S-Y12+YBN13混剂处理的人参根茎、根长以及人参产量等指标显著高于其它处理。这说明,菌剂对人参的生长有一定的促进作用。这与金海强等[16]用Y-S-Y12菌株、YBN13菌株和YBN18菌株发酵液处理人参试验中得到的结果基本一致。
综合各因素的分析,单个菌剂中Y-S-Y12菌剂对人参锈腐病的防病作用及人参生长的促进作用最明显;单剂和混剂效果上看混剂效果优于单剂;混剂中Y-S-Y12+YBN13混剂的效果最佳。
微生物菌剂使用方法有多种,如喷雾、直接施与土壤、移栽后追施等。本文只采用了移栽前参苗浸泡在菌剂溶液中的方法,没尝试其它方法,对此有必要进一步研究。
[1] 傅俊范.药用植物病理学[M].北京:中国农业出版社,2007:146-148.
[2] Sunick Kim.Characteristics of occurrence and cultural,chemical control of Ginseng root rot[D].South Korea:Chungnam National University,006:5-7.
[][]
[3] Yoshida S,Hiradate S,Tsukamoto T,et a1.Antimicrobial activity of culture filtrate of Bacillusamyloliquefaciens RC-2 isolated from mulberry leaves[J].Phytopathology,2001,91:181-187
[4] 韩润亭,张金花,任金平.氯化苦液剂防治人参锈腐病田间药效试验[J].吉林农业科学,2008,33(4):32-33
[5] 马凤茹,邢云章.棉隆防治人参锈腐病试验初报[J].中药材,1985(02):8-9
[6] 王丽华,吕瑞绵,曹戎,等.土壤消毒防治西洋参、人参土传根病的研究[J].特产研究,1986(01):17-20
[7] 周文泽.化学农药的“过”与“功”[J].北京农业,2009(7):75-77
[8] 陈曦,孙晓东,毕思远,等.东北地区人参根际土壤真菌多样性研究[J].安徽农业科学,2010,38(10):5515-5517,5520.
[9] 李熙英,金海强,贾斌.不同生长年限的人参地土壤微生物多样性研究初报.延边大学农学学报[J].2011,33(2):133-136
[10] 李勇,赵东岳,丁万隆,等.人参内生细菌的分离及拮抗菌株的筛选[J].中国中医药杂志,2012,37(6):1532-1535
[11] 姜云,尹望,陈长卿,等.人参内生菌的分离及拮抗菌株的筛选[J].吉林农业大学学报,2012,34(3):517-521
[12] 周如军,傅俊范,卯婷婷,等.人参锈腐病拮抗细菌BS015最适发酵条件研究[J].吉林农业大学学报,2011,33(3):278-282
[13] 傅俊范,李玉娥,周如军,等.人参锈腐病拮抗细菌HN01发酵条件优化[J].沈阳农业大学学报,2012,43(1):12-17
[14] 李刚,赵义涛,姜晓莉,等.EM菌对人参锈腐病的防治研究[J].特产研究,2001,23(2):8-9
[15] 中华人民共和国国家质量监督检验检疫总局.GB20287-2006农用微生物菌剂国家标准[S].北京:中国国家标准化管理委员会,2006.
[16] 金海强,贾斌,李熙英.杨树腐烂病内生拮抗细菌鉴定及防治研究[J].中国森林病虫,2012,31(6):1-4.
.
