环阿尔廷烷型四环三萜化合物对HCT116细胞增殖、细胞周期和凋亡的影响
2018-01-19代晓丽邱明华张继虹
代晓丽,刘 静,年 寅,邱明华,张继虹
(1. 昆明理工大学医学院衰老与分子遗传学实验室;2. 中国科学院昆明植物研究所,云南 昆明 650500)
结直肠癌属于一种常见消化道系统恶性肿瘤,其发病率和死亡率较高[1],尤其是亚洲国家,包括中国[2]。目前,治疗结肠癌的有效药物非常少,急需探索开发[3]。升麻CimicifugafoetidaL.是毛茛科升麻属多年生草本植物,它的根茎(主要入药部分)已经收录在《中国药典》中。我国云南省的大理、香格里拉地区有丰富的云南升麻(C.yunnanensis)和绿升麻(C.foetida)[4]。目前,从升麻属植物中提取分离的单体化合物主要有环阿尔廷烷型三萜皂苷(如升麻醇和升麻亭)和肉桂酸衍生物(如咖啡酸和阿魏酸)。具有抗过敏、缓解妇女更年期综合症、抗肿瘤等广泛的药理活性[5]。研究发现,兴安升麻中三萜皂苷对急性粒细胞白血病细胞和肝癌细胞有很强的细胞毒作用,其机制可能与细胞周期抑制有关[6]。体外研究发现,具有细胞毒活性的三萜皂苷类化合物对12种人肿瘤细胞株具有一定杀伤效果,特别是肺癌A549细胞株效果明显[7]。同时,在人肿瘤裸鼠模型上也表现出对肿瘤生长的抑制作用[8]。另有研究发现,类叶升麻苷通过抑制小鼠皮层组织caspase-3基因表达,进而维持皮层组织神经细胞的正常形态及数量,对小鼠脑损伤具有明显保护作用[9]。从中药材的地域特异性出发,对取材于云贵高原的升麻提取物进行抗肿瘤活性研究,将对未来研究抗肿瘤药物提供依据。
1 材料与方法
1.1材料
1.1.1细胞株 人类结肠癌上皮细胞株(HT-29、HCT116、SW480)、人类乳腺癌细胞株(MCF-7、SK-BR-3、MDA-MB-468)购自中国科学院上海细胞库;正常野生型小鼠成纤维MEF细胞由本实验室提供。
1.1.2 受试化合物与试剂 化合物KY17由中国科学研究院昆明植物研究所提取、分离。噻唑蓝(MTT,货号M2128)、DMSO(货号D2650)、碘化丙啶(PI,货号P4170)均购自美国Sigma公司; Annexin Ⅴ(BD公司,货号556570);RPMI 1640 培养基 (Gibco 公司,货号30800-022);RNA 提取试剂盒(天根生物科技,货号DP419);凋亡染色试剂盒(北京四正柏生物公司,货号FXP021);胎牛血清(Biological Industries,货号04-001-1 B/A)。
1.2方法
1.2.1MTT法检测细胞增殖 细胞培养后,待细胞传代3次以上,选择生长稳定且处于对数期的细胞接种于96孔板中,在37℃ CO2培养箱内培养,使其贴壁生长。加药处理后,放回培养箱中培养72 h后,先观察药物处理后细胞生长情况、密度、形态等。再加入20 μL MTT(0.5 g·L-1),在培养箱中培养4 h。然后小心吸出培养基,并加入150 μL DMSO,在37℃避光恒温箱里震荡10 min,用酶标仪在490 nm波长下测定每孔的吸光值(OD)。根据OD值计算IC50值。
1.2.2PI染色测定细胞周期 以每孔5×105个细胞接种于6孔板中,待细胞贴壁之后,加药处理。药物处理时间到达后收集细胞,用1×PBS洗2次,1 000×g,离心5 min。用70%的乙醇4℃固定过夜。加入RNAnase 缓冲(Rnase A 1 μg·L-1,EDTA 20 mmol·L-1,1×PBS) 37℃温育30 min后,加入PI 工作液(1 mg·L-1),并轻轻混匀,常温避光染色2 h。流式细胞仪检测DNA含量变化,采用Flowjo7.6软件进行分析统计。
1.2.3AnnexinⅤ/PI双染色检测细胞凋亡 以每孔5×105个细胞接种于6孔板中,待细胞贴壁之后,加药处理。药物处理时间到达后,收集细胞。用400目的尼龙筛进行过滤,用血球计数板进行细胞计数,每个样品收集1×105个细胞。将细胞沉淀按照试剂盒的说明书,用100 μL的缓冲液重悬,每个样品加入5 μL的Annexin V-FITC,37℃避光染色20 min。每个样品加入10 μL的PI染液,37℃避光染色10 min。流式细胞仪检测,根据阴性对照组进行设门和调节电压,采用BD Accuri C6进行分析统计。
1.2.4蛋白免疫印迹技术 经药物处理后,收集细胞沉淀,再用细胞裂解液提取总蛋白。Bradford法进行蛋白定量。按照定量浓度,每孔上样量为15 μg,金属浴100℃恒温10 min,冷却后,上样。经4%~20%的梯度胶进行约1.5~2 h、180 V恒压SDS-PAGE电泳。待电泳结束后,将蛋白全部转移到PVDF膜上。转膜完毕,用PBST清洗2次,每次5 min。将膜放入PBST 配制的10%脱脂奶缓冲液中封闭1 h,再用PBST清洗3次,每次5 min。加入按1 ∶10稀释好的一抗,放于4℃摇床摇晃过夜。再用PBST清洗3次,每次5 min。加入用PBST稀释好的二抗,室温摇床摇晃1~1.5 h,PBST清洗3次,每次10 min。清洗干净的膜按顺序摆放在暗盒上,正面朝上,加上显影发光剂,检测蛋白。
1.2.5实时荧光定量PCR 每孔1×105个细胞接种于培养皿中,待细胞完全贴壁后,加药处理,试剂盒提取总RNA,用紫外分光光度仪测RNA浓度。参照First-Strand Synthesis System for q-PCR试剂盒说明书反转录成cDNA。将cDNA加ddH2O稀释,使用5×SYBR Green PCR Master Mix的反应体系分装到RT-PCR专用96孔板中,荧光定量PCR仪检测。引物序列如下:miRNA-34a Forward:5′-TGGCAGTGTCTTAGCTGG-3′,Reverse:5′-TATCCAGTG CGTGTCGTG-3′;U6 Forward:5′-CGCTTCACGAATTT GCGTGTCAT-3′,Reverse 5′-GCTTCGGCACATATACT AAAAT-3′;GAPDH Forward 5′-TGCACCACCAACTG CTTAG-3′,Reverse 5′-GGCATGGACTGTGGTCAT-3′。

2 结果
2.1KY17对肿瘤细胞增殖的影响为了检测升麻中提取的化合物对肿瘤细胞增殖的影响,我们选用了两株小鼠肿瘤细胞(p53-/-+v+Ras/p53-/-+s+Ras)和一株正常野生型小鼠成纤维(MEF)细胞。MTT检测结果表明,KY17作用于MEF细胞的IC50为27.28 μmol·L-1,作用于小鼠肿瘤胞的IC50分别为13.10 μmol·L-1和13.94 μmol·L-1,约为小鼠正常细胞的2.08和1.96倍(Tab 1),结果提示KY17具有一定的抗肿瘤活性。我们还检测了KY17对人类结肠癌上皮细胞(HT-29、HCT116、SW480)、人类乳腺癌细胞(MCF-7、SK-BR-3、MDA-MB-468)增殖的影响。结果表明,KY17的对结肠癌上皮细胞株具有抑制增殖的作用,对乳腺癌细胞株的抑制作用较小,且IC50值都大于50 μmol·L-1。KY17对HCT116细胞的抑制作用较明显,当KY17浓度到达1 μmol·L-1时,与对照组相比有明显的抑制作用,IC50值为9.31 μmol·L-1(Tab 1,Fig 1)。
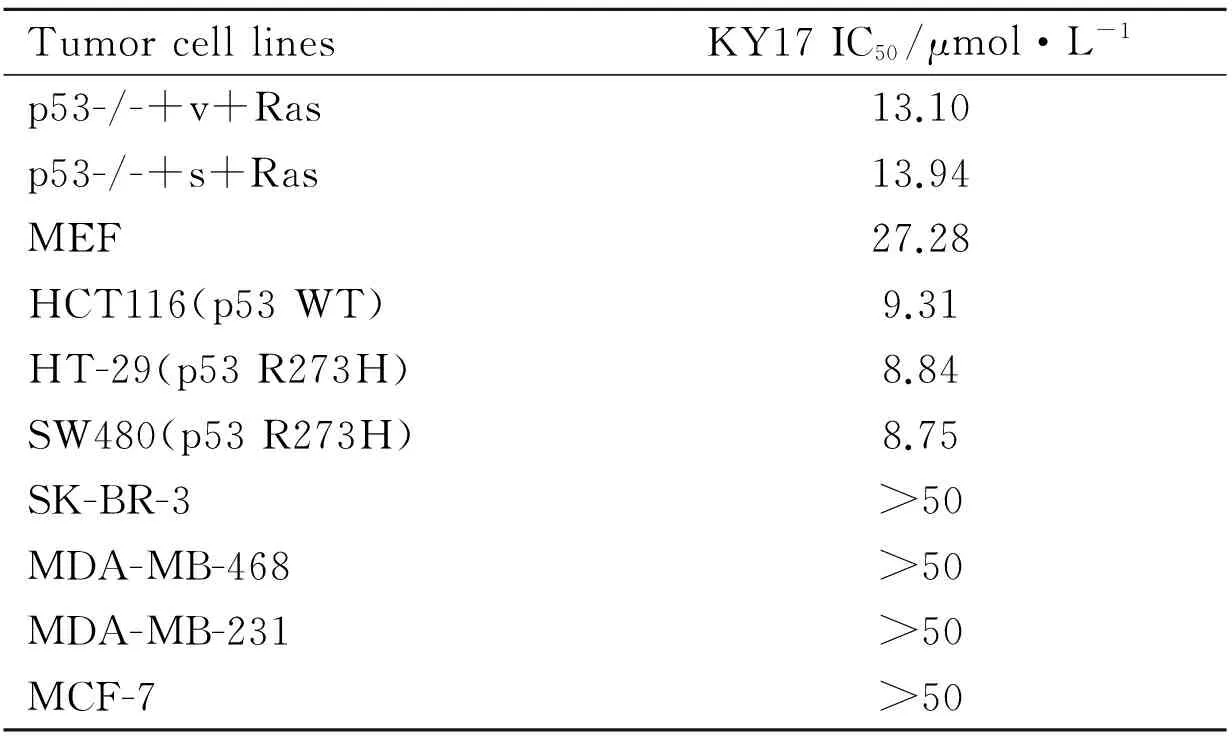
Tab 1 Tumor proliferation activity inhibited by KY17
2.2KY17对HCT116细胞周期的影响细胞周期调控紊乱导致的肿瘤细胞失控性增殖是恶性肿瘤最常见的生物学特征。因此,通过流式细胞仪检测KY17对HCT116细胞的周期变化情况。如Fig 2所示,与对照组(26.60%)相比,用KY17处理HCT116细胞的DNA合成期和分裂期(G2/M)的细胞比例增加,分别为36.61%、38.05%、38.91%,有浓度依赖性。结果表明,化合物KY17抑制结肠癌细胞增殖通过G2/M 期周期阻滞来实现。

Fig 1 KY17 inhibition of HCT116 cell proliferation detected by MTT assay
A: Chemical structure of KY17; B: KY17 on HCT116 cell proliferation.*P<0.05,**P<0.01vscontrol
2.3KY17诱导HCT116细胞凋亡KY17处理HCT116细胞48 h,AnnexinⅤ/PI 双染后,用荧光显微镜观察细胞的荧光强度。早期凋亡细胞膜上的磷脂酰丝氨酸(PS)外翻,并与AnnexinⅤ结合,出现绿色荧光。随着浓度增加,带有绿色荧光的细胞数量越来越多,表明早期凋亡的细胞比例增多(Fig 3A)。与对照组(2.04%)相比,KY17处理HCT116早期凋亡的细胞比例分别为14.26%、15.32%、30.46%。晚期凋亡的细胞核上易被PI染色,发出橙红色荧光。与对照组(0.8%)相比,KY17处理HCT116晚期凋亡的细胞比例为9.14%、13.87%、28.00%(Fig 3B)。
为了确证KY17能诱导HCT116凋亡,采用流式细胞术分析KY17处理24、48 h的HCT116细胞的凋亡情况。Fig 4结果显示,KY17处理24 h,早期凋亡比例趋于平稳;而与对照组(1.1%)相比,晚期凋亡的细胞比例增加至1.3%、6.2%、5.6%。KY17处理48 h,与对照组(3.6%)相比,早期凋亡的细胞比例增加至4.3%、5.0%、5.1%,晚期凋亡的细胞比例从对照组的2.3%增加至2.5%、3.5%、9.9%。结果表明,KY17呈浓度依赖和时间依赖性地诱导 HCT116 细胞凋亡。用Western blot检测凋亡相关蛋白PARP的表达情况。Fig 5结果显示,KY17处理后的细胞,PARP蛋白有切割。随着KY17浓度的增加,PARP蛋白切割越明显。相同浓度处理48 h的切割比24 h更加明显。以上结果表明,化合物KY17可诱导HCT116细胞凋亡。
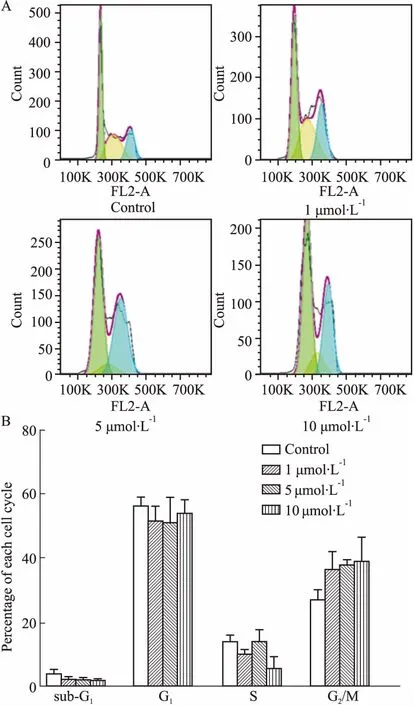
Fig 2 Effect of KY17 on cell cycle of HCT116 cells
A:KY17 histogram of HCT116 cells cycle; B: Quantitative map of KY17 on HCT116 cells.
2.4KY17对HCT116细胞miRNA表达影响p53是重要的抑癌基因,能够调节许多miRNA的表达。为了研究KY17是否调控miRNA的表达,用10 μmol·L-1的KY17处理HCT116细胞72 h后,qPCR检测发现KY17使HCT116 细胞的miRNA-34a上调1倍(Fig 6A)。同时,检测发现p53蛋白表达增加(Fig 6B)。
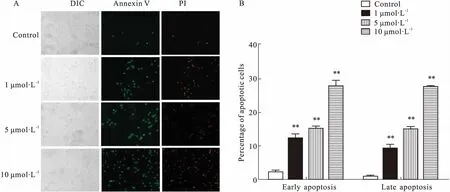
Fig 3 Effect of KY17 on apoptosis of HCT116 cells by fluorescence microscopy
A: Fluorescence microscopy was used to detect the apoptosis of HCT116 cells in KY17; B: Fluorescence microscopy was used for quantitative analysis of apoptosis.**P<0.01vscontrol

Fig 4 Effect of KY17 on apoptosis of HCT116 cells by flow cytometry
A: Flow cytometry was used to detect effect of KY17 on HCT116 cell apoptosis; B: Cell apoptosis quantitative bar graph.*P<0.05,**P<0.01vscontrol
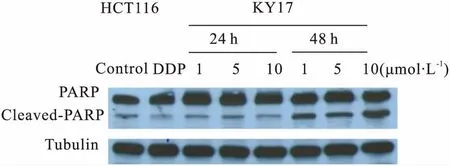
Fig 5 Effect of KY17 on HCT116 cell PARP protein expression by Western blot
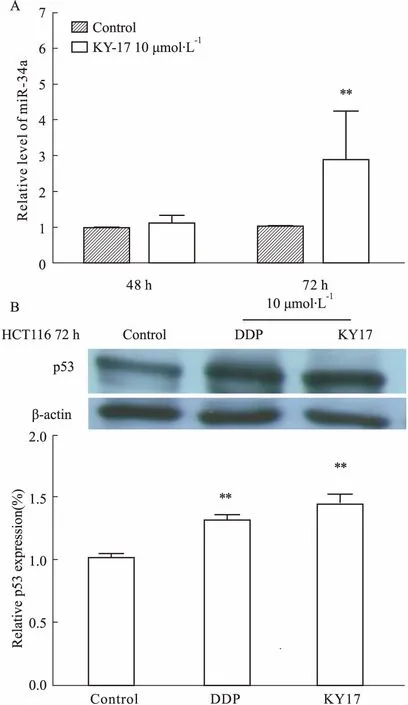
Fig 6 Effect of KY17 on miRNA-34a and p53 protein in HCT116 cells
A:Expression of miRNA-34a in HCT116 cells was detected by qPCR; B: Expression of p53 protein in HCT116 cells was analyzed by Western blot.**P<0.01vscontrol
3 讨论
近年来,包括本实验室在内的多个研究团队发现升麻中含有很多抗肿瘤的活性物质。本实验室先前研究发现KY17对乳腺癌细胞抑制活性较弱,但能诱导结肠癌HT-29细胞发生凋亡和自噬[10]。另有研究表明,从云南升麻中得到的新骨架分子Cimyunnins A-D存在乳腺癌抑制活性,这些分子的抗血管生成活性与一线药物舒尼替尼相当,它们代表了一种新颖的抗血管生成活性分子的结构模板[11]。与此同时,研究还发现,其中一个分子KHF16能够有效抑制三阴性乳腺癌(TNBC)细胞系(MDA-MB-468细胞、SW527细胞)的体外存活,降低XIAP、Mcl-1、Survivin和 Cyclin B1/D1等蛋白的表达水平,并能抑制TNBC细胞中NF-κB信号通路[12]。这些研究结果表明,来源于升麻的活性分子具有抑制多种肿瘤细胞增殖的活性,并且拓宽了研究者对升麻抗肿瘤活性的认识,为中药升麻的研究提供了思路。
本研究发现,升麻中环阿尔廷烷型四环三萜化合物KY17对HCT116细胞具有抑制增殖的作用,并且呈现药物浓度依赖性。这种抑制增殖的作用通过诱导HCT116细胞G2/M期阻滞和细胞凋亡来实现。我们还发现KY17激活PARP蛋白表达,进而诱导HCT116细胞凋亡。但是,细胞周期调控和细胞凋亡涉及多因子和多层次作用,还需要进一步研究探索。
p53是最重要的抑癌基因,研究发现p53能够调节许多miRNA的表达[13]。其中,miRNA-34a是一类在进化上高度保守的miRNA,其主要功能包括细胞周期的阻滞和诱导细胞凋亡[14]。同时,DNA的损伤也能诱导miRNA-34a的表达上调,而miRNA-34a的上调依赖于p53基因的激活[15]。本研究初步探索发现,KY17作用于HCT116细胞会诱导p53激活,同时诱导miRNA-34a上调。因此,KY17诱导HCT116细胞周期阻滞和凋亡是通过激活PARP和p53表达,上调miRNA-34a来实现的。新分子化合物通过调控肿瘤细胞的信号通路,诱导细胞凋亡和细胞周期阻滞来抑制增殖的研究是当今的热点,这也为本研究提供了方向。
(致谢:本实验在昆明理工大学医学院衰老与分子遗传学实验室完成,在此致以由衷的感谢!)
[1] Jemal A,Bray F,Center M M,et al. Globlal cancer statistics[J].CAcancerJClin,2011,61(2):69-90.
[2] Xiong F, Wu C, Bi X, et al. Risk of genome-wide association study-identified genetic variants for colorectal cancer in a Chinese population[J].CancerEpidemiolBiomarkersPrev,2010,19(7):1855-61.
[3] Laubert T, Habermann J K, Hemmelmann C, et al. Metachronous metastasis- and survival-analysis show prognostic importance of lymphadenectomy for colon carcinomas[J].BMCGastroenterol,2012,12:24.
[4] Yamakuchi M, Ferlito M, Lowenstein C J. MiR-34a repression of SIRT1 regulates apoptosis[J].ProcNatlAcadSciUSA,2008,105(36):13421-6.
[5] 曹 丽,杨卫彬,潘瑞乐,等.兴安升麻总苷抗肿瘤药效研究[J].中国中医药信息杂志, 2008,15(12):31-3.
[5] Cao L,Yang W B,Pan R L,et al. Experimental study on antitumor effects of total glycoside of Cimicifuga dahurica Maxim[J].ChinJInfTraditChinMed,2008,15(12):31-3.
[6] Gao J C,Huang F,Zhang J H,et al. Cytotoxic Cycloartane Triterpene Saponins from Actaea asiatica[J].JNatProd,2006,69(10):1500-2.
[7] Sun L R,Qing C,Zhang Y L,et al. Cimicifoetisides A and B, two cytotoxic cycloartane triterpenoid glycosides from the rhizomes of Cimicifuga foetida, inhibit proliferation of cancer cells[J].BeilsteinJOrgChem,2007,3:3.
[8] 吴德松,卿 晨.升麻药理学活性研究进展[J].医学综述,2009,15(6):918-20.
[8] Wu D S,Qing C. Investigation progress on pharmaclogical activities of Cimicifuga Rhizoma[J].MedRecapitulate,2009,15(6):918-20.
[9] 彭晓明,高 莉,霍仕霞,闫 明.类叶升麻苷对阿尔采末病小鼠皮层caspase-3基因表达的影响[J].中国药理学通报, 2014,30(12):1763-8.
[9] Peng X M, Gao L, Huo S X, Yan M. Effects of acteosideon expression of caspase-3 in cerebral cortex of mouse models of Alzheimer’s disease[J].ChinPharmacolBull,2014,30(12):1763-8.
[10] Dai X L,Liu J,Nian Y,et al.A novel cycloartane triterpenoid from Cimicifuga induces apoptotic and autophagic cell death in human colon cancer HT-29 cells[J].OncolRep,2017,37(4):2079-86.
[11] Kong Y J,Nian Y,Liu T Y,et al. New Anti-angiogenic leading structure discovered in the fruit of Cimicifuga yunnanensis[J].SciRep,2015,5:9026-33.
[12] Kong Y J,Nian Y,Zhou Z M,et al.KHF16 is a leading structure from Cimicifuga foetida that suppresses breast cancer partially by inhibiting the NF-kB signaling pathway[J].Theranostics,2016,6(6):875-86.
[13] He L,He X,Lim L P,et al.A microRNA component of the p53 tumour suppressor network[J].Nature,2007,447(7148):1130-4.
[14] Hermeking H.The miR-34 family in cancer and apoptosis[J].Cell DeathDiffer,2010,17(2):193-9.
[15] Tazawa H,Tsuchiya N,Izumiya M,Nakagama H.Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J].ProcNatlAcadSciUSA,2007,104(39):15472-7.
