宁前胡愈伤组织诱导初探
2018-01-17吴沿胜吴沿友邢德科刘宇婧黎明鸿姚香平
吴沿胜,吴沿友,2,邢德科,刘宇婧,于 睿,黎明鸿,姚香平
(1.江苏大学农业装备工程学院现代农业装备与技术教育部重点实验室,江苏 镇江212013;2.中国科学院地球化学研究所环境地球化学国家重点实验室环境生物科技研究中心,贵州 贵阳550081)
宁前胡,学名白花前胡(Peucedanum praeruptorum Dunn),为多年生伞形科(Umbelliferae)前胡属(Peucedanum)野生草本植物[1],以干燥根入药,具有降气化痰、散风清热之功效[2]。前胡始载于《名医别录》,至今有1 500多年的悠久用药历史。安徽宁国盛产道地药材白花前胡,该地所产前胡以个大皮黑、条长肉黄、质地柔软、气味浓郁等特点在中药界享有“宁前胡”之美誉[3]。由于连年采挖,野生资源逐渐枯竭,20世纪90年代末,由宁国医药局牵头开展了野生宁前胡改家种试验并取得成功[4]。目前人工栽培宁前胡多采用种子繁殖和分根繁殖[4],分根繁殖系数低,用种量大,长期分根无性繁殖易导致分叉现象严重[5],伴有变异发生[6],种性退化[7],品质下降。而种子繁殖萌发率低[8],出苗不整齐。另外,宁前胡栽培品种次年易出现抽薹现象,这些问题严重制约了宁前胡的可持续发展。利用组织培养技术可以避免种性退化和遗传变异,高繁殖率也为宁前胡工厂化育苗提供可能。目前有关前胡组织培养的报道并不多见,李忠谊等[9]采用前胡幼苗切段通过愈伤组织诱导分化出胚状体并再生成完整植株,其细胞悬浮培养物同样能分化出胚状体发育成完整植株。王济玫等[10]研究了前胡原生质体培养并成功再生出完整植株,发现蜗牛酶对原生质体的游离起显著作用。彭菲等[11]采用正交设计法以紫花前胡叶柄为外植体成功诱导出愈伤组织,并在愈伤组织中检测出香豆素成分。本实验以野生宁前胡根、茎、叶3种外植体和新型植物生长调节剂TDZ对愈伤组织诱导和生长进行研究,旨在为宁前胡高效快速繁殖提供有效途径,对宁前胡野生资源保护和发展提供相关依据。
1 材料与方法
1.1 材 料
1.1.1 植 物
于安徽省宁国市万家乡西泉村向北约3.1 km(119°9′E,30°21′N)挖取当年4月份优质野生宁前胡实生苗并移栽至江苏大学农业装备工程学院温室大棚,用于组织培养所需的根、茎、叶等外植体均取自同一健壮植株。
1.1.2 试 剂
2,4D、6BA、KT、NAA、TDZ均为美国Sigma公司产品,购自北京索莱宝科技有限公司;蔗糖、琼脂、无水乙醇、Tween20等常规试剂购自国药集团化学试剂有限公司;0.1%HgCl2和MS培养基为本实验室自配。
1.2 方 法
1.2.1 外植体消毒
以长势良好的宁前胡植株的根、茎、叶为材料,分别用75%酒精灭菌30 s,无菌水冲洗3~5次,再用0.1%HgCl2分别消毒15,12 min和10 min(根据预实验结果),无菌滤纸吸干水分,用无菌手术刀将叶片切成0.25 cm2的方块,茎段切成长度约为1.0 cm的小段;根切成0.5 cm3的方块。
1.2.2 培养条件
若无特殊声明,温度控制为(25±3)℃、空气相对湿度保持40%~60%、光照时长12 h/d、光照强度1 500~2 000 lx、MS培养基、琼脂8.0 g/L、蔗糖30 g/L,p H=5.8~6.0。
1.2.3 实验数据统计与分析
采用Excel软件对原始数据进行录入和整理,采用SPSS 20.0进行数据分析,其中包括方差分析和Duncan法进行多重比较。
愈伤组织诱导率(%)=形成愈伤的外植体块数/接种后未污染的植体块数×100%。
2 结果与分析
2.1 不同激素组合对外植体愈伤组织诱导的影响
宁前胡同一植株不同部位外植体诱导形成的愈伤组织能力差异性很大。由表1可看出,宁前胡3种不同外植体在18种愈伤诱导培养基上均可成功诱导出愈伤组织,其中以叶片诱导率最高,在13号培养基上诱导率高达95.56%,与其他愈伤诱导结果相比具有显著性差异;茎段在4号培养基上的愈伤组织诱导率最高为80.00%;根在4号和16号培养基上具有相同的愈伤诱导率,最高为78.89%。

表1 不同激素组合对外植体愈伤组织诱导的影响
另外,宁前胡的不同外植体接种到愈伤组织诱导培养基上后,愈伤组织的生长情况也有很大差异。将宁前胡离体叶片接种在愈伤诱导培养基,暗培养1周后叶片开始卷曲膨大,在切口四周产生黄绿色或奶白色的愈伤组织(图1 a),而未卷曲膨大的叶片则变黄变褐,直至枯死(图1 b)。宁前胡茎段在愈伤诱导培养基上进行暗培养10 d左右,茎段切口两端开始膨大,继续培养3~5 d切口两端膨大处长出少量黄绿色颗粒状愈伤组织,继续培养一段时间后可在大多数愈伤诱导培养基上观察到明显的质地紧密的黄绿色愈伤组织,由茎段产生的愈伤组织呈典型的哑铃状(图1 c)。与叶片和茎段相比,宁前胡根愈伤组织形成缓慢,接种在愈伤诱导培养基上暗培养2周后逐渐产生质地紧密的黄绿色颗粒状愈伤组织或者少量褐色的愈伤组织且愈伤组织生长缓慢(图1 d,e)。
2.2 不同外植体诱导的愈伤组织性状特征
3种不同外植体诱导出的愈伤组织在形态特征方面也表现出不同的差异:叶片愈伤组织多为颗粒状聚集起来的浅白色的疏松易碎或者黄绿色、质地紧密型愈伤组织块(图1 f,g);茎段愈伤组织在茎段两端膨大,形似哑铃,多是质地紧密的黄绿色愈伤组织块;由根形成的愈伤组织呈浅黄绿色或者是褐色,质地紧密,愈伤组织块上凹凸分明。因此,在宁前胡组织培养中,叶片是最佳的愈伤组织诱导外植体,其次分别是茎段和根。

表2 不同外植体诱导愈伤组织的比较
2.3 光照对叶片愈伤组织诱导的影响
选取宁前胡健康植株的离体叶片,接种于叶片愈伤组织最佳诱导培养基(13号培养基)上,进行不同光照条件培养(见表3和表4)。从表3可以看出,黑暗条件有利于宁前胡叶片愈伤组织的形成。而光照500 lx的条件下,叶片愈伤诱导率效果与黑暗条件相比有显著性差异,愈伤诱导率为78.89%,通过观察发现,随着光照强度的增加,叶片愈伤组织诱导率呈下降趋势,光照为2 500 lx时,愈伤诱导率降低到16.67%,且形成的愈伤组织发生褐化,呈紫褐色(图1 h),愈伤组织较小,随后逐渐死亡。实验表明,避光条件有利于提高宁前胡叶片愈伤组织诱导率。
由表4可知,宁前胡叶片愈伤组织的形成因为黑暗条件快速启动,但是愈伤诱导率随着黑暗培养时间的延长而降低。黑暗条件下分别诱导14,21,28 d,诱导率之间存在显著性差异,与此同时愈伤组织颜色和生长状态随着黑暗处理时间的延长状况变差。本研究表明,短时间的暗培养对宁前胡离体叶片愈伤组织的诱导和愈伤组织生长状况不会产生很大影响,而较长时间的暗培养不仅严重抑制宁前胡离体叶片生长,而且对愈伤组织诱导和生长状况产生不良影响。
综合表3和表4的实验结果,宁前胡叶片愈伤组织诱导初始阶段需要在无光或者弱光条件下进行暗培养1周左右,暗培养时间过短或者过长都不利于愈伤组织形成和生长;暗培养1周后逐渐增加光照强度有利于愈伤组织形成,保持愈伤组织健康生长,这样利于后期愈伤组织分化出不定芽。
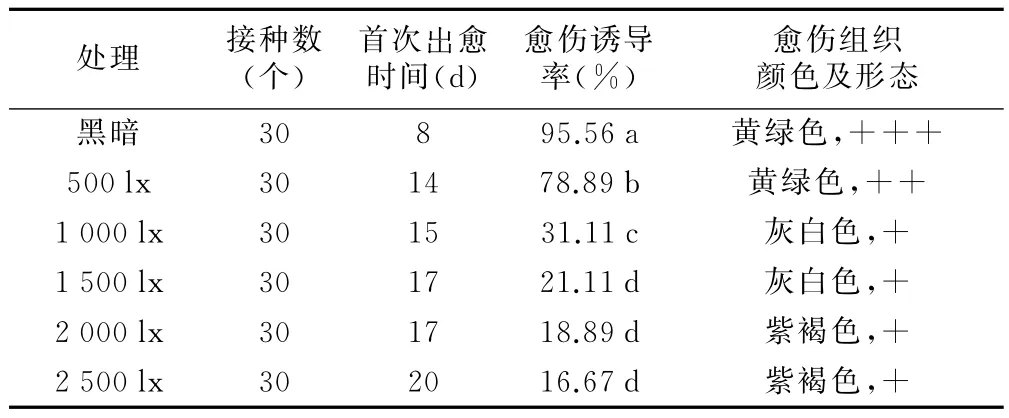
表3 光照条件对叶片愈伤组织诱导的影响

表4 黑暗处理对叶片愈伤组织诱导的影响
2.4 叶片放置方式对愈伤组织诱导的影响
选取宁前胡健康植株的离体叶片,接种在13号培养基上进行暗培养。由表5可知,宁前胡离体叶片的不同放置方式直接影响到愈伤组织首次!愈时间和愈伤诱导能力强弱,以远轴面向下的接种方式更加适合于宁前胡叶片愈伤组织的诱导。出现这种结果很可能与宁前胡叶片自身结构有一定联系。

表5 叶片放置方式对愈伤组织诱导的影响
3 结论与讨论
在植物组织培养过程中,愈伤组织的诱导、生长和发育受到诸多因素的影响,如外植体类型、植物生长调节剂、培养基种类、光照条件、温湿度等。愈伤组织通过分化呈组织器官、体细胞胚途径可再生为完整植株,是濒危植物种质资源保存、遗传操作获得转基因植物、无病毒试管苗生产、工厂化育苗的前提条件。通常,白色、球型的愈伤组织用于体细胞胚的发生;绿色、瘤状愈伤组织多用于器官的发生[12]。本实验结果表明,宁前胡的3种外植体均能成功诱导出愈伤组织,尤以宁前胡叶片的诱导效果最好,其次分别是茎段和根。

图1 宁前胡愈伤组织形态
植物生长调节剂种类、配比及其浓度关系对组织培养的成功至关重要。本研究中,TDZ对宁前胡叶片愈伤组织的诱导表现出显著的促进作用,MS+NAA 0.5 mg/L+TDZ 0.05 mg/L的叶片愈伤组织诱导率达到最高(95.6%),而使用2,4D诱导的愈伤组织多呈白色、疏松易碎状态,在诱导初始阶段,叶片切口四周先形成毛绒化愈伤组织后向中间聚拢(图1 i),随着2,4D浓度的增加,愈伤组织诱导率也呈上升趋势;NAA 0.5 mg/L+6BA 2.0 mg/L组合更适合茎段愈伤组织的诱导,而细胞分裂素6BA在宁前胡茎段愈伤组织诱导中的作用明显强于TDZ和KT,茎段诱导出来的愈伤组织以黄绿色、质地紧密型哑铃状愈伤组织为主;由根诱导出来的愈伤组织适宜在NAA 0.5 mg/L+6BA 2.0 mg/L 或者2,4D 2.0 mg/L+KT 0.5 mg/L组合的培养基上进行诱导,而低浓度的TDZ对根愈伤组织诱导也有一定促进作用,但是高浓度TDZ(0.5 mg/L)则对愈伤组织产生毒害作用,其诱导出的愈伤组织多为褐色,培养一段时间后渐渐死亡。TDZ是一种苯基脲衍生物,作为一种高效的细胞分裂素,在诸多的木本植物离体再生研究中表明,适宜浓度的TDZ能有效促进再生难度大的植物分化[1315]。
光照对外植体愈伤组织的增殖和分化有很大的影响,主要表现在光强、光质和光周期方面。文涛等[16]研究不同光照强度对虎杖愈伤组织诱导发现,暗光有利于虎杖愈伤组织的形成。刘蓉等[17]发现PPO和PAL酶基因上调表达显著提高了PPO和PAL酶活性,是引起葡萄愈伤组织褐变的主要原因,这与姜翠翠等[18]研究结果一致。此外,有研究表明,黑暗或者较低光照强度有利于愈伤组织的诱导,但不利于愈伤组织的生长[1920],这与本研究结果一致,宁前胡外植体前期在黑暗或者低光照度暗培养愈伤组织呈现黄绿色、质地紧密,生长快速且不易衰老和褐化,但随着光照强度的逐渐增强,愈伤组织颜色开始失绿,由乳白色转变为褐色,最后死亡。这可能是由于光照强度的增加提高了相关酶活性[1718],引起愈伤组织中酚类物质氧化加剧褐化程度[21]。而酚类物质的合成和氧化有关的酶是光诱导型酶,将酚类物质氧化成醌类物质是组织培养中导致褐化的最直接原因之一[22]。研究还发现,弱光培养产生的乳白色愈伤组织生长迅速,质地外松内紧,不易褐化和衰老,更适宜转接和增殖。
近年来,一些植物组培实验对外植体不同放置方式对愈伤组织诱导和不定芽再生影响进行了相关研究。张江丽等研究表明,外植体放置方式对桔梗叶片愈伤组织诱导时间和丛生芽数目有关,而对诱导率无影响,均达到100%诱导率,但是近轴面朝下愈伤组织出芽更快[23]。曹斌等观察到马铃薯叶片近轴面向下不定芽诱导率明显高于近轴面向上[24]。而谢利等研究发现,叶片垂直放置对老虎须愈伤诱导率最高,为66.67%,其次依次为正面向下和正面向上水平放置[25]。杨树[26]、柿[27]、梨[28]、鸡心枣[29]的叶片近轴面接触培养基能高效的诱导出愈伤组织,且不定芽再生率高,这与宁前胡叶片离体培养放置方式所产生的结果具有一致性。产生这一结果的原因可能与叶片的结构有关,远轴面接触培养基时,角质层、维管束、木质部朝下,韧皮部朝上,这些结构紧密不易于营养和激素的运输;近轴面接触培养基时,由于背面分布较多的气孔,栅栏组织和海绵组织朝下,背面角质层不发达,这种情况有利于外植体吸收营养和激素。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,2004.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015.
[3]向继仁.宁前胡的道地性研究[J].亚太传统医药,2007(7):5456.
[4]向继仁.宁前胡仿野生栽培技术研究[J].现代中药研究与实践,2006,20(4):1820.
[5]邱晓霞,张玲,岳婧怡,等.宁前胡中3种香豆素含量影响因素的考察[J].中药材,2016(4):713716.
[6]谢贤明,李娟,韦卡娅.不同变异类型白花前胡同工酶分析[J].中国现代中药,2009,11(1):78.
[7]林海,郝慧敏.黄精愈伤组织诱导条件研究[J].江苏农业科学,2011(5):4445.
[8]胡之璧.白芷、前胡、防风等伞形科植物的种子发芽试验[J].南京药学院学报,1961(6):2429.
[9]李忠谊,陈惠民.前胡组织培养和细胞悬浮培养中胚状体发生及植株再生[J].山东大学学报(自然科学版),1988(3):120124.
[10]王济玫,陈惠民.前胡原生质体再生植株[J].植物学报,1991(4):261266.
[11]彭菲,凌红,胡永芳.正交设计法优选紫花前胡组织培养基[J].中药材,2001(7):471472.
[12]PérezJiménez M,LópezSoto M B,CosTerrer J.In vitro callus induction from adult tissues of peach(Prunus persicaL.Batsch)[J].In Vitro Cellular& Developmental BiologyPlant,2013,49(1):7984.
[13]王勇,任淼,杨元.噻苯隆(TDZ)在红掌组织培养中的应用[J].天津农业科学,2013(9):1214.
[14]蔡翼,李志娟,白明珍,等.不同激素组合对尾叶桉愈伤组织分化的影响[J].湖北农业科学,2014(9):2 1772 180.
[15]孙洪雁,陶吉寒,辛力,等.TDZ和BA对金花梨和鸭梨叶片不定芽再生的影响[J].山东农业科学,2016(1):2628.
[16]文涛,梁莉,曾杨,等.不同光照强度对虎杖愈伤组织的影响[J].中国中药杂志,2007(13):1 2771 280.
[17]刘蓉,杨国伟,吴月燕,等.光照强度对葡萄愈伤组织形成过程中相关酶活性和基因表达的影响[J].生物工程学报,2015(8):1 2191 229.
[18]姜翠翠,陈桂信,潘东明,等.木奈生长发育过程中和受机械损伤后PPO 基因的表达[J].园艺学报,2012(2):363369.
[19]刘航空,韩明玉,禹婷,等.影响油桃叶片产生胚性愈伤组织的因素[J].果树学报,2006(3):370374.
[20]Abdollahi H,Muleo R,Rugini E.Optimisation of regeneration and maintenance of morphogenic callus in pear(Pyrus communisL.)by simple and double regeneration techniques[J].Scientia Horticulturae,2006,108(4):352358.
[21]Marks T R,Simpson S E.Reduced phenolic oxidation at culture initiation in vitro following the exposure of fieldgrown stockplants to darkness or low levels of irradiance.[J].Journal of Horticultural Science,1990:103111.
[22]Scorza R,Cordts J M,Gray D J,et al.Producing Transgenic‘Thompson Seedless’Grape(Vitis viniferaL.)Plants[J].Journal of the American Society for Horticultural Science,1996,121(4):616.
[23]张江丽,李培飞,苑雄雄,等.桔梗高效离体再生体系的建立[J].湖北农业科学,2015(21):5 4365 438.
[24]曹斌,刘光明,朱传霞.马铃薯叶片外植体再生系统的建立[J].湖南城市学院学报(自然科学版),2010(2):4951.
[25]谢利,周欢,曾瑞珍,等.老虎须的组织培养研究[J].种子,2015,34(8):9194.
[26]沈周高,项艳,蔡诚,等.3个杨树品种叶片再生体系的建立[J].中国农学通报,2006(11):9096.
[27]刘月英,马俊莲,唐霞,等.柿叶片不定芽再生的研究[J].湖北农业科学,2006(5):618621.
[28]周莉莉,蔡斌华,乔玉山,等.不同处理对丰水梨离体叶片不定芽再生的影响[J].南京农业大学学报,2007(2):3438.
[29]王慧瑜,马锋旺,张晓申,等.鸡心枣试管苗叶片再生植株的研究[J].中国南方果树,2007(4):4850.
