席夫碱Cu(II)络合物的超分子螺旋手性及其手性光谱
2018-01-13曾丽丽万仕刚
曹 石 曾丽丽 谢 菁 万仕刚 李 丹 章 慧
席夫碱Cu(II)络合物的超分子螺旋手性及其手性光谱
曹 石 曾丽丽 谢 菁 万仕刚 李 丹 章 慧*
(厦门大学化学化工学院化学系,福建 厦门 361005)
本文通过不同的手性二胺(pn = 1,2-丙二胺、chxn = 1,2-环己二胺、dpen = 1,2-二苯基乙二胺)与脱氢乙酸(dha)缩合,获得了N2O2型手性席夫碱配体(dha-en),进而合成了相应的三对手性席夫碱Cu(II)络合物([Cu(dha-/-pn)] (1a和1b)、[Cu(dha-,/,-chxn)] (2a和2b)、[Cu(dha-,/,-dpen)] (3a和3b),对其进行的固体和溶液电子圆二色(ECD)及溶液振动圆二色(VCD)光谱测试表明,这些化合物在固体和溶液状态下的金属中心的主要配位模式和绝对构型基本一致。此外,通过单晶结构分析发现:对于络合物2a/2b以及3a/3b,中心金属Cu(II)除了与手性dha-en四齿配位外,还与相邻分子内酯环上的羰基发生弱的轴向配位形成一维超分子螺旋链,即实现了配位键构筑的席夫碱络合物的手性超分子自组装。本文对两对手性络合物2a/2b以及3a/3b的手性结构基元及其与超分子螺旋之间的关系进行了讨论。将本文所获实验VCD光谱数据与文献报道的相关数据进行比对分析,可以相互印证,并呈现一定的绝对构型关联规律且具有手性配位立体化学结构的指纹特征。
席夫碱Cu(II)络合物;电子圆二色;振动圆二色;单晶结构;超分子手性组装
1 引言
1933年,配位化学创始人Werner的学生Paul Pfeiffer首次制备了四齿席夫碱配体salen(水杨醛与乙二胺缩合的产物),并将其应用于[CoII(salen)]的人工可逆载氧,由此开创了salen配体及其金属络合物研究和应用的先河。1990年,Jacobsen等1–3率先应用取代的水杨醛与手性环己二胺缩合所得salen-Mn(III)络合物催化非官能化烯烃的不对称环氧化反应,随后,与手性salen类络合物相关的基础和应用研究更加引起科学家们的关注,各种结构迥异的手性席夫碱络合物合成和应用的报道层出不穷。1996–2000年,Kureshy等采用脱氢乙酸、水杨醛衍生物与手性二胺缩合,相继合成出含非对称4或对称5(此处的非对称和对称特指中心金属两侧N-O配位五元螯环及其取代基的异同)手性N2O2型席夫碱配体的系列手性金属络合物[M = Mn(III)、Ru(III)、Ni(II)],它们在上述不对称催化环氧化反应中亦获得不俗的应用。
Pasini等曾对手性salen络合物中金属的配位环境(配位数、配位多面体和手性二胺取代基的性质)、螯环构象、溶液ECD光谱和绝对构型关联进行了详细研究6,所得数据迄今仍有重要参考价值7。伴随着近期集成手性光谱技术的迅猛发展,结合单晶结构测试(或关联)的ECD和VCD光谱及其理论计算等手性结构分析技术,已经成为表征各类手性席夫碱络合物[包括四齿salen7–9、四齿氮(N4型)席夫碱10,11、二(双齿)席夫碱12–14、三齿席夫碱15配体配位的四配位或五配位络合物]精细手性配位立体化学结构的主流研究方法7。
近十多年来,本课题组对四配位手性席夫碱Ni(II)络合物的手性配位立体化学与ECD光谱及其绝对构型关联进行了一系列探究7,16–21,其中特别关注了由脱氢乙酸衍生的对称和非对称的N2O2型席夫碱Ni(II)络合物在可见区ECD信号的符号与其绝对构型关联的研究7,16,18–21。最后,终于通过与山西大学王越奎教授合作,对[Ni(sal-,- chxn)][sal-,-chxn = (,)-N,N-双(亚水杨基)- 1,2-二亚氨基环己烷]的溶液ECD光谱进行理论计算,解决了长期以来悬而未决的问题,即,我们的研究表明:可见区第一个ECD吸收带主要是→荷移跃迁(LMCT)所致,而不是通常认为的–跃迁,并以此指纹信号来指认具有“闭壳层”电子结构的其它准平面四方型手性[Ni(salen)]和六配位-[CoIII(salen)L2]络合物的金属中心绝对构型。同时,我们还欣喜地发现:由于8组态的准平面四方形席夫碱M(II)络合物(M = Ni、Pd、Pt)在可见区具有类似的荷移跃迁(LMCT或MLCT)性质,则这一绝对构型关联规则或可以进一步拓展,对此研究结果我们将另外撰文讨论。
Downing等22曾经报道了一系列salen类及相关N2O2型席夫碱Cu(II)络合物的ECD光谱,认为可通过其“双生色团”(紫外区的激子裂分和可见区的跃迁信号)特征来关联手性Cu(II)络合物的绝对构型。Pasini等6获取了系列手性[M(salen)] [M = Cu(II)、Ni(II)]络合物的溶液ECD光谱,根据激子手性方法推测了[Cu(salen)]衍生物的螯环构象和金属中心绝对构型。Szlyk等23则进一步对非对称N2O2型手性席夫碱Cu(II)络合物进行了晶体结构和ECD光谱表征,也采用激子手性方法关联了其绝对构型。但由于系列[Ni(salen)]衍生物的准平面性,其溶液ECD光谱在紫外区并未呈现明显的激子裂分特征6,7,使得难以确认金属中心绝对构型和螯环构象,因此我们确立了上述以可见区第一个ECD吸收带的符号来关联金属Ni(II)中心绝对构型的规则7。
已知[Cu(salen)]与[Ni(salen)]具有不同的中心金属电子组态与几何构型(前者更倾向于形成准四面体结构),不宜对它们采用类似的绝对构型关联规则。而对于本文所研究的手性[Cu(dha-en)]络合物而言,应用ECD光谱对其进行绝对构型表征更有其局限性:(1) 基于–跃迁生色团的绝对构型关联法对中心金属电子构型、配位环境(几何构型和对称性)和配位螯环的一致性有非常严苛的要求24;另从仪器测试的角度来看,一些旧型号的ECD光谱仪,对高于650 nm乃至近红外波段的ECD光谱扫描,难以企及;再者,当某些[Cu(dha-en)]的配位基元采用准平面构型时,金属中心跃迁的宇称禁阻特征24将严重阻碍在可见区对相关ECD吸收峰的观察。换句话说,在后两种情况下,可见区跃迁的ECD信号能提供的绝对构型关联信息十分有限,很难作为确定的指纹特征。(2) 当dha-en配体上存在其它ECD生色团的干扰时,在紫外区的甲亚胺基团吸收波段不易观察到系列[Cu(dha-en)]络合物的激子裂分现象,并不能采用类似于经典[Cu(salen)]衍生物6或非对称N2O2型手性席夫碱Cu(II)络合物23ECD光谱的激子耦合现象来判断其金属中心的绝对构型。因此,欲对其手性配位立体化学结构进行精准表征,还需要另辟蹊径。
此外,仔细考察和比较图1所示的[Cu(salen)]和[Cu(dha-en)]络合物的结构,可以发现,两者的配位环境非常相似,主要差别在于配位内界的第三层(见图2):在[Cu(dha-en)]中含有两个甲基取代的甲亚胺基,而配体内酯环上的羰基除了可能对甲亚胺基的ECD生色团产生微扰作用外,在构筑配位键中亦可能起着某些微妙作用。遗憾的是,除了Kureshy等曾对三个手性[Ni(dha-en)]络合物(en =-pn、,-dpen和,-dpen)的晶体结构做出一定描述5,以及本课题组对系列手性[Ni(dha-en)]络合物溶液和固体ECD光谱的详细研究7,16–21外,文献上没有任何关于[Cu(dha-en)]络合物的晶体结构报道,并且迄今仍无从获得已知手性[Ni(dha-en)]衍生物晶体结构的细节。
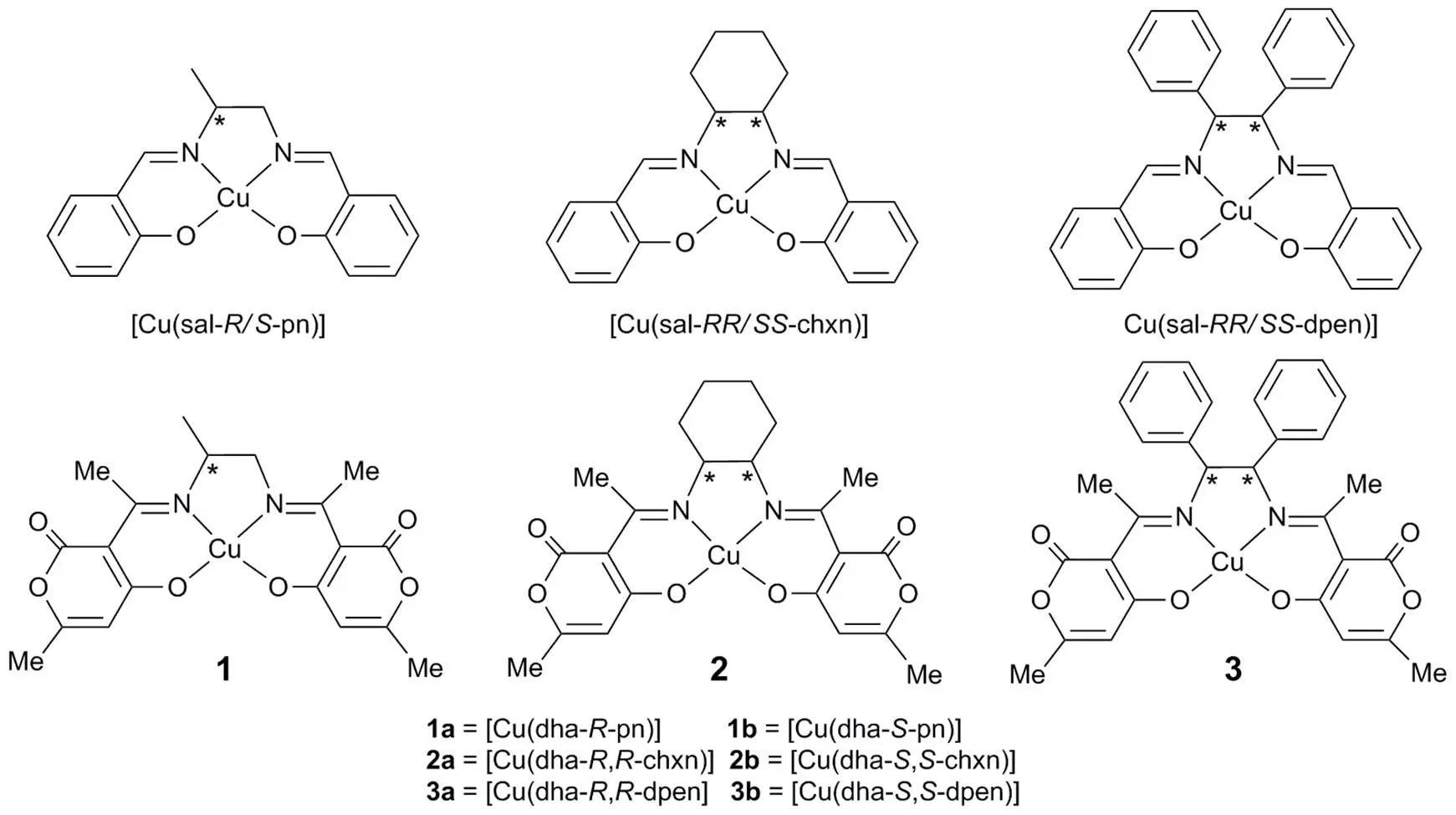
图1 手性席夫碱Cu(II)络合物的分子结构及其缩写

图2 单核手性[M(dha-chxn)]络合物配位内界的三个层次
在上述研究工作和相关文献报道的基础上,本文以手性[Cu(dha-en)]络合物为例,通过固体和溶液ECD光谱、溶液VCD谱表征,及其晶体结构所呈现的超分子螺旋手性来观察固态和溶液结构的差异,获得了一些令人感兴趣的实验结果。
2 实验部分
2.1 仪器与试剂
试剂:手性1,2-丙二胺(pn)、手性1,2-环己二胺(chxn)、手性1,2-二苯基乙二胺(dpen)、脱氢乙酸(dha)均购于百灵威科技有限公司,乙酸铜[Cu(OAc)2·H2O]、三乙胺、氯化钾、无水乙醚、无水乙醇、甲醇均购于国药集团化学试剂公司。所有商品化试剂均为分析纯,使用前未经纯化。
仪器;德国布鲁克公司Esquire 3000 plus电喷雾离子阱质谱仪、日本JASCO公司J-810型圆二色光谱仪、美国BioTools ChiralIR-2X VCD光谱仪、日本理学电机株式会社Rigaku R-AXIS SPIDER Image Plate单晶X射线衍射仪、德国布鲁克公司SMART Apex CCD单晶X射线衍射仪、中国天津天光光学仪器有限公司FW-4型压片机。
2.2 系列手性席夫碱金属络合物的合成
2.2.1 手性[Cu(dha--pn)] (1a)的合成
本文中的手性配体均已被报道5,7,16–18,21,25。下面以手性席夫碱配体dha--pn的合成为例:于50 mL圆底烧瓶中加入手性丙二胺(-pn, 74.1 mg, 1 mmol)、脱氢乙酸(336.3 mg, 2 mmol)、30 mL甲醇,回流搅拌5 h后,冷却至室温,旋转蒸发除去溶剂,加入20 mL乙醚,析出淡黄色沉淀,静置10 min,抽滤,分别用少量甲醇、无水乙醚洗涤,真空干燥,所得目标产物dha--pn用于下一步合成。
手性席夫碱络合物的合成(以[Cu(dha--pn)]为例):于50 mL两颈圆底烧瓶中加入席夫碱配体dha--pn (187 mg, 0.5 mmol),分别加入6 mL甲醇及0.70 mL三乙胺,加热搅拌5 min。将100 mg (0.5 mmol) Cu(OAc)2·H2O溶于10 mL热甲醇溶液中,经由恒压滴液漏斗逐滴加入烧瓶中,在65 °C下回流搅拌30 min,得到紫色溶液,冷却后过滤、浓缩,用二氯甲烷和甲醇(1 : 1)混合溶剂重结晶,室温下真空干燥,得紫色产物。
2.2.2 手性[Cu(dha-en)] (1b–3b)的合成
其他手性席夫碱配体及其Cu(II)络合物的合成方法与1a类似。所得络合物的颜色、产率和质谱分析结果见表1。
2.3 溶液和固体ECD光谱测试
在溶液ECD光谱测试中,所合成的手性[Cu(dha-en)]以甲醇为溶剂,配制浓度为2 × 10–4mol·L–1(可见区测试)和2 × 10–5mol·L–1(紫外区测试)的试样。在J-810型ECD光谱仪上测试的条件,光程:1 cm;波长范围:200–700 nm,扫描速率:500 nm·min–1;狭缝宽度:2 nm。
固体片膜的制样方法详见文献25。所用稀释剂KCl在使用前于100 °C下真空干燥5 h后,冷却,置干燥器中备用。固体样品片膜总质量均为50 mg,各个样品的质量百分比浓度见相关固体ECD谱图中的详细标注。测试固体ECD谱的条件,波长:200–700 nm;扫描速率:500 nm·min–1;狭缝宽度:3 nm。
2.4 溶液VCD光谱测试
以氘代氯仿为溶剂,准确配制浓度为0.05–0.06 mol·L–1的样品约150 μL,将试样注入样品池中。样品池的光程为100 μm。将VCD同步器设置为 4 cm–1,单次循环为2.75 s。调制器(PEM)设置为1400 cm–1。为了提高信噪比,对样品进行多次循环测试,每次循环为30 min,循环次数为6次。
2.5 单晶X射线衍射分析
以甲醇(或甲醇与乙腈)的混合溶剂培养单晶,挑选合适的单晶,用单晶X射线衍射仪进行单晶结构测试。测试时均以石墨单色器单色化的Mo-K射线为入射光源(= 0.071073 nm),以/2扫描的方式收集衍射点,单晶结构解析采用 Olex2-1.2、SHELXS-97程序得到初结构。然后利用全矩阵最小二乘法修正,并用差值Fourier合成法完善,得到最后结构。所有非氢原子都做各向异性精修,氢原子的位置由理论计算确定,所得晶体数据用Diamond软件作图。
3 结果与讨论
3.1 晶体结构分析
本文共获得了两对手性[Cu(dha-en)]络合物2a和2b,以及3a和3b的晶体结构,相关晶体学数据见表2,并已存入英国剑桥晶体学数据中心:CCDC 1059507、1059508、1059509和1522855。
3.1.1 席夫碱金属络合物的超分子螺旋手性

表1 手性席夫碱Cu(II)络合物的颜色、产率和质谱分析
迄今为止,陆续有一些双齿13,14、三齿15或四齿10,23,26–29手性席夫碱配位的Cu(II)络合物的晶体结构被报道,但是,却较少见具有超分子螺旋手性的席夫碱络合物的晶体结构数据。2005年Scheurer等报道了具有超分子螺旋结构的手性salen-Ni(II)络合物30,晶体结构分析表明,在其结构中,中心金属通过弱的轴向分子间配位作用形成了一维超分子手性螺旋链,在分子单元中金属中心采取了与乙二胺螯环的δ构象手性相匹配的Δ绝对构型[为了避免绝对构型指认产生的歧义,本文统一采用Holm的绝对构型命名法(参见图3)7,31];然而,由于该化合物的中心金属和四齿N2O2配体所在准平面的二面角值较小(7.16°),并不能左右其形成更高层次一维超分子手性螺旋链的取向,因此在晶体堆砌中采取了与手性基元并不匹配的左手螺旋(M)方式(图4),由此说明这一分子基元中较弱的Δ-配位多面体手性并不能有效地诱导超分子螺旋手性为。遗憾的是,该文并没有提供这一化合物的手性光谱数据,以使相关研究者一探究竟。

图3 [M(salen)]络合物的四面体扭曲及其绝对构型命名7

图4 手性salen-Ni (II)络合物的配位多面体基元及其一维超分子螺旋30
2015年,Bhattacharyya等15报道了一例含非手性三齿席夫碱配体的手性Cu(II)络合物的晶体结构及其固体ECD光谱,该化合物是通过结晶过程中的自发拆分而形成的,具有大宗产物对映体过量的性质。虽然对该体系也观察到一维超分子螺旋的形成,但由于配位基元的四方锥底平面的扭曲太小,因此无法评估其配位基元的手性(绝对构型)与超分子螺旋手性之间的关系。尽管如此,固体ECD光谱还是给出了与超分子螺旋手性相关的信息,可以推测,其较弱的ECD信号主要源自于配位超分子螺旋链对该络合物中各类生色团(、–、LMCT)的微扰作用24。
3.1.2 络合物2a和2b的晶体结构分析
晶体结构分析表明,一对络合物2a和2b的单晶均属于正交晶系,空间群为21212,单晶结构的Flack参数分别为−0.01(2)和−0.01(3),可以确定绝对构型。除了与手性dha-chxn配体的四齿N2O2型配位外,络合物的中心金属还分别与相邻分子内酯环上的羰基发生弱的轴向配位形成五配位的四方锥结构基元,进而通过自组装构筑成一维超分子手性螺旋链(图5)。在2a和2b中,四方锥结构的轴向Cu―O键长分别为0.243 nm和0.244 nm,而四方锥底准平面上Cu―O和Cu―N配位键的平均键长均为0.193 nm,二面角分别为18.53°和18.47°(表3);两个配位基元之间中心金属的平均距离分别为0.736 nm和0.738 nm。对于手性chxn衍生的四齿手性席夫碱络合物而言,由于两个共边的相邻环状结构(配位乙二胺五元螯环并环己基)的刚性稳定了它们的绝对构型和螯环构象,螯环构象与配体上的碳手性是密切相关的,这是一个特例。以2a为例,金属中心采取了与配体的碳手性(,)以及乙二胺螯环的λ构象手性相匹配的Λ绝对构型,所形成的一维手性螺旋链(左手螺旋)的取向与手性基元的Λ-绝对构型一致,我们可以称之为三重匹配,并将分子式表示为-Λλ-[Cu(dha-,-chxn)]。而2b的金属中心则采取了与乙二胺螯环的δ构象手性相匹配的Δ绝对构型,从而形成了右手螺旋的超分子结构,类似地,可将其分子式表示为-Δδ-[Cu(dha-,-chxn)]。由此说明,手性[Cu(dha-chxn)]的配位多面体手性(Λ和Δ)能够有效地诱导其超分子螺旋手性。根据前文7的文献调研可知,salen-Cu(II)络合物的二面角值一般大于10°,最大二面角接近20°。与Scheurer等报道的超分子螺旋结构30相比,2a和2b中配位基元的较大变形可能是影响其超分子螺旋手性方向的主要因素。

图5 络合物2a和2b的手性超分子螺旋结构(上)和2a的配位基元(下)

表3 手性[Cu(dha-en)]络合物的θ值
3.1.3 络合物3a和3b的晶体结构分析
晶体结构分析表明,一对络合物3a和3b的单晶均属于正交晶系,空间群为21212,单晶结构的Flack参数分别为0.019(15)和0.03(3),可以确定绝对构型。与2a和2b类似,除了与手性dha-dpen配体的四齿N2O2型配位外,络合物的中心金属还分别与相邻分子内酯环上的羰基发生弱的轴向配位形成五配位的四方锥结构基元,进而通过自组装构筑成一维超分子手性螺旋链(图6)。在3a和3b中,四方锥结构的轴向Cu―O键长分别为0.233和0.234 nm,而四方锥底准平面上Cu―O和Cu―N配位键的平均键长均为0.193 nm,二面角值分别为13.41°和13.48°(表3);两个配位基元之间中心金属的平均距离为0.747和0.750 nm。以3a为例,金属中心虽然采取了与乙二胺螯环δ构象匹配的Δ绝对构型,但进而形成的一维手性螺旋链(左手螺旋)与手性基元的Δ-绝对构型并不匹配,可将分子式表示为-Δδ-[Cu(dha-,-dpen)];而3b的结构与之正好相反,可表示为-Λλ-[Cu(dha-,-dpen)],即,3a和3b互为对映体。显然,手性[Cu(dha-dpen)]络合物的配位多面体手性并不能有效地决定其超分子螺旋手性的取向,这一现象与Scheurer等30报道的手性salen-Ni(II)络合物的结构类似。
综上所述,通过对本文所得两对手性[Cu(dha-en)]络合物晶体结构的仔细考察,发现在这类手性席夫碱Cu(II)络合物中,引起超分子螺旋手性取向的因素是比较复杂的,可能是配位作用、分子间非共价相互作用和晶体堆砌的综合结果,因此,手性席夫碱金属络合物配位基元的多面体手性与其结晶状态下的超分子螺旋手性之间的关系仍有待获得更多实例来进一步探究。
3.2 手性[Cu(dha-en)]络合物的ECD光谱
3.2.1 手性席夫碱金属络合物ECD光谱与绝对构型的关联
当手性席夫碱金属络合物的手性立体结构和ECD生色团性质满足激子耦合条件时,若不受紫外区其它生色团干扰,采用激子手性方法来指认金属中心的绝对构型较为简便,因为它不被中心金属种类和配位结构(配位多面体、配位环境)所限制24。

图6 络合物3a和3b的手性超分子螺旋结构(上)和3a的配位基元(下)
结合3.1节的晶体结构分析和本课题组对相关手性席夫碱络合物的前期研究7,21,可以认为,本论文所述手性[Cu(dha-en)]络合物的手性来源主要包含以下几个层次:(1) 配体中的固有碳手性(/);(2) 配位螯环的构象手性(λ/δ);(3) 由于配体在金属周围的不对称排列引起金属中心的手性(或称配位多面体手性)(Λ/Δ);(4) 超分子螺旋手性或。一般而言,在合适的波段,与这些手性来源相关的生色团对ECD光谱信号都可能有贡献。例如,前述手性[Ni(dha-en)]络合物在可见区长波处的第一个ECD吸收带主要归属于LMCT7,它源自于配位螯环的构象手性和金属中心绝对构型的共同贡献;而在王要兵和徐云洁等报道的手性[M(pyr-,/,-chxn)] [pyr-chxn = 邻羟基吡咯醛与手性chxn缩合所得四齿氮(N4型)手性席夫碱配体,M = Ni(II)、Pd(II)、Pt(II)、Cu(II)、Zn(II)等]络合物中10,11,各类生色团(、、LMCT、MLCT等)对其在紫外-可见区的ECD光谱信号均有贡献,尤其是基于该系列络合物的甲亚胺基生色团不被干扰的性质,位于紫外区的激子裂分样式清晰可见,为绝对构型的指认带来极大方便,但对于[Cu(pyr-,/,-chxn)]络合物的跃迁而言,除非增大样品测试浓度同时将检测波长设置到750 nm,否则在ECD光谱可见区获取的跃迁吸收信息是不完整或似是而非的,但很少研究者能够注意到这一点6,10,11,22;在Bhattacharyya等报道的含非手性三齿席夫碱配体的手性Cu(II)络合物固体ECD光谱(测试波段200800 nm)中,我们可以看到包括极弱的跃迁在内的起因于其超分子螺旋结构的ECD光谱信息15,但由于该化合物的生色团性质不满足激子耦合条件,其ECD光谱并不呈现激子裂分现象。
3.2.2 手性[Cu(dha-en)]络合物的ECD光谱分析
Pasini等曾经采用相同碳手性的1,2-pn、chxn和dpen衍生的[M(salen)]络合物的ECD光谱比较作为判断中心金属配位数的参考6:对于准平面四方形络合物,sal-pn和sal-dpen衍生物的ECD光谱是类似的,但与sal-chxn衍生物的相反;对于五配位络合物,后两者的ECD光谱是类似的,但与sal-pn衍生物相反;而对于六配位络合物,这三种络合物的ECD光谱是类似的。考察图7–图9所示的三对手性[Cu(dha-en)]络合物的溶液和固体ECD光谱,可以发现,对于同样的配体碳手性,图8所示手性[Cu(dha-chxn)]的ECD光谱与图7和图9所呈现的每一对光谱曲线都是相反符号的,因此推测这些化合物主要表现出准平面四方形席夫碱络合物的手性配位立体化学特征。
从这三对手性[Cu(dha-en)]络合物的ECD光谱(实线和虚线分别代表配体上不对称碳原子的和构型)可以看出,其溶液与固体ECD 光谱的大部分特征峰位置相近,表明这些化合物在固体及溶液状态下存在物种的金属中心的主要配位模式和绝对构型基本一致。与手性salen-Cu(II)络合物22,32,33以及[Cu(pyr-,/,-chxn)]络合物10,11类似,它们在可见区的固体和溶液ECD弱信号主要归属为Cu(II)的跃迁,且在图7和图9呈现的可见区ECD信号还特别微弱。此外,由于相应席夫碱配体的内酯环上其它生色团的干扰,它们的ECD光谱在350–400 nm之间并不出现基于甲亚胺基激子耦合的激子裂分样式,从而无法从给出的ECD光谱中获得这些络合物在固体和溶液状态绝对构型的准确信息。从3.1节的晶体结构分析得知,与手性[Cu(dha-dpen)]比较(表3),手性[Cu(dha-chxn)]的准四方平面的二面角值相对较大(意味着该分子的扭曲变形性增大,可以在一定程度上松弛宇称禁阻的跃迁24),这与其在可见区跃迁的ECD信号大于前者的现象是一致的,而在其固体ECD光谱中表现得特别明显,这可能是四配位手性席夫碱金属络合物的值在溶液中要小于固体中值的缘故,徐云洁等11通过计算发现了这一现象。

图7 手性[Cu(dha)-pn]]络合物的溶液(左)和固体(右)ECD光谱

图8 手性[Cu(dha)-chxn]]络合物的溶液(左)和固体(右)ECD光谱

图9 手性[Cu(dha)-dpen]]络合物的溶液(左)和固体(右)ECD光谱

图10 手性[Cu(dha-chxn)]络合物的溶液VCD光谱

图11 手性[Cu(dha-dpen)]络合物的溶液VCD光谱
虽然本文未能获得手性[Cu(dha-pn)]络合物的晶体结构,但仍可以从图7所示的ECD光谱推测,它们与手性[Cu(dha-dpen)]络合物类似,不论在固体和溶液状态均存在着较小的二面角值。这种准平面性意味着在手性[Cu(dha-pn)]和[Cu(dha-dpen)]络合物中,跃迁被较严格地禁阻了。
3.3 手性[Cu(dha-en)]络合物的溶液VCD光谱
2015年徐云洁等11在王要兵10、吴骊珠等34–36报道的[M(pyr-,/,-chxn)] [M = Ni(II)、Pd(II)、Pt(II)、Cu(II)、Zn(II)]络合物的晶体结构和ECD谱研究基础上,对其ECD、VCD实验谱及其理论计算进行了认真细致的探究。从王要兵等提供的单晶分析可知10,其中的手性Cu(II)络合物可分别表示为Λλ-[Cu(pyr-,-chxn)]和Δδ-[Cu(pyr-,-chxn)],溶液ECD光谱表明10,11,Λλ-[Cu(pyr-,-chxn)]在350 nm处的激子裂分样式为(–/+),而Δδ-[Cu(pyr-,-chxn)]的激子裂分样式为(–/+),这与Pasini等6报道的[Cu(sal-,-chxn)]的ECD光谱完全一致。徐云洁等的实验和理论VCD光谱研究还表明,在1600–1700 cm–1波段,对应着Λλ-[Cu(pyr-,-chxn)]的C=N基团红外伸缩振动,其VCD信号的似激子裂分样式为(–/+),而在1300–1400 cm–1区域,由C―H键等引起的面内弯曲振动对应的VCD谱的似激子裂分样式为(–/+)。但是在该文中并没有讨论这两处VCD信号与相应络合物绝对构型之间的关系。本文首次对获得单晶结构的两对手性[Cu(dha-en)]络合物分别进行了溶液VCD光谱表征(图10和图11)。以其中的-Λλ-[Cu(dha-,-chxn)](2a)为例(图10),可以发现与单核Λλ-[Cu(pyr-,-chxn)]类似,在1680 cm–1处的一对VCD峰为(–/+),而在1450 cm–1附近的VCD信号样式亦为(–/+)。但对于-Δδ-[Cu(dha-,-dpen)](3a)和-Λλ-[Cu(dha-,-dpen)](3b)而言(图11),VCD信号的似激子裂分样式虽然与其超分子螺旋手性(/)一致,但却与配位多面体的绝对构型(Δ/Λ)不一致,由此说明,当用这两处的VCD信号样式来定性指认含四齿配体的手性超分子席夫碱络合物的绝对构型时必须特别谨慎,可靠的经验规则还有待理论计算加以证明。
4 结 论
(1) 本文设计合成了三对手性[Cu(dha-en)]络合物,对其中两对络合物进行的晶体结构分析表明,它们均能形成一维超分子手性螺旋链,可分别将其分子式表示为:-Λλ-[Cu(dha-,-chxn)](2a)、-Δδ-[Cu(dha-,-chxn)](2b)、-Δδ-[Cu(dha-,-dpen)](3a)和-Λλ-[Cu(dha-,-dpen)](3b);并发现扭曲程度较大的手性[Cu(dha-chxn)]的配位基元多面体手性能够有效地诱导其超分子螺旋手性,而接近准平面型的手性[Cu(dha-dpen)]则不然。
(2) 通过对系列手性[Cu(dha-en)]络合物进行的固体和溶液ECD光谱表征,可知在固体和溶液状态下存在物种的金属中心的主要配位模式和绝对构型基本一致;但由于配体内酯环上其它生色团的干扰,相关固体和溶液 ECD光谱在350–400nm之间并不出现典型的激子裂分现象,无法与其绝对构型进行关联。
(3) 首次对2a/2b和3a/3b进行的溶液VCD光谱测试表明,-Λλ-[Cu(dha-,-chxn)](2a)在1680 cm–1处的一对VCD峰为(–/+),在1450 cm–1附近的VCD信号样式亦为(–/+)。对于-Δδ-[Cu(dha-,-dpen)](3a),虽然VCD光谱的似激子裂分样式(–/+)与超分子螺旋手性(M)一致,但却与其配位多面体的Δ-绝对构型不一致。因此认为,对于含四齿配体的手性超分子席夫碱金属络合物,可靠的VCD绝对构型关联规则还有待于发现更多实例以及进行相关的理论计算加以证明。
(1) Zhang, W.; Loebach, J. L.; Wilson, S. R.; Jacobsen, E. N..... 1990,(7), 2801.doi: 10.1021/ja00163a052
(2) Jacobsen, E. N.; Zhang, W.; Muci, A. R.; Ecker, J. R.; Deng, L.....1991,(18), 7063. doi: 10.1021/ja00018a068
(3) Larrow, J. F.; Jacobsen, E. N.; Gao, Y.; Hong, Y. P.; Nie, X. Y.; Zepp, C. M.... 1994,(7), 1939. doi: 10.1021/jo00086a062
(4) Kureshy, R. I.; Khan, N. H.; Abdi, S. H. R.; Bhatt, A. K....:. 1996,(1), 33. doi: 10.1016/1381-1169(96)00040-4
(5) Kureshy, R. I.; Khan, N. H.; Abdi, S. H. R.; Patel, S. T.; Iyer, P.; Suresh, E.; Dastidar, P...:. 2000,(2), 217. doi: 10.1016/S1381-1169(00)00213-2
(6) Pasini, A.; Gullotti, M.; Ugo, R....,. 1977, No. 4, 346.
(7) Zhang, H.; Zeng, L. L.; Wang, Y. K.; Cao, S.; Guo, D.;Li, D.; Fang, X. M.; Lin, L. R.. -..2015,(12), 2229. [章 慧, 曾丽丽, 王越奎, 曹 石, 郭 栋, 李 丹, 方雪明, 林丽榕. 物理化学学报, 2015,(12), 2229.] doi: 10.3866/PKU.WHXB201510301
(8) Sato, H.; Mori, Y.; Yamagishi, A..2013,(19), 6873. doi: 10.1039/c3dt00112a
(9) Ru, J.; Gao, F.; Yao, M. X.; Wu, T.; Zuo, J. L.. 2014,(48), 18047. doi: 10.1039/c4dt02518k
(10) Wang, Y. B; Fu, H. B; Shen, F. G; Sheng, X. H; Peng, A. D; Gu, Z. J; Ma, H. W; Ma, J. S; Yao, J. N... 2007,(9), 3548. doi: 10.1021/ic062316z
(11) Dezhahang, Z.; Poopari, M. R.; Cheramy, J.; Xu, Y... 2015,(9), 4539. doi: 10.1021/acs.inorgchem.5b00386
(12) Chamayou, A. C.; Luedeke, S.; Brecht, V.; Freedman, T. B.; Nafie, L. A.; Janiak, C... 2011,(22), 11363. doi: 10.1021/ic2009557
(13) Enamullah, M.; Uddin, A. K. M. R.; Pescitelli, G.; Berardozzi, R.;Makhloufi, G.; Vasylyeva, V.; Chamayou, A. C.; Janiak, C.. 2014,(8), 3313. doi: 10.1039/c3dt52871e
(14) Chamayou, A. C.; Makhloufi, G.; Nafie, L. A.; Janiak, C.; Lüdeke, S... 2015,(5), 2193. doi: 10.1021/ic502661u
(15) Bhattacharyya, A.; Ghosh, B. N.; Rissanen, K.; Jiménez-Aparicio, R.; Chattopadhyay, S.. 2015,(2), 493. doi: 10.1039/c4dt03166k
(16) Li, L. Synthesis, Characterization and Solid CD Spectra of Chiral Schiff Base Complexes. Master Dissertation, Xiamen University, Xiamen, 2005. [李 丽. 手性席夫碱金属配合物的合成、表征及其固体CD光谱研究[D]. 厦门: 厦门大学, 2005.]
(17) Zhang, H.; Chen, Y. C.; Wang, F.; Qiu, X. M.; Li, L.; Chen, J. G.. -.. 2006,(6), 666. [章 慧, 陈渊川, 王芳, 邱晓明, 李丽, 陈坚固. 物理化学学报, 2006,(6), 666.] doi: 10.3866/PKU.WHXB20060605
(18) Wang, F.; Zhang, H.; Li, L.; Hao, H. Q.; Wang, X. Y.; Chen, J. G.:. 2006,(14), 2059. doi: 10.1016/j.tetasy.2006.07.021
(19) Wang, F. Synthesis, Characterizations and Properties of Chiral Unsymmetric Schiff base and Cu-Ln Complexes. Master Dissertation, Xiamen University, Xiamen, 2007. [王 芳. 非对称手性席夫碱配合物与手性双核(Cu-Ln)席夫碱配合物的合成、表征及性能研究[D]. 厦门: 厦门大学, 2007.]
(20) Ding, L.; Wang, F.; Chen, L.; Zhang, H.; Zhao, Y.:2008,(23), 2653. doi: 10.1016/j.tetasy.2008.12.009
(21) Zeng, L. L. Correlation between ECD Spectra and Absolute Configuration of Chiral N2O2-Type Schiff Base Metal Complexes. MasterDissertation, Xiamen University, Xiamen, 2015. [曾丽丽. 手性N2O2型席夫碱金属络合物的ECD光谱及其绝对构型关联[D]. 厦门: 厦门大学, 2015.]
(22) Downing, R. S.; Urbach, F. L..... 1969,(22), 5977. doi: 10.1021/ja01050a009
(23) Barwiolek, M.; Szlyk, E.; Muziol, T. M.; Lis, T.. 2011,(41), 11012. doi: 10.1039/c1dt10882d
(24) Zhang, H.; Chemical Industry Press: Beijing, 2008; Chapter 6. [章慧. 配位化学—原理与应用. 北京: 化学工业出版社, 2009: 第六章.]
(25) Zhang, H.; Yan, J. X.; Wu, S. T.; Li, D.; Wan, S. G.; Ding, L.; Lin, L. R.. -.. 2013,(12), 2481. [章 慧, 颜建新, 吴舒婷, 李 丹, 万仕刚, 丁 雷, 林丽榕. 物理化学学报, 2013,(12), 2481.] doi: 10.3866/PKU.WHXB201310152
(26) Storr, T.; Verma, P.; Pratt, R. C.; Wasinger, E. C.; Shimazaki, Y.; Stack, T. D. P.....2008,(46), 15448. doi: 10.1021/ja804339m
(27) Bunce, S.; Cross, R. J.; Farrugia, L. J.; Kunchandy, S.; Meason, L. L.; Muir, K. W.; O'Donnell, M.; Peacock, R. D.; Stirling, D.; Teat, S. J..1998,(23-24), 4179. doi: 10.1016/S0277-5387(98)00226-5
(28) Rusere, L. N.; Shalumova, T.; Tanski, J. M.; Tyler, L. A.. 2009,(17), 3804. doi: 10.1016/j.poly.2009.08.002
(29) Bernardo, K.; Leppard, S.; Robert, A.; Commenges, G.; Dahan, F.; Meunier, B... 1996,(2), 387. doi: 10.1021/ic950700i
(30) Scheurer, A.; Maid, H.; Hampel, F.; Saalfrank, R. W.; Toupet, L.; Mosset, P.; Puchta, R.; van Eikema Hommes, N. J. R..... 2005, No. 12, 2566. doi: 10.1002/ejoc.200500042
(31) Holm, R. H.....1967,(24), 6104. doi: 10.1021/ja01000a019
(32) Zolezzi, S.; Decinti, A.; Spodine, E.1999,(6), 897. doi: 10.1016/S0277-5387(98)00376-3
(33) Yamazaki, A.; Akitsu, T.. 2012,(7), 2975. doi: 10.1039/c2ra00407k
(34) Shan, X. F.; Wu, L. Z.; Liu, X. Y.; Zhang, L. P.; Tung, C. H..... 2007, (21), 3315. doi: 10.1002/ejic.200700352
(35) Shan, X. F.; Wang, D. H.; Tung, C. H.; Wu, L. Z.... 2007,(11), 1581. doi: 10.1007/s11434-007-0229-6
(36) Shan, X. F.; Wang, D. H.; Tung, C. H.; Wu, L. Z.2008,(23), 5577. doi: 10.1016/j.tet.2008.03.077
Supramolecular Helical Chirality of Schiff Base Copper(II) Complexes and Their Chiroptical Spectroscopy
CAO Shi ZENG Li-Li XIE Jing WAN Shi-Gang LI Dan ZHANG Hui*
()
Three pairs of N2O2-type Schiff base ligands were synthesized by condensing dehydroacetic acid (dha) with chiral 1,2-diaminopropane (pn),-1,2-diaminocyclohexane (chxn), and 1,2-diphenylethylenediamine (dpen). These chiral ligands were used to coordinate copper(II) ions to produce the corresponding Schiff base Cu(II) complexes: [Cu(dha-/-pn)] (1a and 1b), [Cu(dha-,/,-chxn)] (2a and 2b), and [Cu(dha-,/,-dpen)] (3a and 3b). Detailed analyses using electronic circular dichroism (ECD) and vibrational circular dichroism (VCD) spectroscopies reveal that these Schiff base Cu(II) complexes retain the main coordination modes and the absolute configurations of the metal centers, both in solution and the solid state. In addition, according to the crystal structures, the central Cu(II) ions of 2a/2b and 3a/3b were found to not only coordinate to the chiral dha-en ligands, but were also axially coordinated to the carbonyl groups of the contiguous lactonic rings, providing one-dimensional supramolecular helical chains through self-assembly. In this work, we deeply studied the relationship between the chiral coordination units and the supramolecular helical structures of 2a/2b and 3a/3b. By comparing our experiment VCD spectroscopic data with related VCD spectral features reported in the literature, a specific correlation between the VCD spectral properties and absolute configurations was investigated, which provided fingerprint characteristics for chiral coordination structure.
Schiff base Cu(II) complex; Electronic circular dichroism; Vibrational circular dichroism; Single-crystal structure; Supramolecular chiral assembly
May 5, 2017;
June 2, 2017;
June 12, 2017.
Corresponding author. Email: huizhang@xmu.edu.cn; Tel: +86-592-2183910.
10.3866/PKU.WHXB201706122
O641
The project was supported by the National Natural Science Foundation of China (21273175).
国家自然科学基金(21273175)资助项目
