鼠尾藻(Sargassum thunbergii)对邻苯二甲酸二甲酯(DMP)胁迫的响应*
2018-01-12王翔宇吴海一
吕 芳 丁 刚 王翔宇 房 慧 吴海一①
(1. 山东省海洋生物研究院 青岛 266104; 2. 青岛市大型海藻工程技术研究中心 青岛 266104;3. 山东省海水健康养殖工程技术研究中心 青岛 266104)
有机物是近海环境的主要污染物之一, 这类污染物难以降解、易于积蓄, 对海洋生物造成毒害, 使一些海洋水产资源受到严重影响(颜天等, 2000; Chen et al, 2005)。藻类作为海洋环境中的初级生产者, 是生态系统中物质循环和能量流动的重要基础, 其生长和代谢会直接受到有机污染物的影响, 进而影响到初级消费者和次级消费者的生命活动。因此, 研究藻类对有机污染物的响应, 有助于揭示有机污染物对整个生态系统造成的威胁, 为解决海洋环境的污染问题提供科学依据。
邻苯二甲酸酯类(phthalate esters, PAEs)是海洋中主要的有机污染物之一, 对人和动物具有致癌、致畸、致突变和干扰内分泌等毒性(Kasahara et al, 2002),对水生生物(如浮游动物、鱼类、藻类)的生长和繁殖产生影响(Rhodes et al, 1995; 况琪军, 2003; Chen et al, 2005; 余江等, 2007), 且能在生物体内富集和放大(迟杰等, 2005; 聂湘平等, 2008), 其中邻苯二甲酸二甲酯(dimethy1 phthalate, DMP)、邻苯二甲酸二丁酯(dibutyl phthalate, DBP)和邻苯二甲酸二异辛酯[Di(2-ethylhexyl) phthalate, DEHP]被我国列为环境优先控制污染物(陈济安, 2007)。因此PAEs对海洋环境的污染日益引起学者的重视。
国内外在有机污染物对大型海藻生理生化特征的影响方面已有一些报道, 主要集中在色素、蛋白及抗氧化防疫指标的测定方面(李钦等, 2004; 吴志辉等,2006; Yu et al, 2007)。对于大型海藻, 光合生理特征的变化是衡量其生长状况的一个首要指标, 但目前关于有机污染物对大型海藻光合生理特征以及关键基因表达变化的研究还较少。
鼠尾藻(Sargassum thunbergii)是我国沿海常见的经济海藻, 其藻体长、生长快、适应环境能力强, 可用于提取褐藻胶、甘露醇、碘等工业原料以及褐藻多酚、多糖等活性物质, 而且是海洋生态环境修复的理想生物材料(詹冬梅等, 2006; 吴海一等, 2010), 具有广泛的应用前景。本试验以鼠尾藻为研究对象, 选取海洋环境中常见的有机污染物 DMP为代表, 研究鼠尾藻对 DMP的响应, 以期为保护海洋经济藻类的养殖环境提供评价指标和管理依据。
1 材料与方法
1.1 实验材料
鼠尾藻采自青岛市太平湾潮间带(36°05´N,120°35´E)。采集的藻体用低温采集箱运回实验室, 海水反复清洗去除泥沙及杂质后, 置于温度 15°C, 光照1000lx的恒温光照培养箱中充气培养, 5天后用于实验。选取生长健壮、形态较一致、长度在 4—5cm的个体用于实验。
1.2 实验方法
实验培养基质是加DMP的过滤海水, DMP浓度设为 0.1mg/L(低)、0.3mg/L(中)、1.0mg/L(高)三个梯度, 以天然海水加等量的丙酮作为对照组。
实验在容积为3000mL的三角瓶中进行, 每个三角瓶装2000mL培养液。每个实验处理组设置3个重复, 每个重复放置15株藻体。实验在温度15°C、光周期12h∶12h、光照强度3000lx的恒温光照培养箱内充气进行, 每天更换培养液。于实验开始后的第3、5、10、15天取样测定鼠尾藻的比生长速率、叶绿素a含量、光合放氧速率和呼吸速率、rbcL基因的表达量等指标。
1.3 比生长速率的测定
比生长速率(relative growth rate, RGR)的计算公式如下:
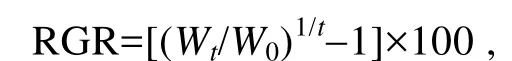
式中Wt为实验中期或结束时藻体鲜重(g),W0为实验开始时藻体鲜重(g),t为培养时间(d)。
1.4 叶绿素a含量的测定
参照 Jeffrey等(1975)与王丽梅(2011)的方法测定。将藻体在液氮中研磨成匀浆状, 加入8mL80%丙酮于4°C黑暗处抽提12h。4000r/min, 4°C离心15min,弃沉淀, 上清用80%丙酮定容至10mL。以80%丙酮作为空白对照, 通过分光光度计测定 639、647和664nm处的光密度值。重复3次以上, 计算平均值。叶绿素a的浓度(Cchla)按照公式Cchla=11.85×OD664-1.54×OD647-0.08×OD639计算, 单位为 mg/L。最后根据稀释倍数计算每克鲜重藻体中的色素含量,单位为mg/g。
1.5 光合放氧速率和呼吸速率的测定
采用氧电极(Chlorolab-3, Hansatech, 英国)测定藻体的光合放氧速率和呼吸速率。测定反应杯的环境温度为 20°C。光照强度选择预实验测定的饱和光强300µmol/m2·s, 光合速率表示为每单位鲜重藻体的放氧速率(nmolO2/min·gFW), 呼吸速率表示为每单位鲜重藻体的耗氧速率(nmolO2/min·gFW), 以净光合放氧速率与呼吸耗氧速率之比获得P/R的值。
1.6 rbcL基因mRNA相对表达量的测定
以 E.Z.N.A.TMPlant RNA Kit(Omega Biotek)提取待测藻体的总RNA, 以High Capacity cDNA Reverse Transcription Kit参照说明书反转录合成cDNA第一链。以18S rRNA作为内参基因, 设计特异性扩增引物(表1), PCR反应在CFX96实时荧光定量PCR检测系统(Bio Rad, USA)中进行, 所有反应均设置3个重复, 反应条件如下: 95°C预变性10min; 95°C处理10s,58°C处理30s, 40个循环; 应用CFX96 Manager软件分析实验数据。以自然海水中生长的藻体作为参照,用ΔΔCT法(Livaket al, 2001)计算待测组藻体rbcL基因的相对表达量。
1.7 数据分析
所得数值以平均值±标准误差表示。显著性差异用单因素方差分析, 分析软件为 SPSS 13.0, 当P<0.05时为显著性差异。
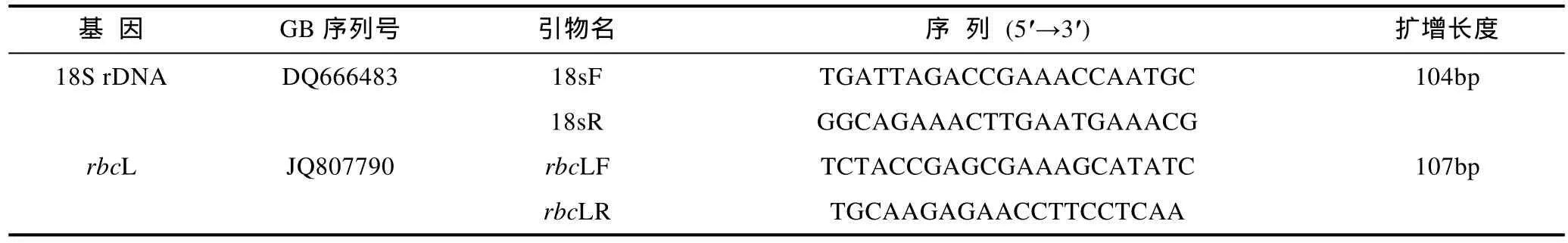
表1 荧光定量PCR的引物Tab. 1 The primers for real-time quantitative PCR
2 结果与分析
2.1 比生长速率
如图 1所示, 当鼠尾藻暴露在不同质量浓度的DMP溶液时, 对照组藻体的比生长速率在实验期间没有显著变化(P>0.05), 低浓度 DMP(0.1mg/L)下藻体的生长速率在实验前5天内显著升高, 然后逐渐下降, 至 15d时已显著低于对照组(P<0.05)。而中、高浓度 DMP下藻体的生长在实验期间均呈负增长, 且DMP浓度越高, 藻体的生长速率越低。
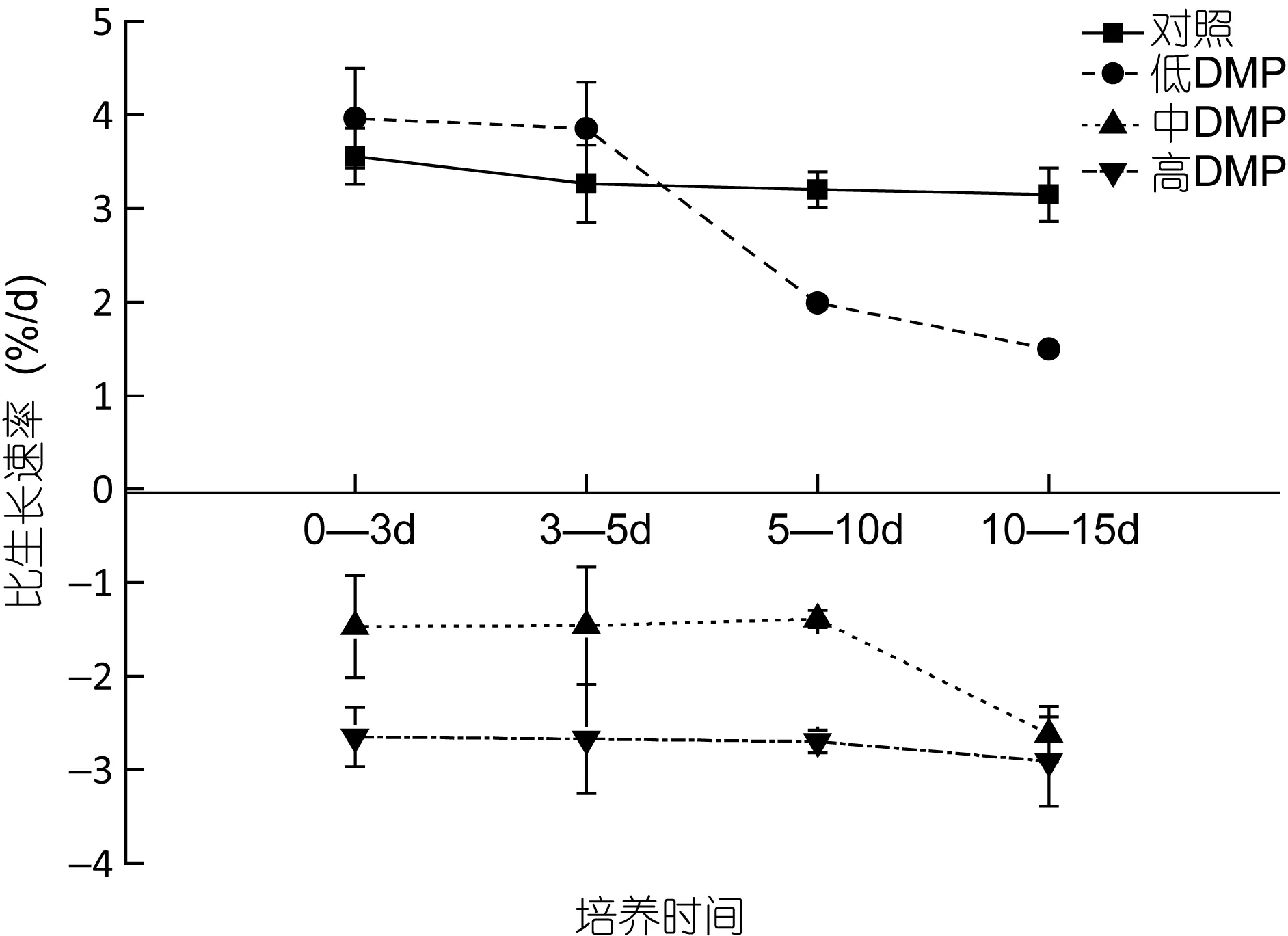
图1 DMP处理下鼠尾藻的比生长速率Fig. 1 The effects of DMP on the specific growth rate of Sargassum thunbergii
2.2 叶绿素a的含量
鼠尾藻在低浓度DMP中, 藻体的叶绿素a含量随着暴露时间的延长呈明显的上升趋势, 至 15d时,较对照组上升了28.4%; 但在中、高浓度DMP中时,叶绿素a含量随着培养时间的延长呈明显的下降趋势, 且DMP浓度越高, 叶绿素a的含量越低, 至培养15d时, 中、高质量浓度DMP下的叶绿素a含量较对照组分别下降了17.9%、22.8%(图2)。
2.3 光合放氧速率和呼吸速率
从图3的比较中可以看出, 对照组藻体的光合放氧速率、呼吸速率和P/R值没有明显变化, 而不同DMP浓度处理下却呈现差异性。低浓度DMP组藻体培养3d后的光合放氧速率和P/R都显著高于对照组(P<0.05), 而呼吸速率与对照组间差异不显著(P>0.05)。中、高浓度 DMP处理下藻体的光合放氧速率明显下降, 在培养15d后, 较对照组分别下降了69%和 92.8%, 而呼吸速率在培养 3d时无显著变化,随后逐渐下降,P/R值在培养期间持续下降, 且DMP浓度越高, 降幅越大, 至15d时较对照组分别下降了66.2%和92.1%。
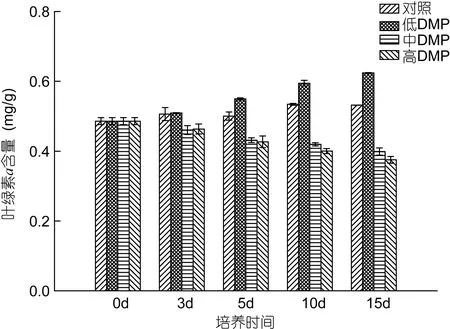
图2 DMP对鼠尾藻叶绿素a含量的影响Fig. 2 The effects of DMP on chlorophyll a content of S.thunbergii
2.4 rbcL基因相对表达量的变化
如图 4所示, 对照组rbcL基因的表达量无显著变化, 低浓度DMP组rbcL基因的表达量却随着培养时间逐渐升高, 15d时升至对照组的1.6倍; 与此同时,中、高浓度DMP组rbcL基因的表达量均显著下降,15d时仅为对照的38.4%和17.4%。
3 讨论
3.1 不同DMP浓度对鼠尾藻生长的影响
本研究结果表明, 有机污染物 DMP对鼠尾藻生长的影响表现为浓度和作用时间的相关性。低浓度DMP(0.lmg/L)下鼠尾藻生长情况良好, 生物量随培养时间的增加而逐渐变大, 表明低浓度的 DMP对鼠尾藻不但没有毒害作用, 反而有促进作用。而高浓度的 DMP(≥0.3mg/L)则明显抑制鼠尾藻的生长, 且随着 DMP浓度的升高和暴露时间的推移, 藻体的新陈代谢受到抑制, 藻细胞开始衰退甚至死亡, 藻体表现出发黄、发白、脱落等表观性状。余江等(2007)在龙须菜(Gracilaria lemaneiformis)对DMP毒性响应的研究中也发现, 低浓度的 DMP(0.lmg/L)对龙须菜有促进作用, 而DMP浓度超过0.3mg/L时表现明显的抑制作用。此外, 在其他一些种类的有机污染物对藻类毒性的研究中, 也发现了同样的现象(李钧等, 2000;李钦等, 2004), 因此这可能是普遍存在的一种毒理学现象。
目前, 有机污染物对藻类产生毒性的机理还没有统一的定论。关于较低浓度污染物对藻类产生促进作用的原因, 学者们普遍认可的一种解释是生物具有一种“毒物的兴奋效应”(Hormesis), 是其自我保护的一种机制(Stebbing, 1982)。产生的机制可能是:(1)低浓度的有机污染物激活了藻细胞内一些相关酶的活性, 因而促进了藻类的代谢; (2)有机物对藻类的毒害和藻类降解有机污染物两个过程同时存在,在浓度较低时降解过程占主导地位, 因而在整体上表现为降解(Chiet al, 2004; 迟杰等,2005; Gaoet al,2015), 降解产物可作为促进藻类生长的营养源; (3)低浓度的有机污染物可以引起藻细胞脂质过氧化程度在一定范围的升高, 而此时脂质过氧化程度的升高并不引发对细胞的伤害, 反而具有刺激藻细胞生长繁殖的作用(谢荣等, 2000)。而高浓度有机污染物对藻类一般都有抑制作用, 本研究也进一步证实了这一结论。
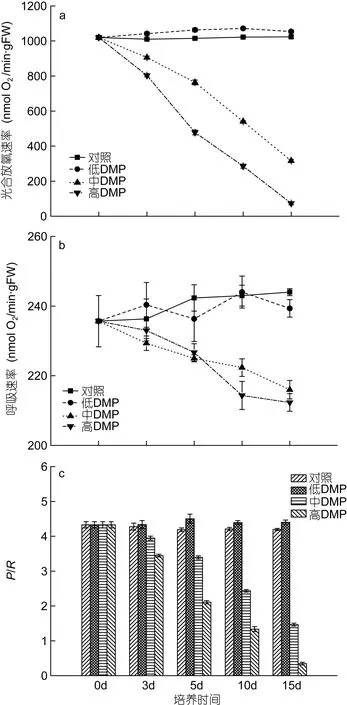
图3 DMP处理下鼠尾藻藻体的光合放氧速率(a)、呼吸速率(b)和P/R (c)的比较Fig. 3 The effects of DMP on the oxygen exchange parameters of S. thunbergii
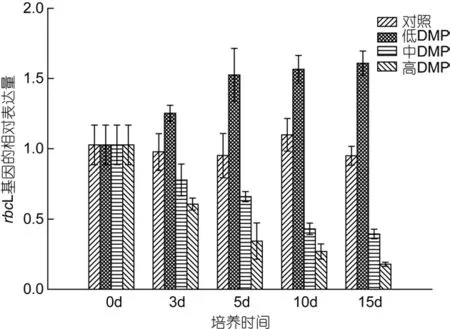
图4 DMP处理下rbcL基因在转录水平上相对表达量的变化Fig. 4 The effects of DMP on the relative expression of rbcL gene at the transcriptional level of S. thunbergii
3.2 不同DMP浓度对鼠尾藻光合作用的影响
高浓度有机污染物对藻类的毒性效应主要表现为抑制光合作用、呼吸作用和固氮作用, 降低酶的活性, 从而影响藻类的活性代谢和生理进程(李钧等,2000; Yuet al, 2007; Liuet al, 2016)。叶绿素a是植物最重要的光合色素, 因此光合作用的强弱与植物体中叶绿素a的含量息息相关。李钦等(2004)对坛紫菜(Porphyra haitannensis)的研究表明0.lmg/L的甲胺磷可使叶绿素a的含量上升; 余江等(2007)对龙须菜的研究结果也表明0.1mg/L DMP作用下叶绿素a含量逐渐上升, 而高浓度的DMP则引起叶绿素a含量的降低。本文的研究结果也充分证实了这一点, 鼠尾藻暴露在DMP中叶绿素a含量变化表现为低浓度略升高而高浓度显著下降的趋势。在一定浓度DMP胁迫下, 叶绿素a含量的上升可能与低浓度DMP胁迫并未对藻的生长造成影响, 反而促进其生长有一定关系。而高浓度DMP作用下, 叶绿素a含量下降的原因可能是: (1)叶绿素a的合成受到抑制, Alberte等(1977)研究发现, 逆境胁迫下叶绿素a含量降低的主要原因是叶绿体片层中捕光 chla/b-Pro复合体合成受到抑制; (2)已有的叶绿素a降解, 原因可能是DMP胁迫使一些叶绿素酶的活性增强, 因此促进了叶绿素a的分解或者DMP胁迫导致藻细胞中活性氧和自由基的催化合成, 进一步引起叶绿素a的降解。
从氧电极的检测结果来看(图3), 低浓度DMP处理下藻体的光合放氧速率高于对照组(P<0.05), 而呼吸速率与对照组间差异不显著, 中、高浓度 DMP处理下藻体的光合放氧速率迅速下降, 而呼吸速率在处理 3d才出现下降趋势。这表明在藻细胞内, 叶绿体可能比线粒体更易受到 DMP的毒害, 但这还需要进一步的实验证实。净光合放氧速率与净呼吸耗氧速率的比值 P/R是衡量细胞代谢水平的有效参数(Humphrey, 1975), 它受众多因素影响, 如细胞生长状态(Ryther, 1955)、营养环境(McAllister et al, 1964)等, 在正常藻体中这一比值约为4 (Melis et al, 2006)。本实验中正常藻体的 P/R比为 4.3, 低浓度 DMP下P/R值约为4.4, 呈现出正常的光合能力, 且光合活性略微增强。而中、高浓度DMP处理5d后, P/R值分别降为3.4和2.1, 已显著低于正常值, 至15d时, P/R值只有约1.5和0.3(图3), 表明此时藻体的光合作用已受到极大的破坏。
3.3 不同DMP浓度对鼠尾藻光合基因rbcL表达的影响
核酮糖-1, 5-二磷酸羧化酶/加氧酶(ribulose bisphosphate carboxylase oxygenase, Rubisco)是植物体内重要的功能蛋白和储能蛋白, 是光合碳同化过程的关键限速酶, 对光合作用的研究有重要意义, 其亚基的编码基因 rbcL的表达受植物生长发育状态和生长环境的影响。许建方(2013)研究了浒苔(Ulva prolifera)的 rbcL基因在干出、不同盐度、不同光照强度和不同温度条件下的表达模式, 结果表明 rbcL基因在干出过程中的表达量逐渐降低, 而在盐度稍高(45‰)或稍低(15‰)、强光和黑暗、高温和低温等胁迫处理时表达量都会升高, 但超过一定范围时, 表达量都会有所降低。Shao等(2014)对海带(Saccharina japonica)的研究发现 rbcL基因的表达是一种快递光响应模式, 光照下表达量上升, 而黑暗条件下表达量下降, 呈现昼夜变化的规律。对于大型海藻在温度、盐度、光照、营养盐等环境胁迫下光合作用的分子变化机制的研究不仅局限于此, 但是有关大型海藻对有机物胁迫的研究却多在生理水平上, 在分子水平的相关研究尚未见报道。
本实验用荧光定量 PCR技术检测了鼠尾藻在不同浓度DMP作用下rbcL基因相对表达量的变化。从本研究的结果(图 4)看, 低浓度的 DMP(0.lmg/L)可以在短时间内诱导 rbcL基因的表达, 长时间暴露和高浓度DMP则抑制rbcL基因的表达。以上结果表明,DMP作用下, rbcL基因表达量与光合作用变化规律一致, 因此我们推测 DMP对鼠尾藻光合作用产生影响的作用机制之一可能是影响 rbcL基因的表达量,从而对细胞中Rubisco酶的合成量产生影响, 使藻的光合作用发生变化。
以上结果可以看出, 有机物胁迫与温度、盐度、光照、营养盐等环境因子一样均可导致 rbcL基因表达的变化, rbcL基因的表达量与藻的生长状况有一定的相关性, 因此, rbcL基因可以作为诊断大型海藻生长状况的潜在分子指标, 通过 rbcL基因的表达量来评估大型海藻应对环境变化的响应特征, 这将为评价海洋经济藻类养殖环境的影响提供一种新的思路。
4 结论
水体有机物污染和藻类生长发育有明显的相关性, 即低浓度的 DMP能促进鼠尾藻的生长和叶绿素a的合成, 并使藻体的光合作用增强, 诱导rbcL基因的表达, 而高浓度的 DMP则抑制鼠尾藻的生长、光合作用和 rbcL基因的表达。藻类对有机物胁迫的响应是多层次的, 既有生理生化方面的, 也有基因转录方面的, 并且这种调控在不同的藻类中可能不同。因此我们下一步将对大量藻种开展广泛研究, 用多项指标综合评价环境胁迫对藻类的潜在影响, 从而更有效地对水环境污染做出早期预警, 对藻类个体、种群、群落和生态系统造成的环境胁迫做出更准确的预测。
王丽梅, 李世国, 柴 雨等, 2011. 鼠尾藻幼苗的室内培养及有性生殖同步化. 水产学报, 35(3): 395—404
许建方, 2013. 浒苔中C3和C4途径关键酶的研究. 国家海洋局第一海洋研究所硕士学位论文, 49—58
李 钦, 魏凤琴, 陈纪新等, 2004. 甲胺磷、辛硫磷对坛紫菜叶状体的生理效应. 水产学报, 28(2): 221—224
李 钧, 于仁诚, 李正炎等, 2000. 三苯基氯化锡(TPTC)对孔石莼光合作用及生长的影响. 海洋与湖沼, 31(4):404—407
吴志辉, 杨宇峰, 聂湘平等, 2006. 酞酸酯对龙须菜的生态毒理研究. 海洋科学, 30(6): 46—50
吴海一, 詹冬梅, 刘洪军等, 2010. 鼠尾藻对重金属锌、镉富集及排放作用的研究. 海洋科学, 34(1): 69—74
余 江, 杨宇峰, 2007. 龙须菜对邻苯二甲酸二甲酯(DMP)毒性的响应. 中山大学学报(自然科学版), 46(5): 88—92
况琪军, 赵文玉, 邓 萍, 2003. DBP对斜生栅藻及天然混合藻类致毒效应研究. 水生生物学报, 27(1): 103—105
迟 杰, 刘 华, 郎铁柱, 2005. 普通小球藻与DBP的相互作用. 环境科学与技术, 28(2): 26—28
陈济安, 邱志群, 舒为群等, 2007. 我国水环境中邻苯二甲酸酯污染现状及其生物降解研究进展. 癌变·畸变·突变,19(3): 212—214
聂湘平, 李桂英, 吴志辉等, 2008. 4种酞酸酯在龙须菜-篮子鱼食物链中的积累放大研究. 海洋科学, 32(1): 19—23
谢 荣, 唐学玺, 李永祺等, 2000. 丙溴磷影响海洋微藻生长机理的初步研究. 环境科学学报, 20(4): 473—477
詹冬梅, 李美真, 丁 刚等, 2006. 鼠尾藻有性繁育及人工育苗技术的初步研究. 海洋水产研究, 27(6): 55—59
颜 天, 李 钧, 李正炎等, 2000. 三苯基氯化锡对黑褐新糠虾的毒性效应. 海洋与湖沼, 31(5): 485—489
Alberte R S, Thornber J P, 1977. Water stress effects on the content and organization of chlorophyll in mesophyll and bundle sheath chloroplasts of maize. Plant Physiology, 59(3):351—353
Chen W L, Sung H H, 2005. The toxic effect of phthalate esters on immune responses of giant freshwater prawn(Macrobrachium rosenbergii) via oral treatment. Aquatic Toxicology, 74(2): 160—171
Chi J, Liu H, Ji M, 2004. Interaction between DEHP and particulate in a eutrophic lake. Transactions of Tianjin University, 10(3): 167—170
Gao J, Chi J, 2015. Biodegradation of phthalate acid esters by different marine microalgal species. Marine Pollution Bulletin, 99(1—2): 70—75
Humphrey G F, 1975. The photosynthesis: respiration ratio of some unicellular marine algae. Journal of Experimental Marine Biology and Ecology, 18(2): 111—119
Jeffrey S W, Humphrey G F, 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae, and natural phytoplankton. Biochemie and Physiologie der Pflanzen, 167: 191—194
Kasahara E, Sato E F, Miyoshi M et al, 2002. Role of oxidative stress in germ cell apoptosis induced by di(2-ethylhexyl)phthalate. Biochemical Journal, 365(3): 849—856
Liu N, Wen F L, Li F M et al, 2016. Inhibitory mechanism of phthalate esters on Karenia brevis. Chemosphere, 155:498—508
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod. Methods, 25(4): 402—408
McAllister C D, Shah N, Strickland J D H, 1964. Marine phytoplankton photosynthesis as a function of light intensity:a comparison of methods. Journal of the Fisheries Research Board of Canada, 21(1): 159—181
Melis A, Melnicki M R, 2006. Integrated biological hydrogen production. International Journal of Hydrogen Energy,31(11): 1563—1573
Rhodes J E, Adams W J, Biddinger G R et al, 1995. Chronic toxicity of 14 phthalate esters to daphnia magna and rainbow trout (Oncorhynchus mykiss). Environmental Toxicology and Chemistry, 14(11): 1967—1976
Ryther J H, 1955. The ratio of photosynthesis to respiration in marine plankton algae and its effect upon the measurement of productivity. Deep Sea Research, 2(2): 134—139
Shao Z R, Liu F L, Li Q Y et al, 2014. Characterization of ribulose-1, 5-bisphosphate carboxylase/oxygenase and transcriptional analysis of its related genes in Saccharina japonica (Laminariales, Phaeophyta). Chinese Journal of Oceanology and Limnology, 32(2): 377—389
Stebbing A R D, 1982. Hormesis—the stimulation of growth by low levels of inhibitors. Science of the Total Environment,22(3): 213—234
Yu J, Yang C C, Yu R A et al, 2007. Toxic response of dimethyl phthalate (DMP) to Gracilaria Lemaneiformis. Electronic Journal of Biology, 3(4): 80—86
