含奥沙利铂化疗方案联合热疗治疗原发性肝癌的临床治疗效果研究
2018-01-05李巍董晓彤傅华于爱军刘金龙李剑
李巍,董晓彤,傅华,于爱军,刘金龙,李剑
(1.承德医学院附属医院 肝胆外科,河北 承德 067000;2.承德医学院护理学院,河北 承德 067000)
含奥沙利铂化疗方案联合热疗治疗原发性肝癌的临床治疗效果研究
李巍1,董晓彤2,傅华1,于爱军1,刘金龙1,李剑1
(1.承德医学院附属医院 肝胆外科,河北 承德 067000;2.承德医学院护理学院,河北 承德 067000)
目的探讨含奥沙利铂化疗方案联合热疗治疗原发性肝癌的临床治疗效果。方法将90例原发性肝癌患者随机分为观察组和对照组,每组45例。对照组给予常规含奥沙利铂化疗方案,观察组在此基础上加用热疗治疗。对比两组患者短期疗效、疼痛缓解水平、免疫细胞变化及不良反应。结果观察组治疗有效率、疼痛缓解水平与对照组比较,差异有统计学意义(P<0.05),观察组治疗有效率高于对照组,观察组疼痛缓解水平优于对照组患者。治疗后观察组四型免疫细胞(CD4+)、CD4+/CD8+及自然杀伤细胞(NK)细胞与对照组比较,差异有统计学意义(P<0.05),观察组高于对照组。观察组消化道反应和肝功能损伤不良反应发生率与对照组比较,差异有统计学意义(P<0.05),观察组低于对照组。结论热疗联合含奥沙利铂化疗方案治疗原发性肝癌的短期疗效确切且能有效缓解癌痛、免疫损伤及不良反应,具有临床应用价值。
原发性肝癌;化疗;奥沙利铂;热疗
肝癌是我国发病率最高的原发性肿瘤之一,具有预后差、中位生存期短、患者生活质量影响大等特点[1]。化疗是治疗原发性肝癌,尤其是无法进行手术的中晚期原发性肝癌的最主要治疗手段,通过合理的化疗治疗可有效增加肝癌患者的中位生存时间,改善患者生存质量[2-3]。但化疗存在肿瘤耐药、毒副作用等不良反应,限制了其临床应用。热疗是一种新型的肿瘤治疗手段,通过升高温度达到诱发生理变化治疗疾病的治疗手段,已有研究报道其在多种癌症的辅助治疗中具有良好效果[4]。因此,探讨含奥沙利铂化疗方案联合热疗治疗原发性肝癌的临床治疗效果,对改善原发性肝癌的治疗具有重要意义。
1 资料与方法
1.1 一般资料
选取承德医学院附属医院2014年9月-2016年9月收治的90例原发性肝癌患者,将其按照随机数字表法分为观察组和对照组,每组45例。所有患者均经影像学检查及血清甲胎蛋白(alpha fetoprotein,AFP)检测确诊为原发性肝癌。其中男性76例,女性14例;年龄35~82岁,平均(58.7±5.4)岁;病灶数目:单发35例,多发55例;肿瘤大小:≥10 cm 32例,<10 cm 58例;据2003年UICC临床分期:32例ⅡB期,33例ⅢA期,25例ⅢB期;所有患者Ksrnofsky评分≥60分。排除标准:①预计生存期<3个月患者;②并发严重梗阻性黄疸、腹水者;③并发严重心血管疾病者。本研究经本院伦理学会批准,所有患者或其家属均被告知且签署了知情同意书。两组患者在性别、年龄、病灶数目、肿瘤大小及UICC临床分期等一般资料差异无统计学意义(P>0.05),有临床可比性。见表1。

表1 两组患者一般资料的比较 (n =45)
1.2 方法
两组患者均给予GEMOX化疗方案,即1和8 d给予吉西他滨1 000 mg/m2,0.5 h内静脉注射。同时第1天给予奥沙利铂130 mg/m2,3.0 h内静脉注射。3周为1个周期,持续治疗6~10个周期或至病情出现进展或不耐受。化疗前给予常规5-HT受体拮抗剂治疗预防不良胃肠道反应。观察组患者加用热疗治疗,将热疗仪的加热板置于病变部位,插入直肠测温线,深度约7~9 cm,依据影像学资料定位肿瘤位置,采用先高后低的策略进行加热。保证直肠内温度在41℃至42℃之间(肿瘤中心有效治疗温度41.5℃以上)。加热治疗75 min,间隔72 h。6次1个周期持续3个周期。
1.3 观察指标
观察与对比两组患者短期疗效(根据RECIST实体肿瘤疗效评定标准)、疼痛缓解水平(采用NRS法评估)、免疫细胞变化及不良反应。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据处理,计数资料以百分率(%)表示,采用χ2检验;计量资料以均数±标准差(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者短期疗效比较
观察组治疗有效率与对照组比较,差异有统计学意义(χ2=5.378,P<0.05),观察组高于对照组。见表2。
2.2 两组患者疼痛水平比较
观察组疼痛缓解水平与对照组比较,差异有统计学意义(χ2=18.519,P<0.05),观察组优于对照组。见表3。
2.3 两组患者免疫水平比较
治疗后观察组四型免疫细胞(type 4 immune cell,CD4+)、CD4+/CD8+及自然杀伤细胞(natural killer cell,NK)均高于对照组患者。见表4。
2.4 两组患者不良反应比较
观察组消化道反应和肝功能损伤不良反应低于对照组(P<0.05)。见表 5。

表2 两组患者短期疗效比较 [n =45,例(%)]

表3 两组患者疼痛水平比较 [n =45,例(%)]
表4 两组患者免疫水平比较 (n =45,±s)
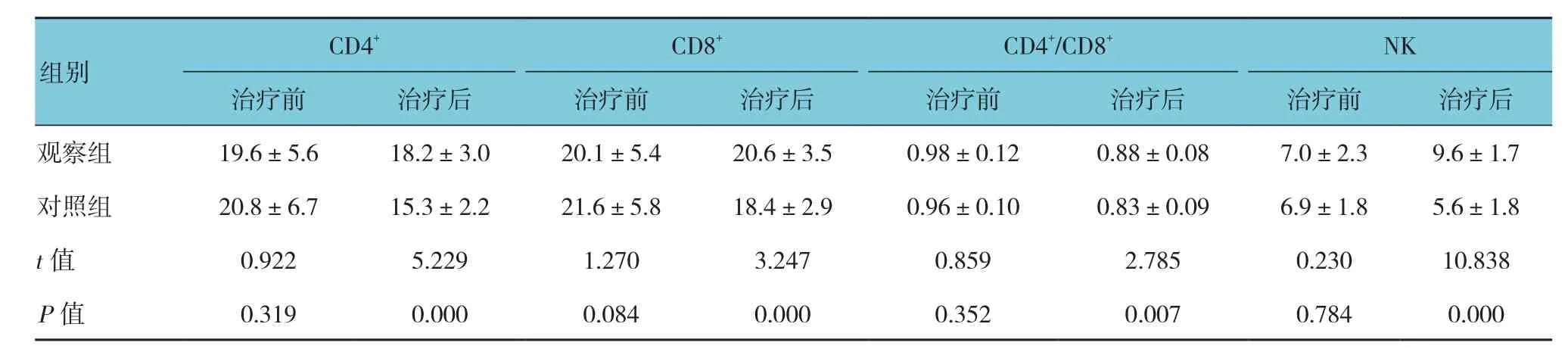
表4 两组患者免疫水平比较 (n =45,±s)
观察组 19.6±5.6 18.2±3.0 20.1±5.4 20.6±3.5 0.98±0.12 0.88±0.08 7.0±2.3 9.6±1.7对照组 20.8±6.7 15.3±2.2 21.6±5.8 18.4±2.9 0.96±0.10 0.83±0.09 6.9±1.8 5.6±1.8 t值 0.922 5.229 1.270 3.247 0.859 2.785 0.230 10.838

表5 两组患者不良反应比较 例
3 讨论
流行病学调查显示,肝癌的发病率和死亡率仅次于肺癌,成为影响我国居民健康的严重疾病[5]。化疗是治疗原发性肝癌的重要治疗手段,相比于射频消融和栓塞化疗等远期疗效更优[6]。奥沙利铂是第3代铂类抗癌药物,其作用机制是通过在细胞内产生烷化剂作用于肿瘤细胞的DNA分子,进而影响肿瘤细胞的DNA复制和合成过程,达到抑制肿瘤复制的作用[7]。与第1代和第2代的铂类抗肿瘤药物相比具有毒副作用更低,临床疗效更好的优势,在多种实体肿瘤的治疗中疗效确切[8-9]。热疗则是化疗和其他治疗方案的补充治疗手段,其原理是通过升高肿瘤部位温度达到治疗目的。由于在肝癌组织中,血管生长急性,因此结构紊乱,血流循环速率下降,仅为正常组织中的1%~10%[10]。因此,通过对肿瘤组织进行局部加热可以有效升高瘤体内部温度。加之肿瘤细胞内普遍呈酸性、营养缺乏,其热敏感性上升[11]。肿瘤组织的这种热敏感和散热差的特性使得热疗在肿瘤组织的治疗中具有了良好基础,在保证了对瘤体内细胞的杀伤力的同时最大限度地降低了对正常组织的破坏。高温不仅可以影响肿瘤的生物学形态还可以与药物相互作用增加其对DNA的损伤[12]。
本研究证实,观察组治疗有效率高于对照组。提示,使用奥沙利铂化疗方案联合热疗治疗原发性肝癌临床疗效优于单使用化疗治疗。为进一步考察联合治疗的优越性,本研究比较了两组患者疼痛水平的变化。研究发现,观察组疼痛缓解水平优于对照组。发现,热疗不仅有助于缩小肿瘤还可以降低患者的癌痛,有效改善患者生存质量。研究认为,联合治疗方案的效果更佳其原因有:①热疗对肿瘤的治疗作用机制为高温影响加热部位细胞的复制过程,与奥沙利铂的作用机制相同发挥联合作用[13];②奥沙利铂的治疗效果是时间依赖性的,在肿瘤细胞加热的过程中破坏了肿瘤血供,在增加药物停留时间的同时增加了药物的敏感性[14];③热疗具有改善患者免疫功能的作用,从而改善患者的治疗效果[15]。为证实这一推测,本研究比较了两组患者淋巴细胞变化情况,发现治疗后观察组CD4+、CD4+/CD8+及NK细胞均高于对照组。证实了热疗在原发性肝癌患者的治疗中确实具有改善患者免疫功能的作用。且在比较两组患者不良反应后发现,观察组消化道反应和肝功能损伤不良反应发生低于对照组。提示,热疗与奥沙利铂化疗方案共同作用还具有降低奥沙利铂不良反应的作用,其作用原理可能与促进化疗药物在肿瘤部位的吸收进而减少对全身的影响。
综上所述,热疗联合含奥沙利铂化疗方案治疗原发性肝癌的短期疗效确切且能有效缓解癌痛,减少免疫损伤及不良反应,具有临床应用价值。
[1]HUNDAL R, SHAFFER E A. Gallbladder cancer: epidemiology and outcome[J]. Clinical epidemiology, 2014, 6(1): 99.
[2]KUDO M, MATSUI O, IZUMI N, et al. Surveillance and diagnostic algorithm for hepatocellular carcinoma proposed by the Liver Cancer Study Group of Japan: 2014 update[J]. Oncology, 2014,87(Suppl.1): 7-21.
[3]LLOVET J M. Liver cancer: time to evolve trial design after everolimus failure[J]. Nature reviews Clinical oncology, 2014,11(9): 506-507.
[4]QUINTO C A, MOHINDRA P, TONG S, et al. Multifunctional superparamagnetic iron oxide nanoparticles for combined chemotherapy and hyperthermia cancer treatment[J]. Nanoscale,2015, 7(29): 12728-12736.
[5]FANG J Y, WU K S, ZENG Y, et al. Liver cancer mortality characteristics and trends in China from 1991 to 2012[J]. Asian Paci fi c Journal of Cancer Prevention, 2014, 16(5): 1959-1964.
[6]PASSOT G, SOUBRANE O, GIULIANTE F, et al. Recent advances in chemotherapy and surgery for colorectal liver metastases[J].Liver Cancer, 2016, 6(1): 72-79.
[7]BALZER M S, EGGERS H, HEUSER M, et al. Oxaliplatin pharmacokinetics on hemodialysis in a patient with diffuse large B cell lymphoma[J]. Annals of Hematology, 2016, 95(4): 649-650.
[8]ROY A, OLSEN J R, MYERSON R J, et al. Oxaliplatin increases disease-free survival in rectal cancer: A single-institution experience[J]. International Journal of Radiation Oncology Biology Physics, 2016, 96(2): E168-E169.
[9]王涛, 赵磊, 李榆. 周剂量多西他赛联合顺铂与周剂量多西他赛联合奥沙利铂治疗晚期胃癌的临床研究[J]. 中国癌症杂志,2015, 25(2): 150-154.
[10]MELERO J T, ORTEGA F G, GONZALEZ A M, et al. Prognostic factor analysis of circulating tumor cells in peripheral blood of patients with peritoneal carcinomatosis of colon cancer origin treated with cytoreductive surgery plus an intraoperative hyperthermic intraperitoneal chemotherapy procedure(CRS+HIPEC)[J]. Surgery, 2016, 159(3): 728-735.
[11]MANTSO T, GOUSSETIS G, FRANCO R, et al. Effects of hyperthermia as a mitigation strategy in DNA damage-based cancer therapies[J]. Academic Press, 2016, 37: 96-105.
[12]王婧, 张沂. 奥沙利铂联合热疗对胃癌耐药细胞基因表达及增殖的影响[J]. 中国药业, 2015,31(22): 78-80.
[13]赵玲俊, 李佳, 姜丽真, 等. 进展期胃癌热疗联合其他治疗的进展[J]. 中国医药导报, 2015, 12(24): 57-60.
[14]文美玲. 三维适行放疗同步GEMOX方案治疗局部晚期食管癌的临床观察[J]. 中南医学科学杂志, 2014, 42(3): 300-301.
Study on clinical therapeutic effect of Oxaliplatin-containing chemotherapy combined with thermotherapy for primary liver cancer
Wei Li1, Xiao-tong Dong2, Hua Fu1, Ai-jun Yu1, Jin-long Liu1, Jian Li1
(1. Department of Hepatobiliary Surgery, the Aff i liated Hospital of Chengde Medical University,Chengde, Hebei 067000, China; 2. College of Nursing, Chengde Medical University,Chengde, Hebei 067000, China)
ObjectiveTo investigate the clinical therapeutic effect of Oxaliplatin-containing chemotherapy combined with thermotherapy in the treatment of primary liver cancer.MethodsNinety cases of primary liver cancer were randomly divided into observation group and control group, with 45 cases in each group. The patients of the control group were given routine Oxaliplatin-containing chemotherapy, while the patients in the observation group were treated with thermotherapy based on the above treatment. The short-term efficacy, the level of pain relief, the changes of immune cells and the incidence of adverse reactions were compared between the two groups.ResultsThe effective rate of the observation group was signi fi cantly higher than that of the control group(χ2= 5.378,P< 0.05). The level of pain relief in the observation group was signi fi cantly better than that in the control group (χ2= 18.519,P< 0.05). CD4+T cells, CD4+/CD8+and NK cells after treatment in the observation group were signi fi cantly higher than those in the control group (P< 0.05). The incidences of the adverse reactions of the digestive tract and liver function damage in the observation group were signi fi cantly lower than those in the control group (P< 0.05).ConclusionsThermotherapy combined with Oxaliplatin-containing chemotherapy has de fi nite short-term curative effect in the treatment of primary liver cancer and can effectively alleviate cancer pain, immune injury and adverse reactions, therefore has clinical value.
hepatocellular carcinoma; chemotherapy; Oxaliplatin; thermotherapy
10.3969/j.issn.1005-8982.2018.01.025
1005-8982(2018)01-0125-04
2017-01-30
R735.7
A
(张西倩 编辑)
