二甲双胍对人胰腺癌细胞增殖、细胞周期和凋亡的影响及机制*
2018-01-05徐萍蒋小猛葛璐黄红梅周朦张尤历徐岷
徐萍,蒋小猛,葛璐,黄红梅,周朦,张尤历,徐岷
(江苏大学附属医院 1.内分泌科,2.消化内科,江苏 镇江 212001)
基础研究·论著
二甲双胍对人胰腺癌细胞增殖、细胞周期和凋亡的影响及机制*
徐萍1,蒋小猛2,葛璐2,黄红梅2,周朦2,张尤历2,徐岷2
(江苏大学附属医院 1.内分泌科,2.消化内科,江苏 镇江 212001)
目的探索不同浓度二甲双胍对人胰腺癌Panc-1细胞增殖、细胞周期和凋亡的影响及其可能的分子机制。方法用不同浓度的二甲双胍处理人胰腺癌Panc-1细胞后,采用MTT法检测其对癌细胞增殖能力的影响,流式细胞术检测其对细胞凋亡和细胞周期的影响,Western blot观察PTEN、p-Akt(Ser473)、mTOR蛋白表达水平的变化。结果干预48 h时,不同浓度二甲双胍(0.5、2.0和8.0 mmol)对细胞生长的抑制率依次为(7.20±5.92)%、(18.35±4.77)%和(33.45±4.10)%;72 h时对细胞生长的抑制率分别为(24.81±4.04)%、(53.42±4.18)%和(61.36±2.00)%。该抑制作用随着药物浓度增加和干预时间延长而增强,呈药物浓度依赖性和时间依赖性。流式细胞术检测结果显示,二甲双胍干预48 h时,8.0 mmol组G1期细胞比例与对照组和0.5 mmol组比较,差异有统计学意义(P<0.05),8.0 mmol组低于对照组和0.5 mmol组;G2/M期细胞比例与对照组和0.5 mmol组比较,差异有统计学意义(P<0.05),8.0 mmol组高于对照组和0.5 mmol组。二甲双胍作用48 h时8.0 mmol组细胞的中晚期凋亡率为(12.64±2.74)%,与对照组(7.01±1.14)%和0.5 mmol组(6.19±0.32)%比较,差异有统计学意义(P<0.05),8.0 mmol组高于对照组和0.5 mmol组。Western blot检测结果显示二甲双胍作用48 h时,2.0 mmol组和8.0 mmol组与对照组和0.5 mmol组比较,PTEN蛋白表达量差异有统计学意义(P<0.05),2.0 mmol组和8.0 mmol组升高,而p-Akt(Ser473)和mTOR的表达水平降低。结论二甲双胍能抑制人胰腺癌Panc-1细胞的增殖能力,引起G2/M细胞周期阻滞,同时诱导胰腺癌细胞的凋亡,其可能的机制是通过激活PTEN的表达,抑制PI3K/Akt/mTOR通路。
二甲双胍;胰腺肿瘤;增殖;细胞周期;细胞凋亡;PTEN;PI3K/Akt/mTOR
二甲双胍是临床上用于治疗2型糖尿病的一种安全有效的药物,它通过减少糖异生,促进外周组织对糖的摄取和利用,从而在机体内发挥降低血糖的作用[1]。近来有研究[2-4]已证实二甲双胍可以抑制胃癌、乳腺癌及肺癌等癌细胞的增殖,具有抗肿瘤的作用。本研究探索不同浓度二甲双胍对人胰腺癌Panc-1细胞株的作用,观察其对癌细胞生长、凋亡及细胞周期的影响,并进一步探讨二甲双胍在胰腺癌细胞中的抗肿瘤作用的分子机制。
1 材料与方法
1.1 细胞株和试剂
人胰腺癌Panc-1细胞株购自中国科学院上海生命科学院细胞所(由江苏大学基础医学研究所保存),细胞培养用胎牛血清、RPMI1640培养基及双抗(链霉素、青霉素)购自美国Gibco公司,二甲双胍、MTT购自美国Sigma公司,DMSO购自美国Sigma公司,Annexin V-FITC流式细胞凋亡检测试剂盒为南京凯基生物科技公司产品,兔抗PTEN、p-Akt、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、actin抗体购自美国Santa Cruze公司,碘化丙啶(propidium iodide,PI)购自美国Sigma公司。酶联免疫检测仪为美国Thermo公司产品,流式细胞仪为美国Becton Dickinson公司产品。
1.2 细胞培养和二甲双胍干预
人胰腺癌Panc-1细胞培养于37℃,5%二氧化碳CO2的无菌、湿润环境中,常规培养于含10%胎牛血清、100 ng/ml链霉素、100 u/ml青霉素的RPMI 1640培养基中。将处于对数生长期的Panc-1细胞消化收集,按细胞量5×103个/孔于96孔板中均匀种板或3×105个/孔接种于6孔板中。实验分为4组,分别是对照组、二甲双胍0.5 mmol组、2.0 mmol组和8.0 mmol组。细胞接种24和48 h后,各组分别更换含有二甲双胍的细胞培养基,药物终浓度分别为0.5、2.0和8.0 mmol,对照组的培养基中加入体积相同的PBS。
1.3 MTT法测定细胞存活率
处于对数生长期的人胰腺癌Panc-1细胞均匀接种于96孔板中,每组设置6个复孔。二甲双胍作用24、48和72 h后,每孔加入10μl、5 mg/ml的MTT试剂后培育4 h,移液器谨慎吸出每孔培养液,再加入DMSO 150μl,于避光条件下轻微震荡5~8 min使结晶完全溶解,吸光度(A)值由酶联免疫检测仪检出,设定检测波长为570 nm,以不含细胞的全细胞培养液孔调零。根据A值计算细胞存活率,细胞存活率=(实验孔A570-调零孔A570)/(对照孔A570-调零孔A570)×100%。
1.4 流式细胞术检测细胞凋亡和细胞周期
将处于对数生长期的Panc-1细胞消化收集,均匀接种于6孔板中,每组设置3个复孔。二甲双胍处理48 h后将各组细胞收集,并以预冷PBS洗涤细胞2次,加入预冷70%乙醇固定,4℃环境下过夜。加入浓度 100μg/ml的 RNase 10μl,浓度 50μg/ml的 PI缓冲液300μl,4℃环境中避光条件下孵育15 min,用流式细胞仪检测细胞凋亡和细胞周期。
1.5 Western blot检测PTEN、p-Akt、mTOR蛋白的表达
用RIPA裂解液常规提取细胞总蛋白,100℃加热10 min,高速离心5 min,-20℃保存待用。12%SDS-PAGE凝胶电泳,湿转法转至PVDF膜上。室温条件下5%脱脂奶粉封闭1.5 h,一抗(PTEN、p-Akt、mTOR、actin),4℃孵育过夜,加入HRP标记的二抗室温孵育1~2 h,用ECL发光试剂检测显影,图像用灰度分析软件处理分析。
1.6 统计学方法
应用SPSS17.0软件进行统计学分析,数据用均数±标准差(±s)表示,两两比较采用LSD-t检验,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍抑制人胰腺癌Panc-1细胞的生长
二甲双胍处理24 h时,细胞存活率仅8.0 mmol组与其他各组比较差异有统计学意义(P<0.05),其他各组之间的比较差异无统计学意义(P>0.05)。干预48 h时,0.5、2.0和8.0 mmol组细胞生长抑制率分别为(7.20±5.92)%、(18.35±4.77)% 和(33.45±4.10)%;干预72 h时各组细胞生长的抑制率分别为(24.81±4.04)%、(53.42±4.18)% 和(61.36±2.00)%,二甲双胍处理癌细胞48和72 h后,与对照组比较,二甲双胍0.5、2.0和8.0 mmol组细胞生长抑制率均差异有统计学意义(P<0.05),且随着二甲双胍药物浓度的增加或干预时间的延长,其对Panc-1细胞的抑制作用逐渐增强。见图1。
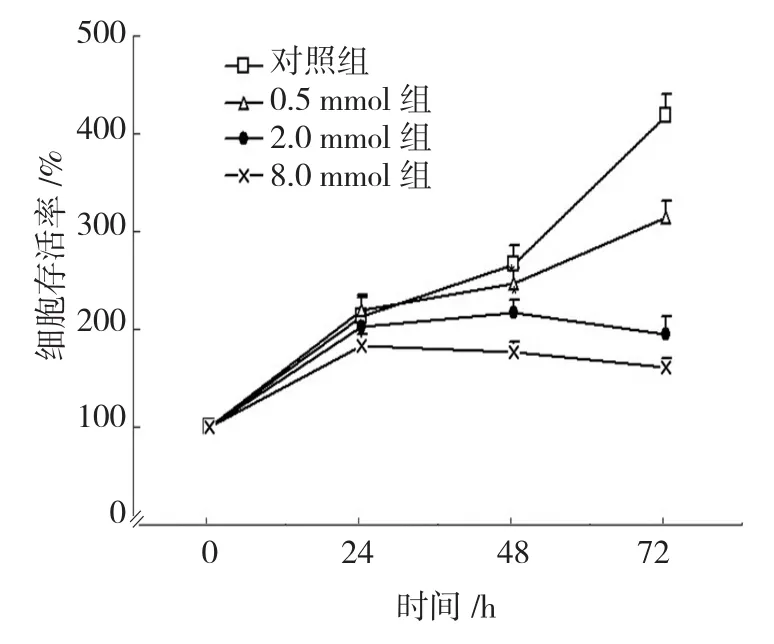
图1 不同浓度二甲双胍干预对胰腺癌Panc-1细胞存活率的影响
2.2 二甲双胍对胰腺癌Panc-1细胞凋亡的影响
二甲双胍干预48 h后,2.0 mmol组与8.0 mmol组癌细胞的早期凋亡与中晚期凋亡的比例呈现增高趋势,但各组之间早期细胞凋亡率比较,差异无统计学意义(P>0.05)。与对照组比较,仅8.0 mmol组中晚期细胞凋亡率的差异有统计学意义(P<0.05)。与0.5 mmol组比较,8.0 mmol组的中晚期细胞凋亡率差异有统计学意义(P<0.05),凋亡率增加。见图2。
2.3 二甲双胍对胰腺癌Panc-1细胞周期的影响
二甲双胍干预48 h时,8.0 mmol组G1期细胞所占比例与对照组和0.5 mmol组比较,差异有统计学意义(P<0.05),8.0 mmol组低于对照组和0.5 mmol组;8.0 mmol组G2/M期细胞所占比例与其他各组比较,差异有统计学意义(P<0.05),8.0 mmol组高于其他各组,表明在胰腺癌Panc-1细胞中,二甲双胍干预能够使细胞周期阻滞于G2/M期。见图3。
2.4 二甲双胍对PTEN、p-Akt、mTOR蛋白的影响
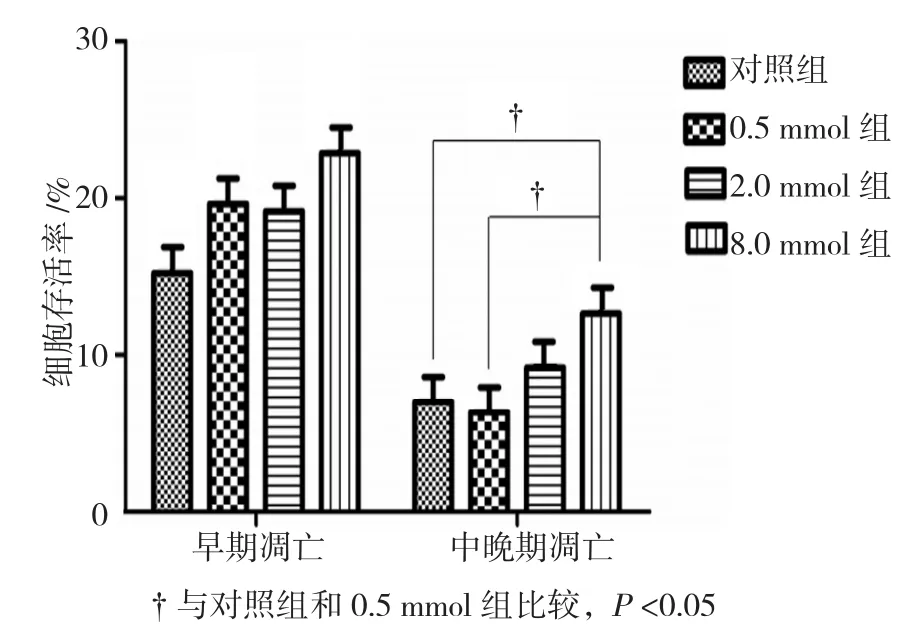
图2 二甲双胍对胰腺癌Panc-1细胞凋亡的影响

图3 不同浓度的二甲双胍干预48 h后对胰腺癌Panc-1细胞周期的影响
二甲双胍干预48 h时,2.0 mmol组和8.0 mmol组中PTEN表达水平与对照组和0.5 mmol组比较,差异有统计学意义(P<0.05),PTEN表达水平升高,而p-Akt(Ser473)和mTOR表达水平降低。见图4。
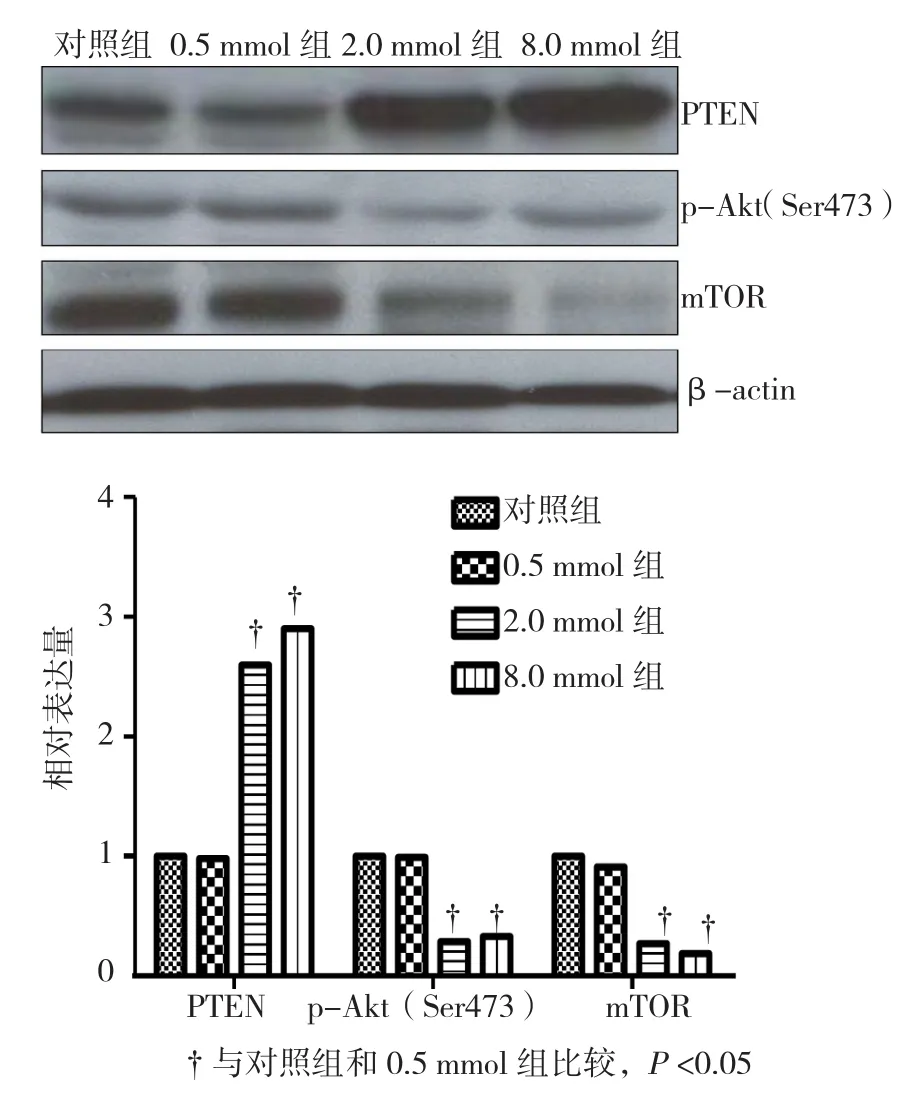
图4 不同浓度的二甲双胍干预48 h后对PTEN、p-Akt、mTOR的影响
3 讨论
胰腺癌是一种恶性度高,病情进展快的消化道恶性肿瘤,2型糖尿病与其的关系目前尚未完全阐明。一方面,胰腺癌可以导致2型糖尿病,另一方面,2型糖尿病也是少数胰腺癌患者的早期临床表现之一。近期研究[5]揭示降糖药物二甲双胍的使用可以减少糖尿病患者发生胰腺癌的可能,引起了人们对二甲双胍的抗肿瘤机制的研究兴趣。
二甲双胍作为一种安全有效的降糖药物,其降血糖的机制被认为与激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)有关。AMPK信号通路的激活可能调控某些肿瘤细胞增殖和凋亡过程。有学者用二甲双胍干预卵巢癌细胞,结果发现细胞的增殖活性降低,AMPK信号通路被活化,磷酸化的AMPK表达增加,进而抑制其下游的mTOR信号分子的表达,导致与增殖相关的蛋白分子合成受抑制。QUEIROZ等[6]证实依赖于AMPK信号通路的二甲双胍在乳腺癌细胞中同样有抑制增殖的作用。本研究发现,用不同浓度的二甲双胍作用于胰腺癌Panc-1细胞48及72 h后,细胞的生长情况均受到抑制,且随着二甲双胍药物浓度的递增或药物干预时间的增加,其对胰腺癌Panc-1细胞的生长抑制逐渐增强。这表明二甲双胍能够较有效地抑制胰腺癌细胞的生长。
二甲双胍同样可通过激活AMPK途径下调mTOR信号来诱发细胞凋亡,QUEIROZ等[6]和HAN等[7]分别证实了二甲双胍对乳腺癌细胞和胃癌细胞的促凋亡作用。WANG等[8]用二甲双胍处理4种胰腺癌细胞株,发现呈现剂量依赖效应的促凋亡趋势。本研究发现,二甲双胍干预48 h后,细胞早期及中晚期凋亡比例均呈增高趋势。8.0 mmol组的细胞凋亡率与0.5 mmol组比较,差异有统计学意义,这提示二甲双胍对胰腺癌细胞的促凋亡作用有可能存在时间及剂量依赖。
本研究发现二甲双胍8.0 mmol组G1期细胞所占比例降低,G2/M期细胞所占比例升高,提示G2/M期细胞周期阻滞。这与BEN等[9]提出二甲双胍联合2-脱氧葡萄糖可以使前列腺癌细胞周期阻滞于G2/M期结果相一致。但也有学者发现,二甲双胍可以使细胞阻滞在G0/G1期[10],并假设二甲双胍可能通过肿瘤抑制激酶LKB1使得磷酸化AMPK增加,活化后的AMPK通过上调P53-P21轴和抑制mTOR途经使得细胞周期阻滞于G0/G1期[11]。二甲双胍对不同细胞株的周期阻滞时期不同,仍需深入研究阐明。
KARNEVI等[12]发现正常血糖浓度下,二甲双胍能够激活胰腺癌细胞的AMPK Thr172,抑制其下游PI3K/Akt/mTOR信号通路。本研究发现二甲双胍作用48 h后,mTOR和p-Akt(Ser473)表达水平下降,说明二甲双胍抑制了这一细胞生长通路。本研究还发现二甲双胍作用48 h后,PTEN表达增高。PTEN作为一种新发现的抑癌基因,在细胞生长、增殖、凋亡等过程中具有重要作用。正常机体中,抑癌基因PTEN拮抗磷酸肌醇激酶PI3K的作用,从而抑制调控细胞增殖和存活的重要信号分子—蛋白激酶Akt的磷酸化,对Akt的活化起负性调控作用,从而使Akt的活性维持在正常范围[13]。KIM等[14]发现,在血管平滑肌细胞中,AMPK能启动PTEN的表达。这一研究提示,二甲双胍具有抗肿瘤作用的分子机制有可能为其激活AMPK的表达,从而启动PTEN,继而抑制下游信号转导通路PI3K/Akt/mTOR。
上述实验初步探明二甲双胍能够抑制胰腺癌细胞的生长,阻滞细胞周期,并促进凋亡,并可能存在时间及剂量依赖性,其机制是通过激活PTEN的表达,抑制PI3K/Akt/mTOR通路。需注意的是,目前关于二甲双胍与肿瘤生长的相关性的体外实验中,所使用的二甲双胍的药物浓度(0.5~8.0 mmol)均高于其作为降糖药物所需的血药浓度。但是,有研究认为二甲双胍在外周组织中聚集浓度数倍高于其血液中的浓度,从而提示二甲双胍用于人体肿瘤治疗中,有可能达到足够有效的抗肿瘤药物浓度。二甲双胍抗肿瘤效应中涉及到的靶点(PTEN、Akt、mTOR等)及其相关通路的变化也为胰腺癌的分子靶向治疗提供了新的研究方向。
[1]ZANDERS M M, VAN HERK-SUKEL M P, VISSERS P A, et al. Statin and aspirin use still associated with overall mortality among colorectal cancer patients with diabetes if adjusted for one another[J]. Br J Cancer, 2015, 113(3): 403-410.
[2]LAU Y K, DU X, RAYANNAVAR V, et al. Metformin and erlotinib synergize to inhibit basal breast cancer[J]. Oncotarget, 2014, 5(21):10503-10517.
[3]GREENHILL C. Gastric cancer. metformin improves survival and recurrence rate in patients with diabetes and gastric cancer[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(3): 124.
[4]O’BRIEN A J, VILLANI L A, BROADFIELD L A, et al. Salicylate activates AMPK and synergizes with metformin to reduce the survival of prostate and lung cancer cells ex vivo through inhibition of de novo lipogenesis[J]. Biochem J, 2015, 469(2): 177-187.
[5]SNIMA K S, NAIR R S, NAIR S V, et al. Combination of antidiabetic drug metformin and boswellic acid nanoparticles: a novel strategy for pancreatic cancer therapy[J]. J Biomed Nanotechnol,2015, 11(1): 93-104.
[6]QUEIROZ E A, PUUKILA S, EICHLER R, et al. Metformin induces apoptosis and cell cycle arrest mediated by oxidative stress, AMPK and FOXO3a in MCF-7 breast cancer cells[J]. PLoS One, 2014, 9(5): e98207.
[7]HAN G, GONG H, WANG Y, et al. AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell[J]. Cancer Biol Ther, 2015,16(1): 77-87.
[8]WANG L W, LI Z S, ZOU D W, et al. Metformin induces apoptosis of pancreatic cancer cells[J]. World J Gastroenterol, 2008, 14(47):7192-7198.
[9]BEN S I, LAURENT K, GIULIANO S, et al. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells[J]. Cancer Res, 2010, 70(6): 2465-2475.
[10]ISAKOVIC A, HARHAJI L, STEVANOVIC D, et al. Dual antiglioma action of metformin: cell cycle arrest and mitochondria-dependent apoptosis[J]. Cell Mol Life Sci, 2007,64(10): 1290-1302.
[11]JONES R G, PLAS D R, KUBEK S, et al. AMP-activated protein kinase induces a p53-dependent metabolic checkpoint[J]. Mol Cell, 2005, 18(3): 283-293.
[12]KARNEVI E, SAID K, ANDERSSON R, et al. Metforminmediated growth inhibition involves suppression of the IGF-I receptor signalling pathway in human pancreatic cancer cells[J].BMC Cancer, 2013, 13: 235.
[13]YU Y, SAVAGE R E, EATHIRAJ S, et al. Targeting AKT1-E17K and the PI3K/AKT pathway with an allosteric AKT Inhibitor,ARQ 092[J]. PLoS One, 2015, 10(10): e0140479.
[14]KIM J, KUNDU M, VIOLLET B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J].Nat Cell Biol, 2011, 13(2): 132-141.
In fl uence of Metformin on proliferation, cell cycle and apoptosis in human pancreatic adenocarcinoma cells and mechanisms*
Ping Xu1, Xiao-meng Jiang2, Lu Ge2, Hong-mei Huang2, Meng Zhou2, You-li Zhang2, Min Xu2
(1. Department of Endocrinology, 2. Department of Gastroenterology, Aff i liated Hospital of Jiangsu University, Zhenjiang, Jiangsu 212001, China)
ObjectiveTo investigate the effect of Metformin on proliferation, cell cycle and apoptosis of pancreatic adenocarcinoma Panc-1 cellsin vitro, and appraise the possible mechanism.MethodsPanc-1 cells were treated with 0.5, 2.0 and 8.0 mmol Metforminin vitro. Cell proliferation was measured by MTT assay. Cell apoptosis and cell cycle distribution were detected by fl ow cytometery. The expression of PTEN, p-Akt (Ser473) and mTOR were dected by Western blot.ResultsAfter 48 h, the inhibition rates of Metformin at dosage of 0.5, 2.0 and 8.0 mmol were (7.20 ± 5.92)%, (18.35 ± 4.77)% and (33.45 ± 4.10)%, respectively. After 72 h, the inhibition rates of Metformin at dosage of 0.5, 2.0 and 8.0 mmol were (24.81 ± 4.04)%, (53.42 ± 4.18)% and (61.36 ± 2.00)%,respectively. The proliferation of Panc-1 cells was inhibited by Metformin in a dose- and time-dependent manner.After 48 h, the percentage of G1 phase cells in the 8.0 mmol Metformin group was signi fi cantly lower than that in the controlled group and the 0.5 mmol Metformin group (P< 0.05). The percentage of G2/M phase cells in the 8.0 mmol Metformin group was remarkably higher than that in the other groups (P< 0.05). After 48 h, the percentage of cells in the middle and late stages of apoptosis was increased from (7.01 ± 1.14)% in the controlled group and(6.19 ± 0.32)% in the 0.5 mmol Metformin group to (12.64 ± 2.74)% in the 8.0 mmol Metformin group (P< 0.05).After 48 h, compared with the controlled group and the 0.5 mmol Metformin group, the expression of PTEN was activated and the expressions of p-Akt (Ser473) and mTOR were reduced in the 2.0 and 8.0 mmol Metformin groups(P< 0.05).ConclusionsMetformin can suppress the proliferation of human pancreatic adenocarcinoma Panc-1 cells, cause G2/M phase checkpoint arrest and induce cell apoptosisin vitroat moderate to high dosage. The mechanism may be inhibition of the PI3K/Akt/mTOR pathway by activating the expression of PTEN.
Metformin; pancreatic neoplasm; proliferation; cell cycle; apoptosis; PTEN; PI3K/Akt/mTOR
10.3969/j.issn.1005-8982.2018.01.001
1005-8982(2018)01-0001-05
2017-03-27
国家自然科学基金(No:81472333;No:81672402)
徐岷,E-mail:peterxu1974@163.com
R735.9
A
(张蕾 编辑)
