羟基喜树碱对人肺癌A549细胞自噬的影响*
2018-01-05魏艳杰彭子荷李晨浩郝帅林张媛李朝阳肖童郝小惠刘和亮田炜王宏丽
魏艳杰 ,彭子荷 ,李晨浩 ,郝帅林 ,张媛 ,李朝阳 ,肖童 ,郝小惠,刘和亮,田炜,王宏丽
(1.华北理工大学 医学实验研究中心,河北 唐山 063210;2.河北省沧州中心医院,河北沧州 061014;3.华北理工大学公共卫生学院,河北 唐山 063210)
羟基喜树碱对人肺癌A549细胞自噬的影响*
魏艳杰1,彭子荷1,李晨浩2,郝帅林1,张媛1,李朝阳1,肖童1,郝小惠1,刘和亮1,田炜1,王宏丽3
(1.华北理工大学 医学实验研究中心,河北 唐山 063210;2.河北省沧州中心医院,河北沧州 061014;3.华北理工大学公共卫生学院,河北 唐山 063210)
目的探究羟基喜树碱(HCPT)对人肺癌A549细胞自噬的作用。方法体外进行肺癌A549细胞的培养,分别使用50、200和400μmol的HCPT处理,利用MTT法检测HCPT对细胞存活率的影响;共聚焦显微镜成像技术观察HCPT对细胞自噬活性的影响;Western blot检测HCPT对自噬相关蛋白LC3、p-mTOR表达的影响。结果HCPT抑制A549细胞的活性;HCPT处理24 h后细胞质和细胞核周围Cyto-ID绿色荧光强度增强;与对照组比较,HCPT治疗各组LC3II/I值升高,p-mTOR表达减少;且加入自噬抑制剂6-氨基-3-甲基嘌呤(3-MA)处理后的各组与相对应的HCPT治疗各组比较,A549细胞的增殖抑制增强。结论HCPT能抑制A549细胞增殖并诱导其发生自噬;HCPT发挥抑制A549细胞增殖作用可能与自噬密切相关;抑制细胞自噬可能会增强HCPT的抗A549细胞增殖能力。
肺癌;自噬;羟基喜树碱;3-MA;mTOR
近年来数据显示,肺癌严重危害人类健康,全球范围内肺癌的发病率和死亡率增加[1]。随着我国经济的发展和环境污染的加剧,肺癌已成为各种癌症死亡的首要原因[2]。在肺癌的治疗方面,目前化疗仍然是重要的辅助治疗手段,但化疗过程中肿瘤细胞的耐药性及其抗凋亡能力是妨碍多种肿瘤治愈的主要原因之一。近年来,细胞自噬与肿瘤之间的关系在肿瘤研究领域已成为热点。最新研究显示,自噬与肿瘤的发生、浸润及转移存在密切的关系,因此自噬有望成为肿瘤治疗中新的靶点。
羟基喜树碱(Hydroxycamptothecin,HCPT)是一种广谱抗肿瘤药物,但其抑制肿瘤细胞的具体机制尚不明确[3]。因此本研究拟通过观察HCPT对人肺癌A549细胞自噬的影响,以期为其今后的临床应用提供理论依据。
1 材料与方法
1.1 细胞株及培养
A549细胞购自中国科学院细胞库。A549细胞株在5% CO2、37℃、饱和湿度培养箱内培养于RPMI1640培养液(含10%胎牛血清)中,贴壁生长至80%~90%时,0.25%胰酶消化传代。
1.2 主要试剂与仪器
HCPT(纯度>99%)由百灵威科技有限公司提供,6-氨基-3-甲基嘌呤(3-MA)、雷帕霉素(RAPA)和兔源LC3B多克隆抗体均购于美国Sigma公司,细胞增殖及毒性检测试剂盒(MTT)为石家庄天舜生物科技有限公司产品,Cyto-ID Autophagy Detection Kit(ENZ-51031-K200)为美国Enzo life science产品。37℃二氧化碳细胞培养箱(美国Thermo Forma公司),半干转运系统(美国BIO-RAD公司),JY200C电泳仪(北京君意东方电泳设备有限公司),激光共聚焦显微镜FV1000(日本Olympus公司)。
1.3 体外药物敏感的MTT法检测
选取对数生长期且细胞状态良好的细胞重复细胞培养步骤,用新培养基使细胞重悬混匀,在96孔板每孔中加入200μl含有大约3 000个细胞的细胞悬液,细胞贴壁后,每孔加入不同剂量HCPT培养液200μl(对照组加普通培养液),HCPT+3-MA组在HCPT处理前1 h加3-MA(5 mmol)处理,每组设5个复孔。培养24 h后每孔分别加入MTT(0.5%MTT)溶液20μl,在细胞培养箱内继续培养4 h后加入二甲基亚砜(dimethyl sulfoxide,DMSO)150μl,15 min后显微镜下观察到蓝色结晶物完全溶解,于570 nm波长用酶标仪测定各孔的光密度(optical density,OD)值。
1.4 激光共聚焦显微镜检测自噬发生情况
选取对数生长期且细胞状态良好的细胞,消化离心后置于共聚焦小皿内培养,待细胞贴壁生长达到50%~70%后,每皿加入不同浓度HCPT培养液2 ml(对照组用普通培养液)继续培养24 h,并设阳性对照组(RAPA组)。按CYTO-ID®Autophagy Detection Kit试剂盒说明书加入Hoechst 33342 Nuclear Stain、CYTO-ID®Green Detection Reagent 37℃避光孵育30 min,置于激光共聚焦显微镜下进行观察。
1.5 Western blot检测自噬相关蛋白LC3、p-mTOR表达
LC3在自噬过程中具有标志性的作用,其在细胞内有2种存在形式(LC3I、LC3II),自噬体的形成过程中伴随着LC3I向LC3II的转变。因此LC3II/LC3I值可以反映自噬发生情况。p-mTOR是细胞自噬的负性调控蛋白。重复细胞传代步骤,用细胞培养液重悬细胞并充分混匀,每个小皿内加入2 ml细胞悬液,培养过夜。实验分为对照组(加入普通培养液)、HCPT组(50、200和 400μmol)、HCPT+3-MA组, 处 理24 h后收集细胞。通过裂解细胞、提取细胞总蛋白进行蛋白浓度测定后,运用Western blot检测LC3、p-mTOR的表达。用Image J进行灰度扫描及定量分析。
1.6 统计学方法
采用SPSS21.0软件处理实验数据,计量资料以均数±标准差(±s)表示,多组均值比较采用完全随机设计的单因素方差分析(One-way,ANOVA),组间两两比较采用LSD法检验,P<0.05为差异有统计学意义。
2 结果
2.1 HCPT对A549细胞活性的影响
MTT法测定A549细胞的存活率,经单因素方差分析,差异有统计学意义(F=186.662,P=0.000),各组细胞的存活率有差别;进一步两两比较显示,与对照组比较,HCPT组(50、200和400μmol)中细胞相对存活率间差异有统计学意义(t=13.614、12.614和44.679,均P=0.000),见附表。表明HCPT剂量越大,其抑制A549细胞的增殖能力越强。
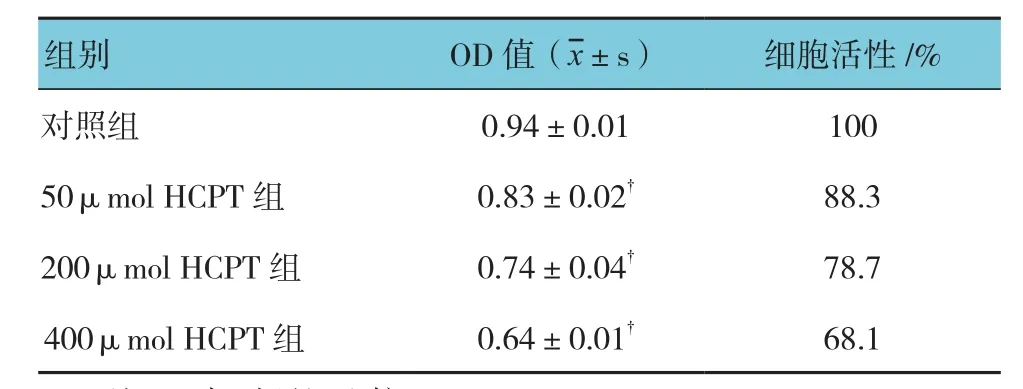
附表 不同剂量HCPT对A549细胞活性的影响 (n =10)
2.2 HCPT对细胞自噬的影响
2.2.1 细胞自噬结果 与对照组比较,HCPT组处理24 h后细胞质和细胞核周围Cyto-ID绿色荧光强度增强,与经典的自噬诱导剂RAPA处理后情况相似,其中200μmol HCPT组Cyto-ID绿色荧光强度增强尤为明显,说明HCPT可以诱导A549细胞自噬发生,且其诱导A549细胞自噬发生的能力与用药剂量有关。见图1。
2.2.2 细胞自噬相关蛋白LC3的表达结果 Western blot检测各组LC3II/LC3I值的变化,LC3II/LC3I值在 对 照 组、50μmol HCPT组、200μmol HCPT组、400μmol HCPT 组表达为(100.0±2.12)、(107.07±0.94)%、(136.36±0.62)% 和(125.25±1.31)%,经单因素方差分析,差异有统计学意义(F=855.315,P=0.000),各组LC3II/LC3I值有差别;进一步两两比较显示,与对照组比较,HCPT组(50,200,400μmol)中LC3II/LC3I值差异有统计学意义(t=-6.625、-38.147和 -23.203, 均P=0.000)。200μmol HCPT组LC3II/LC3I值上升最为显著。进一步说明,HCPT可诱导A549细胞自噬活性增强,其诱导A549细胞自噬的能力与剂量有关。见图2。
2.2.3 细胞自噬相关蛋白p-mTOR的表达结果Western blot检测各组p-mTOR水平的变化,p-mTOR在 对 照 组、50μmol、200μmol及 400μmol HCPT组 表 达 为(100.00±7.36)%、(95.61±7.41)%、(70.29±6.67)%及(49.53±5.42)%,经单因素方差分析,差异有统计学意义(F=716.920,P=0.000),各组p-mTOR水平有差别;进一步两两比较显示,与对照组比较,HCPT组(50、200和400μmol)p-mTOR水平差异有统计学意义(t=3.993、19.502和44.184,P=0.005、0.000和0.000),HCPT诱导A549的细胞自噬可能与m-TOR信号通路有关。见图3。
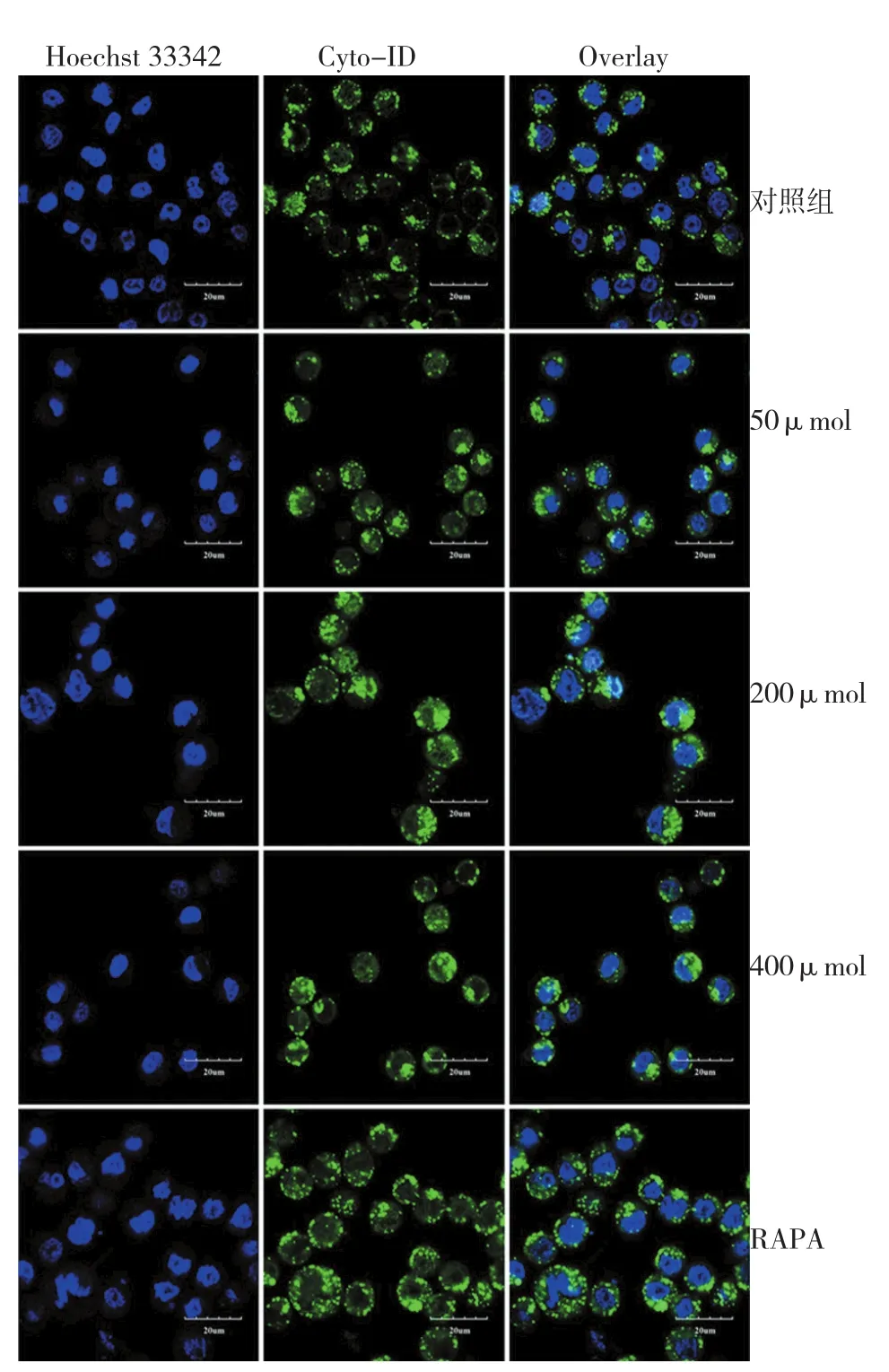
图1 不同浓度HCPT对A549细胞自噬的诱导作用(共聚焦显微镜成像×40)
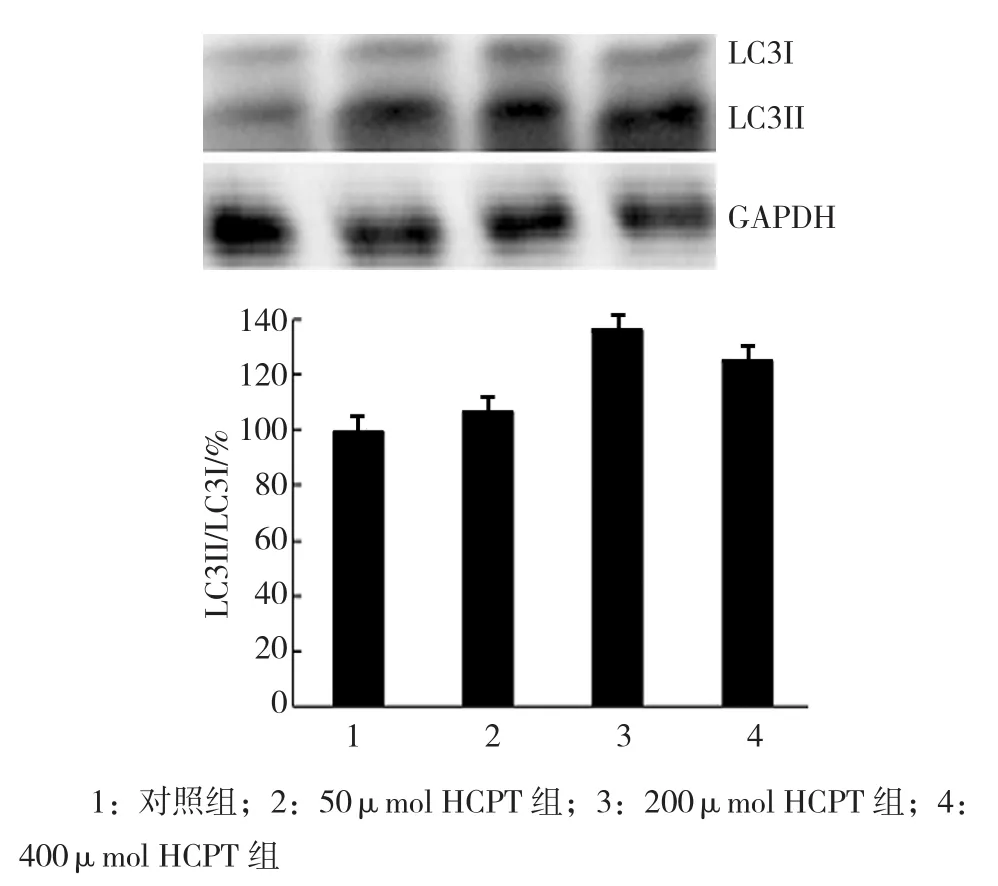
图2 HCPT对A549细胞自噬相关蛋白LC3表达的影响
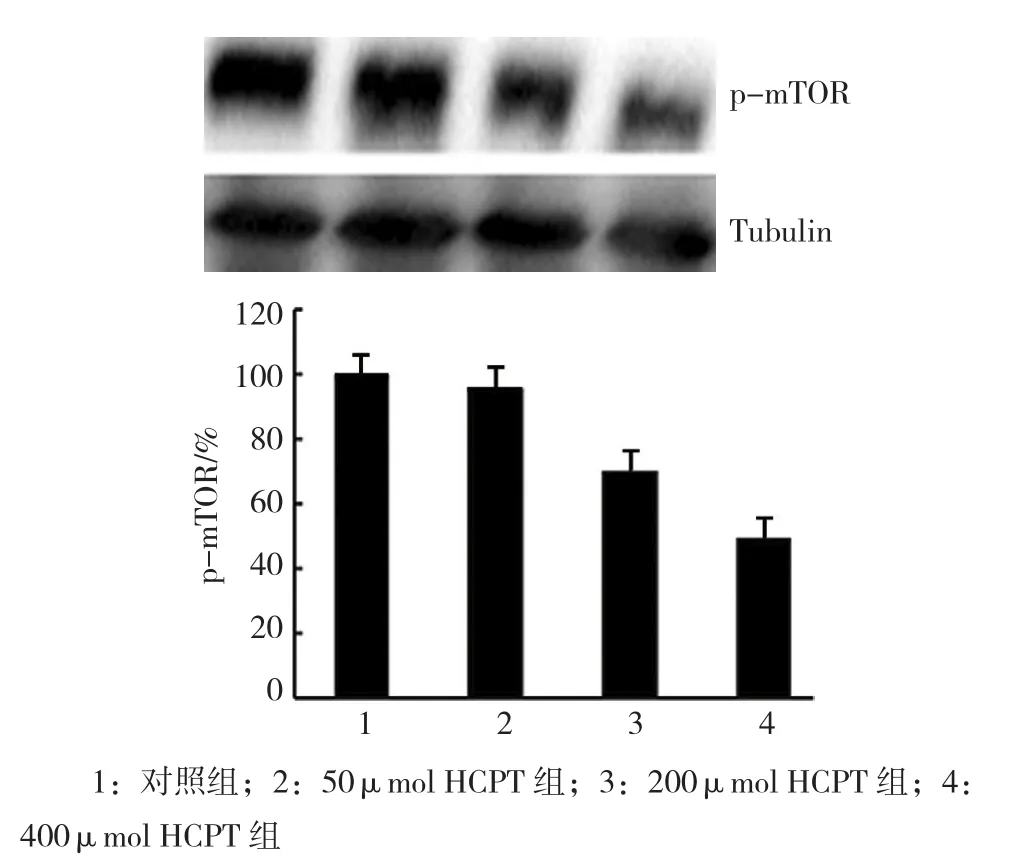
图3 HCPT对A549细胞自噬相关蛋白p-mTOR表达的影响
2.3 HCPT联合自噬抑制剂3-MA对肺癌A549细胞的影响
2.3.1 3-MA抑制HCPT诱导的细胞自噬 Western blot检测各组LC3II/LC3I值的变化,LC3II/LC3I值在200μmol HCPT组、200μmol HCPT+3-MA组、3-MA组及对照组表达为(158.22±3.26)%、(110.30±11.23)%、(107.57±15.86)% 和(100.00±8.02)%,经单因素方差分析,差异有统计学意义(F=37.222,P=0.000),各组LC3II/LC3I值有差别;进一步两两比较显示,3-MA组与对照组比较,LC3II/LC3I值差异无统计学意义(t=0.924,P=0.200),200μmol HCPT组与对照组比较,LC3II/LC3I值差异有统计学意义(t=19.204,P=0.000);200μmol HCPT+3-MA 组 与200μmol HCPT组比较,LC3II/LC3I值差异有统计学意 义(t=11.243,P=0.000);200μmol HCPT+3-MA组与3-MA组比较,LC3II/LC3I值差异无统计学意义(t=0.344,P=0.372)。表明自噬抑制剂 3-MA(5 mmol)可以抑制HCPT诱导的自噬。见图4。
2.3.2 抑制自噬后HCPT对肺癌A549细胞增殖抑制的影响 MTT法测定A549细胞的存活率,自噬抑制剂3-MA联合HCPT(50、200和400μmol)处理24 h后,A549细胞的增殖抑制率分别为(30.7±4.3)%、(38.1±4.6)%和(42.9±1.1)%,高于单用HCPT同剂量组的(12.9±2.3)%、(21.6±4.1)% 和(32.7±2.1)%,经单因素方差分析,差异有统计学意义(F=140.801,P=0.000),各组细胞的存活率有差别;进一步两两比较显示,与相同剂量HCPT组比较,50、200和400μmol HCPT+3-MA组中细胞相对存活率差异有统计学意义(t=18.401、15.771和6.476,均P=0.000),这提示HCPT联合自噬抑制剂治疗肺癌的效果可能更佳。见图5。
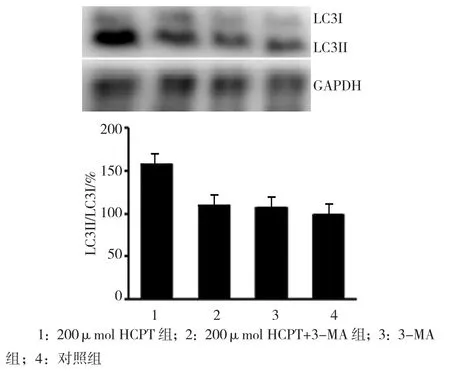
图4 3-MA(5 mmol)抑制200μmol HCPT诱导的细胞自噬作用

图5 3-MA抑制自噬后HCPT对肺癌A549细胞增殖抑制的影响
3 讨论
无限增殖障碍是恶性肿瘤细胞的一个重要特征。大量药物的抗肿瘤作用是通过抑制肿瘤细胞增殖实现的[4-5]。通过实验研究发现,HCPT具有抑制A549细胞增殖的作用,且HCPT剂量越大抑制作用越强。这提示HCPT发挥抗肿瘤的作用可能与其抑制肿瘤细胞增殖有关。
自噬是真核细胞通过溶酶体途径降解和回收受损的细胞器和大分子物质,维持细胞稳态的过程[6]。一些研究指出[7-8],自噬可能在癌症发展的不同阶段发挥不同的作用,肿瘤细胞可以通过自噬途径抵抗由环境变化所造成的损害,也可以通过自噬启动程序性死亡通路,发生自噬性死亡;自噬在不同的肿瘤中所发挥的作用也是不尽相同的。本研究重点探讨了HCPT是否诱导A549细胞发生自噬。研究结果显示,经HCPT处理后,A549细胞的LC3II/LC3I比值升高,自噬负性调控蛋白p-mTOR表达降低,结合激光共聚焦荧光染色法观察结果,可以确定的是,HCPT可诱导A549细胞自噬。有研究指出,肺癌细胞、人宫颈癌HeLa细胞以及结肠癌细胞等均具有较高的自噬潜能,这在其处于恶劣环境时有一定的保护作用[8-9]。在肿瘤进行化疗和放疗的过程中,细胞会通过提高自噬活性,快速降解并循环利用受损的细胞器和大分子物质,及时进行受损DNA的修复,从而抑制肿瘤细胞凋亡,以维持其持续增殖[8]。另外,自噬也使一些抗肿瘤药物的作用减弱:替莫唑胺作用于恶性神经胶质瘤细胞3和7 d,细胞中自噬活性先增强后减弱,同时观察到细胞的增殖先受到抑制后出现增殖现象[10]。有研究表明[8,11],促进自噬的药物有抗肿瘤作用,因此靶向促进自噬的药物在今后的肿瘤治疗将会得到重视。目前雷帕霉素作为自噬诱导剂用于肿瘤治疗的临床实验已经开始,研究证明其具有抑制多种肿瘤细胞的作用[8]。研究发现[8,12]苦参碱和盼生安分别作用于HepG2细胞和肝癌BEL-7402细胞时均有自噬的参与。这些药物不仅可以激发肿瘤细胞的自噬,同时也参与了自噬分子的调控。多种自噬抑制剂可以加强化疗药物的抗肿瘤作用。如抗疟疾药物氯喹联合化疗中的应用,氯喹可以通过改变溶酶体内的酸性环境进而达到抑制细胞自噬发生的目的,从而促进化疗药物对肿瘤细胞的杀伤力[8,13]。有研究[8,14]表明曲古抑菌肽(TSA)和伏立诺他(SAHA)发挥抗肿瘤的作用是通过抑制自噬达到的。此外,有研究表[8,15]明自噬抑制剂如3-MA、渥曼青霉素等多种自噬抑制剂在肿瘤的治疗中都有可能扮演重要角色。由此看来,特定情况下细胞自噬具有保护肿瘤细胞的作用,防止其死亡。这提示抑制细胞自噬也可能作为某些肿瘤的治疗的途径。本研究也发现,HCPT联合3-MA比单用HCPT对肺癌A549细胞的增殖抑制作用更强,由此推测HCPT在治疗肺癌过程中,联合自噬抑制剂可能会使治疗效果更佳。
总之,本研究在体外探讨了广谱抗瘤药物HCPT对肺癌A549细胞自噬的影响,发现HCPT对A549细胞的增殖抑制作用呈剂量依赖性;HCPT诱导的细胞自噬可能与mTOR信号通路有关;HCPT联合自噬抑制剂3-MA发挥的抗细胞增殖能力更强。其具体机制有待于今后进一步的探讨。
[1]SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64: 9-29.
[2]中国抗癌协会肺癌专业委员会主任委员、天津市肿瘤医院副院长王长利. 靶向药物治肺癌切忌滥[N]. 光明日报, 2015-11-21010.
[3]洪伟勇, 严琴英, 杨根生. 抗癌药物羟基喜树碱纳米囊泡的研究[J].浙江工业大学学报, 2012, 40(3): 253-256.
[4]VILGELM A E, PAWLIKOWSKI J S, LIU Y, et al. Mdm2 and aurora kinase a inhibitors synergize to block melanoma growth by driving apoptosis and immune clearance of tumor cells[J]. Cancer Res, 2015, 75(1): 181-193.
[5]MINGCHEN ZHU, YIJUN X U, MENGYUAN G E, et al.Regulation of UHRF1 by microRNA-9 modulates colorectal cancer cell proliferation and apoptosis[J]. Cancer Sci, 2015, 106(7): 833-839.
[6]YUAN Y, WANG H, WEI Z, et al. Impaired autophagy in hilar mossy cells of the dentate gyrus and its implication in schizophrenia[J]. J Genet Genomics, 2015, 42(1): 1-8.
[7]GEWIRTZ D A. The four faces of autophagy: implications for cancer therapy[J]. Cancer Res, 2014, 74(3): 647-651.
[8]魏艳杰, 田炜. 自噬及其在肿瘤发生发展中作用的研究进展[J].中国医学创新, 2016, 13(23): 137-141.
[9]WU Z, CHANG P C, YANG J C, et al. Autophagy blockade sensitizes prostate cancer cells towards Src family kinase inhibitors[J]. Genes Cancer, 2010, 1(1): 40-49.
[10]LI X, FAN Z. The epidermal growth factor receptor antibody cetuximab induces autophagy in cancer cells by down regulating HIF-1alpha and Bcl-2 and activating the beclin 1/hVps34 complex[J]. Cancer Res, 2010, 70(14): 5942-5952.
[11]TANG M C, WU M Y, HWANG M H, et al. Chloroquine enhances gefitinib cytotoxicity in gefitinib-resistant nonsmall cell lung cancer cells[J]. PLoS One, 2015, 10(3): e0119135.
[12]CHIARINI F, EVANGELISTI C, MCCUBREY J A, et al. Current treatment strategies for inhibiting mTOR in cancer[J]. Trends Pharmacol Sci, 2015, 36(2): 124-135.
[13]DUFFY A, LE J, SAUSVILLE E, et al. Autophagy modulation:a target for cancer treatment development[J]. Cancer Chemother Pharmacol, 2015, 75(3): 439-447.
[14]CAO D J, WANG Z V, BATTIPROLU P K, et al. Histone deacetylase (HDAC) inhibitors attenuate cardiac hypertrophy by suppressing autophagy[J]. Proc Natl Acad Sci USA, 2011,108(10): 4123-4128.
[15]COKER-GURKAN A, ARISAN E D, OBAKAN P, et al.Inhibition of autophagy by 3-MA potentiates purvalanol-induced apoptosis in Bax deficient HCT 116 colon cancercells[J]. Exp Cell Res, 2014, 328(1): 87-98.
Effect of hydroxycamptothecin on autophagy of A549 lung cancer cells*
Yan-jie Wei1, Zi-he Peng1, Chen-hao Li2, Shuai-lin Hao1, Yuan Zhang1, Zhao-yang Li1,Tong Xiao1, Xiao-hui Hao1, He-liang Liu1, Wei Tian1, Hong-li Wang3
(1. Medical Research Center, North China University of Science and Technology, Tangshan, Hebei 063210, China; 2. Department of Oncology, Cangzhou Central Hospital, Cangzhou,Hebei 061014, China; 3. Public Health School, North China University of Science and Technology, Tangshan, Hebei 063210, China)
ObjectiveTo investigate whether autophagy is involved in the anticancer mechanisms of hydroxycamptothecin (HCPT) in human lung cancer A549 cellsin vitro.MethodsHuman non-small cell lung cancer cell line A549 was cultured. In our study, cell viability was assessed by MTT assay, Cyto-ID staining was used for autophagy detection which was observed by laser scanning confocal microscope (LSCM), the expression of LC3II/I and p-mTOR were measured by Western blot.ResultsHCPT (50, 200 and 400 μmol) suppressed the viability of A549 cells in a concentration-dependent manner. Moreover, HCPT increased autophagy level in the A549 cells. The autophagy inhibitor 3-MA caused a statistically significant increase in growth inhibition of the HCPT-treated A549 cells.ConclusionsHCPT induces autophagy in lung cancer A549 cellsin vitro. HCPT (50, 200 and 400 μmol) suppresses the viability of A549 cells in a concentration-dependent manner and its induction of cell autophagy is related to the dosage. Autophagy inhibition combined with HCPT may be a better way for the treatment of lung cancer.
lung cancer; autophagy; HCPT; 3-MA; mTOR
10.3969/j.issn.1005-8982.2018.01.006
1005-8982(2018)01-0025-05
2017-02-10
河北省高等学校科学技术研究重点项目(No:ZD2017063);唐山市国际科技合作项目(No:14160201B);2016年地方高校国家级大学生创新创业训练计划项目(No:201610081026);华北理工大学大学生创新实践计划项目(No:X2016026)
王宏丽,E-mail:tsruoshui@163.com
R734.2
A
(张蕾 编辑)
