α-倒捻子素对MCF-7乳腺癌增殖、生长和侵袭的影响及其作用机制
2018-01-05马林伟徐红涛戴小丽韩中保
马林伟,徐红涛,戴小丽,韩中保
(盐城卫生职业技术学院 临床医学教研室,江苏 盐城 224005)
α-倒捻子素对MCF-7乳腺癌增殖、生长和侵袭的影响及其作用机制
马林伟,徐红涛,戴小丽,韩中保
(盐城卫生职业技术学院 临床医学教研室,江苏 盐城 224005)
目的探讨α-倒捻子素对MCF-7乳腺癌增殖、生长和侵袭的影响及其作用机制。方法采用细胞增殖实验(MTS法)研究α-倒捻子素对MCF-7乳腺癌细胞体外增殖的影响;采用裸鼠皮下移植瘤模型研究α-倒捻子素对MCF-7乳腺癌体内生长的影响;采用Transwell实验研究α-倒捻子素对MCF-7乳腺癌细胞侵袭的影响;采用免疫组织化学法研究α-倒捻子素对MCF-7乳腺癌皮下移植瘤组织中翻译控制肿瘤蛋白(TCTP)、基质金属蛋白酶MMP-2及MMP-9蛋白表达的情况;采用Western blot研究α-倒捻子素对MCF-7细胞中Erk、P38、MMP-2及MMP-9蛋白表达的影响。结果体外增殖实验结果显示,α-倒捻子素能够抑制MCF-7乳腺癌细胞的增殖,且具有浓度和时间依赖性;α-倒捻子素能够剂量依赖性地抑制MCF-7乳腺癌的体内生长;α-倒捻子素能够抑制MCF-7乳腺癌细胞的侵袭;免疫组织化学结果显示,α-倒捻子素能够下调TCTP、MMP-2及MMP-9的蛋白表达;Western blot结果显示,α-倒捻子素能够抑制调控肿瘤细胞增殖及侵袭相关蛋白的表达,如磷酸化的Erk、磷酸化的P38、MMP-2及MMP-9。结论α-倒捻子素能够抑制MCF-7乳腺癌增殖、生长及侵袭,其机制可能与抑制调控肿瘤细胞增殖及侵袭相关蛋白的表达有关。
α-倒捻子素;乳腺癌;增殖;生长;侵袭;作用机制
乳腺癌是全球女性最为常见且危害最大的恶性肿瘤,给人们的健康生活带来极大威胁[1]。美国最新统计研究表明,全美女性乳腺癌的发病率和死亡率居高不下[2]。诸多因素可导致乳腺癌的发生,诸如遗传[3]、激素分泌紊乱[4]、致癌物诱导[5]、环境污染[6]及不良生活习惯[7]等。目前乳腺癌的治疗主要还是以手术切除并辅以放化疗为主[8],这种治疗方法确实能够有效控制患者的病情,延长患者的生存期,但缺点也是极为明显:①手术切除乳房,特别是双侧全乳切除,不仅给女性身体上带来很大的伤痛,同时给女性精神上也带来难以弥补的创伤[9];②放化疗虽然能够有效控制癌细胞的生长和扩散,但其对正常细胞的杀伤使得患者的免疫力急剧下降,抗病能力骤降,导致患者更加虚弱[10]。随着医学技术的不断发展,近年来针对乳腺癌的治疗出现了一些新疗法,如免疫疗法[11]、靶向治疗[12]、激素疗法[13]及内分泌疗法[14]等。不可否认,这些新型疗法确有一定疗效,也给患者的治疗多了一些选择,但也存在相应的问题。以靶向疗法为例,单一的靶向治疗并不能彻底的杀死肿瘤细胞,因为作为肿瘤的发生是多阶段、多环节、多通路的一个过程,单一的1种或是2种联用效果还是不够理想[15]。因此,还要继续找寻新型的治疗乳腺癌的方法,而从天然产物中找到能够抑制肿瘤生长及转移的有效成分是一个很好的方向。α-倒捻子素是从植物山竹中提取分离出来的一种活性成分[16],研究发现,α-倒捻子素作为一种双苯吡酮衍生物,具有多种药理活性,包括抗菌[17]、抗炎[18]、抗氧化[19]及抗肿瘤[20]等。α-倒捻子素对于乳腺癌的作用已有少量报道,但其研究主要集中在细胞水平,且研究的内容主要是其对乳腺癌细胞凋亡的诱导及脂肪酸的合成[21-23],目前尚未见在动物水平研究α-倒捻子素对乳腺癌的作用,为此本研究将重点放在了体内研究上,同时基于肿瘤细胞的侵袭和转移是导致肿瘤患者死亡的主要原因[24],本研究也考察了α-倒捻子素对乳腺癌细胞侵袭的影响及可能的作用机制,为α-倒捻子素在临床的推广应用提供重要实验依据。
1 材料与方法
1.1 实验材料
人源性乳腺癌细胞系MCF-7购自中国科学院昆明动物研究所细胞库,BALB/c裸小鼠(雌性,6~8周龄,18~20 g)、SPF级、购自北京维通利华实验动物技术有限公司[生产许可证号:SCXK(京)2012-0001],10%小牛血清、DMEM培养基及0.25%胰蛋白酶购自美国Gibco公司,24孔板(含Transwell小室)购自美国Corning公司(批号:07111036),MatrigelTM基底膜基质购自美国BD公司(No.2342761,包装规格 5 ml),p-Erk、p-P38、基质金属蛋白酶(matrix metalloproteinases,MMP)MMP-2、MMP-9及 GAPDH抗体购自美国Cell Signaling公司。
1.2 方法
1.2.1 细胞增殖实验(MTS法)检测α-倒捻子素对MCF-7细胞增殖的影响 MCF-7细胞用DMEM培养基(含10%小牛血清)进行培养,待细胞处于指数生长期时,用不含EDTA的0.25%的胰酶对细胞进行消化并计数,用DMEM完全培养基将细胞浓度调整为4×105个/ml,然后在96孔板中接种以吹打均匀的悬浮细胞,每孔200μl,接种完毕后置37℃培养箱内培养。待细胞生长到80%~85%左右时,向培养孔中加入不同浓度的α-倒捻子素,组别设为1、2、4、8、16、32、64μmol和溶剂对照组(DMSO),每个组别设置5个复孔,加药完毕后置培养箱继续孵育。处理12 h后,向每孔加入20μl MTS试剂,向各孔中加入MTS试剂,每孔20μl,然后置培养箱继续孵育3 h。孵育结束后,利用紫外分光光度计检测96孔板中各孔的光密度(optocal density,OD)值OD490 nm,实验重复3次。然后同上述操作,加药分别处理24和48 h,其他处理与上述一致,检测各孔的OD值OD490 nm,实验重复3次。
细胞增殖抑制率计算方法:增殖抑制率(%)=(1-实验组OD值/阴性对照组OD值)×100%。
1.2.2 Transwell实验检测α-倒捻子素对MCF-7细胞侵袭的影响 首先在Transwell小室上室的膜表面均匀铺被上含Matrigel(去生长因子)的DMEM培养基稀释液(体积比1∶4),完毕后置培养箱中稍微受热使其凝固,以备后续实验使用。将处于指数生长期的MCF-7细胞悬液接种在Transwell小室的上室,接种体积为100μl,同时将不同浓度的α-倒捻子素(0~4μmol)接种于上室。将600μl含20%小牛血清的DMEM培养基加入下室,置培养箱中处理24 h,实验各组均设3个复孔。药物处理结束后,用棉签小心将上室中没有迁移的细胞拭去,并按下述操作处理:用4%多聚甲醛固定10 min→PBS洗涤→0.1%结晶紫染色30 min→PBS漂洗3次→置于载玻片上→×200镜下随机选5个视野,计数→将小室置于400μl/孔的甲醇中将结晶紫溶解→取200μl溶解液置于96孔板中,于370 nm波长处检测OD值,计算相对迁移率。
1.2.3 MCF-7裸鼠皮下移植瘤模型检测α-倒捻子素对肿瘤体内生长的影响 按常规方法复苏、传代及培养人乳腺癌细胞MCF-7,待细胞传代至10个100 mm培养皿且细胞融合至85%以上时,用胰酶将培养皿中的细胞进行消化,然后1 000 r/min,离心3 min,去胰酶,离心后的细胞用PBS进行重悬,10倍稀释后用细胞计数仪进行计数。然后用PBS将细胞浓度调整为1×107个/ml,置冰上备用。取健康的BALB/c裸小鼠20只,用1 ml注射器吸取0.2 ml(2×106个细胞)接种于裸小鼠右侧腋窝皮下,重复上述操作对所有裸小鼠进行接种。接种5 d后,选择复制模型成功的15只裸鼠,对裸鼠称重,并随机分组,实验共分为3个组:模型组、α-倒捻子素5 mg/kg组、α-倒捻子素20 mg/kg组,每组5只,实验组采用灌胃方式连续给予待测药物35 d(因α-倒捻子素不溶于水,药物用食用油进行溶解),模型组只给予等体积的食用油。每隔3天称取每只裸鼠的体重,并用游标卡尺测量移植瘤的直径(长、短径各测3次,求得长径均值a和短径均值b),并计算瘤体积(瘤体积=1/2×a×b2)。给予待测药物35 d后,将各组裸鼠颈椎脱臼处死动物,剪开皮肤后并小心剥离整个瘤块,称重、拍照后,用4%多聚甲醛液固定,备用。
1.2.4 免疫组织化学法检测α-倒捻子素对瘤组织中相关蛋白表达的影响 将所有实验样本进行固定、包埋及切片处理,采用免疫组织化学SP法(链霉素抗生物素蛋白-过氧化物酶法)进行样本检测。实验操作步骤按所购试剂盒说明书进行。第一抗体:翻译控制肿瘤蛋白(translationally controlled tumor protein,TCTP)、MMP-2和MMP-9鼠抗人单克隆抗体;第二抗体:免疫组织化学SP试剂盒、DAB显色试剂盒。
1.2.5 Western blot检测α-倒捻子素对MCF-7细胞中相关蛋白表达的影响 将约5×106个细胞加至蛋白裂解液,冰上静置30 min,低温离心20 min(12 000 r/min),提取上清液。应用BCA定量法计算蛋白的浓度。取60μg总蛋白跑胶(恒压100 V)。电转膜80 min。转膜结束后,用含5%脱脂奶粉的TBST将膜封闭1 h。封闭结束后,用TBST溶液清洗膜5次,每次10 min,然后结一抗,置4℃冰箱过夜。第2天回收一抗,用TBST溶液清洗膜5次,每次10 min,然后结二抗,孵育1.5 h后显影。
1.3 统计学方法
采用Graphpad 5.0软件进行统计学分析,结果以均数±标准差(±s)表示,采用单因素方差分析,样本均数间的比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 α-倒捻子素抑制MCF-7细胞的体外增殖
用α-倒捻子素处理MCF-7细胞12 h,发现在8μmol时表现出对肿瘤细胞的抑制作用;随着剂量的增加,肿瘤细胞的增殖抑制作用增强。进一步用α-倒捻子素处理MCF-7细胞24及48 h时,发现其抑制作用与对照组相比均差异有统计学意义(P<0.05),见图1。结果表明,在一定浓度范围内,α-倒捻子素能够抑制MCF-7细胞的体外增殖。
2.2 α-倒捻子素抑制MCF-7细胞的侵袭
侵袭实验中,选取对MCF-7细胞增殖无明显影响的浓度:0、1、2和4μmol处理MCF-7细胞24 h,结果表明,α-倒捻子素在1μmol时对MCF-7细胞的侵袭表现出抑制作用,随着α-倒捻子素浓度的增加,其对MCF-7细胞侵袭的抑制作用逐渐增强,侵袭出的细胞数量减少,且表现出一定的浓度依赖性,见图2、3。结果表明,α-倒捻子素能够抑制MCF-7乳腺癌细胞的侵袭,且在在一定浓度范围内,表现出浓度依赖性。

图1 α-倒捻子素对MCF-7乳腺癌细胞增殖的影响

图2 α-倒捻子素对MCF-7乳腺癌细胞侵袭的影响 (×200)
2.3 α-倒捻子素抑制MCF-7裸小鼠异种移植瘤的生长
裸小鼠异种移植瘤实验结果表明,给药35 d后,模型组肿瘤体积(1.51±0.036)cm3,α-倒捻子素5 mg/kg组肿瘤体积(0.71±0.029)cm3,α-倒捻子素20 mg/kg组肿瘤体积(0.42±0.023)cm3,与模型组比较,α-倒捻子素5、20 mg/kg组肿瘤体积大小差异有统计学意义(t=54.725和80.685,均P=0.000)。α-倒捻子素对人乳腺癌裸鼠异种移植瘤的生长具有抑制作用,肿瘤的体积变小,且有一定的剂量依赖性,见图4、5。该体内研究结果表明,α-倒捻子素能够抑制MCF-7裸小鼠异种移植瘤的生长。
2.4 α-倒捻子素降低肿瘤组织中TCTP、MMP-2及MMP-9蛋白的表达
基于TCTP在介导调控肿瘤生长中的重要作用,将TCTP在肿瘤组织中的表达作为检测指标[25]。同时基于MMP在肿瘤细胞侵袭中的作用,将MMP-2和MMP-9作为检测指标。免疫组织化学结果显示,在乳腺癌肿瘤组织中,α-倒捻子素能够降低TCTP、MMP-2及MMP-9的表达,见图6。α-倒捻子素能够通过下调TCTP、MMP-2及MMP-9的表达,发挥其抑制肿瘤生长和侵袭的能力。
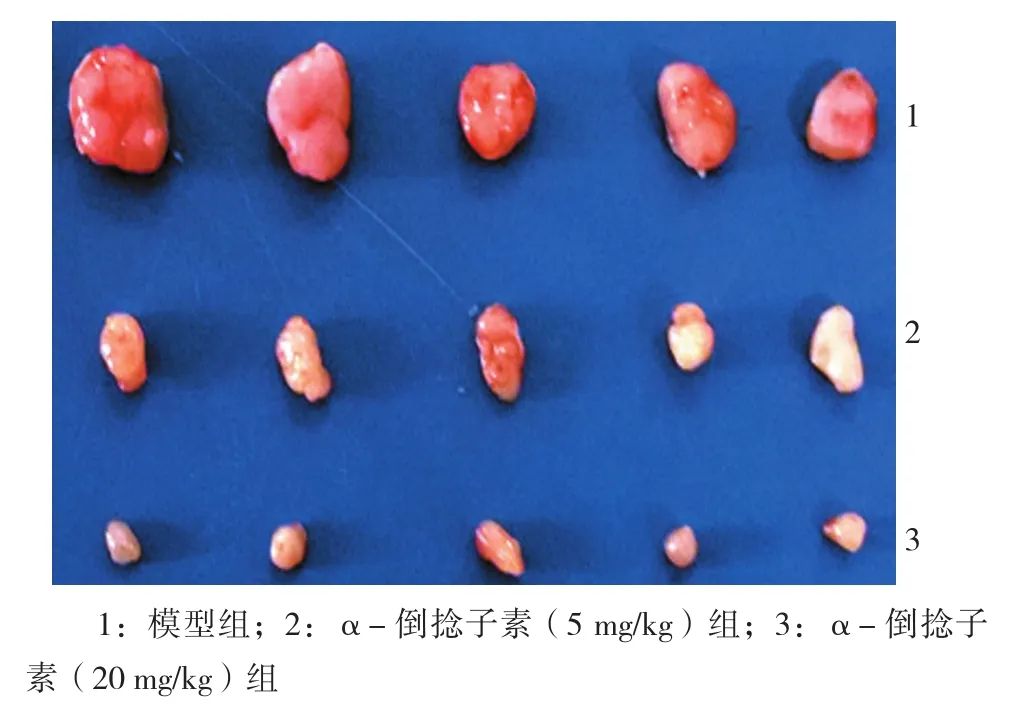
图4 α-倒捻子素对MCF-7裸鼠皮下移植瘤体内生长的影响
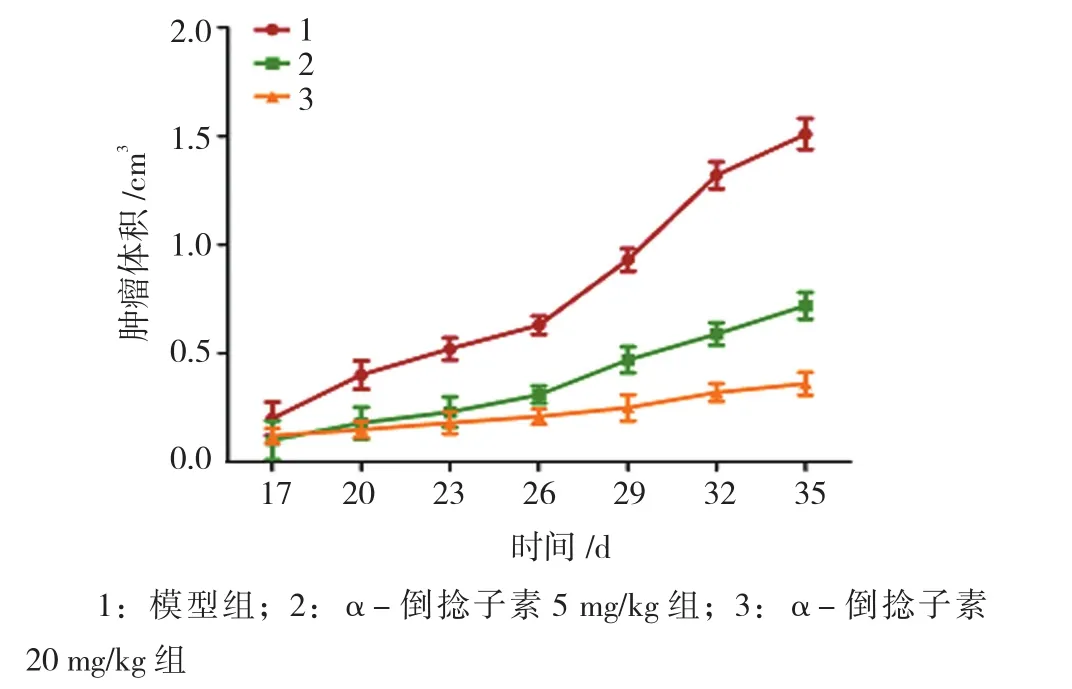
图5 肿瘤体积定量比较
2.5 α-倒捻子素抑制MMP-2、MMP-9、p-Erk及p-P38蛋白的表达
基于MMP在介导肿瘤细胞侵袭及转移中的重要作用[26],选取MMP-2及MMP-9作为检测指标,考察α-倒捻子素对其蛋白表达的影响;同时基于Ras/Raf信号通路在调控肿瘤细胞增殖及生长方面的关键作用[27],选取该通路下游的Erk及P38作为检测指标,考察α-倒捻子素对其蛋白表达的影响。实验结果发现,在一定浓度范围内,α-倒捻子素能够剂量依赖性的下调MMP-2、MMP-9、p-Erk及p-P38蛋白的表达,但对t-Erk及t-P38蛋白的表达无明显影响,见图7。α-倒捻子素能够通过下调MMP的表达发挥其抑制肿瘤细胞侵袭的作用,同时α-倒捻子素对MCF-7细胞增殖的抑制作用可能与下调磷酸化的Erk及P38相关。
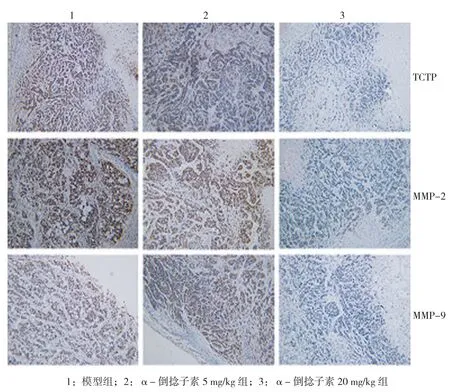
图6 α-倒捻子素对裸鼠皮下移植瘤中相关蛋白表达
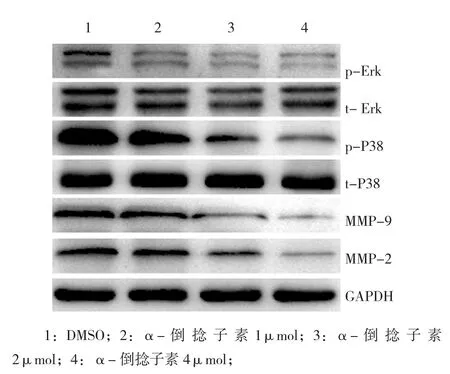
图7 α-倒捻子素对MCF-7细胞中相关蛋白表达的影响
3 讨论
本文主要考察了山竹里的一种活性成分α-倒捻子素对于乳腺癌生长和侵袭的影响及其作用机制。实验结果表明,α-倒捻子素能够在体外和体内分别抑制乳腺癌的增殖和生长,同时α-倒捻子素能够抑制乳腺癌细胞的侵袭能力。机制研究方面,本研究选择了TCTP作为研究对象,研究发现,TCTP是一个在物种间高度保守、广谱表达和多功能的蛋白质[28],能够①对细胞骨架的动态变化、细胞的生长与增殖及细胞周期发挥调节作用,②调控细胞凋亡及分化,③保护细胞免受应激损伤,④介导炎症反应及癌症发生[29]。TCTP主要通过蛋白表达量的快速变化来适应细胞内状态的改变[29]。本研究通过免疫组织化学考察了该蛋白在肿瘤组织中的表达,结果显示α-倒捻子素能够抑制TCTP在乳腺癌瘤组织中的表达,这表明α-倒捻子素对乳腺癌生长的抑制作用可能与调控该蛋白的表达有关。而在研究α-倒捻子素对乳腺癌细胞侵袭作用的机制时,选取了MMP-2和MMP-9作为研究对象,主要是因为它们属于IV型胶原酶,即所谓的明胶酶,研究证实[30],明胶酶是目前为止唯一能够降解IV型胶原的基质蛋白水解酶,而细胞外基质的基本骨架恰恰是由IV型胶原组成的。研究发现[31],它们可以通过破坏基质的降解平衡,进而促进肿瘤细胞突破基底膜的屏障,侵袭周围组织。本研究发现无论是在乳腺癌肿瘤组织中,还是在乳腺癌细胞中,α-倒捻子素都能够下调MMP-2和MMP-9的蛋白表达,这表明,α-倒捻子素抑制乳腺癌细胞侵袭的作用可能与抑制MMP-2和MMP-9的蛋白表达有关。与此同时,基于Ras/Raf信号通路在调节肿瘤细胞增殖方面的重要作用,本研究也对该通路的相关蛋白进行了研究,选取该通路下游的Erk及P38作为研究对象,结果发现,α-倒捻子素能够抑制磷酸化的Erk及P38的表达,而对Erk及P38总蛋白的表达没有影响,这表明α-倒捻子素能够通过介导Erk及P38蛋白的活化,发挥其调控肿瘤细胞增殖的作用。
综上所述,本研究主要考察了α-倒捻子素对乳腺癌肿瘤在体内的生长抑制作用,同时对其体外侵袭能力也做了研究。本研究显示α-倒捻子素会是一种很有前景的治疗乳腺癌的候选化合物,值得进一步的研究和开发。
[1]GINSBURG O M, LOVE R R. Breast cancer: a neglected disease for the majority of affected women worldwide[J]. Breast J, 2011,17(3): 289-295.
[2]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J].CA CANCER J CLIN, 2015, 65(1): 5-29.
[3]TEJADA-BERGES T. Breast cancer: genetics and risk assessment[J].Clin Obstet Gynecol, 2016, 59(4): 673-687.
[4]KUZ’MIN V I. Hormonal disorders in women with precancerous diseases and cancer of the breast[J]. Akush Ginekol (Mosk), 1971,47(9): 39-42.
[5]BARACCO E E, PIETROCOLA F, BUQUE A, et al. Inhibition of formyl peptide receptor 1 reduces the efficacy of anticancer chemotherapy against carcinogen-induced breast cancer[J].Oncoimmunology, 2016, 5(6): e1139275.
[6]HYSTAD P, VILLENEUVE P J, GOLDBERG MS, et al. Exposure to traffic-related air pollution and the risk of developing breast cancer among women in eight Canadian provinces: a case-control study[J]. Environ Int, 2015, 74: 240-248.
[7] NITTA J, NOJIMA M, OHNISHI H, et al. Weight gain and alcohol drinking associations with breast cancer risk in Japanese postmenopausal women - results from the Japan Collaborative Cohort (JACC) study[J]. Asian Pac J Cancer Prev, 2016, 17(3):1437-1443.
[8]GUAN Y, LI A, XIAO W, et al. Efficacy of concurrent chemoradiotherapy for patients with locally recurrent or advanced inoperable breast cancer[J]. Oncotarget, 2015, 6(32): 33926-33934.
[9]VAN MAAREN M C, DE MUNCK L, JOBSEN J J, et al. Breastconserving therapy versus mastectomy in T1-2N2 stage breast cancer: a population-based study on 10-year overall, relative, and distant metastasis-free survival in 3071 patients[J]. Breast Cancer Res Treat, 2016, 160(3): 511-521.
[10]LEONARDI M C, MORRA A, SANTORO L, et al. Nonrandomized comparison between concomitant and sequential chemoradiotherapy with anthracyclines in breast cancer[J]. Tumori, 2015, 101(1): 64-71.
[11]SVOBODA M, NAVRATIL J, SLABY O. Immunotherapy for the prevention and treatment of breast cancer[J]. Klin Onkol, 2015,28(6): 416-25.
[12]THILL M, KRAFT C, FRIEDRICH M. Targeted therapy in her2-positive breast cancer[J]. Oncol Res Treat, 2016, 39(5): 295-302.
[13]CHEN X L, DU F, HONG R X, et al. Hormonal therapy might be a better choice as maintenance treatment than capecitabine after response to first-line capecitabine-based combination chemotherapy for patients with hormone receptor-positive and HER2-negative, metastatic breast cancer[J]. Chin J Cancer, 2016,35: 39.
[14]LI J J, SHAO Z M. Endocrine therapy as adjuvant or neoadjuvant therapy for breast cancer: selecting the best agents, the timing and duration of treatment[J]. Chin Clin Oncol, 2016, 5(3): 40.
[15]SAJI S, KIMURA-TSUCHIYA R. Combination of moleculartargeted drugs with endocrine therapy for hormone-resistant breast cancer[J]. Int J Clin Oncol, 2015, 20(2): 268-272.
[16]XIA Y, CHEN J, GONG C, et al. Alpha-mangostin, a natural agent, enhances the response of nras mutant melanoma to retinoic acid[J]. Med Sci Monit, 2016, 22: 1360-1367.
[17]LE T T, PANDEY R P, GURUNG R B, et al. Ef fi cient enzymatic systems for synthesis of novel alpha-mangostin glycosides exhibiting antibacterial activity against Gram-positive bacteria[J].Appl Microbiol Biotechnol, 2014, 98(20): 8527-8538.
[18]GUTIERREZ-OROZCO F, CHITCHUMROONCHOKCHAI C, LESINSKI G B, et al. alpha-Mangostin: anti-inflammatory activity and metabolism by human cells[J]. J Agric Food Chem,2013, 61(16): 3891-3900.
[19]HAFEEZ B B, MUSTAFA A, FISCHER J W, et al. Alphamangostin: a dietary antioxidant derived from the pericarp of Garcinia mangostana L. inhibits pancreatic tumor growth in xenograft mouse model[J]. Antioxid Redox Signal, 2014, 21(5):682-699.
[20]LEE H N, JANG H Y, KIM H J, et al. Antitumor and apoptosisinducing effects of alpha-mangostin extracted from the pericarp of the mangosteen fruit (Garcinia mangostana L.) in YD-15 tongue mucoepidermoid carcinoma cells[J]. Int J Mol Med, 2016,37(4): 939-948.
[21]KRITSANAWONG S, INNAJAK S, IMOTO M, et al.Antiproliferative and apoptosis induction of alpha-mangostin in T47D breast cancer cells[J]. Int J Oncol, 2016, 48(5): 2155-2165.
[22]LI P, TIAN W, MA X. Alpha-mangostin inhibits intracellular fatty acid synthase and induces apoptosis in breast cancer cells[J]. Mol Cancer, 2014, 13: 138.
[23]WON Y S, LEE J H, KWON S J, et al. Alpha-mangostin-induced apoptosis is mediated by estrogen receptor alpha in human breast cancer cells[J]. Food Chem Toxicol, 2014, 66: 158-165.
[24]CAO H, HUANG Y, WANG L, et al. Leptin promotes migration and invasion of breast cancer cells by stimulating IL-8 production in M2 macrophages[J]. Oncotarget, 2016, 7(40): 65441-65453.
[25]TSAI M J, YANG-YEN H F, CHIANG M K, et al. TCTP is essential for beta-cell proliferation and mass expansion during development and beta-cell adaptation in response to insulin resistance[J]. Endocrinology, 2014, 155(2): 392-404.
[26]JIANG Q, PAN Y, CHENG Y, et al. Lunasin suppresses the migration and invasion of breast cancer cells by inhibiting matrix metalloproteinase-2/-9 via the FAK/Akt/ERK and NF-kappaB signaling pathways[J]. Oncol Rep, 2016, 36(1): 253-262.
[27]LING Y, ZHAO X, LI X, et al. Novel FTS-diamine/cinnamic acid hybrids inhibit tumor cell proliferation and migration and promote apoptosis via blocking ras-related signaling in vitro[J].Cancer Chemother Pharmacol, 2015, 75(2): 381-392.
[28]REN J, MAO X, CHEN M, et al. TCTP expression after rat spinal cord injury: implications for astrocyte proliferation and migration[J]. J Mol Neurosci, 2015, 57(3): 366-375.
[29]ACUNZO J, BAYLOT V, SO A, et al. TCTP as therapeutic target in cancers[J]. Cancer Treat Rev, 2014, 40(6): 760-769.
[30]HUI W, ROWAN A D, CAWSTON T. Insulin-like growth factor 1 blocks collagen release and down regulates matrix metalloproteinase-1, -3, -8, and -13 mRNA expression in bovine nasal cartilage stimulated with oncostatin M in combination with interleukin 1alpha[J]. Ann Rheum Dis, 2001, 60(3): 254-261.
[31]AROUI S, NAJLAOUI F, CHTOUROU Y, et al. Naringin inhibits the invasion and migration of human glioblastoma cell via downregulation of MMP-2 and MMP-9 expression and inactivation of p38 signaling pathway[J]. Tumour Biol, 2016,37(3): 3831-3839.
Effect of α-mangostin on proliferation, growth and invasion of MCF-7 breast cancer and its mechanisms
Lin-wei Ma, Hong-tao Xu,Xiao-li Dai, Zhong-bao Han
(Department of Clinical Medicine, Yancheng Institute of Health Sciences, Yancheng, Jiangsu 224005, China)
ObjectiveTo explore the effect of α-mangostin on proliferation, growth, and invasion of MCF-7 breast cancer and its mechanisms.MethodsMTS was used to study the effect of α-mangostin onin vitroproliferation of MCF-7 breast cancer cells. MCF-7 breast cancer xenograft model was used to examine the effect of α-mangostin onin vivogrowth of the tumor. The effect of α-mangostin on invasion ability of MCF-7 breast cancer cells was examined by Transwell experiment. Immunohistochemistry was used to study the effect of α-mangostin on the expressions of translationally-controlled tumor protein (TCTP), matrix metalloproteinase-2 (MMP-2) and MMP-9 in MCF-7 subcutaneous transplantation tumor tissue. Western blot was used to detect the expressions of Erk, p38,MMP-2 and MMP-9 proteins.ResultsThe proliferation of MCF-7 breast cancer cells was signi fi cant inhibited by α-mangostinin vitrocompared to the control group. α-mangostin signi fi cantly inhibited the growth of MCF-7 breast cancer subcutaneous transplantation tumorin vivocompared to the control group. The invasion ability of MCF-7 breast cancer cells was signi fi cantly inhibited by α-mangostin. The expressions of TCTP, MMP-2 and MMP-9 were significantly inhibited by α-mangostin as shown in immunohistochemistry. The results of Western blot showed that α-mangostin inhibited the expressions of MMP-2, MMP-9, p-Erk and p-p38.Conclusionsα-mangostin has anti-proliferation, anti-growth and anti-invasion effect on MCF-7 breast cancer, and such effect can attribute to its inhibition of growth and invasion-related proteins in MCF-7 breast cancer.
α-mangostin; breast cancer; proliferation; growth; invasion; action mechanism
10.3969/j.issn.1005-8982.2018.01.007
1005-8982(2018)01-0030-07
2017-02-17
R737.9
A
(张蕾 编辑)
