变形假单胞菌2-酮基葡萄糖酸差向异构酶基因的原核表达
2018-01-04孙文敬何小用崔凤杰王大明钱静亚齐向辉
孙文敬,杨 荔,栾 方,何小用,崔凤杰,*,王大明,钱静亚,齐向辉
变形假单胞菌2-酮基葡萄糖酸差向异构酶基因的原核表达
孙文敬1,2,杨 荔1,栾 方1,何小用1,崔凤杰1,2,*,王大明2,3,钱静亚1,2,齐向辉1
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.百勤异VC钠有限公司,江西 德兴 334221;
3.江南大学生物工程学院,江苏 无锡 214122)
采用降落聚合酶链式反应(touchdown polymerase chain reaction,TD-PCR)技术,从2-酮基葡萄糖酸工业生产菌株变形假单胞菌JUIM01中克隆了编码2-酮基葡萄糖酸差向异构酶的基因kguE。将目的基因与质粒pET-28a(+)重组后转入宿主表达菌中,获得了重组菌株大肠杆菌BL21(DE3)/pET-28a(+)-kguE。在异丙基-β-D-硫代半乳糖苷的诱导下,该重组菌株表达了一个分子质量约为30.5 ku的融合蛋白,且该蛋白的Western-blot鉴定结果显示为阳性。生物信息学分析结果表明,该蛋白是一种由256 个氨基酸残基组成的分子质量为28.5 ku的亲水性蛋白,与恶臭假单胞菌的2-酮基葡萄糖酸差向异构酶在氨基酸序列上的一致性达78%,定位于细胞质中,其二级结构中α-螺旋、延伸链和无规则卷曲所占的比例分别为40.62%、17.19%和42.19%。本研究结果为变形假单胞菌2-酮基葡萄糖酸差向异构酶的功能研究提供了一定理论支持。
变形假单胞菌;2-酮基葡萄糖酸差向异构酶;kguE基因;克隆;表达;生物信息学
2-酮基葡萄糖酸(2-ketogluconic acid,2KGA)即2-酮基-D-葡萄糖酸,是杂环化合物合成、区域选择性和立体选择性化学反应中的基础材料[1],目前最主要的用途是作为食品抗氧化剂D-异抗坏血酸及其盐类合成的前体[2-5]。2KGA的生产方法主要有4 种,即化学合成法、酶法、发酵法和静息细胞转化法[6-8]。其中,发酵法是迄今为止最为经济、高效和环境友好的2KGA工业生产方法[9]。
氧化细菌[10-11]如假单胞菌(Pseudomonas)[12-13]、欧文氏菌(Erwinia)[14]、葡萄糖酸杆菌(Gluconobacter)[15]、沙雷菌(Serratia)[16-18]、克雷伯菌(Klebsiella)[19-20]、醋酸杆菌(Acetobacter)[21]等,存在着由膜结合吡咯喹啉醌依赖的葡萄糖脱氢酶[22]和膜结合黄素腺嘌呤二核苷酸依赖的葡萄糖酸脱氢酶[23]组成的葡萄糖直接氧化系统,能够以葡萄糖为底物在细胞的周质空间中生物合成2KGA。在国内外2KGA的工业生产中,通常采用的菌株是具有相对高效、稳定发酵性能的假单胞菌[24]。
在假单胞菌的葡萄糖代谢中,随着培养条件的变化,积累于培养液中的中间代谢产物2KGA可以被转运至其细胞质内而被分解代谢[25]。相关研究结果[26-29]表明,与假单胞菌2KGA分解代谢相关的基因位于染色体上的2KGA利用操纵子即kgu操纵子中,并受到阻遏蛋白PtxS的调控,该蛋白同时调控其自身的合成。kgu操纵子包含kguT、kguK、kguE和kguD等结构基因,分别编码2KGA转运蛋白(2-ketogluconate transporter,KguT)、2KGA激酶(2-ketogluconate kinase,KguK)、2KGA差向异构酶(2-ketogluconate epimerase,KguE)和2KGA还原酶(2-ketogluconate reductase,KguD)。其中:KguT是一种跨膜转运蛋白,能够将周质空间或培养环境中的2KGA转运至细胞质中;KguK是一种ATP依赖性激酶,在ATP存在的条件下能够将2KGA磷酸化为2-酮基-6-磷酸葡萄糖酸;KguD是一种NADPH依赖性还原酶,能够将2-酮基-6-磷酸葡萄糖酸还原为中心代谢产物6-磷酸葡萄糖酸。利用基因敲除技术,Swanson等[26]证实了KguE是假单胞菌2KGA代谢过程中必不可少的一种异构酶,但到目前为止其在2KGA代谢中的作用尚未得到揭示,也鲜见到进一步的相关文献报道。为全面理解假单胞菌的2KGA代谢调控机制,有必要开展KguE功能的相关研究。
本研究以国内2KGA工业生产的主要用菌变形假单胞菌(P. plecoglossicida)JUIM01[30]为材料,利用降落聚合酶链式反应(touchdown-polymerase chain reaction,TD-PCR)克隆KguE的编码基因,原核表达带有His标签的KguE蛋白,并通过生物信息学方法分析和预测该蛋白的基本生物学特性,为后续的KguE蛋白纯化、鉴定及其结构与功能研究奠定基础,进而为2KGA的高效生产提供相关的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
变形假单胞菌JUIM01,国内2KGA的工业生产用菌,由本实验室选育保藏;大肠杆菌(Escherichia coli)JM109、表达菌株大肠杆菌(E. coli)BL21(DE3)和表达质粒pET-28a(+)由本实验室保存;克隆质粒pMD19-T购自宝生物工程(大连)公司。
1.1.2 培养基
LB培养基:酵母提取物5.0 g/L、胰蛋白胨10.0 g/L、NaCl 10.0 g/L,pH 7.0。
LB平板:含有15.0 g/L琼脂的LB培养基。
1.1.3 主要试剂和工具酶
琼脂糖凝胶DNA回收试剂盒(离心柱型)、细菌基因组DNA提取试剂盒(离心柱型) 上海捷瑞生物工程有限公司;2×Pfu MasterMix 天根生化科技(北京)有限公司;SanPrep柱式质粒DNA小量抽提试剂盒、改良型Bradford法蛋白质浓度测定试剂盒、Anti-6×His antibody、Goat Anti-Rabbit IgG/HRP、W-TMB显色试剂盒、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG) 生工生物工程(上海)股份有限公司;限制性内切酶EcoRⅠ、限制性内切酶BamHⅠ、T4 DNA连接酶、DNA A-Tailing Kit、DL5 000 DNA Marker、Protein Molecular Weight Marker (Low)和5×Protein十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)Loading Buffer 宝生物工程(大连)公司;预染蛋白分子质量标准 碧云天生物技术研究所;考马斯亮蓝G250 国药集团化学试剂有限公司;其他试剂均为国产分析纯试剂。
1.2 仪器与设备
C1000 TouchTM型PCR仪、PowerPac Basic型电泳仪、GelDocTMXR+型凝胶成像仪 美国Bio-Rad公司;Eporator电转化仪、BioPhotometer plus核酸蛋白定量仪德国Eppendorf公司;DYCZ-40A型电泳仪 北京市六一仪器厂;UVG20型防紫外割胶仪 上海领成生物科技有限公司;QL-901型旋涡混合器、TS-2型脱色摇床 海门市其林贝尔仪器制造有限公司;TGL-18M型冷冻离心机上海卢湘仪离心机仪器有限公司;HYL-C型组合式摇床太仓市强乐实验设备有限公司。
1.3 方法
1.3.1 变形假单胞菌JUIM01基因组DNA的提取
挑取活化后的变形假单胞菌JUIM01单菌落,接种于5.0 mL的LB培养基中,30 ℃、200 r/min的条件下振荡培养12 h,然后离心(8 000 r/min,2 min)收集菌体,并用无菌水洗涤菌体2次。按照细菌基因组DNA提取试剂盒的操作方法,提取变形假单胞菌JUIM01的总DNA,并贮存于-20 ℃,备用。
1.3.2 PCR引物的设计与合成
根据本实验室在GenBank中公布的变形假单胞菌JUIM01的kgu操纵子的核苷酸序列(KU168040),结合生物信息学软件DNAMAN的分析结果,设计了PCR引物。为便于克隆与表达,在上、下游引物的5’端分别引入了BamHⅠ和EcoRⅠ酶切位点。设计的PCR引物如下:
P1:5’-CGGGATCCATGCATGCGAACCCTGT-3’(BamHⅠ)
P2:5’-GGAATTCTCAGCCATGGTGGACCT-3’(EcoRⅠ)
1.3.3 变形假单胞菌kguE基因的扩增及测序
以设计的P1和P2为引物,以变形假单胞菌JUIM01的基因组DNA为模板,利用TD-PCR技术扩增kguE基因的全长序列。
PCR体系(50.0 μL):2×Pfu MasterMix 25.0 μL,引物P1(10.0 μmol/L)1.0 μL,引物P2(10.0 μmol/L)1.0 μL,基因组DNA 1.0 μL,ddH2O 22.0 μL。
PCR程序:94 ℃预变性3 min;94 ℃变性30 s,退火30 s(第1个循环的退火温度为75 ℃,以后每个循环降低1 ℃),72 ℃延伸1 min/kb,反应20个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min/kb,反应25 个循环;72 ℃延伸5 min。
参照文献[30]所述的方法对PCR产物进行处理,然后提交生工生物工程(上海)股份有限公司进行DNA测序。
1.3.4 异源表达载体的构建与鉴定
利用限制性内切酶BamHⅠ和EcoRⅠ分别对PCR产物和表达载体pET-28a(+)进行双酶切处理;采用1%琼脂糖凝胶电泳分别纯化目的基因和表达载体的酶切产物;切胶获取二者的目标条带,利用琼脂糖凝胶DNA回收试剂盒回收目的DNA片段;在T4 DNA连接酶作用下,使回收的目的基因片段与线性化的表达载体pET-28a(+)连接(16 ℃连接16 h),获得重组质粒pET-28a(+)-kguE(图1)。
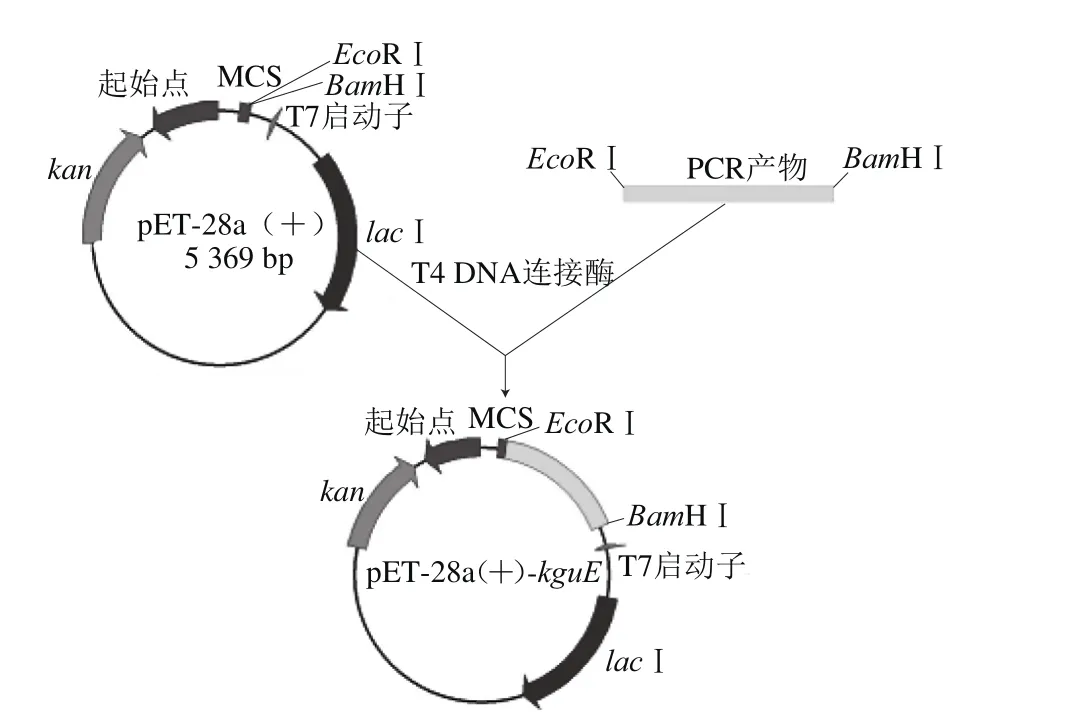
图1 重组质粒pET-28a()-kguE的构建Fig. 1 Construction of the recombinant plasmid pET-28a(+)-kguE
将重组质粒pET-28a(+)-kguE转入E. coli JM109的感受态细胞。取适量经转化的菌液涂布于含有50 μg/mL卡那霉素的LB平板上,37 ℃培养12 h左右。从平板上挑取阳性单克隆,接种于含有50 μg/mL卡那霉素的LB培养基中,在30 ℃、200 r/min的条件下振荡培养12 h。利用质粒DNA提取试剂盒从扩大培养的阳性单克隆中提取重组质粒,然后进行质粒PCR验证、酶切验证和测序验证。
在翻转课堂的实践中,教师的角色不仅仅是课程内容的传授者,更多则转变为学习过程的引导者,学生则由原来被动的接受者,转变为积极主动的参与者[3]。
1.3.5 变形假单胞菌kguE基因的原核表达
将经过验证的重组质粒pET-28a(+)-kguE导入E. coli BL21(DE3)的感受态细胞中,然后涂布于含有50 μg/mL卡那霉素的LB平板上,37 ℃培养12 h。挑取阳性单克隆接种于含有50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min培养过夜。取上述培养物,按10%(体积分数)的比例接种于250 mL含有50 mL的LB培养基的锥形瓶中进行扩大培养。当培养液的OD600nm值达到0.5~0.8时,分别加入终浓度为0.6 mmol/L的IPTG,18 ℃、200 r/min的条件下诱导表达16 h。离心收集菌体,利用SDSPAGE及Western-blot对蛋白的表达情况进行检测。
1.3.6 表达产物的SDS-PAGE分析与Western-blot鉴定
取细胞培养液2.0 mL,离心(8 000 r/min,3 min)收集菌体,并用预冷的无菌PBS洗涤2次,然后使菌体重悬于200 μL的PBS中。取20.0 μL的重悬菌液与5.0 μL的上样缓冲液充分混匀,100 ℃煮沸5 min。冷却样品,对重组菌株的全细胞蛋白进行SDS-PAGE分析。
以预染蛋白质分子质量标准为Marker,以抗6×His单克隆兔抗(Anti-6×His antibody)为一抗、IgG/HRP羊抗兔(Goat Anti-Rabbit IgG/HRP)为二抗,对SDS-PAGE分离的KguE融合蛋白进行Western-blot鉴定。
1.3.7 变形假单胞菌KguE蛋白的序列分析
利用在线生物信息学分析工具对变形假单胞菌KguE蛋白的氨基酸序列进行分析[30]。
2 结果与分析
2.1 变形假单胞菌kguE基因的PCR扩增
以变形假单胞菌JUIM01的基因组为模板,以P1和P2为引物,按照设定的程序进行TD-PCR。取5.0 μL的PCR产物进行1%琼脂糖凝胶电泳,结果(图2)显示:在750 bp附近有一条非常明显的条带,其大小与预计的kguE基因的大小相符,可初步认为已克隆到目的基因kguE。

图2 变形假单胞菌kguE基因PCR扩增产物的电泳分析Fig. 2 Agarose gel electrophoresis of PCR amplif i ed kguE gene from P. plecoglossicida

图3 变形假单胞菌KguE的基因序列及氨基酸序列Fig. 3 Nucleotide and amino acid sequences of KguE from P. plecoglossicide
采用DNA A-Tailing Kit对切胶回收的PCR产物加A尾后,使其与克隆载体pMD19-T连接,再经转化、蓝白斑筛选和质粒提取等步骤,得到了重组质粒pMD19-T-kguE。将验证正确的重组质粒送生工生物(上海)股份有限公司进行DNA测序,结果(图3)表明:克隆的kguE基因片段与本实验室克隆的变形假单胞菌kgu操纵子(GenBank:KU168040)中的kguE在核苷酸序列上是完全一致的,其核苷酸序列长度为771 bp。采用DNAMan软件分析发现,克隆的基因片段具有一个完整的开放阅读框,起始密码子为ATG,终止密码子为TGA。通过同源性比对发现,该基因片段与P. putida IEC33019、Pseudomonas sp. CCOS191、P. mosselii SJ10和P. putida S13.1.2等假单胞菌的kguE基因在核苷酸序列上的一致性达到75%~80%。
2.2 异源表达载体pET-28a(+)-kguE的构建
将经过双酶切处理的变形假单胞菌kguE基因的PCR产物和质粒pET-28a(+)连接,得到重组质粒pET-28a(+)-kguE。将构建的重组质粒转入E. coli JM109的感受态细胞,然后对其阳性单克隆进行质粒PCR验证。从图4可以看出,以阳性单克隆的质粒DNA为模板、采用P1和P2为引物扩增的产物长度在750 bp左右,与预期的长度771 bp相符,可初步认为重组质粒得到正确构建。采用限制性内切酶BamHⅠ和EcoRⅠ对重组质粒进行酶切验证,其结果(图5)与预期相符,因此可以认为目的片段已经准确插入表达载体,重组质粒得到成功构建。将经过验证的重组质粒送生工生物(上海)股份有限公司进行DNA测序,结果表明:重组质粒pET-28a(+)-kguE的kguE与变形假单胞菌kgu操纵子(GenBank:KU168040)的kguE在核苷酸序列上是完全一致的。

图4 重组质粒pET-28a()-kguE的kguE基因PCR扩增产物的电泳分析Fig. 4 Electrophoretic analysis of PCR ampli fi ed kguE gene from the recombinant plasmid pET-28a(+)-kguE
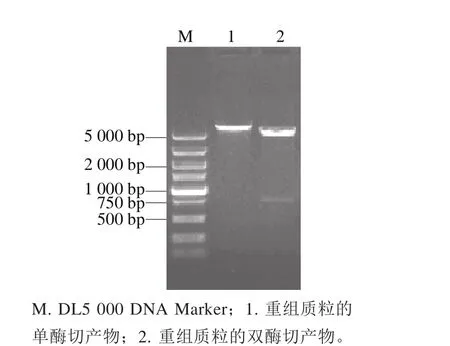
图5 重组质粒pET-28a()-kguE酶切产物的电泳分析Fig. 5 Electrophoretic analysis of the restriction enzyme-digested products of recombinant plasmid pET-28a(+)-kguE
2.3 变形假单胞菌kguE基因在E. coli BL21(DE3)中的诱导表达

图6 重组菌株E. coli BL21(DE3)/pET-28a()-kguE全细胞蛋白的SDS-PAGE分析Fig. 6 SDS-PAGE analysis of whole-cell proteins from E. coli BL21(DE3)/ pET-28a(+)-kguE
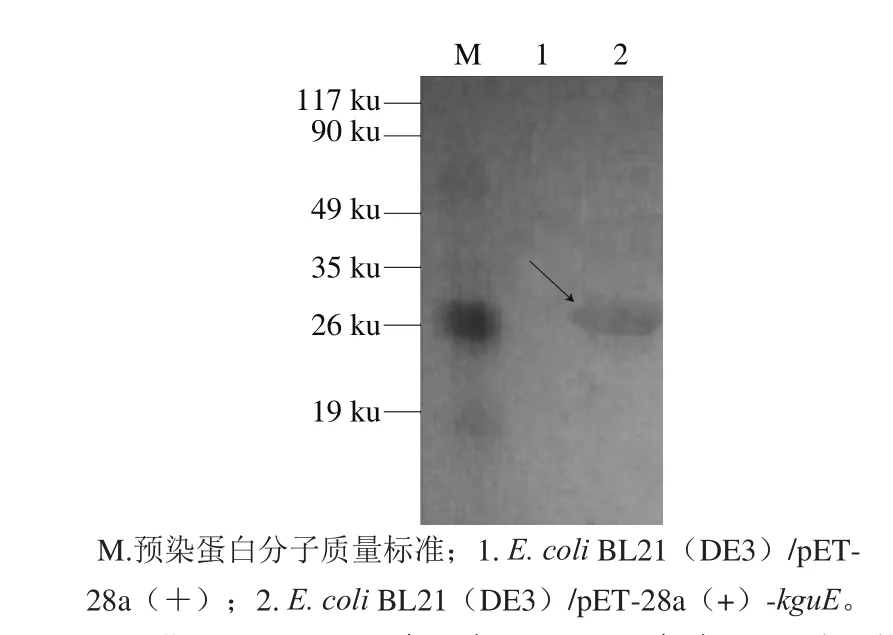
图7 重组菌株E. coli BL21(DE3)/pET-28a()-kguE表达的融合蛋白的Western-blot分析Fig. 7 Western blot analysis of the fusion protein expressed by E. coli BL21(DE3)/ pET-28a(+)-kguE
从含有pET-28a(+)-kguE的E. coli JM109中提取质粒pET-28a(+)-kguE,然后将其转入E. coli BL21(DE3)。经抗性筛选和酶切验证后,得到重组菌株E.coli BL21(DE3)/pET-28a(+)-kguE。在0.6 mmol/L的IPTG诱导下,18 ℃、200 r/min培养E. coli BL21(DE3)/pET-28a(+)-kguE 16 h。离心收集菌体,利用SDSPAGE对变形假单胞菌kguE基因的原核表达情况进行检测。分析结果(图6)表明,E. coli BL21(DE3)/pET-28(+)-kguE表达的带有His标签的重组蛋白的分子质量约为30.5 ku,与预测的变形假单胞菌KguE的分子质量相符,也与铜绿假单胞菌KguE的分子质量(28.9 ku)大致相符,而E. coli BL21(DE3)/pET-28a(+)在相同的诱导条件下并不能表达出相同的蛋白。上述结果表明,变形假单胞菌基因kguE在E. coli BL21(DE3)中得到了成功表达。以抗6×his单克隆兔抗为一抗、IgG/HRP羊抗兔为二抗,对经SDS-PAGE分离的两种融合蛋白进行Western-blot检测,结果(图7)显示为阳性,进一步证明了目的基因的成功表达。
2.4 变形假单胞菌KguE蛋白序列的分析
利用ProtParam工具对变形假单胞菌KguE的基本理化性质进行了预测,结果表明:该蛋白由256 个氨基酸残基组成,其中带负电荷的氨基酸残基(Asp+Glu)总数为35 个,带正电荷的氨基酸残基(Arg+Lys)总数为25 个,其氨基酸组成(表略)中Ala和Leu居多,分别达到12.9%和13.7%。该蛋白的分子质量为28.5 ku,等电点为5.28,分子式为C1278H1988N364O370S7。变形假单胞菌KguE的不稳定指数为49.29(>40),说明其在溶液中的性质不够稳定;该蛋白的脂溶性指数为93.83,总平均亲水性指数为-0.206,预测该蛋白属于亲水性蛋白。
采用PSORT Prediction、TMHMM Server 2.0和SignalP 4.1 Server等在线工具,分别对变形假单胞菌的细胞定位、跨膜结构和信号肽进行了预测,结果显示:该蛋白定位于细胞质中,无跨膜结构域,为非跨膜蛋白,而且没有信号肽的存在。
采用PredictProtein工具对变形假单胞菌KguE的二级结构进行了预测,结果表明:该蛋白的二级结构中包含α螺旋、延伸链和无规则卷曲3种结构形式,所占的比例分别为40.62%、17.19%和42.19%。

图8 KguE蛋白的系统进化树Fig. 8 Phylogenetic tree of KguE and KguE-related proteins
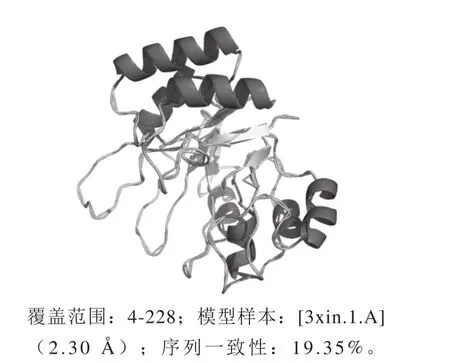
图9 变形假单胞菌JUIM01蛋白KguE的三级结构Fig. 9 Tertiary structure of KguE from P. plecoglossicida JUIM01 predicted by Swiss-model
利用BLAST工具从NCBI中数据库中获得与变形假单胞菌KguE同源性较高的氨基酸序列,并利用ClustW软件进行多序列同源性多重比对,采用MEGA 5.10软件对7 个不同来源的氨基酸序列进行系统进化分析。结果(图8)显示,变形假单胞菌KguE与恶臭假单胞菌KguE的同源性较高,其氨基酸序列的一致性达到78%。
利用蛋白质三级结构预测数据库Swiss-Model对变形假单胞菌KguE的三级结构进行预测。选取与KguE的氨基酸序列一致性为19.35%的D-木糖异构酶为模板,模拟KguE的三级结构。获取预测的蛋白质的三级结构后下载其PDB文件,然后利用蛋白质三级结构显示软件PyMOL进行处理与显示,结果如图9所示。
3 结 论
采用TD-PCR技术,从工业生产菌株变形假单胞菌JUIM01克隆了其kgu操纵子中的结构基因kguE,其核苷酸序列长度为771 bp,与P. putida IEC33019、Pseudomonas sp. CCOS191、P. mosselii SJ10和P. putida S13.1.2等假单胞菌的kguE基因在核苷酸序列上的一致性达到75%~80%。在T4 DNA连接酶的作用下,使经过双酶切处理的kguE基因与表达质粒pET-28a(+)连接,构建了重组菌株E. coli BL21(DE3)/ pET-28a(+)-kguE。在IPTG的诱导下,该重组菌株表达了分子质量约为30.5 ku的融合蛋白。SDS-PAGE分离的KguE融合蛋白的Westernblot鉴定结果显示为阳性,进一步证明了变形假单胞菌JUIM01的kguE基因在E. coli BL21(DE3)中的表达。
生物信息学分析结果表明:变形假单胞菌KguE是由256个氨基酸残基组成的无跨膜结构域的亲水性蛋白,理论分子质量为28.5 ku,定位于细胞质中。在该蛋白的二级结构中,α-螺旋、延伸链和无规则卷曲3 种结构形式所占的比例分别为40.62%、17.19%和42.19%。该蛋白与恶臭假单胞菌KguE的同源性较高,其氨基酸序列的一致性达78%。
[1] STOTTMEISTER U, AURICH A, WILDE H, et al. White biotechnology for green chemistry: fermentative 2-oxocarboxylic acids as novel building blocks for subsequent chemical syntheses[J]. Journal of Industrial Microbiology and Biotechnology, 2005, 32(11): 651-664.DOI:10.1007/s10295-005-0254-x.
[2] SUN W J, ZHOU Y Z, ZHOU Q, et al. Semi-continuous production of 2-keto-gluconic acid by Pseudomonas fl uorescens AR4 from rice starch hydrolysate[J]. Bioresource Technology, 2012, 110: 546-551.DOI:10.1016/j.biortech.2012.01.040.
[3] PAPPENBERGER G, HOHMANN H P. Industrial production of L-ascorbic acid (vitamin C) and D-isoascorbic acid[J]. Advances in Biochemical Engineering-Biotechnology, 2014, 143: 143-188.DOI:10.1007/10_2013_243.
[4] SUN W J, LIU C F, YU L, et al. A novel bacteriophage KSL-1 of 2-ketogluconic acid producer Pseudomonas fluorescens K1005: isolation,characterization and its remedial action[J]. BMC Microbiology, 2012, 12:127. DOI:10.1186/1471-2180-12-127.
[5] UMEZAWA K, TAKEDA K, ISHIDA T, et al. A novel pyrroloquinoline quinone-dependent 2-keto-D-glucose dehydrogenase from Pseudomonas aureofaciens[J]. Journal of Bacteriology, 2015,197(8): 1322-1329. DOI:10.1128/JB.02376-14.
[6] SUN W J, XIAO F F, WEI Z, et al. Non-sterile and buffer-free bioconversion of glucose to 2-keto-gluconic acid by using Pseudomonas fl uorescens AR4 free resting cells[J]. Process Biochemistry, 2015, 50(4):493-499. DOI:10.1016/j.procbio.2015.01.011.
[7] CHIA M, NGUYEN T B V, CHOI WJ. DO-stat fed-batch production of 2-keto-D-gluconic acid from cassava using immobilized Pseudomonas aeruginosa[J]. Applied Microbiology and Biotechnology, 2008, 78(5):759-765. DOI:10.1007/s00253-008-1374-9.
[8] 陈鸿胜, 李克非, 舒行宙, 等. 基于Gluconobacter oxydans膜结合脱氢酶的静息细胞催化合成2-酮基-D-葡萄糖酸[J]. 食品工业科技,2012, 33(19): 177-181. DOI:10.13386/j.issn1002-0306.2012.19.056.
[9] 孙文敬, 高培玲, 魏转, 等. 球形节杆菌C224分批发酵2-酮基-D-葡萄糖酸的条件优化及其动力学模型的构建[J]. 食品与发酵工业, 2013,39(5): 31-36. DOI:10.13995/j.cnki.11-1802/ts.2013.05.026.
[10] MATSUSHITA K, OHNO Y, SHINAGAWA E, et al. Membranebound, electron transport-linked, D-glucose dehydrogenase of Pseudomonas fluorescens. Interaction of the purified enzyme with ubiquinone or phospholipid[J]. Agricultural and Biological Chemistry,1982, 46(4): 1007-1011. DOI:10.1080/00021369.1982.10865179.
[11] GILARDI G L, FAUR Y C. Pseudomonas mesophilica and an unnamed taxon, clinical isolates of pink-pigmented oxidative bacteria[J]. Journal of Clinical Microbiology, 1984, 20(4): 626-629.
[12] SUN W J, YUN Q Q, ZHOU Y Z, et al. Continuous 2-keto-gluconic acid (2KGA) production from corn starch hydrolysate by Pseudomonas fl uorescens AR4[J]. Biochemical Engineering Journal, 2013, 77: 97-102. DOI:10.1016/j.bej.2013.05.010.
[13] PALLERONI N J. The Pseudomonas story[J]. Environmental Microbiology, 2010, 12(6): 1377-1383. DOI:10.1111/j.1462-2920.2009.02041.x.
[14] YUM D, LEE Y, PAN J. Cloning and expression of a gene cluster encoding three subunits of membrane-bound gluconate dehydrogenase from Erwinia cypripedii ATTCC 29267 in Escherichia coli[J]. Journal of Bacteriology, 1997, 179(21): 6566-6572.
[15] TOYAMA H, FURUYA N, SAICHANA I, et al. Membrane-bound,2-keto-D-gluconate-yielding D-gluconate dehydrogenase from“Gluconobacter dioxyacetonicus” IFO 3271: molecular properties and gene disruption[J]. Applied and Environmental Microbiology, 2007,73(20): 6551-6556. DOI:10.1128/AEM.00493-07.
[16] MISENHEIMER T J, ANDERSON R F, LAGODA A A, et al.Production of 2-ketogluconic acid by Serratia marcescens[J]. Applied Microbiology, 1965, 13(3): 393-396.
[17] 牛盼清, 杨爱华, 杨松鑫, 等. 一株产2-酮基-D-葡萄糖酸菌的筛选鉴定及其发酵优化[J]. 过程工程学报, 2012, 12(6): 1008-1013.
[18] 张炜, 谢志鹏, 罗玮, 等. 沙雷氏菌Serratia sp. BK-98发酵生产2-酮基-D-葡萄糖酸的工艺优化及动力学研究[J]. 化工学报, 2011, 62(5):1371-1376. DOI:10.3969/j.issn.0438-1157.2011.05.028.
[19] WEI D, XU J Q, SUN J S, et al. 2-Ketogluconic acid production by Klebsiella pneumoniae CGMCC 1.6366[J]. Journal of Industrial Microbiology and Biotechnology, 2013, 40(6): 561-570. DOI:10.1007/s10295-013-1261-y.
[20] SUN Y H, WEI D, SHI J P, et al. Two-stage fermentation for 2-ketogluconic acid production by Klebsiella pneumonia[J]. Journal of Microbiology and Biotechnology, 2014, 24(6): 781-787. DOI:10.4014/jmb.1401.01038.
[21] ŠVITEL J, ŠTURDIK E. 2-Ketogluconic acid production by Acetobacter pasteurianus[J]. Applied Biochemistry and Biotechnology,1995, 53(1): 53-63. DOI:10.1007/BF02783481.
[22] MATSUSHITA K, OHNO Y, SHINAGAWA E, et al. Membrane-bound D-glucose dehydrogenase from Pseudomonas sp.: solubilization,purification and characterization[J]. Agricultural and Biological Chemistry, 1980, 44(7): 1505-1512. DOI:10.1271/bbb1961.44.1505.
[23] MATSUSHITA K, SHINAGAWA E, ADACHI O, et al. Membranebound D-gluconate dehydrogenase from Pseudomonas aeruginosa.Purif i cation and structure of cytochrome-binding form[J]. Journal of Biochemistry, 1979, 85(5): 1173-1181.
[24] 魏转, 余泗莲, 孙文敬, 等. 2-酮基-D-葡萄糖酸发酵生产研究进展[J]. 食品科学, 2008, 29(8): 636-639. DOI:10.3321/j.issn:1002-6630.2008.08.155.
[25] DEL CASTILLO T, RAMOS J L, RODRIGUEZ-HERVA J J, et al.Convergent peripheral pathways catalyze initial glucose catabolism in Pseudomonas putida: genomic and flux analysis[J]. Journal of Bacteriology, 2007, 189(14): 5142-5152. DOI:10.1128/JB.00203-07.
[26] SWANSON B L, HAGER P, PHIBBS P Jr., et al. Characterization of the 2-ketogluconate utilization operon in Pseudomonas aeruginosa PAO1[J]. Molecular Microbiology, 2000, 37(3): 561-573.DOI:10.1046/j.1365-2958.2000.02012.x.
[27] DADDAOUA A, KRELL T, ALFONSO C, et al. Compartmentalized glucose metabolism in Pseudomonas putida is controlled by the PtxS repressor[J]. Journal of Bacteriology, 2010, 192(17): 4357-4366.DOI:10.1128/JB.00520-10.
[28] DADDAOUA A, FILLET S, FERNANANDEZ M, et al. Genes for carbon metabolism and the toxA virulence factor in Pseudomonas aeruginosa are regulated through molecular interactions of PtxR and PtxS[J]. PLoS ONE, 2012, 7(7): e39390. DOI:10.1371/journal.pone.0039390.
[29] SWANSON B L, HAMOND A N. Autoregulation of the Pseudomonas aeruginosa protein PtxS occurs through a specif i c operator site within the ptxS upstream region[J]. Journal of Bacteriology, 2000, 182(15):4366-4371. DOI:10.1128/JB.182.15.4366-4371.2000.
[30] 孙文敬, 栾方, 王大明, 等. 变形假单胞菌2-酮基葡萄糖酸转运蛋白基因的克隆与分析[J]. 现代食品科技, 2016, 32(6): 50-55.DOI:10.13982/j.mfst.1673-9078.2016.6.009.
Prokaryotic Expression of a 2-Ketogluconate Epimerase Gene from Pseudomonas plecoglossicida
SUN Wenjing1,2, YANG Li1, LUAN Fang1, HE Xiaoyong1, CUI Fengjie1,2,*, WANG Daming2,3, QIAN Jingya1,2, QI Xianghui1
(1. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China;2. Parchn Sodium Isovitamin C Co. Ltd., Dexing 334221, China;3. School of Biotechnology, Jiangnan University, Wuxi 214122, China)
The complete nucleotide sequence of the gene (kguE) encoding 2-ketogluconate epimerase was cloned by touchdown polymerase chain reaction (TD-PCR) from an industrial 2-ketogluconic acid producer, Pseudomonas plecoglossicida JUIM01. A recombinant vector was constructed by ligating the restriction enzymes digested products of the target gene to pET-28a(+) vector and then transferred into the expression host E. coli BL21(DE3). A specif i c fusion protein with molecular weight of about 30.5 ku was expressed in the recombinant strain E. coli BL21(DE3)/pET-28a(+)-kguE after isopropyl β-D-1-thiogalactopyranoside (IPTG) induction with a positive Western-blot result. Bioinformatic analysis showed that the protein was predicted to be a hydrophilic protein with molecular weight of 28.5 ku located in the cytoplasm, sharing 78% amino acid sequence identity with the 2-ketogluconate epimerase from P. putida. The predicted secondary structure consisted of 40.62% of α-helix, 17.19% of extended strand and 42.19% of random coil. This study is expected to provide a basis for further elucidating the function of 2-ketogluconate epimerase in P. plecoglossicida.
Pseudomonas plecoglossicide; 2-ketegluconate epimerase (KguE); kguE gene; cloning; expression;bioinformatics
10.7506/spkx1002-6630-201802011
Q781
A
1002-6630(2018)02-0066-07
孙文敬, 杨荔, 栾方, 等. 变形假单胞菌2-酮基葡萄糖酸差向异构酶基因的原核表达[J]. 食品科学, 2018, 39(2): 66-72.
DOI:10.7506/spkx1002-6630-201802011. http://www.spkx.net.cn
2017-02-25
国家自然科学基金面上项目(31571885);国家高技术研究发展计划(863计划)项目(2012AA022103);
江西省科技计划项目(赣知发[2015]64号);江西省创新团队建设计划项目(20142BCB24024);
江西省科技平台建设计划项目(2010DTZ01900);德兴市科技计划项目(德科发[2015]44号)
孙文敬(1964—),男,研究员,博士,研究方向为食品生物技术。E-mail:juswj@163.com
*通信作者简介:崔凤杰(1980—),男,教授,博士,研究方向为食品生物技术。E-mail:feijiecui@163.com
SUN Wenjing, YANG Li, LUAN Fang, et al. Prokaryotic expression of a 2-ketogluconate epimerase gene from Pseudomonas plecoglossicida[J]. Food Science, 2018, 39(2): 66-72. (in Chinese with English abstract)
10.7506/spkx1002-6630-201802011. http://www.spkx.net.cn
