苦参洗剂对儿童特应性皮炎皮损定植金黄色葡萄球菌影响的体内外研究
2017-12-29姬爱华王广新史传奎周爱妍
姬爱华,王广新 ,史传奎 ,周爱妍,高 蕾
(1.山东大学齐鲁儿童医院 皮肤科,山东 济南 250022;2.山东大学齐鲁儿童医院 儿研所,山东 济南 250022)
临床医学研究
苦参洗剂对儿童特应性皮炎皮损定植金黄色葡萄球菌影响的体内外研究
姬爱华1,王广新2,史传奎1,周爱妍1,高 蕾1
(1.山东大学齐鲁儿童医院 皮肤科,山东 济南 250022;2.山东大学齐鲁儿童医院 儿研所,山东 济南 250022)
目的通过体内外研究探讨苦参洗剂对特应性皮炎(AD)皮损定植金黄色葡萄球菌的影响。方法选取AD患儿45例,采用随机、自身左右对照的方法,以左侧(或右侧)上肢(或下肢)的典型皮损作为治疗组靶皮损,对侧相应皮损则作为对照组皮损。治疗组靶皮损以苦参洗剂和基础润肤处理,对照组皮损仅基础润肤处理,分别在治疗0、7、14 d比较两组患者皮损处的金葡菌定植密度。检测苦参洗剂体外抑菌活性。测定生物被膜的形成以及生物被膜内菌数。结果治疗后第7天和14天,治疗组靶皮损处的金葡菌定植密度与对照组相比均有显著下降,其结果具有统计学意义(P<0.001)。经24 h培养后,苦参洗剂能够明显抑制金葡菌和耐甲氧西林金葡菌生物被膜的形成(P<0.05)。结论苦参洗剂能有效抑制金葡菌、耐药菌生物被膜的形成,表现出良好的抗菌效果,是发挥抗AD疗效的机制之一,这为开发适合AD儿童使用的中药外用制剂提供了理论基础。
苦参洗剂;儿童;特应性皮炎;金黄色葡萄球菌
特应性皮炎(Atopic dermatitis,AD)是一种与遗传相关的、慢性炎症性皮肤病,其病程长、复发率高,多在儿童和青少年人群中起病[1]。中医药外治法治疗湿疹皮炎类的皮肤病有着悠久的历史。
苦参洗剂是一种外用中药复方制剂,该方主要由苦参、黄柏、黄连、地肤子、蛇床子、百部6味中药构成,其功效主要是清热解毒、燥湿止痒。为了评价苦参洗剂对儿童AD的疗效,本研究以儿童AD患者皮损处金黄色葡萄球菌定植密度为指标,在体研究苦参洗剂对AD儿童的疗效,同时采用体外抑菌试验,评价苦参洗剂对金葡菌和耐甲氧西林金葡菌的抑菌活性,以期阐释苦参洗剂治疗AD可能的机理。
1 资料与方法
1.1 研究对象 选取就诊于本院皮肤科门诊的儿童AD患者,共计45例,其中男30例,女15例,年龄3~12岁,平均年龄(7.1±1.2)岁;病程0.3~9.1年,平均(4.2±0.8)年。纳入标准:所有入选患者均符合Hanifin和Rajka的AD临床诊断标准[2],皮损呈左右对称分布;金葡菌培养阳性;监护人已签署知情同意书。治疗前2周,45例患者均未使用过任何抗菌剂以及局部或系统使用过抗生素。排除标准:已知对苦参洗剂中所含成分过敏者;急性期渗出严重、不宜通过外用药进行治疗的;有严重心、肝、肾等方面的疾病;其他皮肤病需要合并治疗的患者。
1.2 试剂 用苦参洗剂中药免煎颗粒(深圳华润三九医药贸易有限公司)加蒸馏水配制溶液,浓度为1 g/mL。体外抑菌试验阳性药:注射用夫西地酸钠(成都诺迪康生物制药有限公司,批号:国药准字H20058151),以生理盐水配制成含夫西地酸钠2%溶液,待用。
1.3 治疗方法 采用随机、自身左右对照的方法,随机选取儿童AD患者左侧(或右侧)上肢(或下肢)的典型皮损作为治疗组的靶皮损,而其对侧相应皮损作为对照组皮损。其中,治疗组靶皮损部位以苦参洗剂外洗或者湿敷处理,15 min/次,2次/d。苦参洗剂治疗后以润肤、保湿剂外搽做基础润肤治疗。对照组仅作基础润肤处理。以14 d为一个疗程,分别在治疗0、7、14 d根据皮损表面微生物密度计算方法检测各患者皮损处的金葡菌定植密度,考察苦参洗剂对AD的治疗效果。
1.4 体外抑菌试验 根据常规皮损取材和细菌培养、鉴定方法[3],以无菌棉签擦拭收集治疗组靶皮损和对照组皮损处细菌,将棉签置于4 mL生理盐水中多次震荡后,取5 μL菌液接种于琼脂培养基中,35 ℃培养24 h。经过常规细菌鉴定和药敏分析后,记录所有分离出的金葡菌的菌落数目,计算每平方厘米的菌落数。
将金葡菌和耐甲氧西林金葡菌两种菌株在M-H琼脂培养基中于37 ℃培养24 h,选取典型菌落于预先配置好的M-H液体培养基中继续培养,过夜,调整菌液浓度为3×1010CFU/mL,备用[3-4]。将增菌后的菌液密度稀释至105CFU/mL,采用二倍递减浓度稀释法测定苦参洗剂对金葡菌和耐甲氧西林金葡菌两种菌株抑菌作用的最小抑菌浓度(minimum bacteriostatic concentration,MIC)MIC值。取灭菌试管36支,编号。每12支为1组,共3个重复组[5],1~10号管为浓度依次递减的苦参洗剂药液2 mL,其浓度分别为1、0.5、 0.25、 0.125、 0.062 5、 0.031 3、 0.015 6、 0.007 8、 0.003 9、0.001 9 g/mL,各样品pH范围为8.32±0.15。再向各管中分别加入0.1 mL稀释后的菌液。第11号管作为金葡菌阴性对照组,其中仅加入M-H液体培养基和苦参洗剂原液各1 mL;第12号管为金葡菌阳性对照组,其中仅加入M-H液体培养基2 mL和菌液0.1 mL。所有试管均于恒温恒湿培养箱中37 ℃培养24 h后取出,观察各试管溶液澄清度以评价细菌生长情况,以细菌不生长的最低药液浓度为苦参洗剂的MIC值。
同法操作,考察苦参洗剂对耐甲氧西林金葡菌的体外抑菌活性,以及阳性药夫西地酸钠对两种菌株的抑菌活性,夫西地酸钠的浓度梯度设置分别为0.36、0.32、 0.28、 0.24、 0.20、 0.16、 0.12、 0.08、 0.04、0.02 mg/L[6]。
1.5 生物被膜体外模型制备[7]取金葡菌典型单菌落接种于2 mL M-H液体培养基中,置于37 ℃培养箱中过夜培养。次日用M-H液体培养基调整菌液密度至1×107CFU/mL,并取200 μL加入96孔板中。37 ℃静置培养24 h,之后洗涤3次,自然风干后即得金葡菌的早期生物被膜体外模型。同法操作,制备耐甲氧西林金葡菌的体外生物被膜模型。
1.6 生物被膜形成的影响[8]在96孔板中加入金葡菌菌液和苦参洗剂,4个复孔,苦参洗剂的终浓度为1×MIC、1/2×MIC、1/4×MIC、1/8×MIC、1/16×MIC、1/32×MIC,置于37 ℃恒温培养箱中孵育24 h。采用结晶紫染色半定量法测定生物被膜的量:每孔洗涤3次,风干后加入0.1%结晶紫染色20 min,洗净,加入200 μL 95%乙醇以去掉黏附细菌结合的结晶紫,于595 nm处测定OD值。同法操作,考察苦参洗剂对耐甲氧西林金葡菌生物被膜形成的影响。
1.7 生物被膜存活菌数的测定[9]体外制备金葡菌生物被膜模型,加入含有苦参洗剂的M-H液体培养基,终浓度为2×、10×、50×和100×MIC,将不含苦参洗剂的M-H液体培养基作为对照。37 ℃孵育24 h,洗涤3次,加入200 μL M-H液体培养基,轻轻刮下生物被膜,45 Hz频率下超声5 min,释放生物被膜内的细菌,进行活菌计数。同法操作,考察耐甲氧西林金葡菌生物被膜内的存活菌数。
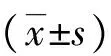
2 结果
2.1 临床疗效评价 治疗前后患者皮损处金葡菌定植密度的统计结果。治疗前(第0天),两组患者靶皮损处的金葡菌定植密度无显著性差异(P>0.05),对治疗后的效果比较无影响;经苦参洗剂外洗或湿敷治疗后第7天和14天,治疗组靶皮损处的金葡菌定植密度与对照组相比均有显著下降,其结果具有统计学意义(P<0.001,见表1),说明经过一个疗程的治疗,苦参洗剂对儿童AD表现出了良好的疗效。


组别定植密度(0d)定植密度(7d)定植密度(14d)治疗35099.90±20290.4410080.45±5842.41∗2746.91±970.35∗对照39117.28±20765.5032497.61±19243.3649605.59±35283.05
*与对照组相比P<0.001。
2.2 体外抑菌活性评价 经24 h培养后,可以明显发现,苦参洗剂在浓度大于0.015 6 g/mL时,对金葡菌和耐药菌两种菌株的生长均产生较好的抑制作用(见表2),由此得出苦参洗剂对金葡菌和耐甲氧西林金葡菌的MIC值是0.015 6 g/mL。而阳性对照组夫西地酸钠对金葡菌和耐甲氧西林金葡菌的MIC分别是0.2 mg/L、0.24 mg/L。
表2苦参洗剂对金葡菌和耐甲氧西林金葡菌的MIC测定结果
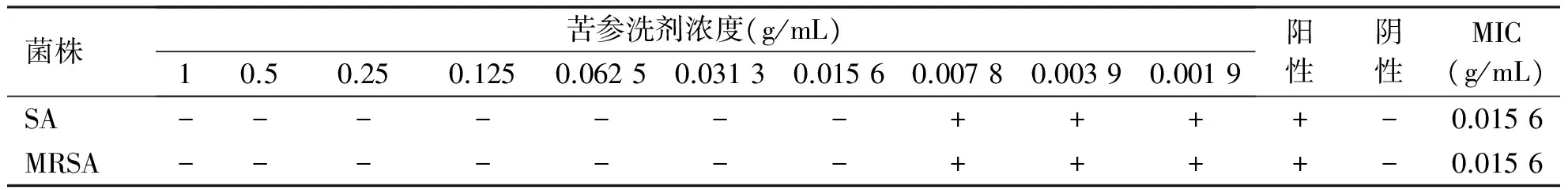
菌株苦参洗剂浓度(g/mL)10.50.250.1250.06250.03130.01560.00780.00390.0019阳性阴性MIC(g/mL)SA-------++++-0.0156MRSA-------++++-0.0156
SA:金葡菌;MRSA:耐甲氧西林金葡菌;“-”表示无细菌生长;“+”表示有细菌生长。
2.3 对生物被膜形成的影响 从表3可知,苦参洗剂能够剂量依赖性的抑制金葡菌和耐甲氧西林金葡菌生物被膜的形成;在高浓度下(1×MIC,1/2×MIC或1/4×MIC),OD值与对照组比较均显著性降低(P<0.05),表明能显著抑制金葡菌和耐甲氧西林金葡菌生物被膜的形成;且在1×MIC浓度下对金葡菌和耐甲氧西林金葡菌生物被膜的抑制率均高于80%。
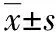
SA:金葡菌;MRSA:耐甲氧西林金葡菌;*与对照组相比P<0.05。
2.4 生物被膜存活菌数的测定 苦参洗剂作用于金葡菌和耐甲氧西林金葡菌生物被膜24 h后,两个菌株的存活菌数均明显下降(P<0.05)。如表4所示,与对照组相比,在2×MIC~100×MIC的药物作用下,金葡菌中的存活菌落数分别下降了1.57、0.86、1.03和1.21 log10CFU/mL;耐甲氧西林金葡菌菌数分别下降了0.84、1.73、1.91和2.02 log10CFU/Ml,与对照相比,差异均具有统计学意义。说明苦参洗剂能减少金葡菌和耐甲氧西林金葡菌生物被膜内的菌数,对已形成生物被膜具有抑制作用。
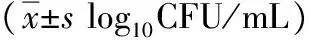

菌株02×MIC10×MIC50×MIC100×MICSA7.68±0.046.11±0.11∗6.82±0.15∗6.65±0.14∗6.47±0.14∗MRSA7.66±0.136.82±0.17∗5.93±0.13∗5.75±0.17∗5.64±0.26∗
SA:金葡菌;MRSA:耐甲氧西林金葡菌;*与对照组相比P<0.05。
3 讨论
随着社会的快速发展,在环境污染、气候变化等外界因素的影响下,AD的患病率大大升高,其中90%为儿童和青少年患者,并且3岁以内儿童患有AD的人数约占44%[10]。由于AD可从多方面影响病人的心理状态以及生活质量,如影响睡眠,令病人产生焦虑、缺乏自信、难以融入集体生活等,对人们的健康生活尤其是对青少年儿童的健康成长构成了极大的障碍[11]。已有很多相关研究证实,细菌感染在AD的发病进程中扮演着十分重要的角色,而其中金葡菌是重要因素之一[12],大多数AD患者皮损处存在较为严重的金葡菌定植现象,其金葡菌的检出率可至80%~100%[13-14]。因此在治疗AD疾病时,通常采取的治疗策略以抗金葡菌为主。局部外用抗生素是一种主要治疗AD的手段。但由于抗生素的滥用,也令金葡菌的耐药菌株渐渐增多起来,其中耐甲氧西林金葡菌在AD患者中的检出率可达到10%~25%。耐甲氧西林金葡菌可对现有多种抗生素产生明显的耐药性,严重影响了疾病的治疗效果[15]。生物被膜(bacterial biofilm,BF)是细菌粘附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等物质,将其自身包绕其中而形成的大量细菌聚集膜样物,是导致耐药的重要因素之一,也是引起慢性难治性感染的主要原因之一[16-17]。目前研究表明,中药在抗生物被膜方面具有独特的优势,许多单味或复方中药都具有抑制或破坏细菌生物被膜的作用[18-20],这成为了中药抗菌治疗的新思路。
苦参洗剂是我院专家由大量临床经验总结而得的经验方,一直以来在治疗湿疹、瘙痒症等皮肤病中取得了较好的临床疗效[21-23]。为了系统分析和评价苦参洗剂是否对儿童AD患者有较明显的治疗作用,我们对45例儿童AD患者进行了随机、自身对照的治疗方法,发现经过14d的治疗后,苦参洗剂可明显改善各AD患者的病情,显著降低皮损处金葡菌的定植密度(P<0.001),且无不良反应发生。另外,在体外抑菌试验中,我们发现苦参洗剂可显著抑制金葡菌和耐甲氧西林金葡菌的生长,其MIC值为0.0156 g/mL。从BF的研究结果来看,苦参洗剂对生物被膜的形成具有明显的抑制作用,这可能是因为其减弱了细菌的起始黏附的结果;同时,在苦参洗剂的作用下,生物被膜内的存活菌数也呈显著性下降,因此,苦参洗剂对已形成的生物被膜也具有一定的抑制作用,但并不能完全清除生物被膜内的细菌,这可能是细胞外多种基质阻碍药物的渗入所导致的。综上所述,苦参洗剂可以通过抑制金葡菌和耐药菌生物被膜的形成,从而表现出良好的抗菌效果,由此推测苦参洗剂显著的抗菌作用可能是其发挥抗AD疗效的机制之一,这为开发适合儿童使用的、安全有效的中药外用制剂提供了理论基础。
[1] Kwon J,Kim J,Cho S,et al.Characterization of food allergies in patients with atopic dermatitis[J].Nutr Res Pract,2013,7(2):115-121.
[2] Hanifin J M,Rakja G.Diagnostic features of atopic dermatitis[J].Acta Dermatol Venereol,1980,92(4):44-47.
[3] 林颖,陈达灿,陈淑慧,等.特应性皮炎皮损处金黄色葡萄球菌定植情况和药敏分析[J].广东医学,2011,32(9):1140-1142.
[4] Allen G P,Hankins C D.Evaluation of the mutant selection window for fluoroquinolones against neisseria gonorrhoeae[J].J Antimicrob Chemothe,2009,64(2):359-363.
[5] 崔俊昌,刘又宁,王睿,等.4种氟喹诺酮类药物对金黄色葡萄球菌的防耐药变异浓度[J].中华医学杂志,2004,84(22):1863-1866.
[6] 杜书章.金黄色葡萄球菌对夫西地酸的体外耐药现状及耐药性改变研究[J].医药论坛杂志,2010(16):65-67.
[7] Peeters E,Nelis H J,Coenye T.Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J].Journal of Microbiological Methods,2008,72(2):157-165.
[8] Dosler S,Karaaslan E,Gerceker A A.Antibacterial and anti-biofilm activities of melittin and colistin,alone and in combination with antibiotics against Gram-negative bacteria[J].Journal of Chemotherapy,2016,28(2):95.
[9] Pérez-Giraldo C,Gonzalez-Velasco C,Sánchez-Silos R M,et al.Moxifloxacin and biofilm production by coagulase-negative staphylococci[J].Chemotherapy,2004,50(2):101-104.
[10]Liselotte B H,Lotte L,Frederik F,et al.Development of atopie dermatitis during the first 3 years of life:the Copenhagen prospective study on in childhood cohort study in highrisk children[J].Areh Dermatol,2006,142(5):561-566.
[11]张文婷,张玲,吴波.畅迪联合雅漾三重滋润霜治疗儿童特应性皮炎的临床研究[J].遵义医学院学报,2017,40(1):91-94.
[12]卢忠义,宋鸿.金黄色葡萄球菌生物膜的研究进展[J].遵义医学院学报,2012,35(5):464- 467.
[13]Breuer K,Kapp A,Werfel T.Bacterial inefetions and atopic demratitis[J].Allergy,2001,56(5):1034-1041.
[14]Leung D Y.Atopic dermatitis and the immune system:the role of superantigens and bacteria[J].J Am Acad Dermatol,2001,45(1):S13-S16.
[15]瓦庆彪,陈永艳,晏文.丹参酮ⅡA联合派瑞松霜治疗皮炎湿疹类皮肤病30例疗效观察[J].遵义医学院学报,2005,28(3):258.
[16]喻锦莉,姜路路,谢鲲鹏,等.五倍子抑制MRSA生物被膜形成的作用机制[J].中国生化药物杂志,2017,37(2):24-27.
[17]王素霞,陈向东,汪辉,等.多尼培南抗铜绿假单胞菌生物被膜的体外活性研究[J].中国抗生素杂志,2016,41(6):466-472.
[18]冯韬,何玉张,李志强,等.6味中药提取物对金黄色葡萄球菌生物膜形成的抑制作用[J].中国兽医杂志,2017,53(1):16-19.
[19]宋鸿,金瑛,王明胜.苦参对铜绿假单胞菌生物膜干预作用的体外研究[J].遵义医学院学报,2015,38(3):235-238.
[20]向晓波,周艳萌,冯琳颖,等.厚朴冷浸液对白色念珠菌生物膜作用的体外研究[J].遵义医学院学报,2016,39(1):51-53.
[21]吴晓霞,贾红声.苦参洗剂治疗肛门皮肤癣的实验研究[J].中医外治杂志,2001,10(3):6-7.
[22]孙跃.自拟苦参洗剂治疗湿疹146例[J].中医外治杂志,2001,10(3):25.
[23]李欢梓.苦参洗剂联合特比萘芬乳膏治疗婴幼儿皮肤念珠菌病[J].中国麻风皮肤病杂志,2007,23(6):493-494.
[收稿2017-09-26;修回2017-10-31]
(编辑:王福军)
Impactofanti-inflammatorysophoramoisturizinglotiononstaphylococcusaureusatopicdermatitisinchildren:invitroandinvivoresearches
JiAihua1,WangGuangxin2,ShiChuankui1,ZhouAiyan1,GaoLei1
(1.Department of Dermatology, Qilu Children’s Hospital of Shandong University, Jinan Shandong 250022,China;2.Institute of Pediatrics,Qilu Children’s Hospital of Shandong University, Jinan Shandong 250022,China)
ObjectiveTo study Sophora lotion on atoptic dermatitis (AD) in children, develop suitable compound preparation for pediatric use.MethodsSelect 45 AD children, use a randomized, self-control method to detect lesions of each patient and staphylococcus aureus colonization density; Collect target skin lesion bacteria in treated group and the control group for in vitro study. The number of colonies per square centimeter, biofilm formation and the number of living bacteria in biofilm were assayed.ResultsAt 0,7 and 14 days after sophora lotion washing or wet treatment, staphylococcus aureus colonization density of target lesions was significantly decreased, compared to control group. The results are statistically significant (P<0.001); After 24 h incubation, sophora lotion inhibited the biofilm formation of staphylococcus aureus and methicillin-resistant staphylococcus aureus obviously(P<0.05).ConclusionSophora lotion is effective to inhibit biofilm of staphylococcus aureus and methicillin-resistant staphylococcus aureus to exhibit excellent antibacterial effect, which is one of the mechanisms for the anti-AD efficacy, and provides a theoretical basis for the development of traditional Chinese medicine external preparations for children use.
sophora lotion; children; atopic dermatitis; staphylococcus aureus
R758.2
A
1000-2715(2017)06-0641-05
