缺血再灌注损伤大鼠心肌线粒体蛋白质组学的研究
2017-12-29魏义勇喻守佳
魏义勇,李 科,喻守佳,喻 田
(1.遵义医学院附属医院 麻醉科,贵州 遵义 563099;2.遵义医学院附属口腔医院 麻醉科,贵州 遵义 563099;3.遵义市 第一人民医院 ICU,贵州 遵义 563000)
基础医学研究
缺血再灌注损伤大鼠心肌线粒体蛋白质组学的研究
魏义勇1,李 科2,喻守佳3,喻 田1
(1.遵义医学院附属医院 麻醉科,贵州 遵义 563099;2.遵义医学院附属口腔医院 麻醉科,贵州 遵义 563099;3.遵义市 第一人民医院 ICU,贵州 遵义 563000)
目的运用蛋白质组学的研究方法探讨心肌缺血再灌注损伤的机制。方法建立Langendorff大鼠离体心脏缺血再灌注损伤模型,随机分为正常组(Nor组)和缺血再灌注损伤组(IR组),每组9只。提取心肌线粒体蛋白质行双向凝胶电泳,质谱鉴定差异大于2倍的蛋白质点。结果Nor组和IR组比较,共发现4个差异蛋白质:其中NADH脱氢酶铁硫蛋白2(NDUFS2)表达上调,ATP合酶α亚基(ATPA)﹑电子传递黄素蛋白α亚基(ETFA)和细胞色素C1 亚基2表达下调。结论ATPA﹑ETFA﹑细胞色素C1亚基2和NDUFS2可能与心肌缺血再灌注损伤有关。
缺血再灌注损伤;线粒体;蛋白质组学
体外循环下心内直视手术以及心脏移植术已成为治疗众多心脏疾病的重要手段,但手术时发生的心肌缺血/再灌注损伤,包括心律失常、心肌梗死面积的扩大、心肌顿抑和心力衰竭等,将会严重影响患者愈后。因此,心肌缺血再灌注损伤被认为是引起人类死亡的主要原因之一[1],但具体机制仍不清楚。本研究拟通过分析缺血再灌注损伤大鼠心肌线粒体蛋白质表达的变化,试图找到相关的靶蛋白,进一步研究心肌缺血再灌注损伤的具体发生机制,以期为研发新药奠定理论依据。
1 材料与方法
1.1 材料
1.1.1 动物选择和分组 健康雄性清洁级SD大鼠,体重250~300 g,4~5月龄。随机分成两组(n=9):正常组(Nor组)和缺血再灌注损伤组(IR组)。
1.1.2 主要试剂 线粒体分离介质1×MS(1 mmol/L EDTA、70 mmol/L sucrose、210 mmol/L mannitoll、5 mmol/L Tris-HC,pH 7.4),裂解液(5 mmol/L EGTA、2 mol/L硫脲、7 mol/L 尿素、4% CHAPS、65 mmol/L DTT,pH 7.4),灌注液为K-H液[成分(单位mmol/L):CaCl22.50、glucose 11.1、KCl 4.75、NaHCO324.80、MgCl2·6H2O 1.19、KH2PO41.19和NaCl 118.00,Nycodenz密度梯度介质等。以上试剂均购自Sigma公司。RCDC蛋白质定量试剂盒由Bio-Rad公司提供,BCA蛋白浓度测定试剂盒由江苏碧云天生物技术研究所提供。
1.1.3 主要仪器 双向凝胶电泳仪(美国Bio-Rad公司)、Langendorff离体心脏灌流系统、基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF-MS)分析仪等。
1.2 方法
1.2.1 建立模型 麻醉大鼠后沿剑突下打开胸腔,于主动脉根部剪下心脏,放入K-H液中,将主动脉固定于Langendorff灌注管口,每组均灌注氧合的K-H液20 min后,Nor组续灌37 ℃含氧K-H液100 min。IR组常温缺血40 min,续灌37 ℃含氧K-H液60 min。按照本实验室的前期研究,建立Langendorff离体大鼠心脏缺血再灌注损伤模型[2-4]。剪开左心耳,将球囊置于左心室,根据信息采集系统收集左室舒张末压(LVEDP)和左室发展压(LVDP)。
1.2.2 提取线粒体蛋白 离体灌注后将心脏置于线粒体分离介质中行组织匀浆,1 500×g离心10 min,吸取上清液再15 000×g离心10 min,即提取到粗提线粒体。将粗提线粒体加入Nycodenz密度梯度介质中以100 000×g离心60 min,得到纯化线粒体。将离解液加入纯化线粒体中超声破碎后,20 000×g离心30 min,即得到纯化后的线粒体蛋白。通过RCDC试剂盒(由Bio-Rad公司提供)行蛋白定量。
1.2.3 双向凝胶电泳及质谱分析 选择pH 5~8,24 cm的线性IPG胶条行第一向等电聚焦分离后,再行第二向SDS-PAGE电泳。对凝胶进行硝酸银染色并通过扫描以获取图像,PDQuest 8.0软件分析找寻表达量改变大于2倍的蛋白质斑点。切取斑点行胶内酶解,用MALDI-TOF-MS分析,通过Mascot软件检索蛋白质数据库。
1.2.4 回复验证 选取部分差异蛋白质通过Western blot法行回复验证,向Sigma公司购买抗体。提取心肌线粒体蛋白质,BCA蛋白试剂盒行浓度测定并分装。配置凝胶,蛋白上样,电泳后PVDF膜加入一抗,4 ℃孵育过夜,加入荧光二抗后扫描。
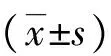
2 结果
2.1 心功能的变化 两组灌注20 min(LVEDP)和(LVDP)比较差异无统计学显著性(P>0.05),续灌末,Nor组LVEDP低于IR组(P<0.05),而LVDP高于IR组(P<0.05),见表1。
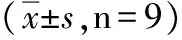

组别灌注20minLVEDP(mmHg)LVDP(mmHg)续灌注100minLVEDP(mmHg)LVDP(mmHg)Nor3.69±1.01117.67±10.876.49±0.80102.49±8.30IR4.04±0.89115.70±6.8821.81±2.47∗56.81±7.40∗
与Nor组比较:*P<0.05。
2.2 双向凝胶电泳 双向凝胶电泳蛋白质斑点图片,见图1,红色编号为差异蛋白质斑点。这些差异蛋白质的数据检索结果,见表2。差异蛋白质的丰度变化,见图2。
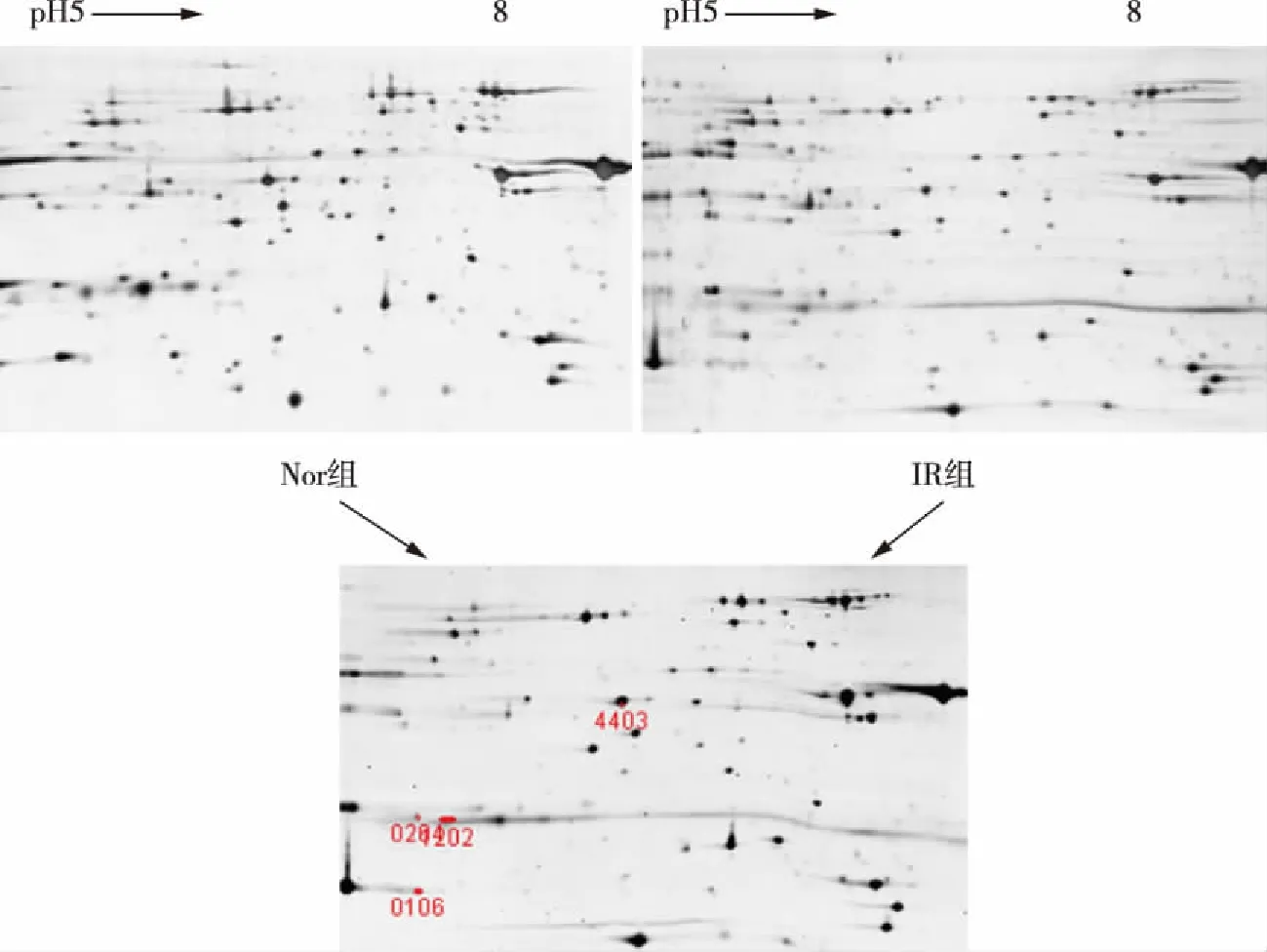
图1 Nor组与IR组比较凝胶图像
表2差异表达蛋白质数据检索结果

SSPNCBI(no)AA%(coverage)ProteinIDMrPIChange>2times0106gi|4053874223%ATPA598319.22↓1202gi|1338500647%Isoform2ofCytochromec1297076.55↓0204gi|22750028111%ETFA352728.62↓4403gi|5886538426%NDUFS2529276.52↑
Nor vs IR比较,AA% coverage:氨基酸序列匹配率;NCBI no.:数据库蛋白质的登录号;SSP:在凝胶图谱上蛋白质点编号。
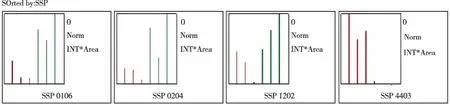
图2 IR组与Nor组比较差异蛋白质丰度变化
2.3 回复验证 Western blot法测定NDUFS2和ATPA的表达,见表3。这两个蛋白质的免疫印迹,见图3。在IR组NDUFS2的表达均明显高于Nor组(P<0.05),但ATPA的表达要低于Nor组(P<0.05)。该结果与双向凝胶电泳的变化趋势一致。因此,证明本研究结果可靠。
表3 Western blot法回复验证各蛋白荧光强度值
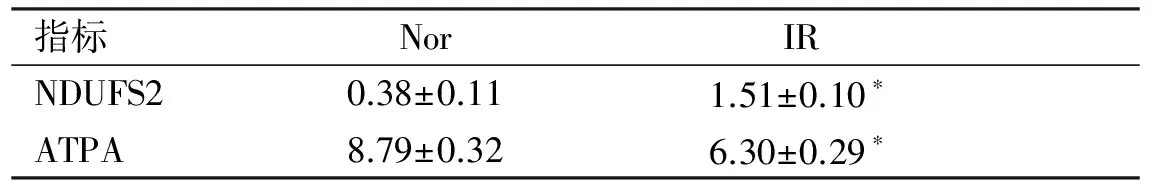
指标NorIRNDUFS20.38±0.111.51±0.10∗ATPA8.79±0.326.30±0.29∗
与Nor比较:*P<0.05。
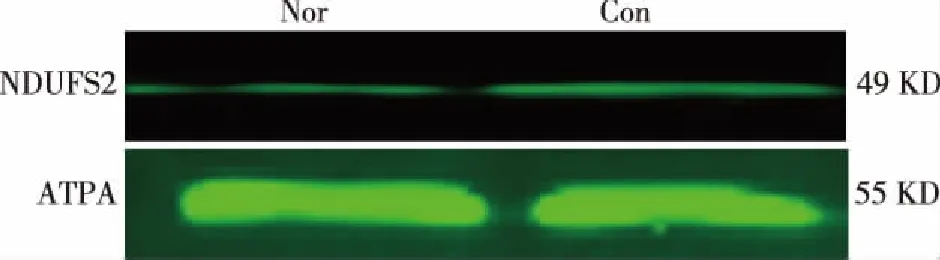
图3 NDUFS2和ATPA在各组表达的免疫印迹分析
3 讨论
本研究证实缺血再灌注严重损害了大鼠的心功能,与既往的研究结果一致[5]。本实验通过Nor组与IR组比较发现有4个线粒体蛋白质表达差异大于2倍。NDUFS2是复合体Ⅰ的一个亚基,复合体Ⅰ由45种蛋白质组成,有两个膜臂。NDUFS2位于复合体Ⅰ亲水性膜臂接近线粒体基底部,属亲水性蛋白质。NADH脱氢酶的亚基构成了复合体Ⅰ催化核心,NDUFS2便是其催化核心之一[6]。ATP合酶是线粒体氧化磷酸化的关键酶,从F0基底部使c亚基构成的环朝顺时针方向旋转,从而带动γ亚基旋转,它的旋转引起F1的β亚基3个催化位点构象周期性变化,使ADP+Pi不断合成ATP[7-8]。ATPA是ATP合酶的重要亚基;ETFA在脂肪酸氧化电子传递链中自FADH2转移一对电子给黄素-硫蛋白,在酯酰-辅酶A的β-氧化过程中,把辅酶Q还原为QH2,从而一个接一个的把电子转移给线粒体电子传递链。细胞色素是一类含血红素的Fe蛋白,在把电子从氧分子传递到氧的过程中起着重要作用。细胞色素C1是细胞色素C的一种,主要存在于线粒体内膜,其含量减少和缺失将影响细胞的呼吸功能。
上述蛋白质涉及线粒体呼吸链和能量代谢,其表达的变化可能与线粒体功能是否正常运转密切相关。KIM等[9]通过兔心肌缺血预处理比较蛋白组学研究发现,缺血再灌注损伤后NDUFS2的表达较正常组高。本实验缺血组NDUFS2的表达变化与他们的结果相似,其机制可能为IR导致线粒体氧化磷酸化受到抑制,线粒体内H+产生过多,pH值下降,导致细胞内代谢性酸中毒,从而诱导NDUFS2表达上调。另外,他们还发现ATP合酶表达发生了变化,其中ATPA在缺血组较正常组表达低,该蛋白质的变化在本研究中同样存在。文献显示,IR导致ATP合酶受到严重抑制,ATP生成显著减少[10-11]。我们利用Western blot技术对这两个蛋白质进行了回复验证,提示双向电泳结果可靠。此外,本实验还发现,ETFA和细胞色素C1亚基2缺血组表达较正常组出现了明显的下降。
鉴于此,我们推测,正常组与缺血组比较NDUFS2表达升高可能是作为代偿机制,以最大限度维持线粒体功能。但由于缺血后心肌损伤较为严重,这种代偿机制尚不能满足机体需要,从而心肌损伤导致了与线粒体呼吸链相关的一些蛋白质表达降低。正常组心功能明显优于缺血组,且这种变化势必会引起一些功能蛋白质表达发生改变。因此,本实验发现ATPA、ETFA和细胞色素C1亚基2在缺血组表达降低,而NDUFS2表达增加,它们可能均与心肌缺血再灌注损伤有关。对这些蛋白质进行更深入的研究,不仅对揭示心肌缺血再灌注的发生机制有重要作用,而且还可以为临床研发新药奠定理论基础。
[1] Shin B,Cowan D,Emani S,et al.Mitochondeial transplantation in myocardial lschemia and reperfusion injury[J].Adv Exp Med Biol,2017,5(28):595-619.
[2] 王颖,张永国,喻 田,等.吡那地尔后处理对缺血/再灌注大鼠离体心脏超微结构的影响[J].遵义医学院学报,2014,37(6):595-597.
[3] 邓胜利,喻田,余志豪.缺血预处理对离体大鼠心肌线粒体心磷脂及心功能的影响[J].第三军医大学学报,2009,31(18):1736-1739.
[4] 喻守佳,王海英,喻田,等.NRF2-ARE通路在缺氧/吡那地尔后处理减轻大鼠心肌细胞缺氧复氧损伤中的作用[J].中国病理生理杂志,2013,29(9):1696-1699.
[5] 魏义勇,李科,喻田,等.吡那地尔后处理大鼠缺血再灌注损伤心肌线粒体的蛋白质组学研究[J].中国病理生理杂志,2015,31(12):2287-2290.
[6] Rhein V F,Carroll J,Ding S,et al.NDUFAF5 hydroxylates NDUFS7 at an early stage in the assembly of human complexⅠ[J].J Biol Chem,2016,291(28):14851-14860.
[7] Bernardi P,Fogolari F,Lippe G,et al.From ATP to PTP and back:A dual function for the mitochondrial ATP synthase[J].Circ Res ,2015,116(11):1850-1862.
[8] Bernardi P,Lisa F D.The mitochondrial permeability transition pore:Molecular nature and role as a target in cardioprotection[J].J Mol Cell Cardiol,2015,78:100-106.
[9] Kim N,Lee Y,Kim H,et al.Potential biomarkers for ischemic heart damage identified in mitochondrial proteins by comparative proteomics[J].Protemics,2006,6(4):1237-1249.
[10]Granger D N,Kvietys P R.Reperfusion injury and reactive oxygen species:The evolution of a concept[J].Redox Biol,2015,12(6):524-551.
[11]Bagheri F,Khori V,Alizadeh A M,et al.Reactive oxygen species-mediated cardiac-reperfusion injury:Mechanisms and therapies[J].Life Sci,2016,11(15):43-55.
[收稿2017-08-10;修回2017-10-12]
(编辑:谭秀荣)
Proteomicsofmyocardialmitochondriabyischemiareperfusioninjuryinisolatedrathearts
WeiYiyong1,LiKe2,YuShoujia3,YuTian1
(1.Department of Anesthesiology,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China;2.Department of Anesthesiology,Stomatological Hospital Affiliated of Zunyi Medical University,Zunyi Guizhou 563099,China;3.Department of Critical Care Medicine,Zunyi First People 's Hospital,Zunyi Guizhou 563000,China)
ObjectiveTo investigate the mechanisms of ischemia/reperfusion injury on rat myocardium by mitochondria proteomics.MethodsLangendorff apparatus was used to establish the model of myocardial ischemia reperfusion injury.Sprague-Dawley rats were randomly divided into 2 groups (n=9 each):the normal group (Nor group) and the ischemia reperfusion injury group (IR group).After 20 min of perfusion with K-H buffer,the perfusion was suspended for 40 min (global ischemia) follow by 60 min of reperfusion in IR group.Nor group was perfused 100 min with K-H buffer.Total proteins extracted from the mitochondria were applied to the two-dimensional gel electrophoresis.The differentially expressed protein spots over 2 times were evaluated by PD Quest 8.0 software.Then they were subjected to in-gel digestion,and analyzed by spectrometry.ResultsThe expression levels of NDUFS2 was elevated but those of ATPA ,ETFA and Isoform 2 of Cytochrome c1 were decreased in IR group compared with Nor group.ConclusionATPA,ETFA,Isoform 2 of Cytochrome c1 and NDUFS2 may be the identification proteins of IR.
ischemia and reperfusion injury; mitochondria; proteomics
卫生部公益性行业科研专项(NO:200802173)。
喻田,女,硕士,教授,博士生导师,研究方向:全身麻醉机制、疼痛相关机制、心肌保护,E-mail:zunyiyutian@163.com。
R332
A
1000-2715(2017)06-0613-04
