TAT-DV3-Bcl-2 siRNA促进U251胶质瘤细胞凋亡的研究
2017-12-29胡晓芳刘茂生李建平罗江福
胡晓芳,刘茂生,卢 巍,李建平,罗江福,陈 跃
(1.遵义医学院 珠海校区人体解剖与组织胚胎学教研室,广东 珠海 519041;2.遵义医学院 珠海校区临床医学系2016级,广东 珠海 519041)
基础医学研究
TAT-DV3-Bcl-2 siRNA促进U251胶质瘤细胞凋亡的研究
胡晓芳1,刘茂生1,卢 巍1,李建平1,罗江福2,陈 跃2
(1.遵义医学院 珠海校区人体解剖与组织胚胎学教研室,广东 珠海 519041;2.遵义医学院 珠海校区临床医学系2016级,广东 珠海 519041)
目的设计合成肿瘤靶向穿膜肽TAT-DV3,联合Bcl-2 siRNA,体外实验研究其对U251胶质瘤细胞的作用。方法设计合成特异性Bcl-2 siRNA及靶向肽TAT-DV3,利用静电作用使两者结合。体外培养U251胶质瘤细胞,TAT-DV3-Bcl-2 siRNA复合物处理细胞后,激光共聚焦显微镜追踪Bcl-2 siRNA进入细胞的分布。PCR检测靶基因Bcl-2沉默情况,Western blot检测Bcl-2蛋白表达;Annexin-V FITC与PI联合标记细胞后,流式细胞仪检测细胞凋亡。结果激光共聚焦显微镜结果证明TAT-DV3-Bcl-2 siRNA成功进入U251细胞内。PCR及Western blot验证了TAT-DV3-Bcl-2 siRNA沉默了目标基因Bcl-2。利用流式细胞仪进行凋亡检测,发现与对照组相比TAT-DV3-Bcl-2 siRNA可以显著促进U251细胞凋亡。结论靶向肽TAT-DV3可有效投递Bcl-2 siRNA进入U251胶质瘤细胞,通过降解Bcl-2 mRNA抑制Bcl-2的表达并促进胶质瘤细胞的凋亡。
脑胶质瘤;siRNA;靶向肽;Bcl-2;U251
RNA干扰技术(RNAi)作为一种新的治疗方法攻克肿瘤为当前研究热点[1],siRNA可有效沉默特定基因,但其本身的结构和性质阻碍了基于siRNA的治疗方法的发展,比如分子量大,且自身带负电荷等,普通脂质体转染效率较低[2-3]。TAT是第一个发现的穿膜肽,有较强的穿膜作用,DV3是趋化因子受体-4(CXCR4)的结合区域,可与肿瘤特异性结合[4],以TAT-DV3作为siRNA投递系统来抑制肿瘤生长尚未见文献报道,本课题将二者结合,作为靶向投递Bcl-2 siRNA进入胶质瘤细胞的载体,使siRNA发挥抑制胶质瘤生长的作用。
1 材料与方法
1.1 材料与仪器 U251胶质瘤细胞株购自美国ATCC公司;高糖DMEM培养基、胎牛血清(美国Gibico公司);0.25%胰蛋白酶、PBS(凯基生物公司);PCR扩增目的基因Bcl-2及内参GAPDH引物(上海生工生物工程有限公司);Bcl-2 siRNA(美国Invitrogen公司);RNA提取试剂Trizol、逆转录试剂盒及qPCR试剂盒(日本Takara公司);Bcl-2一抗、GAPDH一抗及兔抗IgG(英国Abcam公司);Annexin-V凋亡试剂盒(凯基生物公司);CO2恒温培养箱(德国Heraeus公司);荧光定量PCR仪(德国Biometra公司);激光共聚焦扫描显微镜(日本Olympus公司)。
1.2 方法
1.2.1 TAT-DV3-Bcl-2siRNA的合成 设计合成Bcl-2 siRNA及TAT-DV3。Bcl-2 siRNA序列为:sense(5’-3’) GUGAAGUCAACAUGCCUGC,antisense(5'-3')GCAGGCAUGUUGACUUCAC-dTdT。肿瘤靶向穿膜肽TAT-DV3序列为NH2-YGR KKRRQRRRGGGLGASWHRPDKGKKK KKK-COOH[5]。siRNA带负电荷,因此siRNA和带正电荷的TAT-DV3可以通过静电作用结合。分别用DEPC水溶解TAT-DV3和siRNA,以浓度比2∶1将两者混合,漩涡震荡30 s混匀,室温放置30 min,形成TAT-DV3-Bcl-2 siRNA复合物。
1.2.2 细胞培养 U251胶质瘤细胞复苏后用含10%FBS的高糖DMEM培养基,置于37 ℃,5%CO2培养箱中常规培养。细胞融合率为80%~90%时用含0.02%EDTA的0.25%的胰蛋白酶消化传代。
1.2.3 细胞摄取siRNA实验 通过荧光追踪的方法来证明siRNA是否被细胞摄取。实验前在siRNA的5'端标记Cy3-红色荧光染料,用于追踪siRNA在细胞内的分布。首先将105个/孔U251细胞接种到六孔板中,贴壁生长24 h后换液为含100 nM siRNA的培养基。实验分为3组:正常对照组(control)、Bcl-2 siRNA及TAT-DV3-Bcl-2 siRNA,培养12 h后,采用DAPI标记细胞核。再利用激光共聚焦显微镜分析荧光的位置和强度。
1.2.4 目标基因沉默 取对数生长期的U251细胞,用胰蛋白酶消化后,以约105个/孔的密度接种于六孔板中,待细胞贴壁后,用终浓度为100 nM的Bcl-2 siRNA,TAT-DV3-Bcl-2 siRNA作用48 h,收集细胞,用Trizol法提取mRNA,逆转录后采用荧光定量PCR分析Bcl-2 mRNA的表达。Bcl-2引物序列为:sense(5'-3')GGA TTG TGG CCT TCT TTG AG;antisense(5'-3')CCA AAC TGA GCA GAG TCT TC。内参GAPDH引物序列为:sense(5'-3') TGCACCACCAACTGCTTAGC; antisense(5'-3')GGCATGGACTGTGGTCATGAG。扩增程序为:95 ℃预变性10 min→(95 ℃变性15s→60 ℃退火15 s→72 ℃延伸45 s(读荧光))×40个循环。用终浓度为100 nM的Bcl-2 siRNA,TAT-DV3-Bcl-2 siRNA处理细胞48 h后,收集细胞,用RIPA细胞裂解液提取细胞总蛋白,western blotting检测Bcl-2蛋白的表达。蛋白提取物用SDS/PAGE电泳分离后转膜,用TBS配制的5%BSA封闭液分别稀释Bcl-2和GAPDH一抗,4 ℃封闭过夜。用5%BSA封闭液稀释相应的二抗,室温孵育1 h,化学发光法检测蛋白的表达。
1.2.5 细胞凋亡检测 取对数生长期的U251细胞,用胰蛋白酶消化后,以约105个/孔的密度接种于六孔板中,待细胞贴壁后,用终浓度为100 nM的Bcl-2 siRNA,TAT-DV3-Bcl-2 siRNA作用48 h,收集细胞,按照Annexin V-FICT/PI细胞凋亡检测试剂盒说明书处理细胞,染色后用流式细胞仪检测。
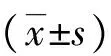
2 结果
2.1 TAT-DV3促进细胞摄取siRNA 激光共聚焦显微镜结果显示对照组(control)中未发现红色荧光,Bcl-2 siRNA组和TAT-DV3-Bcl-2 siRNA组中有红色荧光。在后两组中,发现TAT-DV3-Bcl-2 siRNA组的荧光强度明显强于Bcl-2 siRNA组(见图1)。结果表明,在TAT-DV3的作用下,Bcl-2 siRNA成功进入U251细胞,且效果优于单纯Bcl-2 siRNA。
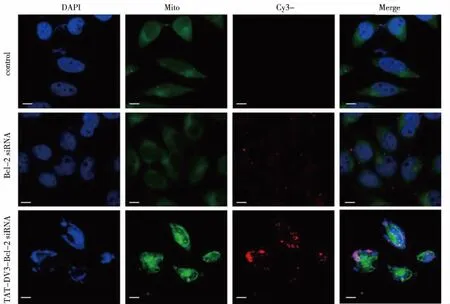
图1 Bcl-2 siRNA-Cy3(第2行)、TAT-DV3-Bcl-2 siRNA-Cy3(第3行)在细胞内分布的激光共聚焦显微镜图像(细胞核用DAPI标记;Bar=10 μm)
2.2 TAT-DV3-Bcl-2 siRNA促进Bcl-2 mRNA及蛋白表达下调 Bcl-2 siRNA、TAT-DV3-Bcl-2 siRNA处理细胞48 h后 ,荧光定量PCR分析Bcl-2 mRNA含量,如图2。统计结果显示,TAT-DV3-Bcl-2 siRNA组与对照组比较有统计学差异(P<0.001)。Western blotting分析各组蛋白的表达情况,如图3。统计结果显示TAT-DV3-Bcl-2 siRNA组与对照组比较有统计学差异(P<0.001),与荧光PCR结果一致。荧光定量PCR及Western blotting结果证明TAT-DV3-Bcl-2 siRNA组被投递到U251细胞内的Bcl-2 siRNA能有效沉默目标基因Bcl-2。
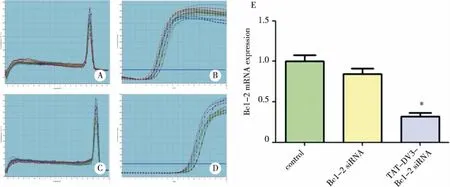
A~B:GAPDH基因的溶解曲线及扩增曲线;C~D:Bcl-2基因的溶解曲线及扩增曲线;E:各实验组Bcl-2基因的表达水平(以GAPDH为内参);“*”表示和对照组相比,n=3,P<0.001。图2 荧光PCR分析Bcl-2 mRNA的表达水平
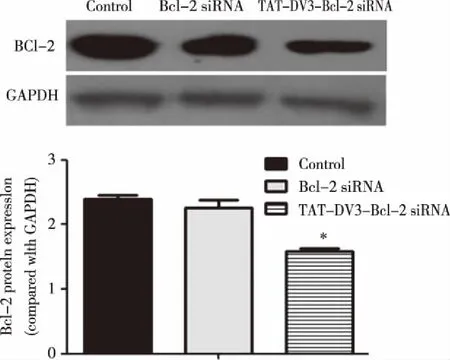
“*”表示和对照组相比,n=3,P < 0.001。图3 Western blotting分析Bcl-2的表达水平
2.3 TAT-DV3-Bcl-2 siRNA促进U251细胞凋亡 Annexin V-FITC细胞凋亡实验结果显示早期凋亡细胞分布于右下象限中,3个组早期凋亡细胞比例分别为:(3.95±0.31)%、(7.15±0.57)%、(17.91±2.48)%;晚期凋亡细胞分布在右上象限中,3个组晚期凋亡细胞比例分别为:(1.45±0.52)%、(1.75±0.26)%、(3.58±0.55)%;活细胞分布在左下象限,3组的活细胞比例分别为:(94.25±0.84)%、(90.43±0.28)%、(78.17±2.61)%(见图4)。实验结果经统计分析,发现与对照组比较,TAT-DV3-Bcl-2 siRNA组中的活细胞、早期凋亡细胞及晚期凋亡细胞所占的比例均有明显差异(P<0.001);而单纯Bcl-2 siRNA组与对照组比较,活细胞、早期凋亡细胞及晚期凋亡细胞所占的比例均无显著差异,证明TAT-DV3作为载体投递Bcl-2 siRNA,比单纯Bcl-2 siRNA效率高。
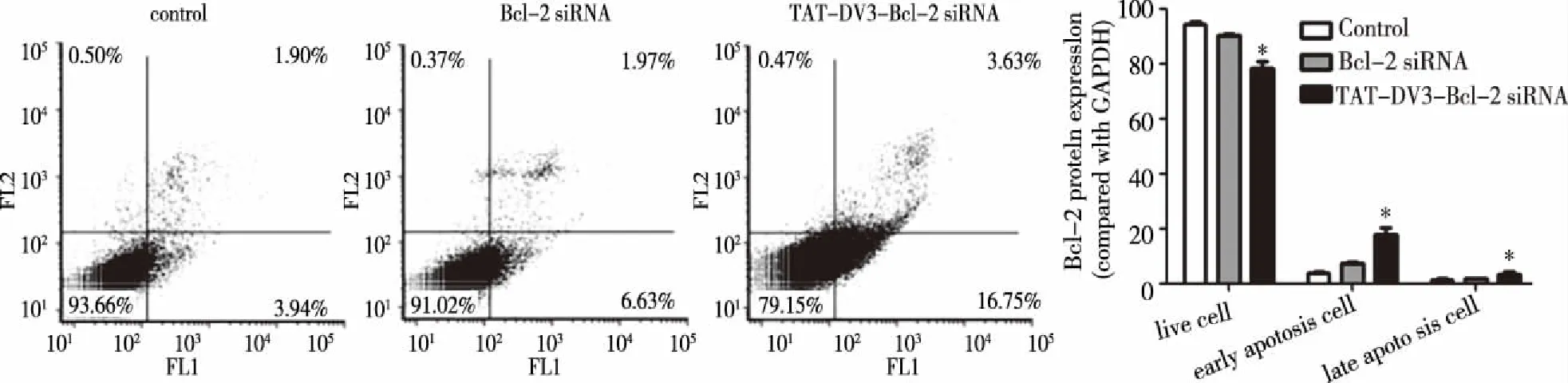
*表示和对照组相比,n=3,* P< 0.001。图4 各组处理U251细胞后的凋亡实验及统计分析结果
3 讨论
脑胶质瘤是临床最常见的恶性肿瘤之一,由于其具有侵袭性生长的特性,手术、放化疗治疗效果并不理想,预后较差。因此,探索有效的治疗措施是临床亟待解决的问题之一[6-7]。近年来发展起来的RNA干扰技术作为一种新的治疗思路攻克肿瘤成为当前研究热点。siRNA干扰技术可有针对性地沉默在细胞癌变过程中发挥关键作用的原癌基因、凋亡相关基因等,使基因表达降低,抑制癌细胞生长,从而达到治疗目的。但siRNA具有分子量大,且自身带负电荷等特性,普通脂质体转染效率较低。
细胞穿膜肽(CPP)是一类具有细胞膜穿透能力的小分子多肽,可携带大分子生物活性物质进入胞浆,转导效率高、不影响转导物质的活性,且无细胞毒性[8-10]。Jiang等连接碳纳米管和CPP投递siRNA,并用其沉默目标蛋白mTOR,抑制肿瘤细胞生长,为siRNA进入胞浆建立一个合理的载药系统[11]。TAT是第一个被发现的穿膜肽,被广泛应用于siRNA投递的研究中。但目前仍然存在肿瘤特异性和体内转导效率等问题。因此研究肿瘤靶向的穿膜肽成为新的方法和策略,利用靶向肽与肿瘤表面物质特异性结合而发挥靶向作用[12]。Bing Fang[13]等设计的TAT-A1能够投递siRNA并且具有肿瘤靶向作用。郑旭[14]等研究发现TAT-KDR靶向siRNA有显著肿瘤靶向性和抗肿瘤活性。本课题拟设计一种新的肿瘤靶向穿膜肽TAT-DV3并验证其能否有效投递siRNA并发挥作用。
DV3是趋化因子受体-4(CXCR4)的结合区域[15], CXCR4属趋化因子家族,目前发现CXCR4在多种肿瘤中表达上调,包括乳腺癌、卵巢癌、胶质瘤、胰腺癌、前列腺癌、急性骨髓性白血病等,且与肿瘤细胞的增殖、侵袭、转移及预后密切相关[16]。因此DV3在药物治疗中可成为靶向肿瘤细胞的工具,Eric L Snyder[17]等研究发现DV3可提高TAT对CXCR4高表达细胞的亲和力。Sun M[18]等证明抗肿瘤核糖核酸酶Onconase结合DV3可特异性地引起肿瘤细胞毒性,而不针对正常细胞。Yongjun Liu等研究证明TAT-DV3-BH3融合肽可靶向结肠癌细胞且引起细胞凋亡,其中TAT-DV3可穿膜且具有肿瘤靶向作用,BH3可引起肿瘤细胞凋亡[5]。肿瘤靶向穿膜肽TAT-DV3是否可以投递siRNA尚未见文献报道。
本课题以原癌基因Bcl-2为靶标,设计合成Bcl-2特异性的siRNA,联合TAT和DV3制备肿瘤靶向穿膜肽TAT-DV3,利用TAT的穿膜作用及DV3可与肿瘤特异性结合,将Bcl-2 siRNA投递进入肿瘤细胞,增加siRNA在靶点位置的聚集,发挥siRNA的基因沉默作用,研究其是否可以促进肿瘤细胞凋亡。siRNA本身带负电荷,我们设计连接有多个赖氨酸的TAT-DV3,使其带正电荷,利用静电技术使两者结合为TAT-DV3-Bcl-2 siRNA复合物。实验通过荧光追踪的方法证明TAT-DV3可以有效投递Bcl-2 siRNA进入U251细胞。荧光定量PCR及western blotting验证了Bcl-2 siRNA可有效沉默目的基因Bcl-2 mRNA,使Bcl-2蛋白表达下调。Annexin V-FITC/PI细胞凋亡检测试剂盒分析U251胶质瘤细胞的凋亡情况,结果证明TAT-DV3-Bcl-2 siRNA能显著促进U251细胞的早期和晚期凋亡。
综上所述,以TAT-DV3作为载体可有效投递Bcl-2 siRNA进入U251胶质瘤细胞,引起目的基因沉默,目的蛋白表达下调,并促进胶质瘤细胞凋亡,本实验为进一步基因治疗脑胶质瘤提供了体外实验依据。
[1] Massimo M,Giorgia N,Stefano I,et al.RNA interference:Implications for cancer treatment[J].Mol Aspects Med,2007,28(1):143-166.
[2] Dominska M,Dykxhoorn D M.Breaking down the barriers:siRNA delivery and endosome escape[J].J Cell Sci,2010,123(Pt 8):1183-1189.
[3] Guruprasath P,Kim J,Gunassekaran G R,et al.Interleukin-4 receptor-targeted delivery of Bcl-xL siRNA sensitizes tumors to chemotherapy and inhibits tumor growth[J].Biomaterials,2017,142:101-111.
[4] Snyder E L,Saenz C C,Denicourt C,et al.Enhanced targeting and killing of tumor cells expressing the CXC chemokine receptor 4 by transducible anticancer peptides[J].Cancer Res,2005,65(23):10646-10650.
[5] Liu Y J,Li Y F ,Wang H J,et al.BH3-based fusion artificial peptide induces apoptosis and targets human colon cancer[J].Mol Ther,2009,17(9):1509-1516.
[6] Ostrom Q T,Bauchet L,Davis F G,et al.The epidemiology of glioma in adults:a “state of the science” review[J].Neuro Oncol Rep,2014,16(7):896-913.
[7] 耿飞,孙涛,卢葵凤,等.HDJ2促进体外培养胶质瘤细胞的侵袭并抵抗其凋亡[J].遵义医学院学报,2017,40(3):896-913.
[8] Zorko M,Langel U.Cell-penetrating peptides:mechanism and kinetics of cargo delivery[J].Adv Drug Deliv Rev,2005,57(4):529-545.
[9] Pujals S,Fernández-Carneado J,López-Iglesias C,et al.Mechanistic aspects of CPP-mediated intracellular drug delivery:relevance of CPP self-assembly [J].Biochim Biophys Acta,2006,1758(3):264-279.
[10]Lindgren M,Langel U.Classes and prediction of cellpenetrating peptides [J].Methods Mol Biol,2011,683(4):3-19.
[11]Jiang X L,Wang G B,Liu R,et al.Rnase non-sensitive and endocytosis independent siRNA delivery system:delivery of siRNA into tumor cells and high efficiency induction of apoptosis[J].Nanoscale,2013,5(16): 7256-7264.
[12]高红林,刘鉴峰,宋娜玲,等.靶向肽在递送siRNA进行肺癌治疗研究中的应用[J].中国肺癌杂志,2014,9(17):674-678.
[13]郑旭,张简丽,任玥,等.穿膜素TAT介导的KDR-siRNA 慢病毒载体的构建及其靶向肺癌A549 细胞的抗肿瘤作用[J].微生物学杂志,2013,12(33):37-42.
[14]Fang B,Jiang L,Zhang M,et al.A novel cell-penetrating peptide TAT-A1 delivers siRNA into tumor cells selectively[J].Biochimie,2013,95(2):251-257.
[15]Yang Y,Gao M,Zhang Q,et al.Design,synthesis,and biological characterization of novel PEG-linked dimeric modulators for CXCR4[J].Bioorg Med Chem,2016,24(21):5393- 5399.
[16]Balkwill F.The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol,2004,14(1):171-179.
[17]Snyder E L,Saenz C C,Denicourt C,et al.Enhanced targeting and killing of tumor cells expressing the CXC chemokine receptor 4 by transducible anticancer peptides[J].Cancer Res,2005,65(23):10646-10650.
[18]Sun M,Tang H,Gao Y,et al.Constitutive expression and anticancer potency of a novel immunotoxin onconase-DV3[J].Oncol Rep, 2016,35(4):1987-1994.
[收稿2017-10-14;修回2017-11-10]
(编辑:谭秀荣)
TAT-DV3-Bcl-2siRNAinducestheU251cellapoptosisinvitro
HuXiaofang1,,LiuMaosheng1,LuWei1,LiJianping1,LuoJiangfu2,ChenYue2
(1.Department of Anatomy,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China;2.Department of Clinical medicine grade 2016,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China)
ObjectiveDesign the cell-penetrating peptide TAT-DV3 to deliver Bcl-2 siRNA,and study its effect on glioma U251 cells in vitro.MethodsDesign and synthesize Bcl-2 siRNA,and assemble them into TAT-DV3.U251 cells were cultured in vitro,and then treated with TAT-DV3-Bcl-2 siRNA.The intracellular distribution of siRNA was detected by confocal laser scanning microscopy.The expression of Bcl-2 mRNA and protein were detected by qPCR and Western blotting respectively.The percentages of apoptotic U251 cells were detected by flow cytometry.ResultsLaser Scanning Confocal Microscope indicated that TAT-DV3-Bcl-2 siRNA was successfully delivered into cells.The results of PCR and Western blotting showed that the expression of Bcl-2 was reduced in the group of TAT-DV3-Bcl-2 siRNA.Flow Cytometry revealed TAT-DV3-Bcl-2 siRNA could induce U251 cell apoptosis and death.ConclusionTAT-DV3 could deliver Bcl-2 siRNA into U251 cells,significantly reduced the expression of Bcl-2 mRNA and protein,and caused U251 cell apoptosis obviously.
Glioma;siRNA;TAT-DV3;Bcl-2;U251
贵州省科学技术基金资助项目(NO:黔科合J字[2014]2179)。
R739.4
A
1000-2715(2017)06-0594-05
