旱柳在Pb、Cd胁迫下实时荧光定量PCR内参基因的筛选
2017-12-29孙吉康杨岚鹏
曾 璟 ,王 平 ,孙吉康 ,杨岚鹏 ,周 韬 ,荣 健
(中南林业科技大学 a.生命科学与技术学院;b.环境科学与工程学院, 湖南 长沙 410004)
旱柳在Pb、Cd胁迫下实时荧光定量PCR内参基因的筛选
曾 璟a,王 平b,孙吉康a,杨岚鹏b,周 韬a,荣 健a
(中南林业科技大学 a.生命科学与技术学院;b.环境科学与工程学院, 湖南 长沙 410004)
为筛选适用于Pb与Cd胁迫下旱柳实时荧光定量PCR的内参基因,应用荧光定量PCR技术分析UBQ1、TUB6、Actin、EF1α、18SRNA、GAPDH、TUA8和UBQ2这8个内参基因在旱柳根部的表达情况。通过Norm finder、geNorm和Best Keeper3个软件进行综合分析,发现在Pb与Cd胁迫下表达较为稳定的内参基因均为EF1α、GAPDH和Actin,差别是在Pb胁迫下的旱柳根组织中最为稳定的内参基因是EF1α,而在Cd胁迫下的旱柳根组织应最稳定的内参基因为GAPDH。该研究结果可用于旱柳根组织在Pb、Cd胁迫下基因表达的进一步研究。
铅;镉;实时荧光定量PCR;内参基因
常用检测基因表达水平的方法有4种,分别是实时定量PCR(quantitative real-time polymerase chain, qRT- PCR)、原位杂交(in situ hybridization,ISH)、Northern印 迹 (northern blot)和 DNA 微阵列(DNA microarray)[1]。qRT-PCR是最为常用的一种,其具有定量快速准确、重复性好、高灵敏度和特异性强的特点[2],已被广泛应用于微生物学、生物科学、分子医学以及诊断学等领域。qRT-PCR对所提取RNA的品质、模板cDNA的浓度和质量、引物的特异性、扩增效率以及内参基因的选择等有着严格的要求[3],因此筛选表达稳定的内参基因是qRT-PCR至关重要的一部分。内参基因也被称作管家基因或看家基因,内参基因的作用是为了消除在运用qRT-PCR方法计算基因相对表达量时,由于RNA质量、不同效率的酶促反应以及其他因素引起的偏差[4]。目前在植物学研究中,常用稳定表达的内参基因有18S核糖体RNA(18SrRNA)、微管蛋白基因(Tubulin)、多素泛聚酶基因(UBQ)、肌动蛋白基因(Actin)、甘油醛-3-磷酸-脱氢酶基因(GAPDH)以及延伸因子基因(EF1-α)等[5]。内参基因的稳定性在不同植物组织部位、生长环境等因素下都会产生不同程度的表达差异[6],因此根据不同的材料,不同的实验设计选择合适的内参基因在qRT-PCR中就很有必要。
旱柳(Salix matsudanakoids)作为一种对多种重金属有较强耐受性的木本能源植物,在修复土壤重金属污染方面有着巨大的潜力[7-11]。针对旱柳的这一特性,Yang等[12]运用分子生物学手段研究了Cd胁迫下旱柳根与叶的转录组和生理响应机制,同时还发现旱柳转录组和生理对Cd胁迫的响应表现出组织特异性。杨卫东等[13]系统地研究了旱柳对Cd的积累、忍耐与解毒生理机制,以及Cd胁迫对旱柳幼苗的生长、低分子量巯基化合物含量、抗坏血酸-谷胱甘肽循环、谷胱甘肽代谢的影响。朱健等[14]研究旱柳对Pb的耐性和富集、转运特征,分析了旱柳根、茎、叶的生理生化、微观结构、官能团组成、矿质元素吸收对不同含量Pb胁迫的响应。由于旱柳在重金属胁迫下的内参基因筛选尚无报导,为了研究Pb、Cd胁迫下旱柳根部主要的3种抗性酶的基因表达量,本文针对Pb、Cd胁迫下旱柳根部的内参基因筛选进行研究,为今后旱柳在Pb、Cd胁迫下的分子研究奠定基础。
1 材料与方法
1.1 植物材料和处理方法
本实验使用的旱柳取自浙江旱柳养殖基地1年生幼苗。将长势一致的旱柳枝条修剪为15 cm长,放入烧杯中进行水培,水培基质为1 L纯水加入3滴浓缩培养液组成,水培14 d待扦插的旱柳根部生长至一定程度之后进行梯度实验(见表1)。实验设计2种重金属离子胁迫处理,分别为Cd与Pb,每种重金属胁迫设置4组梯度3组平行实验,然后将根部生长较好的旱柳水培苗以每十枝一组分别放入不同重金属离子浓度梯度的烧杯中培养,培养14 d后取根系用液氮速冻后放入-80 ℃冰箱保存,供下一步分析。

表1 实验设计的样品浓度梯度Table 1 Experimental design of the sample concentration gradient
1.2 RNA提取和cDNA合成
利 用TIAN GEN RNA prep Pure Plant Kit(Polysaccharides & Polyphenolics rich)RNA prep Pure多糖多酚植物总RNA提取试剂盒提取旱柳根部总RNA,并用DNase I (RNase free)消化去除DNA污染。用琼脂糖电泳检测总RNA提取质量并拍照。然后利用反转录试剂盒PrimeScript TM RTreagent Kit with g DNA Eraser将RNA逆转录为cDNA,将获得的产物放入-20 ℃保存备用。
1.3 内参基因的筛选与引物设计
选择8个常用的内参基因作为候选基因,这8个基因分别是ACT(肌动蛋白基因)、TUA8(α微管蛋白基因)、TUB6(β微管蛋白基因)、GAPDH(甘油醛-3-磷酸-脱氢酶基因)、18SrRNA(18S 核糖体RNA基因)、EF1α(转录延伸因子)、UBQ2(泛素基因)、UBQ1(泛素基因)。通过同源基因序列比对之后,利用软件primer5.0进行引物设计。
1.4 内参基因的普通PCR
反应体系为 20 μL,其中包括 0.5 μL 10 μmol·L-1上游引物、0.5 μL 10 μmol·L-1下游引物,1 μL cDNA 模 板,10.5 μLPCRmix 和 7.5 μL dd H2O。反应条件为94 ℃预变性1 min;98 ℃变性15 s,60 ℃退火 30 s,72 ℃延伸 1 min,35 个循环;72 ℃延伸5 min。最后用1.5%的琼脂糖凝胶电泳检测扩增产物。
1.5 内参基因qRT-PCR扩增程序
采用CFX96 Real-Time PCR Detection System进行各内参基因的qRT-PCR分析。反应体系10 μL,包括SYBR Green Fast q PCR Master Mix (BBI)5 μL、0.2 µLROX Reference Dye Ⅱ (10 µmol/L)、1 μL 10 μmol·L-1上游引物、1 μL 10 μmol·L-1下游引物、2 μL cDNA 2 μL 和 0.8 µL dd H2O。每个样品重复3次,并设置不加模板的阴性对照。反应条件为95 ℃预变性30 s,95 ℃变性5 s,57 ℃退火34 s。采集溶解曲线荧光信号。实验数据采用相对定量法分析。
1.6 内参基因的扩增效率与线性考察
随机选取Pb胁迫下的旱柳的第一链cDNA样品,用dd H2O依次稀释5个梯度,稀释梯度为起始模板浓度的1、1/2、1/4、1/8和1/16。每个反应设3个技术重复,按1.5的反应体系和程序进行分析。
1.7 数据分析
实验共用3种软件geNorm、Bestkeeper和Norm Finder,分析8个常用的内参基因在不同浓度的Pb与Cd胁迫下的表达稳定性。
程序根据8个常用内参基因在不同浓度的Pb与Cd胁迫下对8个内参基因的表达稳定性进行分析,筛选合适的内参基因。根据公式Q=EΔCt利用Excel 2010对各个扩增样品的Ct值计算8个内参基因的相对表达量。其中E为基因扩增效率,ΔCt=Ct(min)−Ct(样品 ),Ct(min)为所有样品中最低的Ct值,Ct(样品)为每个样品的Ct值[15]。
2 结果分析
2.1 RNA样品品质的检测
各总RNA样品在浓度适宜的情况下OD值在A260/A280以及A260/A230均为1.8左右,均可满足转录实验的要求,各总RNA样品均呈现28 S和18 S共2条清晰的条带(见图1),并且28 S条带亮度较为明亮大约为18 S条带的2倍,说明RNA完整性良好,符合后续实验要求[16]。

图1 旱柳根组织部位总RNA的电泳结果Fig. 1 Electrophoresis results of total RNA extracted from roots of Salix matsudana
2.2 内参基因的普通PCR扩增
经1.5%琼脂糖凝胶电泳显示,各内参基因的普通PCR结果均可见预期大小的PCR产物,在100~250 bp之间存在较亮的特异条带,且条带单一,没有引物二聚体及非特异性条带,表明引物设计成功,可用于后续qRT-PCR分析(见图2)。
2.3 内参基因的线性分析

图2 8种内参基因的PCR扩增产物Fig.2 PCR products of eight reference genes
将cDNA模板以2倍梯度稀释,对8个内参基因作标准曲线分析,结果为线性关系很好,各内参基因的标准曲线相关系数为R2≥0.990。并且,扩增效率E均在100%以上(见表2),各3组技术重复的样品间的重复性良好,熔解曲线均只产生单一的熔解峰,不存在引物二聚体等非特异扩增。表明各内参基因的线和性扩增效率均符合要求。
2.4 内参基因Ct值分析
通过qRT-PCR分析可以得到8个内参基因在Pb和Cd不同浓度胁迫下旱柳根部的Ct值。由基因表达量与Ct值呈反比,可得知在Pb与Cd胁迫下表达量最高的都是18SRNA。并且可以观察到不同浓度的Cd胁迫对内参基因表达量的影响更加明显(见图3)。
2.5 内参基因的筛选
2.5.1 geNorm 分析
geNorm V3.5是根据平均表达稳定指数M判断内参基因的稳定性,M值越大则表示内参基因越不稳定,反之则越稳定[17]。M=1.5为判定上线,只有M<1.5才认为内参基因表达稳定。geNorm分析结果表明,8个内参基因的M值均<1.5,说明这8个内参基因都比较稳定,而在Pb胁迫条件下EF1α与GAPDH的M值最小,说明在此条件下这两个内参基因表达最为稳定,8个内参基因稳定性排序为EF1α=GAPDH>18SRNA>Actin>UBQ2>TUB6>TUA8>UBQ1;在Cd胁迫条件下Actin与GAPDH的M值最小,说明在此条件下这两个基因表达最为稳定8个内参基因稳定性排序为GAPDH=Actin>EF1α>TUB6>UBQ2>TUA8>UBQ1>18SRNA(见图4)。
2.5.2 BestKeeper 分析
BestKeeper分析标准变异系数和变异相关系数来判断其表达稳定性,运用Ct值计算标准偏差SD来进行分析内,SD值越小,基因的稳定性越好。若SD>1,则认为该基因不稳定[18]。有结果分析可以的到在Pb胁迫下表达最为稳定的内参基因为UBQ2其次是GAPDH,8个内参基因稳定性排序为UBQ2>GAPDH>TUB6>EF1α>18SRNA>Actin>UBQ1>TUA8;在Cd胁迫下表达最为稳定的内参基因为TUB6其次是18SRNA,8个内参基因稳定性排序为TUB6>18SRNA>Actin>EF1α>GAPDH>UBQ2>TUA8>UBQ1(见表3与表4)。

表2 qRT-PCR检测中所用的8个看家基因的引物序列及在Pb、Cd胁迫下的PCR扩增效率Table 2 Primer sequences and PCR efficiency of eight reference gene under stress of Pb and Cd for q RT-PCR analysis

图3 在Pb、Cd胁迫下8个内参基因旱柳根组织中的表达情况(左图为Pb胁迫,右图为Cd胁迫)Fig. 3 Expression levels of eight reference genes in roots under Pb and Cd stress of Salix matsudana

图4 Pb、Cd胁迫下8个看家基因的表达稳定性的geNorm分析(左图为Pb胁迫,右图为Cd胁迫)Fig. 4 Expression stability of eight reference genes analyzed under Pb and Cd stress by geNorm

表3 用Best Keeper软件分析Pb胁迫下内参基因的表达稳定性Table 3 Expression stability of reference genes analyzed under stress of Pb by Best Keeper
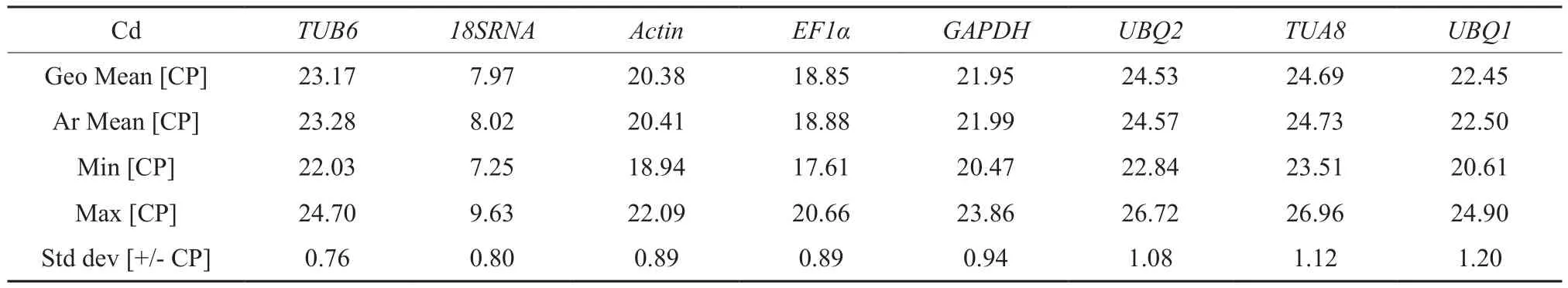
表4 用Best Keeper软件分析Cd胁迫下内参基因的表达稳定性Table 4 Expression stability of reference genes analyzed under stress of Cd by Best Keeper
2.5.3 Norm Finder 分析
Norm Finder程序是运用Excel进行计算方差,根据方差分析得到M值,根据M值评价内参基因的稳定性,M值越大则表示内参基因越不稳定,反之则越稳定[19]。经过计算的出8个内参基因不同胁迫条件下的M值,Pb胁迫下EF1α的M值最小,稳定性最佳,其次是Actin稳定性为第二,8个内参基因稳定性排序为EF1α>Actin>GAPDH>18SRNA>TUB6>UBQ2>TUA8>UBQ1;Cd胁迫下GAPDH稳定性最佳,其次是EF1α,8个内参基因稳定性排序为GAPDH>EF1α>TUB6>Actin>UBQ2>TUA8>UBQ1>18SRNA(见图5)。

图5 Pb、Cd胁迫下8个看家基因的表达稳定性的 Norm Finder 分析(左图为Pb胁迫,右图为Cd胁迫)Fig. 5 Expression stability of eight reference genes analyzed under Pb and Cd stress by Norm Finder
综上所述,根据3种软件geNorm、Bestkeeper和Norm Finder分析结果可知,在Pb和Cd胁迫下旱柳根部的8个内参基因的表达稳定性略有差异,Pb胁迫下表达最为稳的内参基因为EF1α,而Cd胁迫下表达最为稳定的内参基因为GAPDH(见表5),因此EF1α与GAPDH可作为旱柳在Pb与Cd胁迫下基因研究的内参基因。
3 讨 论
本实验基于 Genorm、Bestkeeper和NormFinder软件分别分析比较了在Pb与Cd胁迫下UBQ1、TUB6、Actin、EF1α、18SRNA、GAPDH、TUA8和UBQ2等8个内参基因在旱柳根部的表达情况。这3个软件由于算法不相同所以分析得出的结果也不相同,这种情况也经常出现在其他的研究中[20-21],综合分析可以得出本研究中Pb与Cd胁迫下表达较为稳定的内参基因均为EF1α、GAPDH和Actin,只是在这两种重金属离子胁迫下表达稳定的程度不一致,而最不稳定的内参基因都为UBQ1。EF1α是一种多功能蛋白,其参与多种重要的细胞学过程例如:癌基因转化、病毒复制、细胞骨架组成、信号转导、翻译控制及凋亡等[22]。在Jain等的研究过程中发现,在水稻Oryza sativa不同的组织和发育期表达比较稳定的内参基因为EF1α[23]。当杨树组织处在干旱胁迫下,EF1α基因的表达也很稳定[24];GAPDH是糖酵解反应中的一个不可缺少的酶类,在大部分组织中都高水平表达并且在同种组织或者细胞中的蛋白质表达量一般恒定,在部分研究中,例如在毛果杨和烟草组织中GAPDH相对不稳定不适合做为内参基因[25-26],但在甘蔗Saccharum of ficinarum的不同组织器官中表达最为稳定的为GAPDH[27],并且在本研究的Pb与Cd胁迫下其表现也非常稳定。Actin基因编码的肌动蛋白普遍存在于真核生物中,是一种重要的蛋白质,参加多种重要的生理活动,几乎在所有的真核细胞中具有较为稳定的表达[28]。内参基因应该是不受环境、非生物及生物胁迫等影响且在生物体不同组织、不同细胞中均稳定表达的一类基因,但是实际情况下内参基因的稳定性是相对的。所以应该根据不同的实验对象,不同的实验环境来筛选出合适的内参基因[29]。因此本实验筛选的2个相对稳定的内参基因,仅适用于在Pb与Cd胁迫下旱柳根部组织中基因表达水平的研究,其他组织或胁迫条件有待进一步完善。

表5 在Pb、Cd胁迫下内参基因稳定性Table 5 Stability ranking of candidate reference genes under stress of Pb and Cd
4 结 论
本实验经Genorm、Bestkeeper和NormFinder软件分析得出,内参基因EF1α、GAPDH和Actin在Pb与Cd胁迫下表达均较为稳定,在Pb胁迫下最为稳定的内参基因为EF1α,而在Cd胁迫下应最稳定的内参基因为GAPDH。本实验为后续进行的Pb与Cd对旱柳根部组织中主要抗性酶的基因表达的影响提供基础资料,同时也为其他重金属胁迫下内参基因的筛选提供参考。
[1] Bustin S A, Benes V, Nolan T,et al. Quantitative real-time RTPCR--a perspective[J]. Journal of Molecular Endocrinology,2005, 34(3):597-601.
[2] Bustin S A, Benes V, Garson J A,et al. The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J]. Clinical Chemistry, 2009, 55(4):611-22.
[3] 张艳君, 朱志峰, 陆 融, 等. 基因转达表录分析中内参基因的选择[J]. 生物化学与生物物理进展, 2007, 34(5):546-550.
[4] Vandesompele J, Preter K D, Pattyn F,et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology, 2002, 3(7):341-3411.
[5] Bustin S A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems[J]. Journal of Molecular Endocrinology, 2002, 29(1):23-39.
[6] Thellin O, Zorzi W, Lakaye B,et al.Housekeeping genes as internal standards: use and limits[J]. Journal of Biotechnology,1999, 75(2-3):291-5.
[7] 汤春芳. 旱柳和狭叶香蒲对重金属吸收及其活性炭吸附的比较研究[D].长沙:中南林业科技大学,2015.
[8] 施 翔,陈益泰,王树凤, 等. 废弃尾矿库15种植物对重金属Pb、Zn的积累和养分吸收[J]. 环境科学,2012(6):2021-2027.
[9] 朱宇恩,赵 烨,徐东昱,等. 旱柳Salix matsudanaKoidz体内Cu迁移特征的水培模拟研究[J]. 环境科学学报,2011,31(12): 2740-2747.
[10] 周疆丽. 旱柳对重金属的耐性研究[D].合肥:安徽农业大学,2011.
[11] 李彩霞, 朱国强, 彭 坤. 绿化带土壤重金属污染特征及植物富集研究——以长沙市为例[J]. 中南林业科技大学学报,2016, 36(10):101-107.
[12] Yang J, Li K, Wei Z,et al. Characterization of early transcriptional responses to cadmium in the root and leaf of CdresistantSalix matsudanaKoidz[J]. BMC Genomics, 2015,16(1): 1-15.
[13] 杨卫东, 李廷强, 丁哲利,等. 旱柳幼苗抗坏血酸谷胱甘肽循环及谷胱甘肽代谢对镉胁迫的响应[J]. 浙江大学学报(农业与生命科学版), 2014, 40(5):551-558.
[14] 朱 健, 王 平 , 夹书珊,等 . 旱柳Salix matsudanaKoidz对Pb的耐性、富集、转运与胁迫响应研究[J]. 环境科学学报,2016, 36(10): 3876-3886.
[15] 刘成前, 吴文凯, 周志刚.用于莱茵衣藻荧光定量PCR分析的内参基因选择[J]. 植物生理学通讯, 2009, 45(4):667-672.
[16] 崔秀娜, 袁丽钗, 苏晓娟,等. miR1444a参与毛果杨对锌胁迫的响应[J]. 中国科学:生命科学, 2012, 42(10):850-860.
[17] Vandesompele J, Preter K D, Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology, 2002, 3(7):341-3411.
[18] PfafflM W, Tichopad A, Prgomet C,et al.Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper--Excel-based tool using pairwise correlations[J]. Biotechnology Letters, 2004, 26(6):509-515.
[19] Andersen C L, Jensen J L, Ørntoft T F. Normalization of realtime quantitative reverse transcription-PCR data: a modelbased variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J].Cancer Research, 2004, 64(15):5245-50.
[20] 侯维海, 孙 鹏, 陈全家,等. 地黄实时定量PCR内参基因的筛选[J]. 中国农学通报, 2011, 27(17):76-82.
[21] Hong S Y, Seo P J, Yang M S,et al.Exploring valid reference genes for gene expression studies in Brachypodium distachyon by real-time PCR[J]. BMC Plant Biology, 2008, 8(1):112.
[22] Zhou B, Cao C. Advances in Research on Translation Elongation Factor 1 Alpha[J]. Letters in Biotechnology, 2007,18(2):281-285.
[23] Jain M, Nijhawan A, Tyagi A K,et al.Validation of housekeeping genes as internal control for studying gene expression in rice by quantitative real-time PCR[J]. Biochemical & Biophysical Research Communications, 2006, 345(2):646-651.
[24] Pettengill E A, Parmentier-Line C, Coleman G D. Evaluation of qPCR reference genes in two genotypes of Populus, for use in photoperiod and low-temperature studies[J]. BMC Research Notes, 2012, 5(1):366.
[25] 苏晓娟, 樊保国, 袁丽钗, 等. 实时荧光定量PCR分析中毛果杨内参基因的筛选和验证[J].植物学报,2013,48(5):507-518.
[26] Schmidt G W, Delaney S K. Stable internal reference genes for normalization of real-time RT-PCR in tobacco (Nicotiana tabacum) during development and abiotic stress[J]. Molecular Genetics and Genomics, 2010, 283(3):233-241.
[27] Iskandar H M, Simpson R S, Casu R E,et al. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J]. Plant Molecular Biology Reporter, 2004, 22(4):325-337.
[28] Reid K E, Olsson N, Schlosser J,et al.An optimized grapevine RNA isolation procedure and statistical determination of reference genes for real-time RT-PCR during berry development[J]. BMC Plant Biology, 2006, 6(1):14-27.
[29] 胡瑞波, 范成明,傅永福. 植物实时荧光定量PCR内参基因的选择[J]. 中国农业科技导报, 2009, 11(6):30-36.
Selection of reference genes for quantitative real-time PCR inSalix matsudanaunder stress of Pb and Cd
ZENG Jinga, WANG Pingb, SUN Jikanga, YANG Lanpengb, ZHOU Taoa, RONG Jiana
(a. College of Life Science and Technology; b. College of Environmental Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
In order to screen the internal reference gene ofSalix matsudanaunder the stress of Pb and Cd, the quantitative analysis ofUBQ1,TUB6,Actin,EF1α,18SRNA,GAPDH,TUA8andUBQ2genes in the roots ofSalix matsudanawere studied by fluorescence quantitative reaction Expression. The results showed that the stability ofEF1α,GAPDHandActinwere better, but the degree of expression stability is not consistent under stress of Pb and Cd, through the combination of Normfinder, geNorm and Best Keeper.Therefore, the most stable reference geneEF1αshould be selected under Pb stress, And the most stable internal reference geneGAPDHshould be selected under Cd stress.The results of this study can be used for the further study ofSalix matsudanathe roots of gene expression under Pb and Cd stress.
lead; cadmium; quantitative real-time PCR; reference gene
S792.12;X53
A
1673-923X(2017)08-0086-07
10.14067/j.cnki.1673-923x.2017.08.015
2016-12-12
湖南省重点研发计划项目“微生物-植物协同修复土壤重金属污染及配套支撑技术”(2016SK2030)
曾 璟,硕士研究生
王 平,教授; E-mail:wangping@csuft.edu.cn
曾 璟,王 平,孙吉康,等. 旱柳在Pb、Cd胁迫下实时荧光定量PCR内参基因的筛选[J].中南林业科技大学学报,2017,37(8): 86-92.
[本文编校:文凤鸣]
