不同品种薄壳山核桃种胚组织培养研究
2017-12-29谭鹏鹏彭方仁
曹 凡 ,冯 刚 ,谭鹏鹏 ,张 洁 ,杨 宏 ,彭方仁
(1. 南京林业大学 林学院,江苏 南京 210037;2. 南京林业大学 南方现代林业协同创新中心,江苏 南京 210037)
不同品种薄壳山核桃种胚组织培养研究
曹 凡1,2,冯 刚1,2,谭鹏鹏1,2,张 洁1,杨 宏1,彭方仁1,2
(1. 南京林业大学 林学院,江苏 南京 210037;2. 南京林业大学 南方现代林业协同创新中心,江苏 南京 210037)
为促进薄壳山核桃产业发展,缩短育苗周期和提供优质品种苗,本试验以薄壳山核桃成熟的青皮果实的种胚为试验材料,进行了不同品种种胚诱导组织培养技术的研究,包括培养基的筛选、最佳植物生长调节剂的配比以及其它影响该外植体组织培养的因素。试验主要结果如下:(1)薄壳山核桃种胚的组织培养过程中,选用当年成熟带青皮果实的种胚诱导胚根与胚芽的诱导率较高。使用0.1%的升汞溶液消毒种子10~15 min,再用0.1%升汞溶液将种胚消毒5 min,每瓶接种一个能够有效地减少污染,污染率可降低5%左右。(2)薄壳山核桃种子胚的组织培养过程中,‘波尼’品种种胚诱导率:处理组A>C>D>B;‘马罕’品种种胚诱导率:处理组B>C>A>D。(3)140 mL试管培养能够促进胚根生长优越于常用玻璃瓶器皿,可缩短种胚诱导周期;且添加40 g/L的蔗糖全黑暗环境下培养,种胚生长状况最佳。
美国山核桃;种胚诱导;培养基
薄壳山核桃Carya illinoinensis(Wangenh.)C. Koch,又名美国山核桃、长山核桃,胡桃科山核桃属。其果实价值极高,出仁率高达50%以上,种仁含油量在70%以上[1-3]。此外,其种壳粉末是高级的抛光材料,木材材质优良坚韧,树型优美是庭院及城乡良好的绿化树种[2]。因此,薄壳山核桃不但是果材兼用树种,而且具有良好的生态功能,是热带、亚热带地区生态、经济“双赢”型树种[4-5]。但是,薄壳山核桃生长发育期较长,结实较迟,传统的实生苗繁殖选育方法不仅耗资耗时,而且收效缓慢,优良品种缺乏,易感染病虫害,管理困难,短期内无法获得经济价值。
组织培养技术是现代快速无性繁殖的重要手段,它是利用细胞再生将离体的组织以及器官在人工控制的条件下培养以求获得完整植株的方法[2]。它可以极大程度的缩短育苗时间,降低培育成本,并不受环境影响提供苗木,是促进核桃产业化发展的先进技术,对于提高薄壳山核桃成活率及产量具有重大意义,由此可见薄壳山核桃的组织培养技术是一种迫切需要研究的技术[6-9]。然而,木本植物体胚发生比较困难,尤其是胡桃科植物,外植体材料容易褐化,难以诱导分化,为组织培养及体胚发生工作带来巨大困难。目前在核桃Juglans regia、黑核桃J. nigris、灰核桃J. cinerea、函滋核桃J. hindsii等胡桃科植物中均有体胚发生方面的报道[10-13]。在美国山核桃的体胚发生技术也有几篇相关报道,都不同程度地诱导了体胚发生,但都因为诱导体胚发育困难,或者难以诱导生根而没有获得完整的植株[14-17]。Yates 在1990年报道了一篇文章,在1年之内通过体胚仅获得了极少量的植株[18]。后来,Burns通过悬浮培养获得了体胚,继而用固体培养基诱导发育为植株[19]。考虑到体胚发生诱导困难是受到自身材料因素的限制,因此本试验以薄壳山核桃当年生青皮果实的种胚为材料,研究不同培养器皿、培养条件、基本培养基类型及植物生长调节剂的搭配对薄壳山核桃植株再生的影响,通过种胚诱导途径建立薄壳山核桃稳定的组织培养体系,为以后薄壳山核桃组织培养试验提供试验基础,并对薄壳山核桃产业的发展提供理论依据。
1 材料与方法
1.1 试验材料及预处理
试验材料采自健康壮硕的薄壳山核桃品种成年大树,采样地点为江苏省南京市六合区雄州镇绿宙薄壳山核桃果园基地。试验选择2个品种,分别为‘波尼’(‘Pawnee’)和‘马罕’(‘Mahan’),选择果型正常,大小均一,无病虫害的成熟的青皮果实。于2015年9月采集做好标记,用冰盒带回实验室存于冰箱内备用。
将采集的青皮果子剥去青皮,自来水冲洗浸泡2 d,在0.1%HgCl2溶液中浸泡10~15 min,蒸馏水洗4~6次[20]。于超净工作台上剥去外壳,剥取种仁放入0.1%HgCl2溶液中浸泡2~5 min,再用蒸馏水冲洗6次,然后切取种胚接入培养基中培养。
1.2 种胚诱导中不同培养皿的选择
组织培养中种胚诱导培养皿以240 mL玻璃瓶和140 mL试管进行对比,培养皿的选择是促进胚根生长的的重要因素,它可以对根产生胁迫作用,使其向下伸展。适合的培养器皿能够为种胚的组织培养提供更好的生长条件。
1.3 基本培养基的筛选
根据试验设计的培养基配方及前人对核桃及山核桃种胚诱导组织培养中的经验,以MS和改良的DKW为基本培养基诱导胚芽和胚根的分化,各培养基均添加蔗糖40 g/L,琼脂5.8 g/L,pH:5.8~6.0,所有配好的培养基经高压蒸汽灭菌。每处理接种10管,每管接种1个外植体,重复3次。接种后放入组培室进行培养,20 d后观察生长状况。
1.4 培养条件
组培室内:初代培养过程以16 h光照+8 h黑暗处理和全黑暗处理培养为对比,培养25 d左右,光照以日光灯作为光源,光强2 400~2 600 lx,培养温度为(23±2)℃,空气相对湿度保持在75%左右。
1.5 胚芽与胚根的诱导
全部过程在无菌环境下进行:将剥取后消毒过的种仁使用灭菌过的镊子固定,用刀片沿胚轴切取种胚,接入培养基内,接种方式以竖直插入为主,沿胚轴用灭菌过的刀片切取一个小的切口有助于幼胚萌发,用镊子夹取没入培养基1/3即可,每瓶一个[21-22]。A.MS+6-BA4.0 mg/L + VC2.0 mg/L;B.改良的DKW+6-BA4.0 mg/ L +VC2.0 mg/L;C.改良的DKW+KT2 mg/L+6-BA1 mg/L+ IBA0.01 mg/L;D.改良的DKW+6-BA2.0 mg/L和NAA0.05 mg/L。观察‘波尼’和‘马罕’2个不同品种在4种培养基中的生长状况,挑选最适合种胚诱导的组织培养方法。接种后20 d左右统计其胚芽和胚根的诱导萌发率及污染率。萌发率=诱导出的胚根或胚芽/接种的外植体数×100%;污染率=污染的外植体数/接种的外植体数×100%。
1.6 统计指标
培养20 d左右对进行试验的外植体进行记录,观察胚根和胚芽长度、生长周期、以及种子的发芽状况,并运用LSD进行数据分析。
2 结果与分析
2.1 不同培养皿对外植体胚根诱导的影响
通用的玻璃培养皿有两种:分别用140 mL的试管(图1, a)和240 mL的玻璃瓶培养(图1, b)。每瓶一个外植体,在同等数量、同等培养条件以及相同品种和培养周期的情况下进行对比,140 mL试管培养在胚根活动3 d左右会胁迫胚根向下伸长进入培养基内进行生长,能够及时汲取营养,促进胚根的生长发育;240 mL玻璃瓶会限制胚根,无法胁迫胚根向下生长,造成胚根不能进入培养基中吸收营养,从而延长生长周期,延缓生长进度。

图1 两种培养皿中胚根的生长状况(9 d)Fig.1 The root growth conditions of different culture dish (9 d)
2.2 不同培养条件对外植种胚根与胚芽生长的影响
不同植物类别、不同的培养部位及不同的培养时间对培养的环境也有所不同。在植物组织培养中,光照也是影响植物生长的关键因素[23]。在薄壳山核桃种胚诱导过程中,分为两种培养条件进行对比,结果如下:
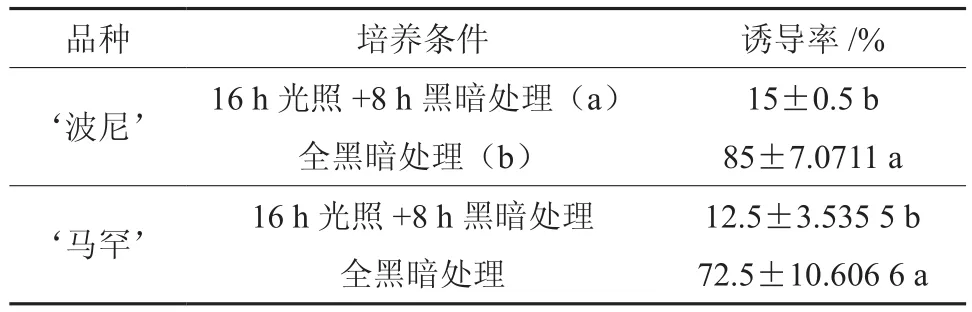
表1 不同光照条件下薄壳山核桃种胚的胚性诱导率(%)Table 1 Zygote embryo inductivity of pecan in different light condition
2个品种的薄壳山核桃试验结果说明15 d内全黑暗培养和正常光照培养种胚诱导的存在差异,全黑暗培养的种胚诱导效果显著,更能促进种胚的生长和发育,且培育周期短,胚根与胚芽的生长状况良好,并且子叶能正常展开[24-27]。
2.3 不同培养基及植物生长调节剂搭配对种胚诱导的影响
采用薄壳山核桃‘波尼’和‘马罕’两个不同品种进行种胚诱导的摸索试验,每种品种试验4种培养基进行种胚诱导的比较,但是不同的品种和材料在不同的培养基上有不同的生长发育进程。所以,不同品种之间、不同培养基之间以及不同品种同一培养基之间种胚诱导水平的变化趋势是不一致的[28-29]。经过数据对比及方差分析显示‘波尼’品种:A处理与D处理对胚根的诱导呈显著性差异,在对胚芽的生长上并无太大差别;而相对于种胚诱导率来说,A处理与B、C、D处理间都存在显著性差异,B与D和C与D之间相差不大(表3;图2,a、b、c、d)。‘马罕’品种对于胚芽与胚根诱导则与‘波尼’相反:A与B、C处理对胚芽的诱导呈显著性差异,在对胚根的生长上并无太大差别;而相对于种胚诱导率来说,B和D与C和D处理间都存在显著性差异(表2;图 3,e、f、g、h)。
2.4 薄壳山核桃种胚胚根与胚芽诱导过程
薄壳山核桃种胚胚根与胚芽从第1 d至第25 d诱导生长的过程见图4。
3 结论与讨论
组织培养技术不仅能遗传其优良的品性,而且能加快品种改良的进程、提高改良的效果在很大程度上支持了薄壳山核桃优良品种繁殖的进程[4]。到目前为止,薄壳山核桃种胚诱导的组织培养试验已得到初步研究成果。在进行的整个试验中,培养皿的选择、光照及植物生长调节剂的配比和培养基的选择对薄壳山核桃的种胚诱导具有决定性的作用[30-33]。

图2 不同光照条件下薄壳山核桃种胚诱导状况(‘波尼’)Fig.2 Zygote embryo of pecan in different light condition (‘Pawnee’)
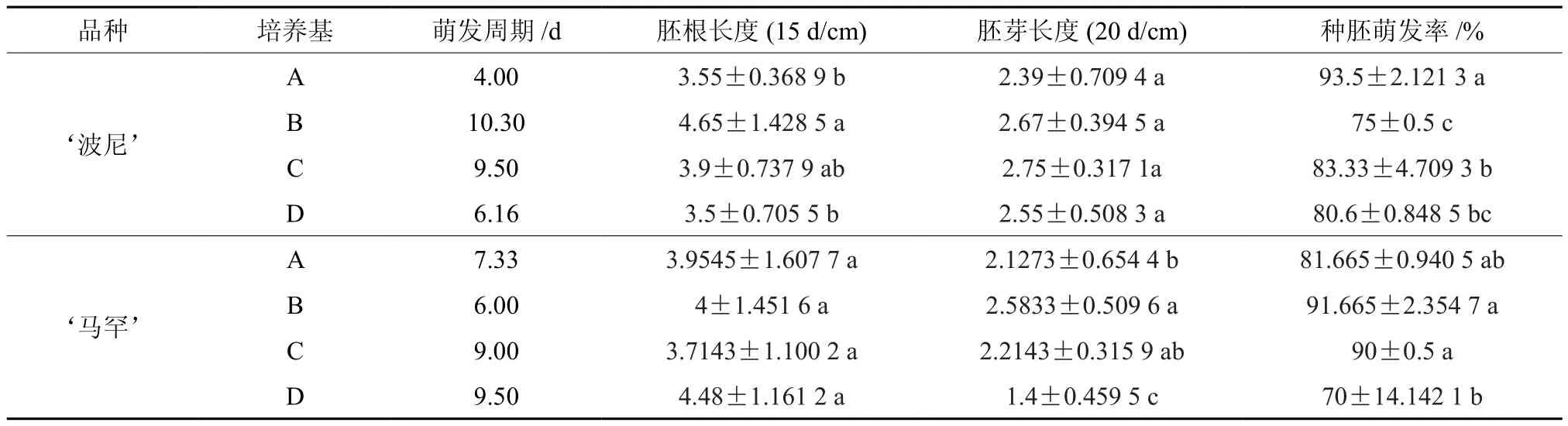
表2 不同培养基处理下胚根与胚芽及种胚诱导率的多重比较(LSD)†Table 2 LSD test of induction of different medium

图3 薄壳山核桃不同品种不同培养基培养15 d的生长状况Fig.3 Roots and shoots of ‘Pawnee’ and ‘Mahan’ using different mediums at 15 days

图4 薄壳山核桃种胚胚根与胚芽诱导过程Fig.4 Inducting process of pecan embryo radicle and embryo
该试验针对目前市场上主推产品的两个品种‘波尼’和‘马罕’,研究结果表明,在前期整个诱导过程中的培养条件下能够成功诱导出胚根与胚芽,诱导萌发率也相对较高且长势良好,污染率几乎为零,并初步得到薄壳山核桃‘波尼’品种种胚诱导的基本培养基为MS培养基(A),在蔗糖浓度为40 g/L全黑暗条件培养,种胚诱导率可达93.5%;对于‘马罕’品种来说以改良的DKW培养基(B)相对较好,在相同条件下种胚诱导率可达91.67%。且大量实验表明,蔗糖能支持绝大多数植物离体组织及器官的旺盛生长,因此被作为植物组织培养的标准碳源广泛使用。它的浓度关系到渗透势和能量的供应,是核桃体细胞胚胎诱导和培养的关键之一,而对于薄壳山核桃种胚诱导种蔗糖的浓度的研究可进一步深入探讨[4]。并且,这几种培养基处理对‘波尼’胚芽诱导和‘马罕’胚根诱导的生长并无显著性差异,数值变化趋于接近,对此,出现这种情况的缘由可进一步摸索。其次,这只是针对薄壳山核桃青皮果实的种胚,而对于完全成熟的果实种胚诱导的培养基成分和条件还有待进一步的深入探讨。
此外,在对薄壳山核桃愈伤组织增殖的试验中,植物生长调节剂的配比、培养基的选择、生长的环境以及受实验材料和条件限制的各种情况都是即将摸索和克服的对象,以期能建立完善的薄壳山核桃种胚诱导的组织培养体系[34-35]。并且,对于薄壳山核桃后期壮根及叶片的生长并进行移栽试验将会是下一步研究的重点。
[1] 牛 青. ‘金薄香’核桃组织培养及试管外嫁接体系的建立[D].太原: 山西大学, 2012.
[2] 王 静. 美国山核桃组织培养技术的研究[D]. 长沙: 中南林业科技大学, 2012.
[3] 陈 芬, 姚小华, 王开良, 等. 33 个薄壳山核桃无性系果 (核) 性状以及产量的比较[J]. 中南林业科技大学学报,2016, 36(1): 40-45.
[4] 陈文生. 早实核桃幼胚培养及体细胞胚胎再生技术研究[D].北京:北京林业大学, 2006.
[5] 朱玉球, 廖望仪, 黄坚钦, 等. 山核桃愈伤组织诱导的初步研究[J]. 浙江林学院学报, 2001, 18(2): 115-118.
[6] 董筱昀, 蒋泽平, 蒋 春, 等. 薄壳山核桃试管离体培养中不定芽诱导及增殖技术的研究[J]. 江苏林业科技, 2013, 40(3):10-14.
[7] 张启香, 胡恒康, 王正加, 等. 山核桃间接体细胞胚发生和植株再生[J]. 园艺学报, 2011, 38(6): 1063-1070.
[8] 杜洋文, 曾 博, 邓先珍, 等. 不同施肥配方对美国山核桃生长的影响[J]. 经济林研究, 2015, 33(1): 95-98.
[9] 张 瑞, 李永荣, 彭方仁. 薄壳山核桃品种“马汉”的栽培适应性及其评价[J]. 经济林研究, 2013, 31(2): 176-180.
[10] 汤浩茹. 核桃的体细胞胚胎发生与转基因研究[D]. 成都: 四川农业大学, 2000.
[11] 方宏筠,王关林. 黑核桃体细胞胚状体发生及基因转化系统的建立[J]. 园艺学报, 2000, 27(6): 406-411.
[12] Pijut P M. Somatic embryogenesis in butternut,Juglans cinerea[J]. Canadium J Forest Research, 1993, 23(5): 835-838.
[13] Tulecke W, McGranahan G H. Somatic embryogenesis and plant regeneration from cotyledons of walnut,Juglans regiaL[J]. Plant Sci, 1985, 40(1): 57-63.
[14] Mathews H, Wetzstein H Y. Arevised protocol for efficient regeneration of somatic embryos and acclimatization of plantlets in pecan,Carya illinoensis[J]. Plant Sci, 1993(91): 103-108.
[15] Merkle S A, Sommer H E, Wetxstein H Y. Somatic embryogenesis in tissue cultures of pecan[J]. Hort Science,1987(22): 128-130.
[16] Wetzstein HY, Ault J R, Merkel S A. Further characterization of somatic embryogenesis in pecan (Carya illinoensis)[J]. Plant Science, 1989(64): 193-201.
[17] Wetzstein HY, Ault JR, Merkle S A. Factors in fluencing somatic embryogenesis and plantlet regeneration in pecan,Carya illinoensis[J]. Acta Hort, 1990(280): 69-74.
[18] Yates I E, Reilly C C.Somatic embryogenesis and plant development in eight cultivars of pecan[J]. Hort Science,1990(25): 573–576.
[19] Burns J A, Wetzstein H Y. Development and characterization of embryogenic suspension cultures of pecan[J]. Plant Cell Tiss Org Cult, 1997(48): 93-102.
[20] 孙 婧. 山核桃外植体诱导培养及褐化机理的初步研究[D].合肥:安徽农业大学, 2013.
[21] Adeela H. Propagation Of Pecan (carya Illinoensis) Using In Vitro Techniques[D]. University of the Punjab, Lahore, 2011.
[22] Obeidy A A, Smith M A L. Organogenesis from mature pecan cotyledons and embryonic axes[J]. HortScience, 1993, 28(3):213-215.
[23] 胡恒康. 山核桃合子胚发育、种胚再生及其生物学特性研究[D]. 南昌: 江西农业大学, 2011.
[24] 张启香, 胡恒康, 王正加, 等 . 山核桃间接体细胞胚发生和植株再生[J]. 园艺学报, 2011, 38(6): 1063-1070.
[25] 胡恒康, 江香梅, 张启香, 等. 碳源对山核桃体细胞胚发生和植株再生的影响[J]. 浙江农林大学学报, 2011, 28(6): 911-917.
[26] 李俊南, 李莲芳, 熊新武, 等. 薄壳山核桃无性繁殖技术研究进展[J]. 安徽农业科学, 2012, 40(33): 16226-16228.
[27] 万俊丽, 黄坚钦, 夏国华, 等. 山核桃幼胚不定芽的诱导[J].浙江林学院学报, 2009, 26(5): 762-766.
[28] Mansouri K, Preece J E. The in fluence of plant growth regulators on explant performance, bud break, and shoot growth from large stem segments of Acer saccharinum L[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2009, 99(3): 313-318.
[29] Renukdas N N, Manoharan M, Garner, Jr J O. In vitro propagation of pecan [Carya illinoinensis(Wangenh) K. Koch][J]. Plant biotechnology, 2010, 27(2): 211-215.
[30] 袁巧平, 董茂山, 黄钦才, 等. 核桃体细胞胚诱导的初步研究[J]. 林业科技通讯, 1990, 7(5): 13-14+33.
[31] Payghamzadeh K, Kazemitabar S K. In vitro germination of Pecan (Carya illinoinensis) embryo[J]. Biharean Biologist, 2010,4(1): 37-43.
[32] 宫永红. 核桃组织培养研究进展[J]. 林业科技开发, 2009,23(2): 5-8.
[33] 于艳萍, 侯立群, 赵登超. 核桃组织培养技术研究综述[J]. 山东林业科技, 2012, 1(5): 117-120+61.
[34] Phillips G C, Ramirez J J. Pecan tissue culture[C]//Proceedings of the 17th Western Pecan Conference. 1983: 101-109.
[35] 汤浩茹, 王永清, 任正隆, 等. 德国核桃“NO.120”幼胚胚轴与子叶体细胞胚胎发生及植株再生[J]. 园艺学报,2000,27(1): 59-61.
Research on the zygote embryo tissue culture of different pecan cultivars
CAO Fan1,2, FENG Gang1,2, TAN Pengpeng1,2, ZHANG Jie1, YANG Hong1, PENG Fangren1,2
(1. College of Forestry, Nanjing Forestry University, Nanjing 210037, Jiangsu, China;2. Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing 210037, Jiangsu, China)
In order to promote the development of pecan industry, shorten the period of pecan seedling culture and provide the quality of pecan cultivar seeding, this research studied on pecan tissue culture. The materials were the zygote embryo of mature green husk nut from different pecan cultivars. And research was consisted of selection of the medium, plant growth regulator matching and some other factors which in fluenced explant tissue culture. The main results were as follows: (1) In tissue culture techniques of pecan, the higher induction rate of shoot and root using zygote embryo of pecan’s current mature green husk nut as experimental material. Pecan seeds were disinfected 10~15 min with 0.1% corrosive sublimate, and zygote embryo were disinfected 5 min with 0.1% corrosive sublimate,each container was inoculated one explant could reduce pollution 5%. (2) In pecan zygote embryo study, the ‘Pawnee’ induction rate of shoots and roots: A>C>D>B (different treatment group); the‘Mahan’ induction rate shoots and roots: B>C>A>D (different treatment group). (3) 140 mLvitro culture promoted root development rather than usual containerand shortened zygote embryo period.The best growth condition was that the zygote embryo culturedin the context of 40 g/L sucrose and all dark environment.
Carya illinoensis; zygote embryo induction; medium
S722.3+7;S664.1
A
1673-923X(2017)08-0018-06
10.14067/j.cnki.1673-923x.2017.08.004
2016-03-10
国家林业局948项目“美国山核桃遗传资源及富根容器育苗技术引进”(2015-4-16);江苏省林业三新工程项目[Lysx2016(44)];江苏省高校优势学科建设工程资助项目(PAPD)
曹 凡,博士研究生
彭方仁,教授,博士研究生导师;E-mail:frpeng@njfu.edu.cn
曹 凡,冯 刚,谭鹏鹏,等. 不同品种薄壳山核桃种胚组织培养研究[J].中南林业科技大学学报,2017, 37(8): 18-23.
[本文编校:文凤鸣]
