金纳米粒子动态光散射技术的应用研究进展
2017-12-27周宝青占忠旭许恒毅
周宝青,占忠旭,黄 楠,李 凡,许恒毅
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
金纳米粒子动态光散射技术的应用研究进展
周宝青,占忠旭,黄 楠,李 凡,许恒毅*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
动态光散射(Dynamic light scattering,DLS)作为颗粒粒径分析方法,具有免分离、易操作、检测成本低、数据易处理等优点;功能化的金纳米粒子除具有本身粒子属性外,还能特异性识别待检物,明显放大检测物光散射信号,可通过DLS技术快速、特异、灵敏检测目标物。该文综述了金纳米粒子DLS技术在目标物分析与检测中应用的研究进展,并对动态光散射技术在应用过程存在的问题进行了讨论,旨在为其实际应用提供一定参考。
金纳米粒子;动态光散射技术;检出限;样本检测;综述
动态光散射(Dynamic light scattering,DLS)是一种常规的分析技术,广泛应用于粒子粒径大小及分布情况的分析[1]。自1970年起,该方法已作为一种实用的分析方法应用于目标物分析和检测[2]。商业化的常规DLS检测设备虽然具有易于操作、检测成本低、数据处理容易等优点[3],但存在检测灵敏度低、特异性差等缺点,限制了其在实际样品检测中的应用。纳米材料(金、银、量子点等)作为理想的光散射增强剂,经过修饰后能显著增强DLS信号[4-5],其中金纳米粒子(AuNPs)因其特殊的物理化学性质(高摩尔消光系数、表面增强拉曼散射等)和良好的生物相容性得到越来越多研究者的青睐[6]。通过静电吸附、Au—S或Au—N键等作用,蛋白质、核酸、无机物等可稳定修饰在AuNPs表面构建功能化金探针,将其与DLS技术结合,应用于样品检测,具有特异性好、灵敏度高等优点。本文综述了基于AuNPs的DLS技术的检测原理及其在样品检测中的应用进展,并对其存在的问题进行了讨论,旨在为实际应用提供参考。
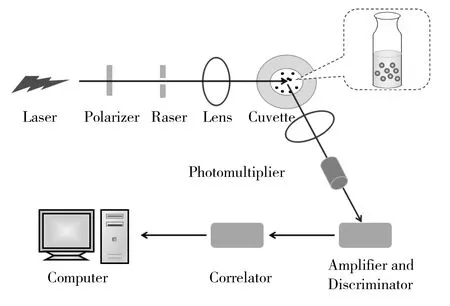
图1 动态光散射实验装置图Fig.1 The experimental equipment of DLS
1 动态光散射技术测量颗粒直径的原理
DLS技术又称时间相关的光散射技术[7],是一种实时监控待检物散射光强度变化的技术。由于待检物溶液中的分子不停地做布朗运动,其粒子散射光的相位发生变动,导致散射光强度在时间上表现为在平均光强附近的随机波动。研究表明,粒子散射光强度的涨幅频率与其粒径相关,粒径越大,涨落越慢[8]。因此,通过测量散射光强度的涨落变化或频移情况,可同时获得颗粒粒径的相关动态参数,进而计算出粒子的粒径,其测量范围为1 nm~5 μm[8]。图1为动态光散射实验装置图,其基本流程为:在固定散射角下,聚焦后的激光照射样品池中的颗粒,颗粒发出的散射光通过光探测器输出相应光信号,经过放大/甄别器和相关器处理,得到颗粒光强自相关函数,最后经计算机处理即可获得颗粒水化粒径及其分布情况。
2 金纳米粒子动态光散射技术在目标物分析与检测中的应用
AuNPs-DLS技术是利用功能化AuNPs探针特异性捕获目标物,AuNPs发生聚集导致其粒径变化,采用DLS技术实时、灵敏、分析其变化情况,从而定量检测目标物[11]。
根据AuNPs探针聚合方式的不同,基于AuNPs-DLS技术建立的常见检测方法主要可分为直接聚合法与间接聚合法两类。直接聚合法是利用功能化修饰AuNPs探针特异性识别目标物聚集,结合DLS进行分析的检测方法,主要利用的聚合方式包括抗原抗体反应、碱基互补配对、核酸适配子特异性识别等。该类方法检测时间短、特异性好、灵敏度高,广泛用于蛋白质[12]、核酸[13]和食源性致病菌[14]的检测。间接聚合法是指通过目标物所带电荷破坏AuNPs之间的静电平衡导致AuNPs聚集,结合DLS进行间接分析的方法,其主要利用的聚合方式为静电相互作用。相比直接聚合法,该类方法检测时间更短、成本更低,主要用于环境中重金属离子的检测[15],但其检测灵敏度较低、特异性较差。图2归纳了近年来功能化金纳米粒子不同聚合方式结合DLS技术在目标物检测中应用的原理,表1总结了AuNPs-DLS技术在样品检测中的应用。
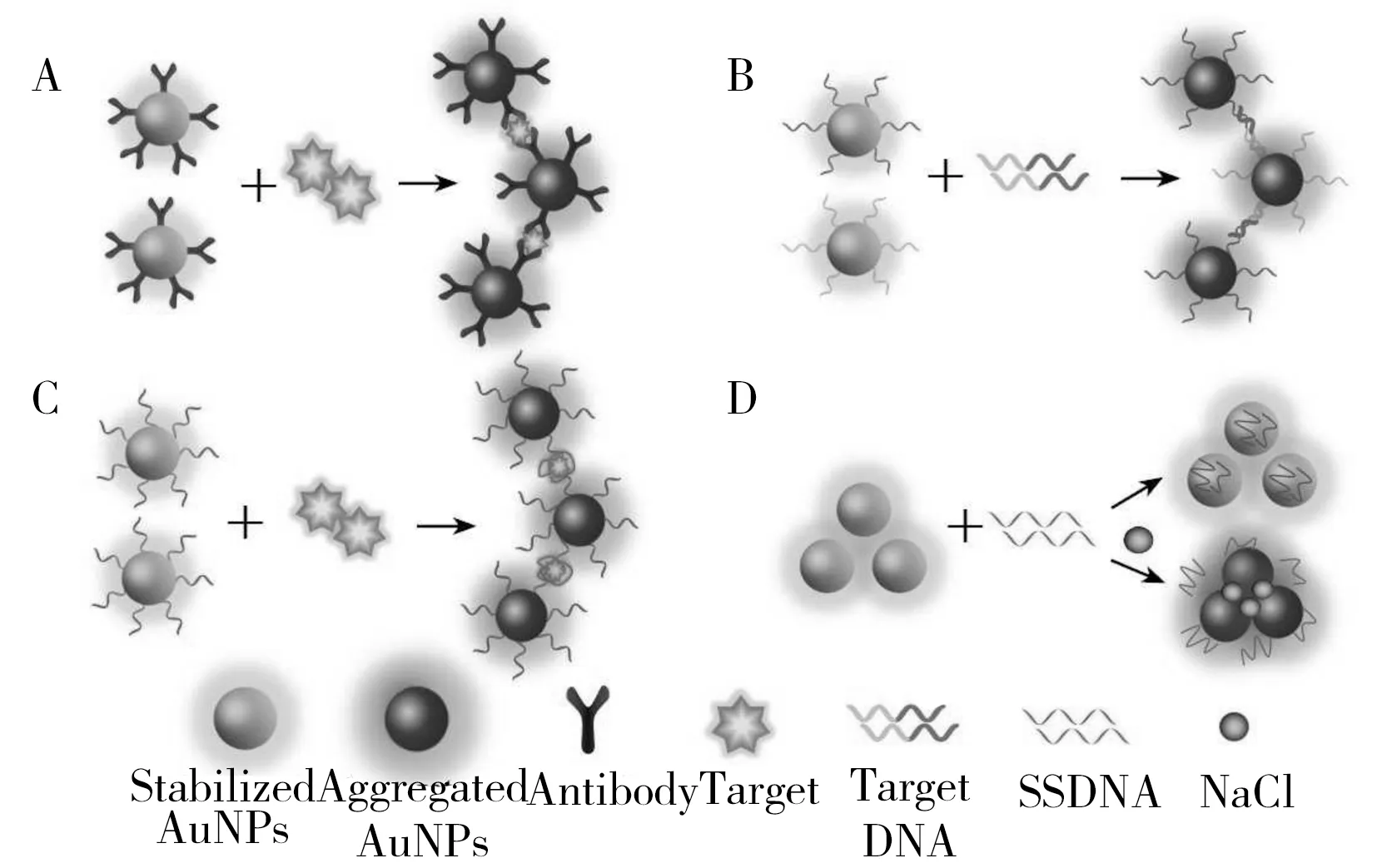
图2 功能化金纳米粒子的聚合方式Fig.2 The aggregation methods of functionalized AuNPsA.antigen-antibody reaction(基于抗原-抗体反应);B.complementary base pairing(基于碱基互补配对);C.aptamer specific recognition(基于核酸适配子特异性识别);D.electrostatic interaction(基于静电相互作用)

表1 AuNPs-DLS技术在不同样本检测中的应用Table 1 The application of AuNPs-DLS technology for the detection of different samples
(续表1)
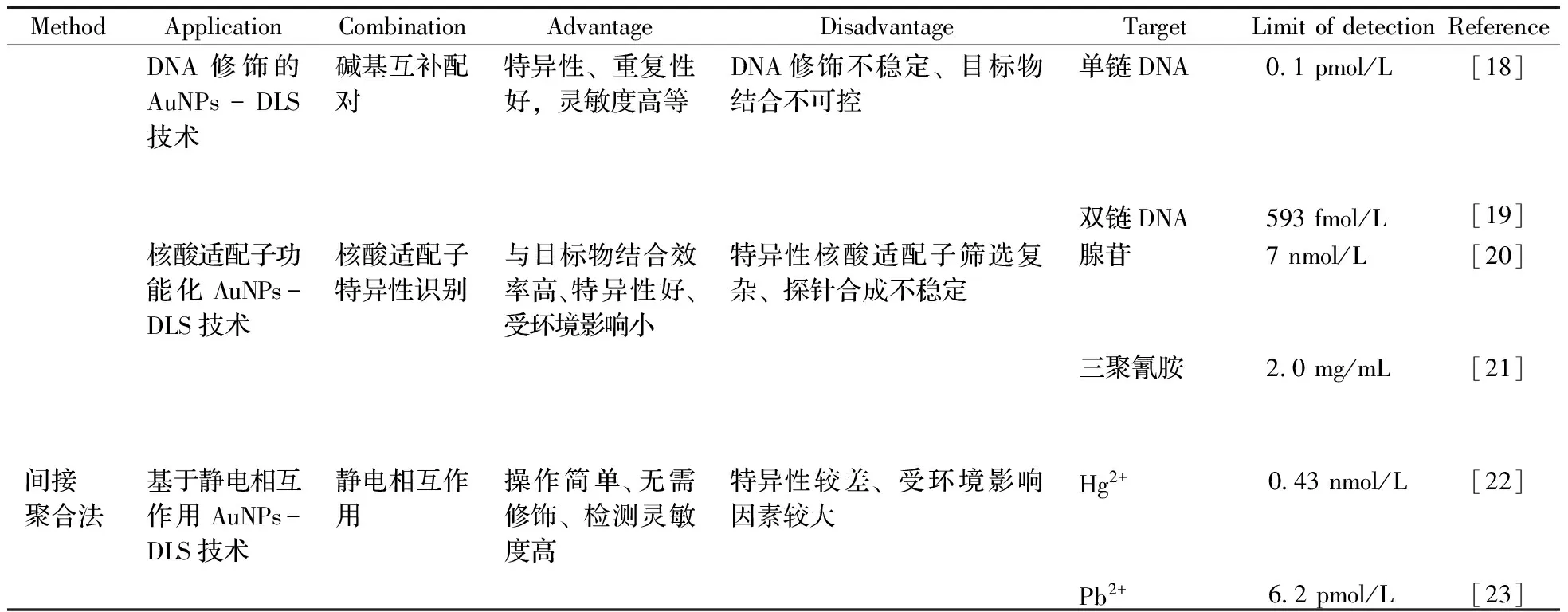
MethodApplicationCombinationAdvantageDisadvantageTargetLimitofdetectionReferenceDNA修饰的AuNPs-DLS技术碱基互补配对特异性、重复性好,灵敏度高等DNA修饰不稳定、目标物结合不可控单链DNA0 1pmol/L[18]双链DNA593fmol/L[19]核酸适配子功能化AuNPs-DLS技术核酸适配子特异性识别与目标物结合效率高、特异性好、受环境影响小特异性核酸适配子筛选复杂、探针合成不稳定腺苷7nmol/L[20]三聚氰胺2 0mg/mL[21]间接聚合法基于静电相互作用AuNPs-DLS技术静电相互作用操作简单、无需修饰、检测灵敏度高特异性较差、受环境影响因素较大Hg2+0 43nmol/L[22]Pb2+6 2pmol/L[23]
2.1 直接聚合
2.1.1基于抗原-抗体反应作为一种高效、特异的生物学捕获方式,抗原抗体反应广泛应用于生物传感器检测方法中。通常,功能化探针通过抗原抗体反应特异性识别目标物并发生聚集,利用DLS技术可定量检测[24]。基于抗原抗体反应聚合方式的AuNPs-DLS检测方法因高效、灵敏、特异等优点已被广泛应用在临床诊断、疾病预防、食源性致病菌检测等方面。Liu等[16]首先合成了抗体包被的不同形状AuNPs探针,构建一步均相双抗夹心模式特异捕获前列腺特异抗原,结合DLS技术实现定量检测,该方法无需分离、样品用量少,检出限为0.5 ng/mL。为了进一步提高前列腺特异抗原的检测灵敏度,Li等[17]通过逐步偶联法分别将聚乙二醇、二氧化锰及抗前列腺结合抗体修饰到AuNPs表面,形成“Ab2-MnO2-pGNPs”聚合物探针,与目标抗原特异性结合后固定在96孔板中,利用DLS技术进行检测,其检出限为1 fmol/L,相比之前的检测方法,其灵敏度提高了4个数量级。Huang等[14]首次建立了基于免疫磁富集和多抗修饰AuNPs探针的DLS技术定量检测食源性致病菌的方法。该方法检测时间短,能特异性捕获生菜中的单增李斯特菌,回收率为74.4%~123.4%,在实际加标样品中的检出限为22 CFU/g。
2.1.2基于碱基互补配对DNA是一类带有遗传信息的生物大分子,DNA之间严格按照碱基互补配对原则进行组装形成功能化结构。在核酸检测过程中,基于碱基互补配对原则设计的核酸修饰的AuNPs探针,能特异识别1个碱基错配,利用DLS技术分析AuNPs探针聚集后粒径的微小变化,可达到快速、灵敏、特异的检测目的。Du等[18]合成了多种单链DNA(Single-stranded DNA,ssDNA)修饰的金探针,当目标DNA存在时,功能化金探针特异捕获目标DNA发生聚集,结合DLS技术分析,可实现一步均相检测靶DNA的目的,其检测时间短(10 min),最低检出限为0.1 pmol/L。Dai等[25]首次利用大粒径AuNPs探针结合DLS技术检测靶DNA,最低检出限达1 pmol/L,相比传统的比色法灵敏度提高了3个数量级。有研究报道,基于碱基互补配对原则,ssDNA除了能形成双链螺旋结构以外,一些特殊碱基序列构成的DNA单链还能形成类似于“麻花状”的三螺旋结构[26-27]。基于三螺旋结构DNA的金探针聚合反应是以Double-stranded DNA(dsDNA)为骨架所形成,相比ssDNA,其dsDNA具有制备简单、保存过程中不易降解等优点。基于这种特殊的三螺旋碱基互补配对原则,Miao等[19]利用只含“G-A”碱基组合的特殊ssDNA合成具有两种不同ssDNA修饰的AuNPs探针,当靶DNA存在时,通过这种特殊碱基结合方式捕获靶DNA形成聚合物,利用DLS技术定量检测dsDNA分子。该检测方法可特异性识别1个碱基错配,其灵敏度高,检出限为593 fmol/L。
2.1.3基于核酸适配子特异性识别核酸适配子是一类通过体外筛选技术(SELEX)经过反复筛选得到的一段与靶物质有高亲和力与特异性的寡核苷酸,不仅拥有类似单克隆抗体功能,而且具有成本低、热稳定性好、环境耐受能力强等特点[28]。近年来,基于核酸适配子特异识别的AuNPs探针结合DLS检测技术因操作简单、灵敏度高、特异性好、适应性强等优点,主要用于疾病诊断、食品安全检测[29]等领域。Yang等[20]首先合成“劈开型”腺苷核酸适配子包被的AuNPs探针,功能化的AuNPs探针特异性捕获腺苷受体形成腺苷-适配子聚合物,通过DLS技术分析聚合物的粒径变化,定量检测腺苷的浓度,检出限为7 nmol/L,相比传统的比色法,提高了5个数量级;与抗体功能化探针相比,该探针合成成本低、环境耐受能力强。Wu等[21]合成了含特定碱基序列的ssDNA功能化AuNPs探针,通过氢键的结合作用,该ssDNA上特定的胸腺嘧啶六联体结构与三聚氰胺单体分子特异性结合形成多聚体,利用DLS技术分析多聚物粒径变化,从而快速、灵敏检测三聚氰胺。该方法检测三聚氰胺耐受环境(温度、pH值、食品基质)的干扰,检出限最低可达2.0 mg/mL。
2.2 间接聚合
静电相互作用是维持胶体体系稳定的主要作用,主要包括静电引力和静电斥力。均相胶体溶液中,粒子之间因表面所带同性电荷相互排斥而保持相对稳定状态。实际应用中,未修饰的AuNPs探针处于高浓度盐(NaCl)缓冲溶液中,其表面的电层被破坏,粒子之间的静电斥力变弱,AuNPs探针之间发生聚合,而一些待检目标物具有稳定AuNPs的作用,如ssDNA在伸展状态下通过Au—N键包被在AuNPs表面,使其保持良好的分散性[30]。基于静电相互作用的AuNPs探针结合DLS技术因操作简单、无需修饰、检测成本低等优点而广泛应用于重金属离子的检测。Xiong等[22]成功构建了基于AuNPs探针DLS技术灵敏检测Hg2+的生物传感器。未经修饰的AuNPs直接加入反应体系,当不存在Hg2+时,AuNPs由于ssDNA的保护作用保持稳定状态[5];而Hg2+存在时,Hg2+与ssDNA发生特异性结合,其ssDNA构象发生变化形成发卡结构、二聚体等,此时AuNPs探针裸露在高盐溶液中发生明显聚合,结合DLS技术分析聚合物的粒径变化可定量检测Hg2+。该方法无需合成功能化AuNPs探针,其最低检出限为0.43 nmol/L。Miao等[23]利用Pb2+特异识别dsDNA发生聚合,同样构建了基于静电相互作用AuNPs探针结合DLS技术一步检测Pb2+的方法,该方法特异性好,能很好地应用于实际水样中Pb2+含量的检测,最低检出限达6.2 pmol/L,回收率为95.12%~104.76%。与传统比色法相比[31],该方法检测灵敏度更高;相比电感耦合等离子体质谱(ICP-MS)等定量分析方法[32-33]的检测成本更低,操作更快速便捷。
3 总结与展望
AuNPs结合DLS技术的检测方法具有操作便捷、特异性好、灵敏度高等优点,在临床诊断、疾病预防、食源性致病菌检测、环境监测等领域得到了广泛的应用。通过比较不同聚合方式AuNPs结合DLS技术在样本检测中的应用发现,该方法在实际应用中尚存在一些问题,需要不断研究和改进:①尽管AuNPs结合DLS技术能灵敏检测目标物,但反应体系中复杂基质的存在易造成假阳性结果,因此可结合一些富集手段(如免疫磁富集技术)去除体系中的杂质干扰,从而更加精确地检测目标物[34];②目前报道的AuNPs结合DLS技术用于样本的检测均通过功能化金探针直接或间接捕获待检物,其检测灵敏度受到一定的限制,可结合杂交链式反应(HCR)、构建人工模拟酶等信号放大方式进一步提高灵敏度;③目前,AuNPs结合DLS的生物传感器方法主要利用AuNPs作为捕获探针载体,形式较为单一,有文献报道结合多种纳米材料或金属材料的检测方法,其检测信号强度能明显增大[8]。因此,在今后的研究中,可以尝试结合多种纳米材料如磁珠、量子点[35]、银纳米粒子等用于样品检测的研究,从而实现超灵敏检测。随着检测技术向快速简便、高灵敏度方向发展,基于AuNPs-DLS技术的生物传感器方法必将得到更广泛的关注与应用。
[1] Goldburg W I.Am.J.Phys.,1999,67(12):1152-1160.
[2] Xu R L.ChinaPowderIndustry(许人良.中国粉体工业),2012,(5):13-16.
[3] Zheng T Y,Bott S,Huo Q.ACSAppl.Mater.Inter.,2016,8(33):21585-21594.
[4] Wang Z X,Ma L.Coord.Chem.Rev.,2009,253(11):1607-1618.
[5] Wang Y X,Bo H Y,Lin K,Wang X,Gao Q.J.Instrum.Anal.(王云香,薄红艳,蔺凯,王晓,高强.分析测试学报),2011,30(7):804-807,812.
[6] Raschke G,Kowarik S,Franzl T,Sönnichsen C,Klar T A,Feldmann J,Nichtl A,Kürzinger K.NanoLett.,2003,3(7):935-938.
[7] Sartor M.DynamicLightScattering.University of California,San Diego,2003:2-21.
[8] Yang L Y.TheDetectionResearchofIonandMicromoleculeBaseonDynamicLightScatteringofNano-particles.Changsha:Hunan University(杨丽燕.基于纳米颗粒动态光散射技术的离子与小分子的检测研究.长沙:湖南大学),2012.
[9] Siddiq M,Wu C,Li B.J.Appl.Polym.Sci.,1996,60(11):1995-1999.
[10] Lu D P,Guan R.ChineseJournalofColloid&Polymer(鲁德平,管蓉.胶体与聚合物),2000,18(2):41-43.
[11] Lai Y H,Koo S,Oh S H,Driskell E A,Driskell J D.Anal.Methods-UK,2015,7(17):7249-7255.
[12] Wang X H,Li Y,Quan D Q,Wang J D,Zhang Y H,Du J,Peng J C,Fu Q X,Zhou Y,Jia S Z,Wang Y L,Zhan L S.Anal.Biochem.,2012,428(2):119-125.
[13] Zhang Y,Fei W W,Jia N Q.NanoscaleRes.Lett.,2012,7(1):564-569.
[14] Huang X L,Xu Z D,Mao Y,Ji Y W,Xu H Y,Xiong Y H,Li Y B.Biosens.Bioelectron.,2015,66:184-190.
[15] Miao X M,Ling L S,Cheng D,Shuai X T.Analyst,2012,137(13):3064-3069.
[16] Liu X,Dai Q,Austin L,Coutts J,Knowles G,Zou J H,Chen H,Huo Q.J.Am.Chem.Soc.,2008,130(9):2780-2782.
[17] Li C,Ma J H,Fan Q X,Tao Y Q,Li G X.Chem.Commun.,2016,52(50):7850-7853.
[18] Du B A,Li Z P,Liu C H.Angew.Chem.Int.Ed.,2006,45(47):8022-8025.
[19] Miao X M,Xiong C,Wang W W,Ling L S,Shuai X T.Chem.-Eur.J.,2011,17(40):11230-11236.
[20] Yang X H,Huang J H,Wang Q,Wang K M,Yang L J,Huo X Q.Anal.Methods-UK,2011,3(1):59-61.
[21] Wu L,Chen K,Lu Z C,Li T T,Shao K,Shao F,Han H Y.Anal.Chim.Acta,2014,845:92-97.
[22] Xiong C,Ling L S.Talanta,2012,89:317-321.
[23] Miao X M,Ling L S,Shuai X T.Anal.Biochem.,2012,421(2):582-586.
[24] Zhang S Y,Moustafa Y,Huo Q.ACSAppl.Mater.Inter.,2014,6(23):21184-21192.
[25] Dai Q,Liu X,Coutts J,Austin L,Huo Q.J.Am.Chem.Soc.,2008,130(26):8138-8139.
[26] Yan H L,Xiong C,Yuan H,Zeng Z X,Ling L S.J.Phys.Chem.C,2009,113(40):17326-17331.
[27] Sau S P,Kumar P,Anderson B A,Østergaard M E,Deobald L,Paszczynski A,Sharma P,Hrdlicka P J.Chem.Commun.,2009,(44):6756-6758.
[28] Mo L T,Li J,Liu Q L,Qiu L P,Tan W H.Biosens.Bioelectron.,2017,89:201-211.
[29] Dong L L,Tan Q W,Ye W,Liu D L,Chen H F,Hu H W,Wen D,Liu Y,Cao Y,Kang J W,Fan J,Guo W,Wu W Z.Sci.Rep.-UK,2015,5:15552.
[30] Ma L N,Liu D J,Wang Z X.Chin.J.Anal.Chem.(马立娜,刘殿骏,王振新.分析化学),2014,42(3):332-336.
[31] Liu J W,Lu Y.J.Am.Chem.Soc.,2003,125(22):6642-6643.
[32] Ochsenkühn-Petropoulou M,Ochsenkühn K M.Frese.J.Anal.Chem.,2001,369(7):629-632.
[33] Luo S Z,Zhao J L,Chen H Y,Yang T.J.Instrum.Anal.(罗世忠,赵金龙,陈怀银,杨涛.分析测试学报),2016,35(1):23-27.
[34] Huang X L,Xu H Y,Xiong Y H,Qu F,Yang L.FoodSci.(黄小林,许恒毅,熊勇华,曲锋,杨林.食品科学),2014,(11):280-285.
[35] Liu K L,Dong Y M,Su J X,Wang G L.J.Instrum.Anal.(刘康丽,董玉明,束军仙,王光丽.分析测试学报),2014,33(8):899-904.
Research Progresses on Application of Dynamic Light Scattering with Gold Nanoparticles
ZHOU Bao-qing,ZHAN Zhong-xu,HUANG Nan,LI Fan,XU Heng-yi*
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Dynamic light scattering(DLS),as a conventional analysis method by particle size,has the advantages of free separation,easy operation,low test costs and easy data processing etc.Functionalized AuNPs,in addition to thier own particle properties,could also specifically identify the target,significantly amplify the light scattering signals from the target,and ultimately achieve a fast,specific and sensitive detection on the target through the DLS technique.In this paper,research progresses on the application of DLS with gold nanoparticles in detection on the target were reviewed.Some problems in the application process of DLS technique were discussed,which was intended to provide some reference for its practical application.
AuNPs;dynamic light scattering;limit of detection;sample detection;review
2017-05-15;
2017-06-20
江西省青年科学家(井冈之星)培养对象项目(2014BCB23004)
*
许恒毅,博士,副研究员,研究方向:食品生物技术,Tel:0791-88304447-222-9520,E-mail:kidyxu@163.com
10.3969/j.issn.1004-4957.2017.12.020
O433.4;G353.11
A
1004-4957(2017)12-1536-05
