阳离子交换净化/气相色谱-质谱法与气相色谱法测定蔬菜水果中15种三唑类农药残留
2017-12-27许天钧苏建峰
许天钧,苏建峰
(1.辽东学院 化学工程学院,辽宁 丹东 118003;2.福建中检华日食品安全检测有限公司,福建 福州 350008)
阳离子交换净化/气相色谱-质谱法与气相色谱法测定蔬菜水果中15种三唑类农药残留
许天钧1,苏建峰2*
(1.辽东学院 化学工程学院,辽宁 丹东 118003;2.福建中检华日食品安全检测有限公司,福建 福州 350008)
采用离子交换净化法,建立了蔬菜水果中15种三唑类农药残留测定的前处理方法。样品用乙腈提取,加入氯化钠均质,离心分层后取部分乙腈层经溶剂转换后过阳离子交换柱净化,所得净化液经浓缩定容后供气相色谱仪(GC)和气相色谱-质谱仪(GC-MS)分析。气相色谱-质谱法采用选择离子扫描方式(SIM),外标法定量。结果表明,在最优条件下15种三唑类农药的定量下限(S/N≥10)均可达到0.01 mg/kg,在0.01、0.05、0.10 mg/kg三个加标水平下的回收率为68%~102%,相对标准偏差为2.4%~16.2%。实验特别考察了该净化方法在气相色谱-电子捕获检测器(ECD)上的适用性,发现各种蔬菜水果(包括葱属蔬菜)均可获得干扰极少的ECD谱图。方法简单、快速,适用于多种蔬菜水果中15种三唑类农药残留的测定。
固相萃取;气相色谱法;气相色谱-质谱法;三唑类杀菌剂;三唑类植物生长调节剂;蔬菜水果
三唑类农药是一类影响细菌甾醇类生物合成并破坏其细胞膜功能的高效、广谱、低毒的内吸性杀菌剂,被广泛应用于蔬菜水果等农作物的种植中,是目前销售量最大、最有发展前景的一类杀菌剂。除抑菌作用外,该类化合物还具有极强的调节植物生长、提高植物抵抗不良环境伤害的生理效应。
目前应用于食品中三唑类农药残留检测的前处理方法主要是常规农药多残留分析方法和分子印迹法[1-2],常规农药多残留分析方法(包括专属三唑类[3-5]和跨种类[6-12])采用极性、非极性固相萃取柱或复合固相萃取柱(Carb/PSA、Carb/NH2等)净化,如GB 23200.8-2016[13](其前一版为GB/T 19648-2006,方法原理和步骤均一致),或者将吸附剂采用粉末的形式进行净化,如QuEChERS法。本研究发现,由于三唑类农药在化学结构上均是主链上带取代苯基和1,2,4-三唑基团化合物,其中1,2,4-三唑基团在适当pH值条件下可结合质子形成阳离子,经条件优化后可采用阳离子交换法对三唑类农药进行前处理净化,供气相色谱-质谱仪(GC-MS)分析,效果良好。该前处理净化方案应用于食品中三唑类农药残留检测的研究尚未见文献报道。
本实验还考察了该前处理净化方案在气相色谱/电子捕获检测器(GC/ECD)上的适用性。特别地,由于葱属蔬菜样品中含有大量的烷基硫代半胱氨酸、亚砜类化合物等及其活性酶,在制样后会产生大量硫基干扰物质[12,14-15],这些干扰物在ECD检测器上响应值很大,使用常规前处理方法净化得到的样品谱图均密布有大小不一的干扰峰,无法进行定性定量分析。本前处理方法能够实现三唑类农药和大量硫基干扰物质的分离,所得净化效果适用于ECD检测,可应用于部分三唑类农药的测定,满足高通量样品的检测需求。
1 实验部分
1.1 仪器与试剂
7890A-5975C气相色谱-质谱联用仪(美国Agilent公司);Clarus 680气相色谱仪(美国PerkinElmer公司);DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm)、HP-5毛细管柱(30 m×0.32 mm×0.25 μm)均购于美国Agilent公司;T-18basic均质器(德国IKA公司);4 000 r/min低速离心机(德国Sigma公司);旋转蒸发仪(德国Heidolph公司);氮吹仪(上海安谱DC-12);三唑酮、四氟醚唑、戊菌唑、三唑醇、多效唑、腈菌唑、苄氯三唑醇、氟硅唑、乙环唑、丙环唑、戊唑醇、三氟苯唑、氟环唑、联苯三唑醇和苯醚甲环唑15种标准品纯度均≥98%,购自德国Dr. Ehrenstorfer公司;阳离子交换固相萃取小柱(60 mg/3 mL,美国Thermo公司);所用溶剂和试剂均为分析纯或色谱纯;实验用水为三重过滤去离子水。
1.2 实验方法
1.2.1样品处理制备:大葱、菠菜、大白菜、春菜、青葱、黄瓜、荷兰豆、西红柿、苹果、香蕉样品购于农贸市场,取各样品约500 g置于制样均质器中搅碎,备用。
提取:称取10 g(精确至0.01 g)搅碎混匀样品至50 mL离心管中,加入20 mL乙腈,15 000 r/min均质15 s,加入3 g氯化钠,继续均质15 s,旋上盖子充分振荡,4 000 r/min 离心10 min,移取上层乙腈10 mL至鸡心瓶中,40 ℃减压旋转蒸发至近干,用3 mL含2%甲酸的甲醇-水(体积比1∶1)溶解残渣(必要时配合超声),所得溶液待净化。
净化:将阳离子交换柱置于玻璃离心管上,依次用3 mL甲醇、3 mL含2%甲酸的甲醇-水(1∶1)活化,将上述提取液过柱,再依次用3 mL含2%甲酸的甲醇-水(1∶1)、3 mL甲醇淋洗杂质,弃去淋洗液,最后用5 mL 0.5%氨水-甲醇洗脱,收集洗脱液于40 ℃氮气吹干,用丙酮-正己烷(体积比1∶9)定容至1 mL,加入少量无水硫酸镁,涡旋5 s后吸取上清液过滤膜后装瓶,待测。

图1 标准溶液的选择扫描总离子流色谱图Fig.1 SIM chromatogram of standard solution
1.2.2色谱-质谱条件气相色谱-质谱条件:载气为氦气(纯度99.999%),恒流模式,流速为1.0 mL/min,进样口温度260 ℃,进样量1 μL,不分流进样。色谱-质谱接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃,离子化方式EI,电子能量70 eV,倍增器电压在自动调谐后加400 V。15种三唑类农药的色谱分离谱图见图1,色谱质谱相关参数见表1。
气相色谱条件:载气为氮气(纯度99.999%),流速2.0 mL/min,进样口温度260 ℃,进样量1 μL,不分流进样,检测器温度300 ℃。
程序升温:初始柱温60 ℃,保持1 min,以20 ℃/min升至150 ℃,再以15 ℃/min升至230 ℃,最后以 25 ℃/min升至280 ℃,保持5 min。

表1 选择离子监测待测农药的保留时间、定量离子、定性离子Table 1 Retention time,quantitative and qualitative ions for SIM acquisition
2 结果与讨论
2.1 样品前处理条件的选择
三唑类农药在乙腈、丙酮、乙酸乙酯中均有较高的溶解度,对于食品基质中的农药残留,一般选用具有一定极性强度的溶剂或溶剂组合时提取效率较高。丙酮虽然提取效率高,但基质中大量杂质也被提取出来,给净化带来困难。乙酸乙酯在提取时与水分层,无协同效应,且对于新鲜果蔬的渗透效果一般。乙腈通用性强,对三唑类农药溶解度大,可溶入的杂质量适中,且乙腈与样品中自带的水具有协同效应,形成乙腈-水混合提取液,在对目标物的溶解、对样品基质的充分渗透和控制溶入的杂质量方面均具有很好的效果,故选用乙腈提取果蔬中三唑类农药。加入氯化钠均质,利用氯化钠的盐析作用,除去水和水溶性杂质,同时还可沉淀蛋白,提高三唑类农药在有机相中的分配比。离心后的溶液最上层是乙腈层,中间是样品残渣与乙腈的混合层,下层为饱和氯化钠水溶液,氯化钠应过量,确保水溶液中盐的浓度达到饱和,以保证盐析的效果。移取部分上清液即可净化,操作简单迅速。
提取液经盐析分配后采用阳离子交换柱净化,阳离子交换柱中的键合基团能够保留离子化的三唑类农药,通过淋洗去除主要干扰物后,再用碱性溶液洗脱三唑类农药。实验中先用甲醇洗去小柱中的干扰物并使键合官能团打开,再用含2%甲酸的甲醇-水(1∶1)继续活化并平衡。选用含2%甲酸的甲醇-水(1∶1)溶液溶解残留物并上柱(若溶液浑浊,应将其高速离心后取澄清液上柱,以防未溶解的颗粒堵塞小柱或影响其中官能团的吸附与解吸附规律),溶解液中2%甲酸与水配合,使三唑类农药结合质子,呈阳离子形态。实验发现甲酸比例过高(5%)时杂质增多,净化效果下降;比例过低(0.5%)时方法耐受性下降,在应对不同种类样品时,质子化效率不稳定将导致回收率波动。依次采用指定溶液淋洗杂质后以0.5%的氨水-甲醇洗脱,定容时加入少量无水硫酸镁,可确保样液的无水环境,避免对毛细管柱造成伤害。
2.2 结果分析
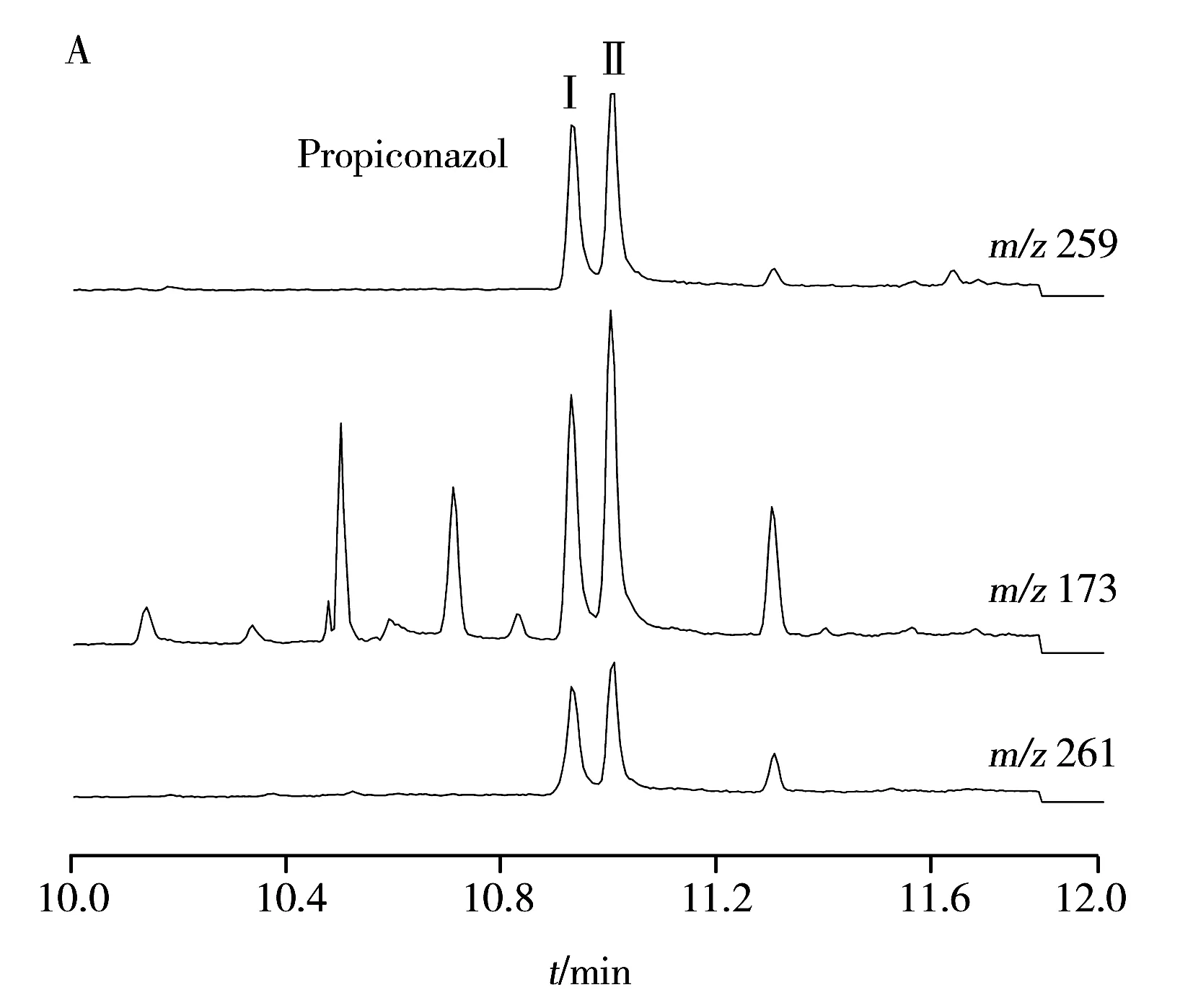
2.2.1气相色谱-质谱测定结果净化后的样液供气相色谱-质谱仪(GC-MS)分析,经优化选择监测离子,各待测物的定量离子基本无干扰,部分定性离子有干扰,干扰幅度尚能满足其定性的要求。采用本法处理的荷兰豆样品(检出丙环唑0.045 mg/kg)和春菜样品(检出苯醚甲环唑0.11 mg/kg)的选择监测提取离子流色谱图见图2。样品经本法净化后,所得各提取离子流色谱图总体较优,丙环唑的定性离子m/z173色谱图中有干扰峰,但其响应值不高,且保留时间与丙环唑不重叠,不影响定性,其它离子色谱图中基本无干扰峰,经仪器自动计算,m/z259、261、265、323、325的信噪比(S/N)均超过200。
2.2.2气相色谱测定结果实验考察了本净化方法在气相色谱/电子捕获检测器(GC/ECD)上的适用性。由于葱属蔬菜样品含有大量的烷基硫代半胱氨酸、亚砜类化合物等及其活性酶,在完整的细胞内,酶与底物是分隔存在的。在制样过程中,细胞受损伤,酶作用于底物,产生大量挥发性硫基干扰物,是葱属蔬菜样品基质干扰的主要来源,且干扰物的含量远高于农残含量,在ECD检测器上响应值很大,因此这类样品被认为是极难分析的样品[12,14-15]。目前主要采用在制样前用磷酸或微波处理的方法来钝化样品中的活性酶[12],降低干扰,但磷酸处理法适用范围较窄,且不好解决采样代表性与称样精确度之间的矛盾,而微波处理法对实验条件要求比较苛刻,易导致农药降解,故本研究亦未采用。实验对以下两种方法进行对照研究(图3):①GB 23200.8-2016中的前处理方法(图3B),虽然该法中后续测试仪器为气相色谱质谱联用仪,但其中的Envi-18、Carb/NH2净化法代表了目前固相萃取法净化的主流;②QuEChERS净化法(图3C),代表了目前粉末分散净化的主流方法。图3B和C虽然基线、干扰峰数量大小等不完全相同,但其干扰均过大。实际上,目前的常规前处理方案处理大葱样品时,所得的ECD谱图均呈现与图3B和C类似的干扰。原因是常规净化方法中未针对葱属蔬菜中含有的大量挥发性硫基干扰物质进行特别净化,所以这些干扰物进入ECD检测器后产生众多干扰峰,无法进行定性定量分析。本法(图3A)针对三唑类农药中1,2,4-三唑基团在适当pH值条件下可结合质子形成阳离子的特点,优化吸附解吸附条件,可以针对性地除去这些干扰物质,获得很好的净化效果。
对于一般蔬菜水果(如菠菜、黄瓜、西红柿等),使用本法与常规前处理方法所得的ECD谱图无较大变化,只是总体杂质峰略少。这是因为对于一般蔬菜水果,其主要杂质使用常规前处理方法即可获得良好的净化效果,故结果差别不大。
由于有些三唑类农药在ECD检测器上无响应或响应极低,并且部分三唑类农药性质相近,无法完全分离,所以GC/ECD法测定三唑类农药有其固有缺陷。本实验同时测定15种三唑类农药多残留,在GC/ECD上既有无响应值的,也有重叠的,故本研究仅给出本前处理的净化方案在GC/ECD上适用性的考察结论,作为GC-MS法的补充。
对于GC/ECD法的应用,在确认所测三唑类农药标准溶液在GC/ECD上有足够响应值的前提下,本研究得出以下结论:①作为初筛方法(与标准溶液对照,若相应保留时间处无色谱峰,则初筛未检出,若有色谱峰,则应使用GC-MS法进行确证);②仅作为少量几个三唑类农药的定量分析方法。

图3 不同前处理方法所得大葱样品的GC/ECD色谱图Fig.3 Chromatograms of GC/ECD from scallion with different pretreatment methodsA:this method;B:GB 23200.8-2016 method;C:QuEChERS method

图4 空白大葱样品(a)及加标水平为0.05 mg/kg大葱样品(b)的GC/ECD色谱图Fig.4 Chromatograms of GC/ECD from blank scallion(a) and blank scallion spiked with 0.05 mg/kg mix standards(b)
图4给出了空白大葱和大葱加标样品的谱图,从图中信号与基线对比可见,对于选择性不高的ECD检测器来说,大葱样品能够获得非常满意的净化效果。
2.3 方法线性范围、定量下限、回收率与精密度
采用标准溶液测试,15种三唑类农药在0.01~1.0 mg/L范围内线性关系良好,r2>0.98。以加标样品10倍信噪比(S/N≥10)确定方法定量下限(LOQ),各农药的LOQ均可达到0.01 mg/kg。采用大葱、黄瓜、苹果样品进行加标回收率实验,加标水平为0.01、0.05、0.10 mg/kg,测定结果见表2,15种三唑类农药回收率在68%~102%之间。本实验采用基质标准曲线对基质效应进行了考察,发现15种三唑类农药的基质效应对回收率的影响均在13%以内,其中苯醚甲环唑的基质效应相对略强,在8%~13%之间,其它14种三唑类农药的基质效应均不明显,这主要得益于前处理的良好净化效果。目标物的RSD为2.4%~16.2%,其中添加水平为0.01 mg/kg样品的RSD值总体略大,这是由于浓度很低时,三唑类农药在前处理和仪器测定时波动性增大,导致精密度有所降低,但仍处于可接受范围内,0.05、0.10 mg/kg添加水平的精密度则有明显提高,总体RSD≤16.2%,结果满意。

表2 方法定量下限、回收率和精密度(n=6)Table 2 LOQ,recovery and RSD of the method(n=6)
(续表2)

No.CompoundLOQ(mg/kg)Spiked(mg/kg)ScallionCucumberAppleRecovery(%)RSD(%)Recovery(%)RSD(%)Recovery(%)RSD(%)3Pencnazole0 010 01905 7854 8868 90 05885 5817 1898 70 10893 9887 4893 14Triadimenol0 010 017212 17416 27110 40 05739 47013 7758 80 107010 26910 2688 55Paclobutrazol0 010 01897 4846 8727 60 05815 9817 1794 50 10824 1854 4775 16Myclobutanil0 010 01866 8809 0928 00 05876 6848 9895 90 10885 5874 2866 07Diclobutrazole0 010 01919 1918 58910 80 05855 7924 9936 70 10862 6846 1906 38Flusilazole0 010 01888 7837 7887 30 05928 0925 0847 20 10824 7875 4834 09Etaconazole0 010 01825 3787 3757 50 05875 8844 6844 80 10775 4893 2892 510Propiconazol0 010 01877 0779 4826 90 05766 8786 4897 10 10817 5892 8816 111Tebuconazole0 010 01789 4726 87611 30 057310 1794 5818 90 10826 6787 0837 212Fluotrimazole0 010 01948 3837 4938 80 05839 0846 6916 40 10827 1886 3884 413Epoxiconazole0 010 01918 1968 91026 70 05936 7895 5975 40 10973 7943 0952 414Bitertanol0 010 019413 710210 29915 00 05939 7898 88712 10 108810 0908 4899 915Difenoconazole0 010 0110010 21019 79211 70 05915 1995 8936 00 10903 6896 9856 7
2.4 实际样品分析
用本方法对市售大葱、菠菜、大白菜、春菜、青葱、黄瓜、荷兰豆、西红柿、苹果、香蕉样品各3份进行测定,结果在1份春菜和1份大白菜样品中检出苯醚甲环唑,含量分别为0.11 mg/kg和0.38 mg/kg,1份菠菜样品中检出氟硅唑0.44 mg/kg,1份荷兰豆样品中检出丙环唑0.045 mg/kg,其中春菜和荷兰豆样品谱图见图2,其它样品均未检出相关农药残留。
3 结 论
本研究针对三唑类农药中1,2,4-三唑基团在适当pH值条件下可结合质子形成阳离子的特点,通过优化吸附解吸附条件,建立了阳离子交换净化/气相色谱-质谱法测定蔬菜水果中15种三唑类农药残留的分析方法,效果良好。通过对本法在GC/ECD上的适用性考察发现,本前处理方法对于葱属蔬菜中含有的大量挥发性硫基干扰物质具有很好的净化效果,有效解决了目前农残分析中“调味蔬菜样品检测”的难点,除了应用于三唑类农药外,对其他相关农药也具有一定的借鉴意义。
[1] Hu Y Y,Xu H Q,Yao J,Lü Y N,Song W,Li W J,Han F,Zheng P.Chin.J.Anal.Chem.(胡艳云,徐慧群,姚剑,吕亚宁,宋伟,李文静,韩芳,郑平.分析化学),2014,42(2):227-232.
[2] Gao L,Li Y L,Liu B,Gao W H.JournaloftheChineseCerealsandOilsAssociation(高林,李亚丽,刘博,高文惠.中国粮油学报),2016,31(10):131-136.
[3] Ge N,Liu X M,Li X M,Huang X Z,Wu Y P,Li J,Liu Y M.J.Instrum.Anal.(葛娜,刘晓茂,李学民,黄学者,吴艳萍,李金,刘永明.分析测试学报),2011,30(12):1351-1355.
[4] Li J G,Wang Y F,Shi J W,Jiang L,Yao X P,Fang L Y.Chin.J.Chromatogr.(李继革,王玉飞,施家威,蒋丽,姚浔平,方兰云.色谱),2012,30(3):262-266.
[5] Wang F,Li T,Ma C.Chin.J.Chromatogr.(王菲,李彤,马辰.色谱),2013,31(3):191-199.
[6] Su J F,Zhong M S,Chen J,Guo X,Chen J X,Liang Z,Liu J J.J.Instrum.Anal.(苏建峰,钟茂生,陈晶,郭昕,陈劲星,梁震,刘建军.分析测试学报),2015,34(6):625-638.
[7] Pang G F,Cao Y Z,Zhang J L,Fan C L,Liu Y M,Li X M,Jia G Q,Li Z Y,Shi Y Q,Wu Y P,Guo T T.J.Chromatogr.A,2006,1125:1-30.
[8] Pang G F,Fan C L,Chang Q Y,Li Y,Kang J,Wang W W,Cao J,Zhao Y B,Li N,Li Z Y,Chen Z M,Luo F J,Lou Z Y.J.AOACInt.,2013,96(4):887-896.
[9] Fan C L,Chang Q Y,Pang G F,Li Z Y,Kang J,Pan G Q,Zheng S Z,Wang W W,Yao C C,Ji X X.J.AOACInt.,2013,96(2):432-440.
[10] Hou X H,Zheng X,Zhang C L,Ma X W,Ling Q Y,Zhao L S.J.Chromatogr.B,2014,969:123-127.
[11] Liu D,Min S G.J.Chromatogr.A,2012,1235:166-173.
[12] Su J F,Lu S Y,Chen J,Chen J X,Liang Z,Liu J J.Chin.J.Chromatogr.(苏建峰,卢声宇,陈晶,陈劲星,梁震,刘建军.色谱),2011,29(7):643-655.
[13] GB 23200.8-2016.National Food Safety Standards-Determination of 500 Pesticides and Related Chemicals Residues in Fruits and Vegetables by Gas Chromatography-Mass Spectrometry(食品安全国家标准 水果和蔬菜中500种农药及相关化学品残留量的测定 气相色谱-质谱法).
[14] Ji S J,Liu C J,Sato M,Li D X,Li J Q.Phys.Test.Chem.Anal.:Chem.Anal.(纪淑娟,刘长江,佐藤元昭,李冬秀,李俊奇.理化检验-化学分册),2006,42(11):914-917.
[15] Zhang H,Chen Z L,Yang G S,Wang W Z,Li X Q,Li R J,Wu Y J.FoodChem.,2008,108(1):322-328.
Determination of 15 Triazole Pesticides in Vegetables and Fruits by Gas Chromatography and Gas Chromatography-Mass Spectrometry
XU Tian-jun1,SU Jian-feng2*
(1.School of Chemical Engineering,Eastern Liaoning University,Dandong 118003,China;2.Fujian CCIC-Fairreach Food Safety Testing Co.,Ltd.,Fuzhou 350008,China)
A method was developed for the determination of 15 triazole pesticides in vegetables and fruits by gas chromatography(GC) and gas chromatography-mass spectrometry(GC-MS) with ion exchange column.The samples were pretreated quickly,then extracted with acetonitrile after sodium chloride homogenization,separated by liquid-liquid partition.The clear supernatant purified by solid phase extraction with ion exchange column was ready for GC-ECD and GC-MS analysis.Determinations were performed by using selected ion monitoring(SIM) mode,and external standard method was used for quantification.After optimizing the conditions for pretreatment and determination,the method was convenient and rapid.Under the optimal conditions,the quantitation limits of the method(S/N≥10) were 0.01 mg/kg.The recoveries at spiked levels of 0.01,0.05,0.10 mg/kg were in the range of 68%-102% with the relative standard deviations of 2.4%-16.2%.Besides,the pretreatment has a good purification effect in GC-ECD chromatogram.The method is easy,rapid and sensitive,and could meet the requirements for the analysis of 15 triazole pesticides in vegetables and fruits.
solid phase extraction(SPE);gas chromatography;gas chromatography-mass spectrometry;triazole fungicides;triazole plant growth mediations;vegetables and fruits
2017-08-22;
2017-09-25
辽宁省科技厅项目(2016LD0112)
*
苏建峰,高级工程师,研究方向:食品中污染物残留分析,E-mail:sujianfeng2005@163.com
10.3969/j.issn.1004-4957.2017.12.009
O657.7;O657.63
A
1004-4957(2017)12-1469-07
