枸杞种质资源遗传多样性的iPBS分析
2017-12-25赵建华王亚军戴国礼曹有龙
尹 跃, 安 巍, 赵建华, 王亚军, 何 军, 戴国礼, 曹有龙
(宁夏农林科学院国家枸杞工程技术研究中心,宁夏 银川 750002)
枸杞种质资源遗传多样性的iPBS分析
尹 跃, 安 巍, 赵建华, 王亚军, 何 军, 戴国礼, 曹有龙
(宁夏农林科学院国家枸杞工程技术研究中心,宁夏 银川 750002)
采用引物结合位点扩增(iPBS)分子标记技术对34份枸杞种质资源进行遗传多样性分析.从83条iPBS引物中筛选出11条引物分别对34份枸杞种质基因组DNA进行扩增,共检测到91条清晰谱带,其中,多态性条带89条,多态性比率为97.8%,平均多态信息含量为0.46.采用POPGENE软件计算34份种质的平均有效等位基因数为1.570,平均Nei′s基因多样性指数为0.327,平均Shannon信息指数为0.489,表明34份种质具有丰富的遗传多样性.采用NTSYS-pc软件计算得到34份种质间的遗传相似系数为0.56~0.93,非加权组平均法(UPGMA)聚类分析结果表明,遗传相似系数为0.65时,可将34份种质分成5大类群,反映出栽培品种与野生种质遗传差异大,亲缘关系较远.iPBS分子标记可有效用于枸杞种质资源遗传多样性分析.
枸杞; iPBS分子标记; 遗传多样性
枸杞(LyciumbararumL.)为茄科枸杞属多年生落叶灌木植物,全球约有80种,呈离散性分布,主要分布在南美洲南部、北美洲南部、非洲南部和欧亚大陆[1].我国有枸杞属的7个种和3个变种,其中,宁夏枸杞主要分布在我国西部,中国枸杞分布在我国东部地区.我国枸杞栽培历史悠久,种植面积、产量和出口量均位居世界首位[2].通过人工选育及在不同生态环境条件下,已形成了丰富的品种、品系及野生种质等类型资源[3],为有效利用这些资源开展枸杞种质资源遗传多样性研究是枸杞新品种选育的基础.
DNA分子标记技术是当前植物资源遗传多样性评价的强有力工具,尤其是基于PCR基础的分子标记已广泛应用在植物遗传多样性分析[4].近年来,采用RAPD、AFLP、ISSR、SSR和SCoT等标记技术[5-11]开展枸杞种质资源遗传多样性评价,为枸杞种质资源利用及保存提供技术支撑.
随着高通量测序和生物信息学技术的飞速发展,基于植物反转录转座子开发的分子标记比常规分子标记更具有优势[12],并已成功应用于基因作图、生物多样性与系统进化和品种鉴定等研究领域[13].基于PCR基础的反转录转座子分子标记类型有引物结合位点扩增( inter-primer binding site, iPBS)、SSAP、REMAP和RBIP[14].其中,iPBS是以长末端重复序列(long terminal repeats, LTRs)类反转录转座子保守位点设计引物进行扩增的一种新型分子标记技术,针对LTR类反转录转座子中2个PBS(引物结合位点)区间进行扩增[15].该方法简单、有效及不用预先获知LTR序列.同时,与传统分子标记技术(RAPD、ISSR和AFLP)相比,iPBS分子标记的品种鉴别能力更强[16].目前,iPBS分子标记已广泛应用于葡萄、牡丹、海枣、豌豆和杨梅等植物的品种鉴定、遗传结构和遗传多样性分析[17-22],而对枸杞的相关研究尚未见报道.
本试验采用iPBS分子标记对34份枸杞种质资源进行遗传多样性分析,在分子水平上确定这些种质间的亲缘关系,旨在为枸杞育种中的亲本选配和利用提供参考.
1 材料与方法
1.1 材料
34份枸杞种质资源分别为来自宁夏、新疆、河北、四川、青海和云南等8个省(自治区)的栽培品种、地方品种及野生种(表1),均保存于国家枸杞工程技术研究中心枸杞种质资源圃(38°38′49″N,106°9′10″E).
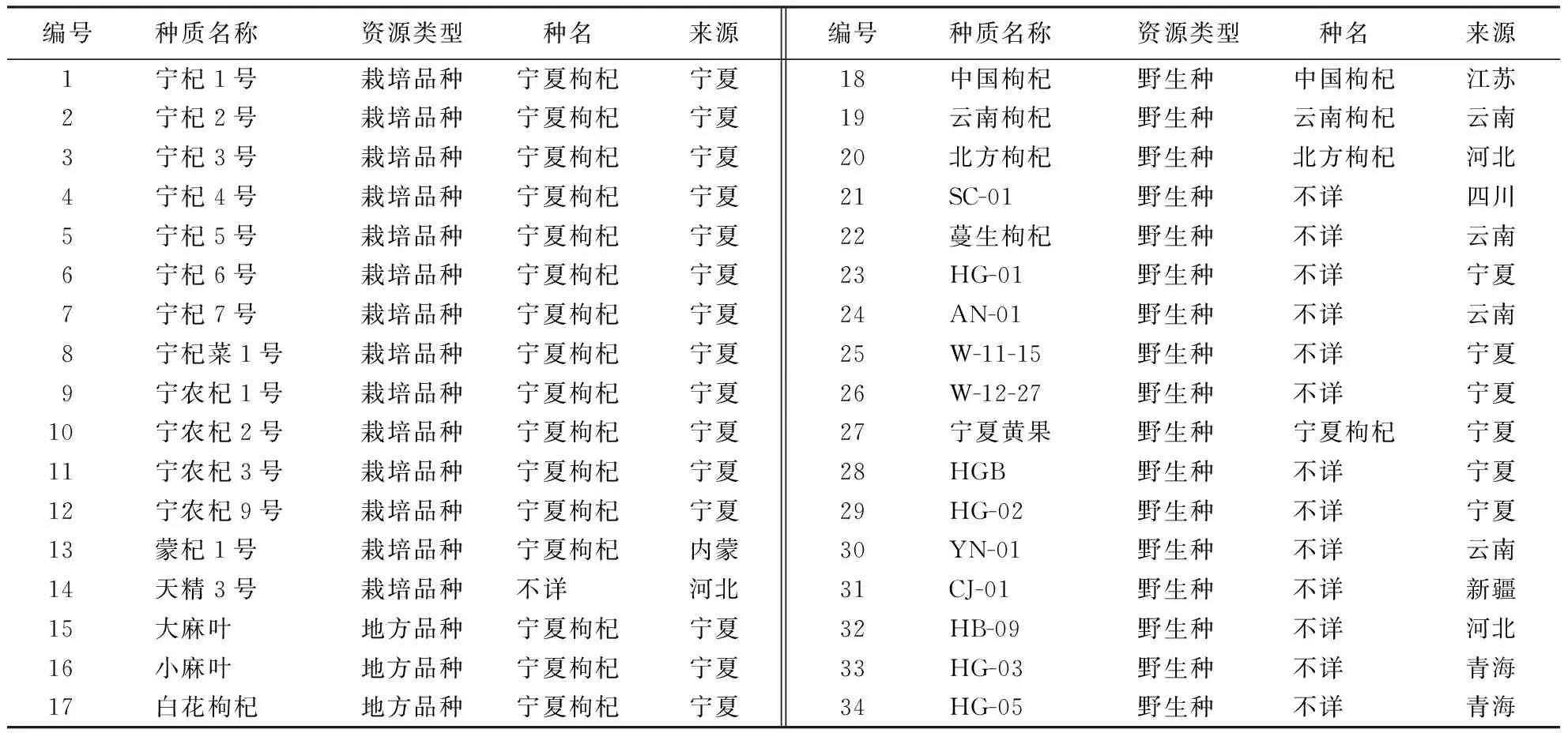
表1 34份枸杞种质的类型及来源Table 1 Basic information of wolfberry materials used for analysis
2016年4月选取幼嫩的健康叶片置于液氮中带回实验室,保存于-80 ℃冰箱中,用于基因组DNA的提取.
1.2 方法
1.2.1 基因组DNA的提取 采用基因组DNA试剂盒(北京天根生化科技有限公司)提取幼嫩叶片基因组DNA, BioPhotometer plus型核酸蛋白检测仪(德国艾本德公司)检测DNA的浓度和纯度,0.8%琼脂糖凝胶电泳检测DNA的质量,并将母液稀释至50 ng·μL-1用于后续的PCR扩增试验.
1.2.2 iPBS-PCR分析 iPBS引物序列来源于文献[15],由上海捷瑞生物工程有限公司合成.PCR扩增在PTC-200型PCR仪(美国伯乐生物公司)上进行,扩增体系和程序参考文献[15],并略有修改.扩增体系25 μL:12.5 μL 2×Taq Plus Master Mix、1.5 μL模板DNA、1.5 μL 10 μmol·L-1引物,剩余用ddH2O补足至25 μL .扩增程序:94 ℃ 3 min;94 ℃ 10 s,50~60 ℃ 60 s,72 ℃ 60 s,32个循环;72 ℃ 5 min,16 ℃保存.
扩增结束后,取6 μL扩增产物加1.5 μL DNA上样缓冲液并离心混匀,经1.6%琼脂糖凝胶电泳检测(电泳缓冲液为1×TAE),EB染色后用Alpa Innotech型凝胶成像仪(美国Alpa Innotech公司)获取,并进行分析.
1.3 数据统计
根据对应的iPBS扩增条带的有无记录条带,有扩增条带的记为1,无扩增条带的记为0,形成(0,1)二元数据矩阵.只统计扩增条带清晰、多态性高的引物.多态性比率/%=多态性条带数/总条带数×100.由于iPBS标记为显性标记,多态信息含量(PIC)按照以下公式计算[23].PICb=1-(p2+q2),式中,p为iPBS引物第b个带出现(1)的频率,q为iPBS引物第b个带出现(0)的频率.显性标记的PIC最大,为0.5,当p=q=0.5.
采用POPGENE软件计算观察等位基因数、有效等位基因数、Nei′s基因多样性指数和Shannon信息指数[24].采用NTSYS-pc 2.1软件的SIMQUAL模块计算遗传相似系数,采用SHAN模块非加权组平均法(unweighted pair-group method with arithmetic means, UPGMA)进行聚类分析[25].
2 结果与分析
2.1 83条iPBS引物的筛选结果

表2 遗传多样性分析的iPBS引物序列Table 2 Inter-primer biding primer sequences for genetic relationship analysis
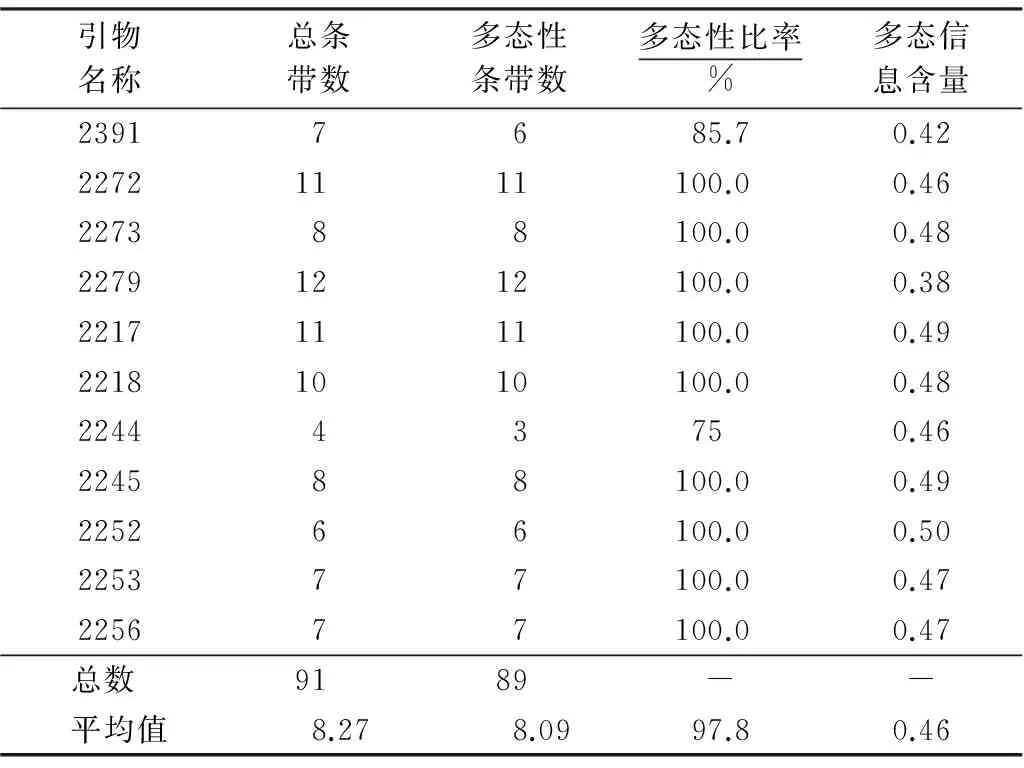
表3 11条iPBS引物多态性扩增结果Table 3 The polymorphic amplification of 11 iPBS primers
应用合成的83条iPBS引物对表型性状差异较大和亲缘关系较远的宁杞1号、中国枸杞、宁杞菜1号和云南枸杞等4份种质进行iPBS-PCR扩增,筛选出具有多态性好、扩增条带清晰的引物11条(表2),用于34份枸杞种质遗传多样性分析.
2.2 11条iPBS引物的多态性
从表3可见,11条iPBS引物在34份枸杞种质中共扩增出91个条带.其中,89条为多态性条带;每条引物可扩增出条带数4~12个,平均8.27个;每条引物可扩增出多态性条带数3~12个,平均8.09个;每条引物多态性比率为75%~100%,平均97.8%;多态信息含量为0.38~0.50,平均0.46.引物2217和2218对34份种质扩增的琼脂糖凝胶电泳图谱分别见图1和2.
2.3 iPBS的遗传多样性
采用POPGENE软件计算,34份枸杞种质的平均观察等位基因数为1.989,平均有效等位基因数为1.570,平均Nei′s基因多样性指数为0.327,平均Shannon信息指数为0.489.各位点遗传多样性程度也存在较大差别,有效等位基因最大值为1.998,最小值为1.000;Nei′s基因多样性指数最大值为0.499,最小值为0.029;Shannon信息指数最大值为0.689,最小值为0.077.表明34份种质间存在丰富的遗传多样性.
2.4 iPBS的聚类分析
采用NTSYS-pc 2.1软件计算34份枸杞种质的遗传相似系数,采用UPGMA构建聚类树.从图3可见:34份种质基因型的遗传相似系数为0.56~0.93;当遗传相似系数为0.65时可将34份种质划分为5大类群.
第Ⅰ大类群包括宁杞1号、小麻叶、大麻叶和宁杞3号等24份种质,其中,宁杞1号、小麻叶和大麻叶等17份种质为栽培品种,均为宁夏枸杞属,亲缘关系较近,这与系圃来源相关.而宁夏黄果、YN-01、中国枸杞、CJ-01、HG-05、W-11-15、W-12-27和HGB等8份种质为野生资源,与栽培品种聚类在一起,说明它们与栽培品种间的基因交流比较频繁.
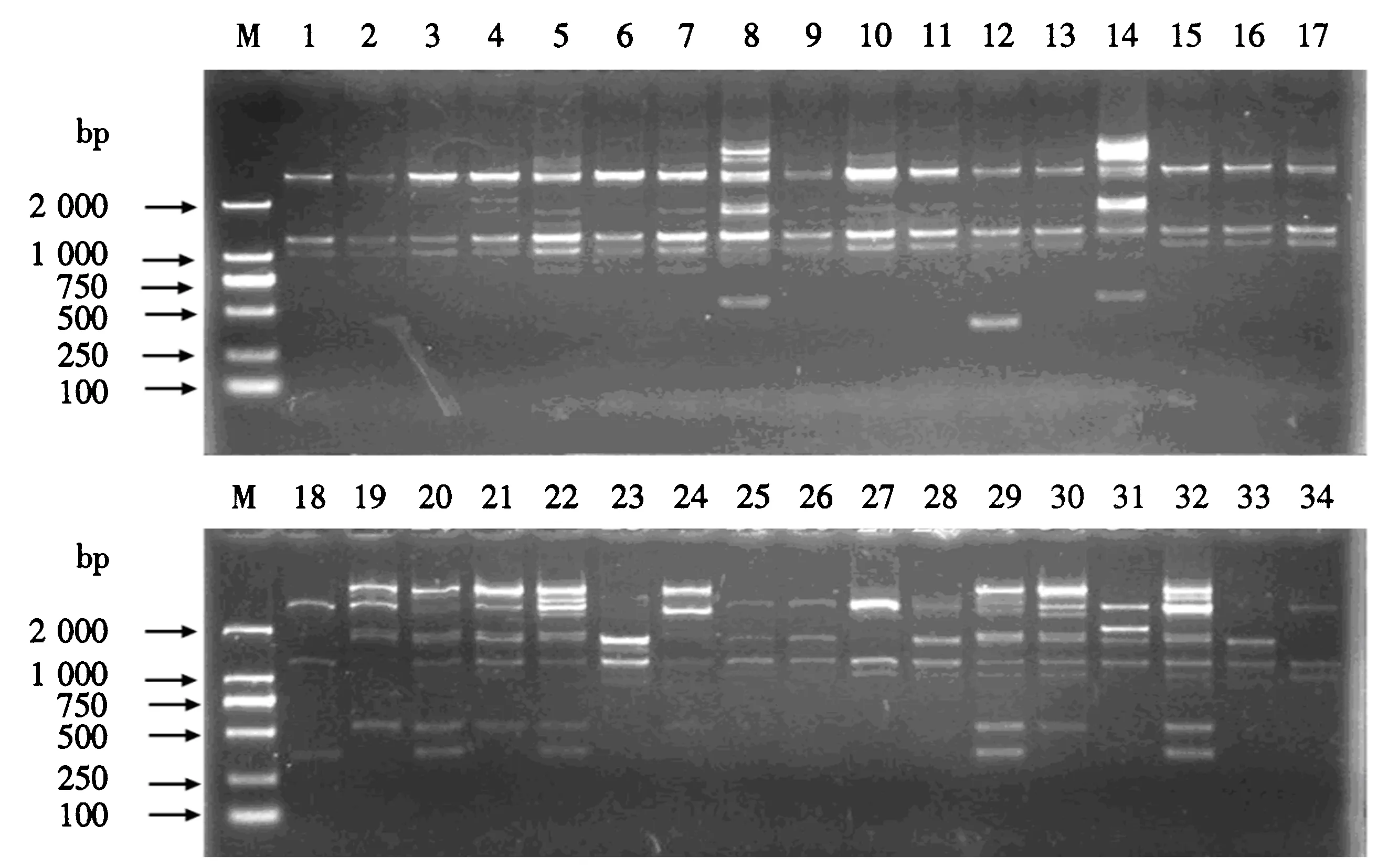
M:DL2000 DNA Marker;1~34为种质编号(与表1的编号对应).图1 引物2217的PCR扩增结果Fig.1 Electropherogram of PCR amplified 2217 iPBS primer
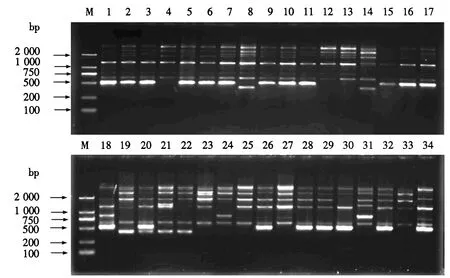
M:DL2000 DNA Marker ;1~34为种质编号(与表1的编号对应).图2 引物2218的PCR扩增结果Fig.2 Electropherogram of PCR amplified 2218 iPBS primer
第Ⅱ大类群包括天精3号、云南枸杞、SC-01、北方枸杞、HG-02、蔓生枸杞和HB-09等7份种质,这7份种质均为野生资源,均表现出枝条匍匐性强、叶片大、叶色深绿色等形态特征.
第Ⅲ、Ⅳ和Ⅴ大类群仅有1份种质,分别为HG-01、HG-03和AN-01,这3份种质也均为引进的野生资源,与其他种质的叶片、果实等表型性状差异较大.
3 讨论
iPBS是一类基于反转录转座子基础的新型分子标记技术,其实验操作过程简单,扩增结果重复性好,且多态性高.本试验从83条iPBS引物中筛选出11条扩增条带清晰、多态性高的iPBS引物,对34份枸杞种质进行扩增,共检测到91个条带,其中,89个为多态性条带,平均多态性比率为97.8%,均高于ISSR标记(7个ISSR引物对115个样品扩增,多态性比率为78.1%)[7]和SRAP标记(12对SRAP引物对30份种质扩增,多态性比率为84.61%)[26].本试验结果进一步说明,iPBS标记是一种基于PCR基础上的简单高效、扩增多态性较高的分子标记.尽管采用1个iPBS标记不能将34份枸杞种质区分开来,这可能与供试种质系谱来源有关.本试验所选用的品种都是通过群体选优,如宁杞1号和宁杞2号均为从大麻叶群体中选育出的优良品种;而采用多对引物组合可将所有材料区分开,如引物2217、2218、2245和2252.因此,iPBS标记可以有效地揭示枸杞种质资源的遗传多样性.
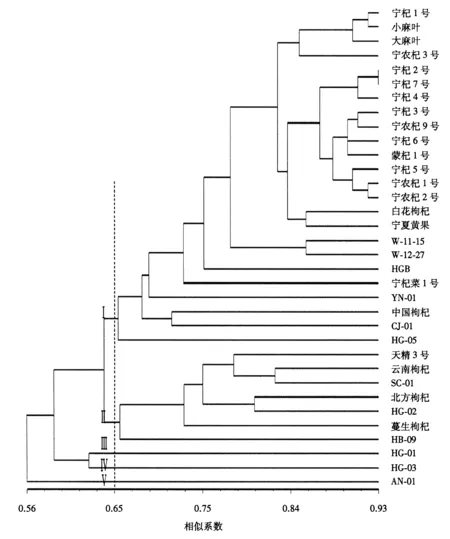
图3 基于11个iPBS引物的34份枸杞种质UPGMA聚类图Fig.3 UPGMA dendrogram of 34 materials based on 11 iPBS primers
iPBS聚类分析表明:遗传相似系数为0.65时,可将34份枸杞种质分为5大类群.第Ⅰ大类群主要为栽培品种,包括宁夏黄果、中国枸杞、W-11-15、W-12-27、HGB、CJ-01、YN-01和HG-05等8份野生种质,这8份种质与栽培品种的亲缘关系较近,这些种质的表型性状、生长习性和结果习性相似.YN-01是从云南引进的野生种质,宁杞菜1号是野生枸杞与宁夏枸杞杂交选育的新品种[27],均表现为叶片肥大、枝条生长力强等特点.HGB、宁夏黄果、W-11-15和W-12-27的果色均为黄色,果形近圆形.CJ-01、HG-05和中国枸杞的果形为圆形,结果习性相似[3].聚类分析结果一方面反映出栽培品种与野生种质的遗传差异较大,亲缘关系较远,栽培品种间的遗传差异较小,亲缘关系较近;另一方面说明栽培品种与部分野生种质可能存在基因交流现象,这与SSR标记的聚类结果[28]相一致.同时,枸杞属于常异花授粉植物,基因型高度杂合,主要采用单株选优、无性扩繁(嫩枝和硬质扦插)方式繁育,经过长期积累使得栽培品种的遗传背景复杂,遗传基础比较狭窄.因此,建议在今后的新种质创制中应加大杂交选育力度,丰富枸杞种质的基因型,保护我国枸杞种质资源的遗传多样性.
[1] FUKUDA T, YOKOYAMA J, OHASHI H. Phylogeny and biogeography of the genusLycium(Solanaceae): inferences from chloroplast DNA sequences [J]. Molecular Phylogenetics and Evolution, 2001,19(2):246-258.
[2] 利河伯,姜丽.枸杞出口趋势分析[J].中国现代中药,2014,16(3):244-246.
[3] 曹有龙,巫鹏举.中国枸杞种质资源[M].北京:中国林业出版社,2014:86-134.
[4] AGARWAL M, SHRIVASTAVA N, PADH H. Advances in molecular marker techniques and their applications in plant sciences [J]. Plant Cell Reports, 2008,27(4):617-631.
[5] CHENG K, CHANG H, HUANG H. RAPD analysis ofLyciumbararummedicine in Taiwan market [J]. Botanical Bulletin of Academia Sinica, 2000,41(1):11-14.
[6] 王锦楠,陈进福,陈武生,等.柴达木地区野生黑果枸杞种群遗传多样性的AFLP分析[J].植物生态学报,2015,39(10):1 003-1 011.
[7] 阿力同·其米克,王青锋,杨春锋,等.新疆产药用植物黑果枸杞遗传多样性的ISSR分析[J].植物科学学报,2013,31(5):517-524.
[8] ZHAO W G, CHUNG J W, CHO Y I, et al. Molecular genetic diversity and population structure inLyciumaccessions using SSR markers [J]. Comptes Rendus Biologies, 2010,333(11-12):793-800.
[9] CHEN H K, ZHONG Y. Microsatellite markers forLyciumruthenicum(Solanaceae) [J]. Mol Biol Rep, 2014,41(9):5 545-5 548.
[10] 安巍,王亚军,尹跃,等.枸杞种质资源的SRAP分析[J].浙江农业学报,2013,25(6):1 234-1 237.
[11] 查美琴,赵玉玲,李疆,等.新疆枸杞种质资源遗传多样性分析及DNA指纹图谱构建[J].植物遗传资源学报,2016,17(6):1 065-1 071.
[12] ALZOHAIRY A M, GYULAI G, RAMADAN M F, et al. Retrotransposon-based molecular markers for assessment of genomic diversity [J]. Functional Plant Biology, 2014,41(8):781-789.
[13] 汪尚,索娜娜,赵红燕,等.反转录转座子分子标记及其在植物研究中的应用[J].杭州师范大学学报(自然科学版),2012,11(5):410-415.
[14] POCZAI P, VARGA I, LAOS M, et al. Advances in plant gene-targeted and functional markers: a review [J]. Plant Methods, 2013,9(1):6.
[15] KALENDAR R, ANTONIUS K, SMYKAL P, et al. iPBS: a universal method for DNA fingerprinting and retrotransposon isolation [J]. Theoretical and Applied Genetics , 2010,121(8):1 419-1 430.
[16] BERNET G P, ASINS M J. Identification and genomic distribution of gypsy like retrotransposons inCitrusandPoncirus[J]. Theoretical and Applied Genetics, 2003,108(1):121-130.
[17] GUO D L, GUO M X, HOU X G, et al. Molecular diversity analysis of grape varieties based on iPBS markers [J]. Biochemical Systematics and Ecology, 2014,52:27-32.
[18] DUAN Y B, GUO D L, GUO L L, et al. Genetic diversity analysis of tree peony germplasm using iPBS markers [J]. Genetics and Molecular Research, 2015,14(3):7 556-7 566.
[19] AL-NAJM A, LUO S, AHMAD N M, et al. Molecular variability and genetic relationships of date palm (PhoenixdactyliferaL.) cultivars based on inter-primer binding site (iPBS) markers [J]. Australian Journal of Crop Science, 2016,10(5):732-740.
[20] BALOCH F S, ALSALEH A, DE MIERA L E S, et al. DNA based iPBS-retrotransposon markers for investigating the population structure of pea (Pisumsativum) germplasm from Turkey [J]. Biochemical Systematics and Ecology, 2015,61:244-252.
[21] CHEN F Y, LIU J H. Germplasm genetic diversity ofMyricarubrain Zhejiang Province studied using inter-primer binding site and start codon-targeted polymorphism markers [J]. Scientia Horticulturae, 2014,170:169-175.
[22] 王文婷.基于EST-SSR和iPBS标记的杨梅遗传多样性研究[D].杭州:浙江大学,2016.
[23] HINZE L L, FANG D D, GORE M A, et al. Molecular characterization of theGossypiumdiversity reference set of the US National Cotton Germplasm Collection [J]. Theoretical and Applied Genetics, 2015,128(2):313-327.
[24] YEH F C, BOYLE T J B. Population genetic analysis of co-dominant and dominant markers and quantitative traits [J]. Belgian Journal of Botany, 1997,129:157.
[25] ROHLF F J. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System [M]. New York: Applied Biostatistics Inc., 1992.
[26] 查美琴,赵玉玲,李疆,等.新疆枸杞种质资源遗传多样性的SRAP分析[J].西北植物学报,2016,36(4):681-687.
[27] 李润淮,石志刚,安巍,等.菜用枸杞新品种宁杞菜1号[J].中国蔬菜,2002(5):48.
[28] 尹跃,安巍,赵建华,等.枸杞品种SSR荧光指纹图谱构建及遗传关系分析[J].西北林学院学报,2017,32(1):137-141.
GeneticdiversityanalysisofwolfberrygermplasmusingiPBSmakers
YIN Yue, AN Wei, ZHAO Jianhua, WANG Yajun, HE Jun, DAI Guoli, CAO Youlong
(Ningxia Academy of Agriculture and Forestry Sciences, National Wolfberry Engineering Research Center, Yinchuan, Ningxia 750002, China)
The genetic diversity among 34 wolfberry germplasm resources were analyzed using an inter-primer binding site (iPBS) molecular marker. Eleven primers were screened from 83 iPBS primers to amplify the genomic DNA of the tested materials. A total of 91 scorable bands were detected, of which 89 bands were polymorphic (97.8%). The average value of polymorphic information content was 0.46. By POPGENE software, average value of effective number of alleles, Nei′s gene diversity and Shannon′s information index was 1.570, 0.327 and 0.489, respectively, indicating that a high level of genetic diversity among 34 wolfberry germplasm. The similarity coefficient among 34 germplasm ranged from 0.56 to 0.93 by NTSYS-pc software. Based on unweighted pair group method with arithmetic means(UPGMA) cluster analysis, 34 tested germplasm could be divided into 5 groups when genetic similarity was 0.65. In conclusion, the genetic relationship of cultivars tested were not close to wild germplasm resources. The iPBS molecular markers can be effectively used for genetic diversity analysis of wolfberry germplasm resources and provide theoretical and technical support for scientific management and utilization of wolfberry germplasm resources.
wolfberry; iPBS molecular markers; genetic diversity
2017-05-02
2017-06-11
国家林木种质资源平台建设项目(2005DKA21003);宁夏农业特色优势产业新品种选育专项(2013NYYZ0101).
尹跃(1985-),男,研究实习员,硕士.研究方向:枸杞分子标记辅助育种.Email:yueyin0112@aliyun.com.通讯作者曹有龙(1963-),男,研究员,硕士生导师.研究方向:枸杞生物技术、育种.Email:youlongchk@163.com.
S567.1+9
A
1671-5470(2017)06-0612-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.003
(责任编辑:施晓棠)
