热缺血时间对循环停止猪心供体冠状动脉内皮功能的影响
2017-12-20苏阳秦广启廖秋明StigSteen乔晨晖
苏阳 秦广启 廖秋明 Stig Steen 乔晨晖
(1.郑州大学第一附属医院 心外科 河南 郑州 450052;2.隆德大学医院 心胸外科 瑞典 22594)
热缺血时间对循环停止猪心供体冠状动脉内皮功能的影响
苏阳1秦广启2廖秋明2Stig Steen2乔晨晖1
(1.郑州大学第一附属医院 心外科 河南 郑州 450052;2.隆德大学医院 心胸外科 瑞典 22594)
目的探究热缺血时间对循环停止猪心供体(DCD)冠状动脉内皮细胞功能的影响。方法将18头健康瑞典家猪随机分为对照组、热缺血30 min组、热缺血40 min组,每组6只。将对照组冠状动脉前降支远端血管截成血管环进行器官浴槽实验;另外两组采用腔静脉插管将循环血液排空建立失血DCD模型,将心脏遗留在胸腔内,分别在30 min和40 min后进行器官浴槽实验(方法同对照组)。比较3组内皮依赖性舒张功能(EDR)。结果对照组、热缺血30 min组和热缺血40 min组最大内皮依赖性舒张百分数(EDRmax)分别为(95.72±0.95)%、(95.09±0.85)% 和(94.41±1.06)%,3组EDRmax比较,差异无统计学意义(P>0.05)。对照组、热缺血30 min组和热缺血40 min组P物质半最大效应浓度负对数(pEC50)分别为(6.53± 0.07)%、(6.43±0.02)%和(6.38±0.04)%,3组pEC50比较,差异无统计学意义(P>0.05)。结论在实验条件下,热缺血30 min及40 min对猪循环停止猪心供体冠状动脉内皮细胞功能无显著影响。
循环停止供体;热缺血;内皮细胞;心脏移植
器官移植是各器官终末期疾病的有效治疗手段,然而供体器官的缺乏仍旧是制约器官移植发展的主要问题。为了填补器官需求与供体数量的缺口,循环停止供体(donation after circulatory death,DCD)又重新回归医学视野。Ali等[1]使用猪心进行循环停止实验,结果显示DCD供心移植术后心室功能恢复正常;Tolboom等[2]通过体外灌注装置研究证实DCD供心的热缺血损伤可以恢复。DCD供体可作为肝、肾来源已得到临床证实和应用[3-4]。由于心脏生理代谢的特殊性及DCD供体引起的不可避免性热缺血损伤,DCD供心的临床可行性需要进一步研究[5]。本研究通过探讨不同热缺血时间对冠状动脉内皮功能的影响,为DCD供心的临床可行性提供理论依据。
1 材料与方法
1.1实验动物雌雄不限的健康家猪18头,体质量为25~30 kg,由瑞典隆德大学医院实验中心提供。本实验通过了隆德大学实验动物伦理委员会批准,在隆德大学心胸外科实验室完成。
1.2药品和溶液Krebs-Ringer缓冲液(含NaCl 119 mmol/L,NaHCO315 mmol/L,KCl 4.6 mmol/L,NaH2PO41.2 mmol/L,MgCl21.2 mmol/L,CaCl21.5mmol/L,葡萄糖11 mmol/L);高K+的Krebs-Ringer缓冲液(含KCl 127mmol/L,NaHCO315 mmol/L,KCl 4.6 mmol/L,NaH2PO41.2 mmol/L,MgCl21.2 mmol/L,CaCl21.5 mmol/L,葡萄糖11 mmol/L);血栓烷A2受体激动剂U-46619;P物质;罂粟碱。
1.3主要仪器7E型Grass polygraph及FT03D型张力传感器(美国Grass Instrument公司);手术显微镜(德国Zeiss公司);手术器械。
1.4实验方法
1.4.1实验分组 按照随机数表法将18头猪随机分为3组,对照组、DCD 30 min组、DCD 40 min组,每组6头。
1.4.2冠状动脉切取 麻醉后,将气管切开进行气管插管,机械通气,吸入氧浓度50%,频率20次/min,潮气量250~300 ml,呼气末正压5 cm H2O。游离一侧颈内动静脉,穿刺置管行血压监测及建立静脉通路。正中开胸,打开心包,充分暴露心脏,全身肝素化。对照组直接切取带周围组织的冠状动脉后放入4 ℃ Krebs-Ringer缓冲液中,立即在显微镜下分离冠状动脉并行器官浴槽实验。DCD 30 min组和DCD 40 min组行下腔静脉插管,排空血液后不做任何操作,待30 min和40 min后分别切取带周围组织的冠状动脉放入4 ℃ Krebs-Ringer缓冲液中,并立即使用同样的方法分离冠状动脉进行器官浴槽实验。
1.4.3冠状动脉环的制作 各组均应用手术显微镜及显微器械,遵循无创分离的原则,游离冠状动脉前降支远端1/3血管(外径1.0~1.5 mm),截成2~3 mm的血管环。
1.4.4冠状动脉功能测定 ①器官浴槽的容积为5 ml,内盛有37.0 ℃的Krebs-Ringer缓冲液,持续通以体积分数95%的O2和体积分数5%包含CO2的混合气体,维持Krebs-Ringer缓冲液的pH在7.4左右。浴槽周围空腔持续循环37.0 ℃恒温水浴锅加热的蒸馏水以维持系统恒温。浴槽内的溶液每15 min更换1次。②将血管环悬挂于浴槽内的两个L型金属挂钩上,一端连接7E型Grass polygraph与张力传感器在电脑上记录数据,另一端可反复移动调节冠状动脉环位置以调节其张力维持在基础张力。③待血管张力稳定后,先以高K+Krebs-Ringer缓冲液置换浴槽内液体,待收缩达峰值后,用Krebs-Ringer缓冲液洗涤血管环到基础张力。重复上述步骤1次。待血管环基础张力稳定后,向浴槽内加入50 μl浓度为5.7×10-7mol/L的U-46619诱导血管环预收缩,待收缩达到平台期后,用Krebs-Ringer缓冲液换洗浴槽内的液体,至血管环恢复基础张力。再次加入同剂量、同浓度的U-46619诱导第2次收缩,记录稳定时的张力值,即预收缩值。④当血管环收缩达预收缩值并稳定后,依次加入50 μl浓度从10-10~10-4mol/L梯度递增的P物质诱导EDR。观察并记算各浓度下P物质诱导舒张值占预收缩值百分比、EDRmax、pEC50。最后加入50 μl的罂粟碱(10-4mmol/L)诱导完全舒张。

2 结果
2.1冠状动脉环内径基础张力下,对照组、热缺血30 min组和热缺血40 min组冠状动脉内径分别是(1.37±0.08)、(1.43±0.07)、(1.35 ±0.12)mm,3组冠状动脉内径比较,差异无统计学意义(F=0.837,P>0.05)。
2.2EDR3组EDRmax以及pEC50比较,差异均无统计学意义(P>0.05)。见表1。
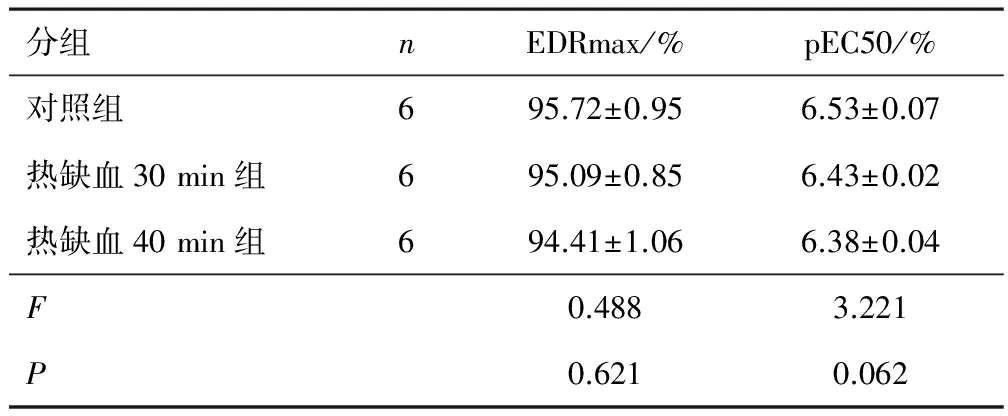
表1 3组EDRmax、pEC50比较
3 讨论
近年来,可用于移植的器官数量相对稳定而等待移植患者数量的持续增加使DCD供体可行性成为新的研究热点[6]。相关实验研究对DCD供心可行性给出了肯定的答案,但是心脏耐受热缺血时间的上限仍无定论[7-10]。Dhital等[7]成功地使用DCD供心完成3例移植手术,供体热缺血时间分别为28、25、22 min,术后心功能恢复正常;Iyer等[8]对DCD供心体外灌注保存液,观察到热缺血时间30 min的供心功能可完全恢复,热缺血时间40 min的供心功能部分恢复;Osaki等[9]证实热缺血时间低于40 min的DCD供心具有和脑死亡供心一样的恢复潜能。这些实验研究都给DCD供心的临床使用可能性提供了依据。
DCD供心的损伤主要来自于热缺血,在器官获取时不可避免的热缺血过程对供心损伤的程度及损伤能否被修复等方面的担忧是阻碍DCD供体应用的原因[10]。暴露在热缺血过程中的心脏由于缺氧、低灌注及能量代谢紊乱等,可对心肌功能和冠状动脉内皮功能产生损伤。在器官移植及移植后一段时期内,血管内皮功能对移植物的存活和功能恢复起决定性的作用[11]。通过浴槽实验测定EDR可以实现对冠状动脉内皮功能的评估。本研究通过失血法建立DCD模型,3组EDRmax以及pEC50比较,差异无统计学意义(P>0.05)。提示热缺血30 min和40 min对循环死亡猪心冠状动脉内皮细胞功能无明显影响。
DCD实验模型常用失血法或缺氧法建立,并且两种模型均可用来研究DCD供心热缺血过程的功能损伤。虽然缺氧法模拟临床情况,但是由于实验动物对缺氧的耐受能力不同,缺氧法诱导循环停止的时间会有所差异,可导致心脏的损伤程度不同,实验变量无法得到控制,而失血法诱导的循环停止供体采用迅速排空血液的方法,使心脏不经历负荷超载相关的损伤,所以对移植后心功能的恢复更有利,但是目前临床接受度不高。另外,本研究仅关注了冠状动脉内皮的功能,未关注热缺血是否导致心肌功能的损伤,需开展进一步相关的研究。
由于猪心的解剖结构和生理功能与人具有很大的相似性,所以本研究所得结果对于DCD供心的临床使用具有一定的指导意义。DCD供心的临床推广不仅需要新技术如体外灌注技术的发展,还要协同心肌保护技术和移植后药物治疗等的进一步研究。
综上,热缺血30 min及40 min对猪心冠状动脉内皮功能无明显损伤,对循环停止供体心脏的使用提供了相应的实验依据。
[1] Ali A A,White P,Xiang B,et al.Hearts From DCD Donors Display Acceptable Biventricular Function After Heart Transplantation in Pigs[J].Am J Transplant,2011,11(8):1621-1632.
[2] Tolboom H,Makhro A,Rosser B A,et al.Recovery of donor hearts after circulatory death with normothermic extracorporeal machine perfusion[J].Eur J Cardiothorac Surg,2015,47(1):173-179.
[3] Summers D M,Watson C J,Pettigrew G J,et al.Kidney donation after circulatory death (DCD): state of the art[J].Kidney Int,2015,88(2):241-249.
[4] Schlegel A,de Rougemont O,Graf R,et al.Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts[J].J Hepatol,2013,58(2):278-286.
[5] Dhanani S,Hornby L,Ward R,et al.Variability in the determination of death after cardiac arrest: a review of guidelines and statements[J].J Intensive Care Med,2012,27(4):238-252.
[6] Bendorf A,Kelly P J,Kerridge I H,et al.An international comparison of the effect of policy shifts to organ donation following cardiocirculatory death (DCD) on donation rates after brain death (DBD) and transplantation rates[J].PLoS One,2013,8(5):e62010.
[7] Dhital K K,Iyer A,Connellan M,et al.Adult heart transplantation with distant procurement and ex-vivo preservation of donor hearts after circulatory death: a case series[J].Lancet,2015,385(9987):2585-2591.
[8] Iyer A,Gao L,Doyle A,et al.Normothermic ex vivo perfusion provides superior organ preservation and enables viability assessment of hearts from DCD donors[J].Am J Transplant,2015,15(2):371-380.
[9] Osaki S,Locher M R,Lushaj E B,et al.Functional evaluation of human donation after cardiac death donor hearts using a continuous isolated myocardial perfusion technique: Potential for expansion of the cardiac donor population[J].J Thorac Cardiovasc Surg,2014,148(3):1123-1130.
[10] Bernat J L,Capron A M,Bleck T P,et al.The circulatory-respiratory determination of death in organ donation[J].Crit Care Med,2010,38(3):963-970.
[11] Christie J D,Edwards L B,Kucheryavaya A Y,et al.The Registry of the International Society for Heart and Lung Transplantation: twenty-eighth adult lung and heart-lung transplant report-2011[J].J Heart Lung Transplant,2011,30(10):1104-1122.
Effectsofdifferentwarmischemiatimeoncoronaryendothelialfunctionofdonorheartsaftercirculatorydeathinpigs
Su Yang1, Qin Guangqi2, Liao Qiuming2, Stig Steen2, Qiao Chenhui1
(1.DepartmentofCardiacSurgery,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China; 2.DepartmentofCardiothoracicSurgery,LundUniversityHospital, 22594,Sweden)
ObjectiveTo investigate the effects of different warm ischemia time on coronary endothelial function of donor hearts after circulatory death in pigs.MethodsEighteen healthy swedish domestic pigs were randomized into control group, warm ischemia 30 min group, and warm ischemia 40 min group. In the control group, the coronary artery was harvested immediately after sternotomy and pericardiotory. The DCD model was induced by rapid exsanguination and left in situ for 30min in the warm ischemia 30 min group, 40min in the warm ischemia 40 min group. Then endothelium-dependent relaxation of the left anterior descending coronary arteries in the three groups was investigated in organ bath.ResultsThe ratio of maximal EDR to the maximal contraction in control group, warm ischemia 30min group and warm ischemia 40 min group were (95.72±0.95)%, (95.09±0.85)% and (94.41±1.06)%, respectively(P>0.05). The negative logarithm of negative logarithm of half effect concentration (pEC50) were (6.53± 0.07)%, (6.43±0.02)% and (6.38±0.04)%, respectively(P>0.05).ConclusionUnder the circumstances of this experiment, there was no coronary EDR caused by either 30 minutes or 40 minutes warm ischemia injury.
donation after circulatory death; warm ischemia time; endothelial cell; heart transplantation
乔晨晖,E-mail:qchenhui@hotmail.com。
R 654.1
10.3969/j.issn.1004-437X.2017.22.002
2017-05-09)
