分光光度法测定杜仲雄花和叶中的总黄酮
2017-12-20杜庆鑫魏艳秀刘攀峰杜红岩
杜庆鑫 ,魏艳秀 ,刘攀峰 ,杜红岩
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2. 国家林业局 杜仲工程技术研究中心,河南 郑州 450003)
分光光度法测定杜仲雄花和叶中的总黄酮
杜庆鑫1,2,魏艳秀1,2,刘攀峰1,2,杜红岩1,2
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2. 国家林业局 杜仲工程技术研究中心,河南 郑州 450003)
采用NaNO2-Al(NO3)3-NaOH显色法和AlCl3比色法分别测定杜仲雄花和杜仲叶中总黄酮,研究杜仲中总黄酮含量测定的最佳方法,并对杜仲雄花和杜仲叶中总黄酮含量差异进行分析。结果表明:NaNO2-Al(NO3)3-NaOH显色法干扰严重,测定结果偏高,AlCl3比色法操作简便,重复性好,结果合理,在5.0~30 μg·mL-1范围内,芦丁浓度与吸光度呈良好线性关系(R2=0.999 7),平均加样回收率达99.27%,RSD为1.21%,适合杜仲中总黄酮含量的大量测定;杜仲雄花和杜仲叶中总黄酮测定结果显示,不同材料间总黄酮含量差异较大,且雄花中总黄酮含量明显高于叶,为杜仲资源的开发利用提供了一定的参考。
杜仲;雄花;叶;总黄酮;分光光度法
杜仲Eucommia ulmoidesOliv.为杜仲科杜仲属植物,系第四纪冰川侵袭后仅留存于我国的孑遗树种,是我国特有名贵中药材和珍稀濒危Ⅱ类保护植物,在军工、航空航天、医疗保健、健康食品等领域有着广泛的应用[1-3]。中国传统以杜仲干皮入药,具有补肝肾、强筋骨的功效[4-5]。现代研究表明,杜仲雄花、杜仲叶含有与皮相类似的有效成分,总黄酮就是主要成分之一,且含量远高于杜仲皮[6-7],具有降脂减肥、抗自由基、抗氧化、抑菌、抗病毒等作用,对治疗冠心病、高血压等疾病有显著的作用[8-12]。近年来,以杜仲雄花和杜仲叶为原料的开发利用日益引起人们重视,其中,以杜仲雄花为原料开发出的茶制品、保健酒、功能饮料等产品具有较高的医疗保健功效,以杜仲叶为原料相继在食品、饲料添加剂以及化妆品等领域开发出系列产品,备受市场青睐[13-16]。
当前,植物总黄酮含量测定的方法有HPLC法、分光光度法等[17-18]。HPLC法结果相对准确,但成本较为高昂。分光光度法测定总黄酮的原理是金属离子与酮羰基、邻位羟基配合形成稳定结构。其中,以NaNO2-Al(NO3)3-NaOH显色法最常用[19],AlCl3比色法也被应用于植物中总黄酮的含量测定[20],但该法在杜仲中总黄酮含量的测定还未见报道。现分别采用NaNO2-Al(NO3)3-NaOH显色法和AlCl3比色法测定杜仲雄花和叶中的总黄酮含量,并对结果进行比较,以期建立杜仲中总黄酮含量测定的最适方法,同时比较分析杜仲雄花和叶片中总黄酮含量的差异,以期为杜仲资源的开发利用提供参考。
1 材料与方法
1.1 试验材料
供试的杜仲雄花和杜仲叶均采自中国林业科学研究院经济林研究开发中心原阳试验基地杜仲基因库,基因库采用6株小区,定植行间距为3 m×3 m。雄花是于盛花期分别在树冠中部的东、西、南、北4个方向采摘雄花各约10簇,叶片是2015年7月分别在树冠中部的东、西、南、北4个方向对成熟叶片进行采集,共约20片杜仲叶。样品采集后低温冷藏带回实验室,保存备用。雄花和叶片均采自同一编号的杜仲样株,且长势旺盛、无病虫害。
1.2 仪器与试剂
仪器:Cary 300紫外-可见分光光度计(美国安捷伦);AL204 电子天平(美国METTLER TOLEDO);HT-300BQ 型数控超声波清洗器(济宁恒通超声电子设备有限公司);DHG-91013SA型电热恒温鼓风干燥箱(上海三发科学仪器有限公司);HH-8数显恒温水浴锅(郑州元强仪器设备有限公司)。
试剂:芦丁标准品(上海源叶生物科技有限公司);三氯化铝、醋酸钠、冰醋酸、乙醇均为分析纯;水为超纯水。
1.3 方 法
1.3.1 对照品溶液的制备
称取20.0 mg芦丁对照品,105 ℃干燥至恒质量,用60%乙醇溶解,定容至200 mL,配成100 μg·mL-1的芦丁标准溶液。
1.3.2 供试品溶液的制备
将采集的杜仲雄花和杜仲叶样品在105℃下杀青3 min,然后60℃烘干,粉碎过60目筛。精密称取杜仲雄花粉末0.10 g,加入60%乙醇,料液比1∶30,超声30 min,离心后取上清液,以60%乙醇定容至10 mL,得杜仲雄花样品提取液,同法制得杜仲叶样品提取液。
1.3.3 检测波长的确定
1.3.3.1 NaNO2-Al(NO3)3-NaOH显色法
准确吸取对照品溶液1.0 mL,移入10 mL 刻度比色管中,加入60%乙醇5 mL,分别加入 5%亚硝酸钠溶液0.5 mL,振摇后放置 6 min,加入10%硝酸铝溶液0.5mL 摇匀后放置6 min,加入1 mol·L-1氢氧化钠溶液2 mL,用60 %乙醇定容至刻度,快速摇匀,室温放置15 min。同法制得空白液,在 300~ 600 nm 扫描,发现芦丁对照品溶液在510 nm处有最大吸收峰。
1.3.3.2 AlCl3比色法
准确吸取对照品溶液1.0 mL,移入10 mL刻度比色管中,依次加入pH值 3.6的醋酸-醋酸钠缓冲液3 mL,0.1 AlCl3溶液3 mL,用60%乙醇定容至10 mL,快速摇匀,室温放置30 min。同法制得空白液,在300~500 nm波长范围内扫描,发现芦丁对照品溶液在400 nm处有最大吸收峰。
1.3.4 标准曲线的绘制
NaNO2-Al(NO3)3-NaOH显色法:准确吸取芦丁对照品溶液0.5、1、1.5、2、2.5、3 mL,按1.3.3.1项下的方法进行显色处理,在510 nm处测定吸光度,以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线。AlCl3比色法:准确吸取芦丁对照品溶液0.5、1、1.5、2、2.5、3 mL,按1.3.3.2项下的方法进行显色处理,在400 nm处测定吸光度,以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2 结果与分析
2.1 标准曲线的绘制
根据1.3.4中的方法,可得NaNO2-Al(NO3)3-NaOH显色法芦丁浓度对吸光度值的线性回归方程为A=0.015 3C-0.002 7(R2=0.999 5),表明对照品在 5.0~ 30 μg·mL-1范围内线性关系良好。AlCl3比色法芦丁浓度对吸光度值的线性回归方程为A=0.020 6C-0.014(R2=0.999 7),表明对照品在5.0~ 30 μg·mL-1范围内线性关系良好。
2.2 NaNO2-Al(NO3)3-NaOH显色法评价
2.2.1 精密度试验
吸取芦丁对照品溶液1.0 mL,按1.3.3.1项下的方法操作,测定吸光度,连续测定6次,RSD为0.53%,表明该方法的精密度良好。
2.2.2 稳定性试验
取杜仲雄花样品溶液1.0 mL,显色后分别在5、10、15、20、25、30 min测定吸光度,RSD为0.82%,说明样品显色后30 min内稳定性良好。
2.2.3 重复性试验
取杜仲雄花样品6份,按1.3.2项下的方法制备供试品溶液,然后测定吸光度,RSD为0.96%,表明该方法重复性良好。
2.2.4 加样回收率试验
精密称取已知含量杜仲雄花样品6份,每份0.1 g,分别加入芦丁对照品1.0 mL,按1.3.2项下的方法制备供试品溶液,测定吸光度,计算回收率,结果见表1。
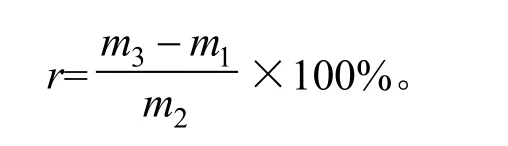
式中:r为回收率,%;m1为样品中总黄酮含量,mg;m2为芦丁加入量,mg;m3为测得量,mg。

表1 加样回收率实验结果Table 1 Results of recovery tests of total flavonoids
由 表1可 知,NaNO2-Al(NO3)3-NaOH显 色法测定总黄酮的平均回收率为99.22%,RSD为0.95%,说明该方法测定杜仲雄花中总黄酮具有较高的回收率。
2.3 AlCl3比色法评价
2.3.1 精密度试验
吸取芦丁对照品溶液1.0 mL,按1.3.3.2项下的方法操作,测定吸光度,连续测定6次,RSD为0.46%,表明该方法的精密度良好。
2.3.2 稳定性试验
取杜仲雄花样品溶液1.0 mL,显色后后分别在 10、20、30、40、50、60 min测 定 吸 光 度,RSD为0.94%,说明样品显色后60 min内稳定性良好。
2.3.3 重复性试验
取杜仲雄花样品6份,按1.3.2项下的方法制备供试品溶液,然后测定吸光度,RSD为0.58%,表明该方法重复性良好。
2.3.4 加样回收率试验
精密称取已知含量杜仲雄花样品6份,每份0.1 g,分别加入芦丁对照品1.0 mL,按1.3.2项下的方法制备供试品溶液,测定吸光度,计算回收率,结果见表2。
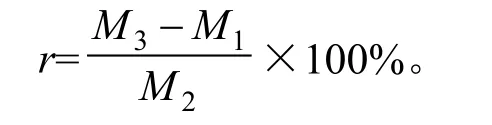
式中:r为回收率,%;M1为样品中总黄酮含量,mg;M2为芦丁加入量,mg;M3为测得量,mg。
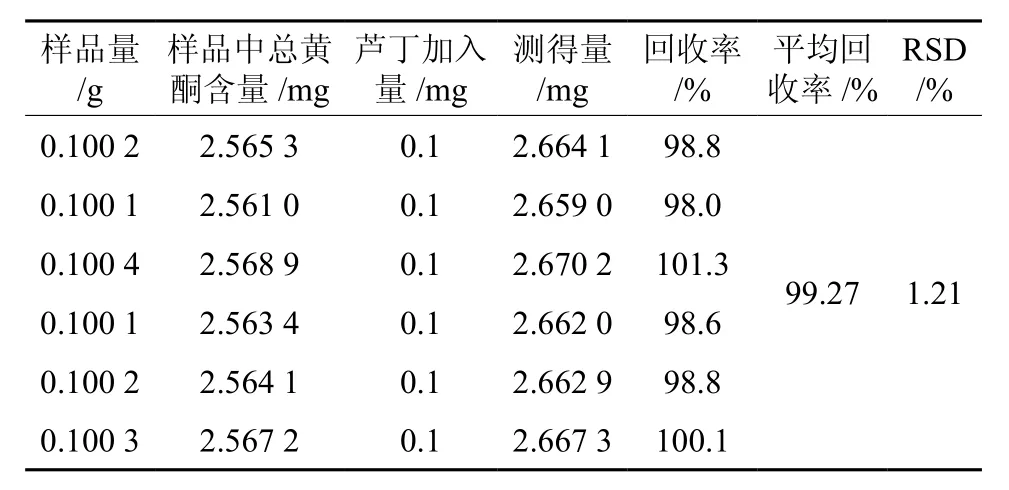
表2 加样回收率实验结果Table 2 Results of recovery tests of total flavonoids
由表2可知,AlCl3比色法测定总黄酮的平均回收率为99.27%,RSD为1.21%,说明该方法测定杜仲雄花中总黄酮具有较高的回收率。
2.4 杜仲雄花和叶中总黄酮含量的测定
分别吸取杜仲雄花和杜仲叶供试品溶液1.0 mL,分别按照1.3.3.1和1.3.3.2项下实验步骤测定吸光度,根据线性回归方程计算出供试品溶液中芦丁的浓度,并计算杜仲雄花和叶中总黄酮的含量。

式中:P为样品中总黄酮的含量,mg·g-1;c为标准曲线读出的供试品溶液中芦丁的浓度,μg·mL-1;V1为样品待测液总体积,mL;V2为样品提取液总体积,mL;V3为测定用体积,mL;m为样品质量,g。
采用NaNO2-Al(NO3)3-NaOH显色法和AlCl3比色法分别测定杜仲雄花和杜仲叶中总黄酮含量,结果见表3。由表3可知,13份样品杜仲雄花和叶中总黄酮含量均存在较大差异。NaNO2-Al(NO3)3-NaOH显色法测定结果显示:5号样品杜仲雄花总黄酮含量最高,达到了为41.31 mg·g-1;其次是4号样品和9号样品,分别为37.29 mg·g-1和37.04 mg·g-1;3号样品总黄酮含量最低,仅为29.28 mg·g-1。5号样品杜仲叶总黄酮含量最高,达到了31.15 mg·g-1;3号样品杜仲叶总黄酮含量最低,仅为16.59 mg·g-1。AlCl3比色法测定结果显示:5号样品杜仲雄花总黄酮含量最高,达到了30.26 mg·g-1,3号样品杜仲雄花总黄酮含量最低,仅为17.35 mg·g-1;杜仲叶中总黄酮含量最高的仍为5号样品,为20.05 mg·g-1,含量最低的也是3号样品,仅为6.70 mg·g-1。采用2种方法测定同一份样品杜仲雄花和杜仲叶中总黄酮含量差别较大,NaNO2-Al(NO3)3-NaOH显色法测定结果明显比AlCl3比色法偏高,此外,2种方法测定结果均为杜仲雄花中总黄酮含量明显高于杜仲叶片中总黄酮含量。
3 结论与讨论
本研究采用2种常见的分光光度计法测定杜仲雄花和杜仲叶中总黄酮含量,主要是依据铝离子与黄酮母核中的3位(或5位)上的羟基和4位羰基配合形成稳定结构[21](见图1)。此外,杜仲中的邻苯二羟基化合物(主要为绿原酸)也会与Al3+形成螯合物,干扰测定。而Al3+与邻苯二羟基形成的螯合物在酸性环境下会分解,降低了邻二酚类化合物的干扰[22](见图2)。因此,AlCl3比色法测定杜仲中总黄酮含量时专属性较强,测定结果可达到预期要求。仇豪文等[23]以ZrOCl2作为显色剂改进了杜仲叶中总黄酮含量测定方法,但该方法测定时间较长,不适于杜仲中总黄酮含量的大量测定。尉芹等[24]用纸层析-Al(NO3)3比色法测定杜仲叶中总黄酮含量,亦可有效消除干扰,但操作步骤繁琐。董发明等[25]采用HPLC法测得杜仲雄花中总黄酮含量平均为13.13 mg·g-1,比本研究中杜仲雄花总黄酮含量(22.12 mg·g-1)要低,可能与采集的杜仲雄花样品不同有关。
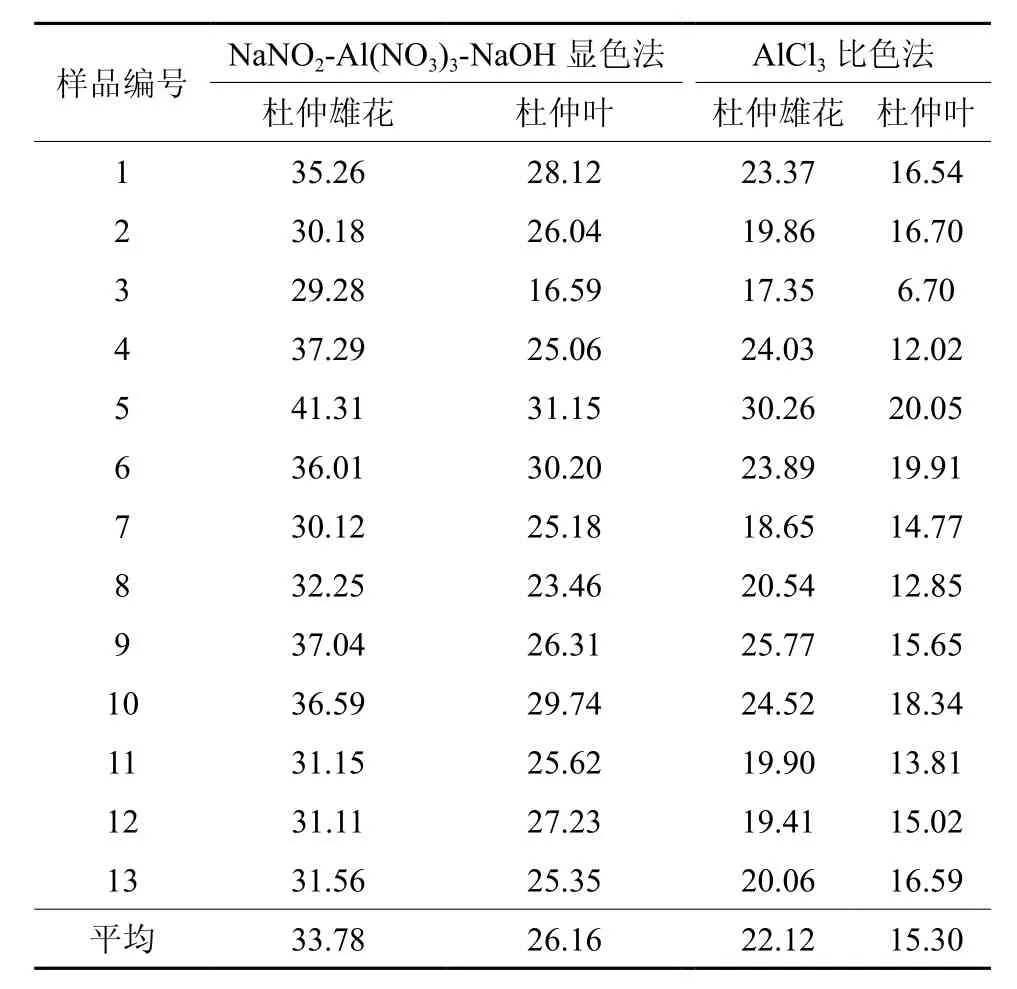
表3 杜仲雄花和叶样品总黄酮含量测定结果Table 3 Results of total flavonoids content in E. ulmoides male flowers and leafs mg·g-1
采用AlCl3比色法测定杜仲中总黄酮操作简便,重复性好,结果准确,适合杜仲中总黄酮含量的大量测定。通过对杜仲雄花和杜仲叶中总黄酮含量的测定,发现不同材料间杜仲雄花和杜仲叶中总黄酮含量差异较大,且杜仲雄花中总黄酮含量明显高于杜仲叶中总黄酮含量,为今后杜仲资源开发利用提供了一定的参考。
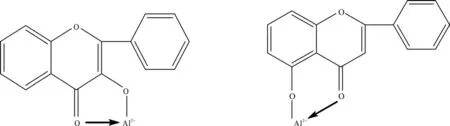
图1 铝离子与黄酮母核中的3位(或5位)上的羟基和4位羰基配合形成的稳定结构Fig. 1 Coordinate structure between Al3+ and hydroxyl and carbonyl groups in flavonoids
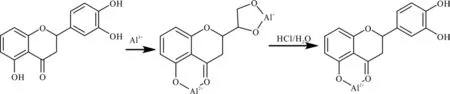
图2 AlCl3比色法测定杜仲雄花总黄酮反应原理Fig.2 Principle of total flavonoids in E. ulmoides male flowers with AlCl3 method
[1]杜红岩.中国杜仲图志[M].北京:中国林业出版社,2014:76-79.
[2]杜红岩,胡文臻,俞 锐,等.杜仲产业绿皮书[M].北京:社会科学文献出版社,2013:1-5.
[3]周 强,陈功锡,熊利芝,等.湘西地区杜仲翅果性状多样性的研究[J].中南林业科技大学学报,2014,34(4):14-19.
[4]Dong J E, Ma X H, Qin W,et al. Effects of growing location on the contents of secondary metabolites in the leaves of four selected superior clones ofEucommia ulmoides[J]. Industrial Crops and Products, 2011, 34: 1607-1614.
[5]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2010:154-155.
[6]刘昌勇,李 钦,杜红岩,等.配方施肥对杜仲雄花主要活性成分含量的影响[J].中南林业科技大学学报,2010,30(8):29-34.
[7]张康健,董娟娥,马柏林,等.杜仲次生代谢部位差异性的研究[J].林业科学,2002,38(6):12-16.
[8]杜红岩,李 钦,杜兰英,等.杜仲雄花茶营养成分的测定分析[J].中南林业科技大学学报,2007,27(6):88-91.
[9]吴 敏,赵 阳,马志刚,等.果园化栽培模式杜仲雄花、果实和叶片产量的调查分析[J].林业科学研究,2014,27(2):270-276.
[10]叶东旭,杜红岩,李 钦,等.杜仲雄花HPLC指纹图谱及成分积累规律的研究[J]中成药,2012,34(4):706-709.
[11]刘 严.杜仲雄花功能成分的提取、分离及活性研究[D].新乡:河南科技大学,2012.
[12]孙兰萍,马 龙,张 斌,等.杜仲黄酮类化合物的研究进展[J].食品工业科技,2009,30(3):359-363.
[13]郭洋静,丁艳霞,许兰波.HPLC法同时测定杜仲雄花中5种活性成分[J].中成药,2014,36(10):2131-2134.
[14]Dong J E, Ma X H, Fu Z R,et al. Effects of microwave drying on the contents of functional constituents ofEucommia ulmoidesflower tea[J]. Industrial Crops and Products, 2011,34:1102-1110.
[15]王 璐,杜兰英,杜红岩.杜仲饲料添加剂的研究进展[J].饲料研究,2014(19):29-31.
[16]杜红岩.我国杜仲工程技术研究与产业发展的思考[J].经济林研究,2014,32(1):1-5.
[17]黄 荣,傅小红,常 波.分光光度法测定火棘提取物中的总黄酮[J].华西药学杂志,2013,28(6):642-643.
[18]付莹娟,国海东,上官新晨,等.HPLC校正分光光度法测定葛根中异黄酮含量[J].食品科技,2012,39(6):284-287.
[19]贾可敬,李湘洲,殷 凯.长沙青皮竹叶中黄酮类化合物的提取工艺条件[J].经济林研究,2014,32(2):125-129.
[20]甘秀梅,陈华国,周 欣,等.火棘果中总黄酮的含量测定[J].光谱实验室,2012,29(2):1223-1226.
[21]徐礼荣,刘爱茹.黄酮类化合物测定方法[J].中草药通讯,1979(7):39-44.
[22]范杰平.柿叶中有效成分的提取与分离研究[D].杭州:浙江大学, 2006
[23]仇豪文,沈 晖,曾 里,等.杜仲叶中总黄酮检测方法的改进研究[J].食品研究与开发,2013,34(20):96-100.
[24]尉 芹,王冬梅.杜仲叶总黄酮含量测定方法研究[J].西北农林科技大学学报(自然科学版),2001,29(5):119-122.
[25]董发明,白喜婷.响应面法优化超声提取杜仲雄花中黄酮类化合物的工艺参数[J].食品科学,2008,29(8):227-231.
Determination on total flavonoids in male flowers and leaves ofEucommia ulmoidesby spectrophotometry
DU Qingxin1,2, WEI Yanxiu1,2, LIU Panfeng1,2, DU Hongyan1,2
(1.Non-timber Forest Research and Development Center of Chinese Academy of Forestry, Zhengzhou 450003, Henan, China;2. The Eucommia Engineering Research Center of National Forestry Administration, Zhengzhou 450003, Henan, China)
To study the optimal method for the determination of total flavonoids content ofEucommia ulmoides, and analyze the differences of total flavonoids content inEucommia ulmoidesmale flowers and leaves.The content of total flavonoids inEucommia ulmoidesmale flowers and leaves were determined by NaNO2-Al(NO3)3-NaOH method and AlCl3colorimetric method, respectivly.The results showed that NaNO2-Al(NO3)3-NaOH method existed interference and the content of total flavonoids is higher, while AlCl3colorimetric method is easy, highly reproducible, accurate, the absorbency and concentration of Rutin had a good linear in range of 5~30 ug·mL-1(R2=0.999 7), the average recovery rate was 99.27%, RSD 1.21%, and the method is suitable for mass determination of total flavonoids ofEucommia ulmoides. According to the determination results, the differences of total flavonoids content is larger among different materials and the content of total flavonoids in male flowers was obviously higher than that in leaves, which could provide a certain reference for the development and utilization ofEucommia ulmoidesresources.
Eucommia ulmoides; male flowers; leaves; total flavonoids; spectrophotometry
10.14067/j.cnki.1673-923x.2017.05.000 http: //qks.csuft.edu.cn
2015-12-24
国家“十二五”农村领域科技计划课题研究任务合约(2012BAD21B0502)
杜庆鑫,硕士研究生
杜红岩,研究员,博士生导师;E-mail:dhy515@126.com
杜庆鑫,魏艳秀,刘攀峰,等.分光光度法测定杜仲雄花和叶中的总黄酮[J].中南林业科技大学学报,2017,37(5):96-100.
S718.43
A
1673-923X(2017)05-0096-05
[本文编校:谢荣秀]
