MiRNA-203在寻常性银屑病皮损的表达及其对HaCaT细胞增殖的影响
2017-12-12梁颖红魏明刘佳龚艳杰涂玲张宜花
梁颖红 魏明 刘佳 龚艳杰 涂玲 张宜花
450052郑州大学第五附属医院检验科
MiRNA-203在寻常性银屑病皮损的表达及其对HaCaT细胞增殖的影响
梁颖红 魏明 刘佳 龚艳杰 涂玲 张宜花
450052郑州大学第五附属医院检验科
目的 研究微小核糖核酸(miRNA)-203在寻常性银屑病患者皮损中的表达,并探讨对角质形成细胞株(HaCaT细胞)增殖的影响。方法 取2014—2016年23例寻常性银屑病患者的皮损组织和相邻非皮损组织。荧光定量PCR法检测组织中miRNA-203的表达水平,并以5′端、3′端地高辛标记的探针对皮肤组织切片中目的miRNA进行原位杂交,观察miRNA-203在皮肤组织中的定位情况。将miRNA-203模拟物(miRNA-203模拟物组)和miRNA-203模拟物阴性对照(阴性对照组)分别转染HaCaT细胞,正常细胞培养组作为空白对照组,采用噻唑蓝(MTT)法、流式细胞仪和Western印迹法分别对HaCaT细胞的增殖、细胞周期及相关周期蛋白(Cyclin D1、Cyclin B1)的变化进行检测。结果 miRNA-203特异性地表达在表皮的角质形成细胞中,除细胞核外,细胞质亦有表达,且寻常性银屑病患者皮损组织中miRNA-203表达水平(1.35±0.28)显著高于非皮损组织(0.52±0.09),差异有统计学意义(t=6.76,P=0.012)。转染miRNA-203模拟物能抑制HaCaT细胞增殖(F=9.36,P=0.007),且空白对照组、阴性对照组和miRNA-203模拟物组HaCaT细胞增殖率均随时间的延长逐渐增加(F=18.68,P<0.001)。与阴性对照组和空白对照组相比,miRNA-203模拟物组HaCaT细胞被阻滞在G2/M期(G2/M期细胞比例:31.33%±4.56%比17.02%±3.53%、16.67%±3.32%,均P<0.05),HaCaT细胞周期蛋白周期蛋白D1表达水平较高(1.15±0.13比0.52±0.05、0.56±0.07,均P<0.05),而周期蛋白B1水平较低(0.43±0.08比0.93±0.16、0.91±0.0.15,均P<0.05)。结论 miRNA-203可能参与了寻常性银屑病的发生发展过程。
银屑病,寻常性;微小核糖核酸;角质形成细胞;细胞增殖
近年来研究发现,微小RNA(micro-RNA,miRNA)在调节角质形成细胞增殖分化、皮肤炎症及免疫细胞之间的相互影响等方面发挥重要作用[1-2]。在银屑病皮损中异常表达的各组成细胞中,只有角质形成细胞表达miRNA-203,具有高度皮肤特异性。通过限制表皮细胞增殖潜能、诱导其退出细胞周期,促进表皮细胞分化[3-4]。但miRNA-203在银屑病发生中的确切作用还不清楚。本研究用荧光定量PCR分析寻常性银屑病患者皮损中miRNA-203的表达,同时以HaCaT细胞为研究模型,分析转染miRNA-203模拟物对HaCaT细胞增殖、细胞周期及其相关蛋白的变化,探讨miRNA-203在寻常性银屑病中可能的作用,为开展寻常性银屑病的靶向治疗提供部分依据。
材料与方法
一、材料
1.组织来源:2014—2016年郑州大学第五附属医院皮肤科23例寻常性银屑病患者,其中男13例,女10例,年龄32.4±6.8(6~65)岁。本研究经郑州大学第五附属医院医学伦理委员会批准,患者术前均签署知情同意书。纳入标准:符合《中国临床皮肤病学》[5]的寻常性银屑病诊断标准;排除标准:近2周内局部外用糖皮质激素及免疫抑制剂;近1个月系统应用糖皮质激素、阿维A、补骨脂素等系统治疗、紫外线治疗及日光浴;有心脏、肝肾疾病及精神疾病者;有感染、妊娠、分娩、外伤等应激状态;有各器官恶性肿瘤者。
2.细胞与主要试剂:人HaCaT细胞由上海复祥生物科技有限公司提供。miRCURYTM原位杂交探针(丹麦Exiqon公司);Anti-DIG-AP抗体、四唑硝基蓝(NBT)/5-溴-4-氯-3-吲哚基-磷酸盐(BCIP)显色试剂盒(瑞士Roche公司)。RNAiso试剂、反转录试剂盒、荧光染料试剂SYBR Green I Master(日本TaKaRa公司);Lipofectamine 2000 Reagent(德国Invitrogen公司);二喹啉甲酸蛋白(BCA)试剂盒、细胞周期试剂盒(南京凯基生物科技发展有限公司);噻唑蓝(MTT)试剂盒(美国Sigma公司)。鼠单克隆抗体、兔二抗、鼠二抗(英国Abcam公司);周期蛋白B1、周期蛋白D1兔单克隆抗体(德国CST公司)。
二、方法
1.标本获取:局麻下行手术取材,术后立即将手术标本的皮损区与相邻非皮损区分离,一部分以4%甲醛固定、石蜡包埋,用于原位杂交,一部分于-196℃液氮中冻存,用于荧光定量PCR检测miRNA-203。
2.原位杂交:将蜡块制成4 μm组织切片,以5′端、3′端地高辛(DIG)标记的目的探针行原位杂交,miRNA-203探针序列为5′-TAGTGGTCCTAAACATT TCA-3′。U6 snRNA探针为阳性对照,序列为5′-CACGAATTTGCGTGTCATCCTT-3′,无义微小 RNA探针为阴性对照,序列为5′-GTGTAACACGTCTATA CGCCCA-3′。脱蜡后蛋白酶K消化10 min,54℃杂交仪中杂交2 h,碱性磷酸酶结合的抗地高辛抗体孵育1 h,NBT/BCIP(含2 mmol/L左旋咪唑)进行显色。各步骤均严格按照试剂操作说明进行,NIKON光学显微镜下观察显色情况,对miRNA-203的表达进行定位。
3.荧光定量PCR检测miRNA-203的表达:按照RNAiso RNA提取试剂盒说明书提取冷冻组织总RNA。以紫外分光光度计测总RNA纯度及浓度。cDNA的合成按照反转录试剂盒操作说明书进行。荧光定量PCR实验所用引物由生工生物工程(上海)股份有限公司设计并合成,以U6作为内参照,引物序列分别为miRNA-203反转录:5′-CTCAACTGGT GTCGTGGA-3′,正向引物:5′-CAGTGCGTGTCGTGG AG-3′,反向引物:5′-GGGTCAGTGCATCACAGAA-3′;U6 反转录:5′-TGGTGTCGTGGAGTCG-3′,正向引物:5′-CTCGCTTCGGCAGCACA-3′,反向引物:5′-AACGCTTCACGAATTTGCGT-3′。反应体系的配制及反应条件的设置均按照荧光定量PCR试剂盒说明书进行。用2-ΔΔCt计算miRNA-203相对表达量。
4.细胞培养:HaCaT细胞在含10%胎牛血清及1%青链霉素的改良DMEM培养基中,37℃、5%CO2条件下培养,待细胞单层铺满培养瓶后,磷酸盐缓冲液(PBS)漂洗1次,加0.25%胰蛋白酶消化液,待镜下细胞圆缩时,DMEM培养液终止消化,细胞收集于离心管中,1 000×g离心5 min,弃上清,将细胞悬液分别移至冷冻管中,每管1.5 ml,将冻存管先置于4℃冰箱2 h,再移至-80℃低温冰箱24 h,然后投入-196℃液氮中保存备用。
5.miRNA-203模拟物的设计、合成、转染及实验分组:针对靶点miRNA-203设计其模拟物,其正向引物为 5′-UCAGUGCAUCACAGAACUUUGU-3′,反向引物为5′-AAAGUUCUGUGAUGCACUGAUU-3′。按照Lipofectamine 2000说明书的要求进行转染。细胞达到70%~80%融合度时,按实验要求分组如下:空白对照组(仅加含Lipofectamine 2000的DMEM高糖培养基)、miRNA-203模拟物阴性对照组(加入含Lipofectamine 2000的DMEM高糖培养基和miRNA-203模拟物阴性对照物)、miRNA-203模拟物组(加入含Lipofectamine 2000的DMEM高糖培养基和miRNA-203模拟物)。孵育6 h后,置换为含10%胎牛血清的RPMI 1640培养液继续培养。每组实验重复3次取均值。
6.Western印迹法检测细胞周期相关蛋白:在HaCaT细胞转染miRNA-203模拟物或阴性对照物后72 h,收集细胞,加入细胞裂解液提取细胞总蛋白,用BCA法测定蛋白浓度。制备十二烷基磺酸钠(SDS)-聚丙烯酰胺凝胶,每孔上样量为12.5 μg,进行常规电泳后,凝胶转移至硝酸纤维素膜上。取出转移膜,用5%脱脂牛奶封闭。分别用兔抗人周期蛋白D1(1∶3 000)、周期蛋白 B1一抗(1∶1 500)、GAPDH一抗(1∶3 000)于4℃冰箱中孵育过夜。TBST洗涤3次,分别加入1∶3 000稀释的兔、鼠二抗,室温孵育1 h。TBST洗涤3次,增强化学发光(ECL)液处理并发光显像。
7.MTT法检测HaCaT细胞增殖:将转染miRNA-203模拟物后的HaCaT细胞浓度调整为2×104/ml,96孔培养板内每孔加入200 μl培养液。分别在转染后的24、48、72和96 h,在各组孔内加入5 g/L MTT工作液20 μl,继续37 ℃孵育4 h。吸去上清液,每孔加入200 μl二甲基亚砜(DMSO),置平板摇床振荡至结晶完全溶解后,酶标仪测定490 nm波长处各孔的吸收度(A)值。阴性对照组和空白对照组同样处理,实验重复3次取均值,并绘制细胞增殖曲线。
8.流式细胞仪检测细胞周期:将HaCaT细胞铺于6孔板并转染。48 h后收集细胞,按照说明书用RNA酶处理细胞后加入碘化丙锭(PI),避光孵育30 min,使用流式细胞仪检测细胞周期变化。
9.统计学方法:采用SPSS17.0软件进行数据分析。寻常性银屑病患者皮损与非皮损区miRNA-203表达的比较采用配对t检验;多组间细胞周期蛋白表达表达量的比较采用单因素方差分析,两两比较采用LSD-t检验;分析转染miRNA-203模拟物不同时间对HaCaT细胞增殖的影响采用重复测量资料的方差分析,调用多元方差分析中的LSD检验进行组间两两比较。P<0.05为差异有统计学意义。
结 果
一、寻常性银屑病患者皮损中miRNA-203的定位及表达
光学显微镜下观察原位杂交切片,miRNA-203特异性地在角质形成细胞表达,除细胞核外,细胞质亦有表达,在基底层表达较高,真皮中没有明显着色,见图1。miRNA-203在寻常性银屑病皮损区的表达(1.35±0.28)高于非皮损区(0.52±0.09),差异有统计学意义(t=6.76,P=0.012)。

图1 寻常性银屑病患者皮损与非皮损中miRNA-203的定位(×100) 1A:非皮损区miRNA-203;1B:皮损区miRNA-203;1C:U6阳性对照;miRNA-203特异性在角质形成细胞表达,除细胞核外,细胞质亦有表达,呈蓝紫色;寻常性银屑病皮损区miRNA-203表达明显高于非皮损区
二、miRNA-203与细胞周期蛋白表达的关系
miRNA-203模拟物转染HaCaT细胞72 h后,miRNA-203模拟物组、阴性对照组和空白对照组间细胞周期蛋白周期蛋白D1和周期蛋白B1的相对表达量均各不相同,差异有统计学意义(F=31.29、25.83,P < 0.001)。miRNA-203模拟物组周期蛋白D1蛋白(1.15±0.13)显著高于阴性对照组(0.52±0.05)和空白对照组(0.56±0.07),差异均有统计学意义(LSD-t=11.26、10.45,P=0.012、0.015),而周期蛋白B1蛋白(0.43±0.08)显著低于阴性对照组(0.93±0.16)和空白对照组(0.91±0.0.15),差异均有统计学意义(LSD-t=15.33、15.16,P=0.009、0.009),见图2。

图2 Western印迹法分析转染miRNA-203模拟物72 h后HaCaT细胞周期蛋白表达 1:空白对照组;2:阴性对照组;3:miRNA-203模拟物组
三、miRNA-203对HaCaT细胞增殖的影响
MTT检测转染miRNA-203模拟物后24、48、72、96 h对HaCaT细胞增殖能力的影响,结果见图3和表1。重复测量方差分析显示,空白对照组、阴性对照组和miRNA-203模拟物组间HaCaT细胞增殖率不同(F=9.36,P=0.007),两两多重比较结果显示,转染后48、72、96 h,miRNA-203模拟物组细胞增殖A值显著低于空白对照组(LSD-t=3.24、4.56、8.67,均P < 0.05)和阴性对照组(LSD-t=3.24、4.68、7.35,均P<0.05),提示转染miRNA-203模拟物能抑制HaCaT细胞的增殖;时间因素有统计学意义(F=18.68,P<0.001),说明HaCaT细胞增殖率有随时间变化的趋势,如图3所示,HaCaT细胞增殖A值随时间的延长逐渐增加;时间和分组的交互作用没有统计学意义(F=1.37,P=0.21),说明各组HaCaT细胞增殖率随时间变化的趋势没有明显差异。

图3 miRNA-203模拟物对HaCaT细胞株增殖的影响(490 nm荧光A值) 空白对照组、阴性对照组和miRNA-203模拟物组HaCaT细胞增殖A值均随时间的延长而逐渐增加,但48~96 h miRNA-203模拟物组
表1 转染miRNA-203模拟物后对HaCaT细胞增殖的影响(A490,±s)
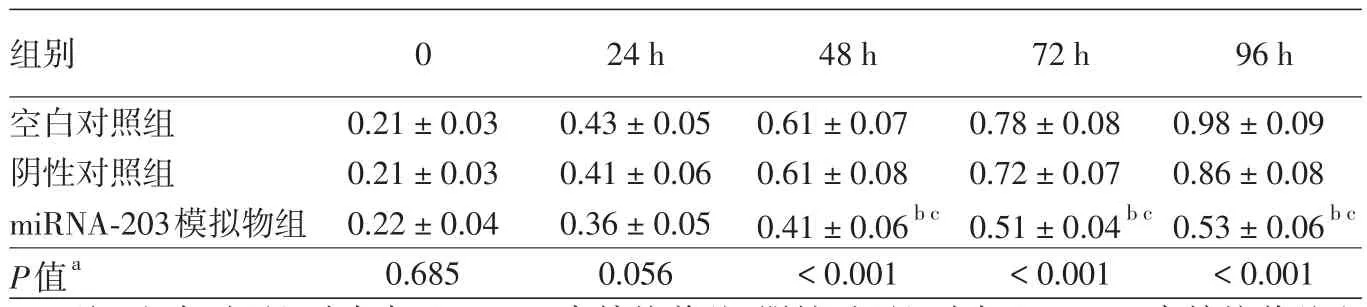
表1 转染miRNA-203模拟物后对HaCaT细胞增殖的影响(A490,±s)
注:空白对照组为仅加入DMEM高糖培养基;阴性对照组为加入DMEM高糖培养基和miRNA-203模拟物阴性对照物;miRNA-203模拟物组:加入DMEM高糖培养基和miRNA-203模拟物;a每个时间点3个分组间的比较;bLSD-t检验显示,与空白对照组相比,差异有统计学意义(P<0.05);cLSD-t检验显示,与阴性对照组相比,差异有统计学意义(P<0.05)
四、miRNA-203对HaCaT细胞G2/M期的影响
miRNA-203模拟物转染HaCaT细胞48 h后,miRNA-203模拟物组、阴性对照组和空白对照组G2/M期HaCaT细胞比例各不相同,差异有统计学意义(F=29.67,P <0.001),且miRNA-203模拟物组G2/M期HaCaT细胞比例(31.33%±4.56%)显著高于阴性对照组(17.02%±3.53%)和空白对照组(16.67%±3.32%),差异均有统计学意义(LSD-t=10.68、11.02,P=0.018、0.016),见图4。

图4 转染miRNA-203模拟物48 h后对HaCaT细胞G2/M期的影响 4A:空白对照组;4B:阴性对照组;4C:miRNA-203模拟物组
讨 论
研究表明,miRNA是一种普遍存在于真核生物中的小分子,已发现的上千条miRNAs基因中,绝大多数在不同组织及发育阶段中的表达水平有差异,即miRNA的表达模式具有时间及空间特异性。Yi等[6]在对小鼠表皮细胞的研究中发现,在小鼠发育的不同时期,miRNA-203的表达是不一样的。随后,Wei等[7]对人胚胎的研究也发现,miRNA-203在胚胎17周时才显著表达,在14周前基本检测不出;在没有钙离子、对苯二甲酸(TPA)等诱导分化因素存在时,miRNA-203也可诱导角质形成细胞的分化。提示miRNA-203在皮肤的增殖和分化中发挥了作用[8]。
本研究结果显示,寻常性银屑病患者皮损区miRNA-203的表达高于非皮损区,与Sonkoly等[9]研究结果一致。原位杂交结果显示,miRNA-203几乎特异性地表达在表皮的角质形成细胞,除细胞核外,细胞质亦有表达,在基底层表达较高,真皮中没有明显着色。据此推测,寻常性银屑病中miRNA-203的异常表达可能参与了银屑病的发病过程,并可导致表皮细胞和浸润细胞间信号传导功能障碍[10-11]。研究发现[12-13],miRNA-203在人角质形成细胞中可通过调控肿瘤坏死因子α(TNF-α)和白细胞介素24(IL-24)的编码基因、直接结合IL-8 3′UTR等途径,参与炎症过程。
周期蛋白D1是G1到S期细胞周期调节的关键因子,是成纤维细胞和上皮细胞增殖所必需的,如降低周期蛋白D1的表达,控制细胞周期G1期到S期的过度,可强有力地抑制角质形成细胞增殖。周期蛋白B1蛋白在整个细胞周期中的表达呈时相性变化,周期蛋白B1蛋白在G1期表达量极低,S期明显增加,在G2期达到最高[14]。我们用HaCaT细胞作为研究模型,探讨miRNA-203生物学功能。在HaCaT细胞中转染miRNA-203模拟物后,miRNA-203模拟物组HaCaT细胞增殖能力下降、细胞周期阻滞、周期蛋白下调,提示miRNA-203可能通过JAK/STAT信号通路参与细胞的增殖、分化和周期改变[15]。
综上所述,miRNA-203在寻常性银屑病皮损区的表达显著高于非皮损区,其表达定位在角质形成细胞的细胞核和细胞质中。miRNA-203与SOCS3、JAK/STAT信号传导通路有密切联系,故有必要针对miRNA-203及其靶点进行深入研究,揭示其在寻常性银屑病中的作用机制。
[1]Labbaye C,Testa U.The emerging role of MIR-146A in the control of hematopoiesis,immune function and cancer[J].J Hematol Oncol,2012,5:13.DOI:10.1186/1756-8722-5-13.
[2]禹欢欢,王晓华,蔡碧珊,等.银屑病相关miRNAs表达的研究进展[J].皮肤性病诊疗学杂志,2015,(3):258-260.DOI:10.3969/j.issn.1674-8468.2015.03.032.
[3]Sonkoly E,Lovén J,Xu N,et al.MicroRNA-203 functions as a tumor suppressor in basal cell carcinoma[J].Oncogenesis,2012,1:e3.DOI:10.1038/oncsis.2012.3.
[4]Ralfkiaer U,Hagedorn PH,Bangsgaard N,et al.Diagnostic microRNA profiling in cutaneous T-cell lymphoma(CTCL)[J].Blood,2011,118(22):5891-5900.DOI:10.1182/blood-2011-06-358382.
[5]赵辨.中国临床皮肤病学(下册)[M].南京:江苏科学技术出版社,2010:1008-1025.
[6]Yi R,Poy MN,Stoffel M,et al.A skin microRNA promotes differentiation by repressing ′stemness′[J].Nature,2008,452(7184):225-229.DOI:10.1038/nature06642.
[7]Wei T,Orfanidis K,Xu N,et al.The expression of microRNA-203 during human skin morphogenesis[J].Exp Dermatol,2010,19(9):854-856.DOI:10.1111/j.1600-0625.2010.01118.x.
[8]Yang Y,Zeng ZY,Liu XH,et al.MicroRNA-203 inhibits cell proliferation by repressing ΔNp63 expression in human esophageal squamous cell carcinoma[J].BMC Cancer,2011,11:57.DOI:10.1186/1471-2407-11-57.
[9]Sonkoly E,Wei T,Janson PC,et al.MicroRNAs:novel regulators involved in the pathogenesis of psoriasis?[J].PLoS One,2007,2(7):e610.DOI:10.1371/journal.pone.0000610.
[10]Rácz E,Prens EP.Molecular pathophysiology of psoriasis and molecular targets of antipsoriatic therapy[J].Expert Rev Mol Med,2009,11:e38.DOI:10.1017/S146239940900129X.
[11]Sonkoly E,Wei T,Janson PC,et al.MicroRNAs:novel regulators involved in the pathogenesis of psoriasis?[J].2007,2(7):e610.DOI:10.1371/journal.pone.0000610.
[12]Primo MN,Bak RO,Schibler B,et al.Regulation of proinflammatory cytokines TNFα and IL24 by microRNA-203 in primary keratinocytes[J].Cytokine,2012,60(3):741-748.DOI:10.1016/j.cyto.2012.07.031.
[13]Wei T,Xu N,Meisgen F,et al.Interleukin-8 is regulated by miR-203 at the posttranscriptional level in primary human keratinocytes[J].Eur J Dermatol,2013.DOI:10.1684/ejd.2013.1997.
[14]张三泉,高歆婧,丘文苑,等.TGM1基因表达沉默对角质形成细胞细胞周期及相关蛋白表达的影响[J].中华医学杂志,2014,(44):3478-3482.DOI:10.3760/cma.j.issn.0376-2491.2014.44.007.
[15]王健,邹仲敏,赵吉清.MiR-203及其调控机制的研究进展[J].现代生物学进展,2012,14(12):2743-2747.DOI:10.13241/j.cnki.pmb.2012.14.014.
Expression of miRNA-203 in psoriasis vulgaris skin lesions and its effect on the proliferation of HaCaT cells
Liang Yinghong,Wei Ming,Liu Jia,Gong Yanjie,Tu Ling,Zhang Yihua
Clinical Laboratory,Fifth Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Wei Ming,Email:gushiweiming@126.com
Objective To investigate the expression of miRNA-203 in skin lesions of patients with psoriasis vulgaris,and to explore its effect on the proliferation of a human keratinocyte cell line HaCaT.Methods Lesional skin and adjacent non-lesional skin tissues were obtained from 23 patients with psoriasis vulgaris from 2014 to 2016.Fluorescence-based quantitative PCR was performed to determine the expression of miRNA-203 in these skin tissues.Targeted miRNA in skin tissues was in situ hybridized by using 5′and 3′digoxigenin-labelled probes,so as to localize the expression of miRNA-203 in skin tissues.Cultured HaCaT cells were divided into 3 groups:miRNA-203 mimic group and negative control group transfected with miRNA-203 mimics and negative control miRNA-203 respectively,and blank control group receiving no treatment.Methyl thiazolyl tetrazolium(MTT)assay,flow cytometry and Western blot analysis were performed to investigate changes in cellular proliferative activity,cell cycle and its related proteins Cyclin D1 and Cyclin B1 in HaCaT cells respectively.Results MiRNA-203 was specifically expressed in epidermal keratinocytes.Besides the cell nuclei,it could be expressed in the cytoplasm.In the patients with psoriasis vulgaris,the expression of miRNA-203 was significantly higher in lesional skin tissues than in nonlesional skin tissues(1.35 ± 0.28 vs.0.52 ± 0.09,t=6.76,P=0.012).The transfection with miRNA-203 mimics could significantly inhibit the proliferation of HaCaT cells(F=9.36,P=0.007).Additionally,the blank control group,negative control group and miRNA-203 mimic group all showed a gradual increase in proliferative activity of HaCaT cells over time(F=18.68,P < 0.001).HaCaT cells were arrested in G2/M phase in the miRNA-203 mimic group with the percentage of cells in G2/M phase being 31.33%±4.56%,compared to 17.02% ±3.53%in the negative control group(P<0.05)and 16.67% ±3.32%in the blank control group(P < 0.05).Moreover,the miRNA-203 mimic group showed significantly higher protein expression of Cyclin D1(1.15 ± 0.13),but significantly lower protein expression of Cyclin B1(0.43 ±0.08),compared with the negative control group(0.52±0.05,0.93±0.16,respectively,both P <0.05)and blank control group(0.56±0.07,0.91±0.0.15,respectively,both P<0.05).Conclusion MiRNA-203 may participate in the occurrence and development of psoriasis vulgaris.
Vulgaris,psoriasis;MicroRNA;Keratinocyte cells;Cell proliferation
魏明,Email:gushiweiming@126.com
10.3760/cma.j.issn.0412-4030.2017.10.006
2017-01-16)
(本文编辑:周良佳 颜艳)
