4种湿地植物对复合垂直流人工湿地N2O排放的影响
2017-12-11蒋旭瑶田云飞黄德英郑潇威祝栋林张继彪
蒋旭瑶,田云飞,黄德英,郑潇威,祝栋林,张继彪
(1. 复旦大学 环境科学与工程系,上海,200433;2. 复旦大学 化学系,上海,200433;3.江苏省工程咨询中心,江苏 南京,210003)
4种湿地植物对复合垂直流人工湿地N2O排放的影响
蒋旭瑶1,田云飞1,黄德英2,郑潇威1,祝栋林3,张继彪1
(1. 复旦大学 环境科学与工程系,上海,200433;2. 复旦大学 化学系,上海,200433;3.江苏省工程咨询中心,江苏 南京,210003)
采用静态箱−气相色谱法对4种植物(菖蒲、美人蕉、风车草和水葱)的复合垂直流人工湿地N2O排放通量进行观测,并检测进出水总氮(TN)指标。研究结果表明:4种植物湿地TN去除率随着季节的变化趋势基本相同,先上升后波动下降,12月份和1月份达到最低,且风车草湿地TN去除率较高,为77.98%;菖蒲、水葱湿地的下行池排放通量比上行池的高,美人蕉湿地上行池排放通量比下行池的高,风车草湿地上、下行池排放量相差不大;风车草、菖蒲、美人蕉和水葱这4种植物湿地的N2O平均排放通量分别为162.80,99.35,84.62和82.56 μg/(m2·h);复合垂直流人工湿地系统总体上表现为大气中N2O的排放源,只有水葱湿地在12月份下半月表现为N2O的弱吸收汇;菖蒲、美人蕉和水葱湿地的TN去除负荷与N2O平均排放通量的比值KTN/N2O随时间变化较大,风车草湿地KTN/N2O变化相对平缓,且较低;菖蒲、美人蕉湿地在11月份上半月以及水葱植物在12月份上半月的KTN/N2O较高,即在这些时间段内人工湿地菖蒲去除污水中相同量的TN,排放出的N2O较少;在复合垂直流人工湿地污水处理植物选种中,菖蒲和美人蕉植物较合适。
复合垂直流人工湿地;湿地植物;N2O排放通量
目前,大气中温室气体CO2,CH4和N2O等体积分数增加而导致全球变暖,这已成为全世界各国政府科学界及社会公众所密切关注的问题之一[1]。N2O是仅次于CO2和CH4的温室气体,虽然大气中N2O的体积分数较低,仅为CO2体积分数的1/1 000,但其增温潜能却是CO2的296倍[2],并且大气中N2O的浓度每增加1倍,将导致全球气温升高0.3 ℃[3]。最重要的是N2O在对流层中可以滞留 150 a左右,增温潜能更大[4]。随着人工湿地污水处理技术在我国大面积推广,其在消减环境污染物的同时释放大量的温室气体,这一问题越来越受到人们的关注。目前普遍的观点认为人工湿地主要通过湿地内部微生物硝化和反硝化的共同作用以去除污水中的氮[5]。N2O是微生物脱氮过程中不完全反硝化、不完全硝化作用的产物[6−8]。MANDER 等[9−10]提出城市污水厂在脱氮处理中存在N2O排放的现象。随后,污水生物脱氮理论不断完善,人们相继开始人工湿地系统释放N2O的研究。SÜMER等[11]研究了潜流式人工湿地污水处理中沿程温室气体的变化情况以及水位高低和温度等因素对气体排放的影响。SØVIK等[4]对欧洲很多国家的自由表面流、水平潜流和垂直潜流人工湿地的N2O的释放量进行了研究,发现垂直潜流人工湿地是N2O释放量最高的一种湿地类型。INAMORI等[5]的研究表明,种植有茭白、芦苇和香蒲的人工湿地系统与未种植植物的对照系统相比,其释放的N2O更多。但是,目前未见有关植物湿地净化水质与释放温室气体关系的报道。为此,本文作者选择目前正在应用推广的复合垂直流人工湿地和耐污能力强、去污效果好、根系发达、抗病虫害能力强、具备美观和经济价值的美人蕉、菖蒲、水葱和风车草湿地植物,探究这4种不同湿地植物的复合垂直流人工湿地的污水净化效果以及N2O温室气体的释放通量,分析复合垂直流人工湿地的污水净化指标和温室气体释放通量关系,以便为人工湿地植物的选择提供技术支撑。
1 材料与方法
1.1 复合垂直流人工湿地系统结构
试验选用4种复合垂直流人工湿地系统,如图1所示。每个人工湿地系统种植1种挺水植物,4个系统分别种植美人蕉、菖蒲、水葱和风车草,植株密度均为20株/m2。每个复合垂直流人工湿地系统分别由下行池和上行池组成,并且在下行池上端设置有进水口,污水分别流经下行池和上行池后,由上行池后端设置出水口流出。模拟生活污水通过蠕动泵从进水口进入布水管,然后通过布水管布水由下行池进入人工湿地系统。人工湿地系统长×宽×高为 1.5 m×0.9 m×0.9 m。其中,湿地下行池基质自下而上依次充填高度为0.2 m砾石(粒径为30~50 mm),0.2 m砾石(粒径为10~20 mm),0.2 m细砂和0.1 m土壤;上行池自下而上依次充填高度为 0.2 m砾石(粒径为30~50 mm),0.2 m 砾石(粒径为 10~20 mm)和 0.1 m 细砂和0.1 m土壤。试验采用模拟生活污水,间歇式进水,每星期连续进水2 d,水力负荷为0.3 m3/(m2·d),TN质量浓度为30~40 mg/L,TP质量浓度为4~6 mg/L,COD 质量浓度为 120~169 mg/L,氨氮质量浓度为19~25 mg/L。
1.2 水样采集与分析
试验运行周期为6月,时间为2015−08—2016−01,试验期间每半月采集水样 5次,采样时间固定在9:30—10:30,TN质量浓度采用日本岛津TOC−L分析仪测定。样品中的TN在燃烧管中720 ℃时转化为NO,经过化学发光检测器被检测出来。实验用水不确定性小,使用该方法操作简单,结果可信。
污染物去除率按照 R=(1−ρe/ρi)×100%进行计算(其中,ρi为污水进水污染物质量浓度,ρe为出水污染物质量浓度)。以半月为时间单位对实验结果进行统计分析,将进出水水质的污染物质量浓度平均值作为每半月的湿地植物对污染物去除效果进行分析。

图1 复合垂直流人工湿地示意图Fig. 1 Schematic diagram of integrated vertical flow constructed wetland
1.3 N2O的采集与分析
N2O 排放通量采用静态箱−气相色谱法[5]进行采集与分析,采样时间为2015−08—2016−01,每周采样3次,采样时间固定为每个观测日的9:30—11:30。某一植物湿地的排放通量为此湿地上行池和下行池排放通量的平均值,每半月为1个时间节点,该半月内测得排放通量的平均值代表此时间节点温室气体的平均排放通量。每次在套箱后的 0,20,40和 60 min用50 mL注射器进行采气,同时记录箱体内部的温度和箱体水面以上的高度。气体样品由气相色谱仪(型号为Agilent 7890B)进行测定,N2O通过电子捕获检测器(ECD)进行检测,ECD检测器的工作温度为300 ℃。载气采用高纯氮气,流量为20 mL/min。柱箱的温度固定在60 ℃[3−5,9]。N2O排放通量采用下式[2]计算:

式中:J 为N2O排放通量,μg/(m2·h);dc/dt为箱体内浓度随时间变化率,mm3/(m3·h);M 为相对分子质量;p为采样装置内的气压,kPa;T为采样装置内温度(取开始和结束的平均值),K;V0为标准状态下气体的摩尔体积,22.4 L/mol;p0为标准状态下气体的气压,101.3 kPa;T0为标准状态下气体的温度,273.1 K;H为水面至采样装置顶端的距离,m。
1.4 统计分析
所有数据都采用Origin 9作图,用SPSS 21进行软件分析。
2 结果与讨论
2.1 4种植物湿地对TN的去除效果
在整个试验阶段,4种湿地植物对TN的平均去除率如图2所示。从图2可见:4种植物湿地的TN平均去除率从高到低分别为风车草湿地(77.98%)、美人蕉湿地(69.99%)、菖蒲湿地(64.64%)、水葱湿地(45.78%);菖蒲、美人蕉、水葱和风车草这 4种植物湿地TN去除率随时间变化趋势基本相同,即先上升然后波动下降,冬季达到最低,且下降较明显;这 4种植物湿地在试验初期TN去除率上升,然后下降。这可能是因为初期湿地系统刚建立,随着植物生长,根系越来越发达,输氧能力加强,基质内也积累了大量氮源和碳源,温度适宜,根系微生物生长迅速,参与硝化与反硝化反应去氮,且反应过程加强,导致去除率呈现上升趋势。冬季因为温度下降,根系微生物活性差,TN去除率开始下降[4]。
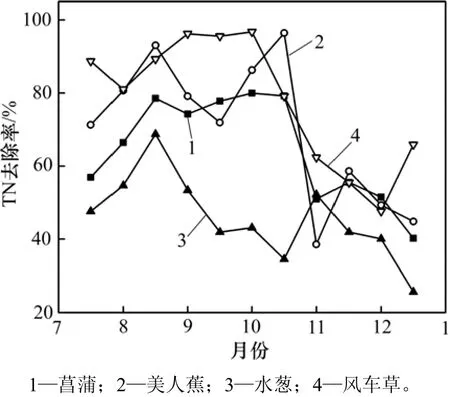
图2 4种植物湿地的TN去除率Fig. 2 TN removal efficiencies from four kinds of plant wetland system
1) 菖蒲湿地对于污水中TN的处理效果,10月份下半月、11月份上半月总氮去除率达到最高为79%以上,进入冬季时,TN的处理效果与之前其他月份的TN去除率存在明显差异(P<0.05),1月份TN去除率最低,为40.2%。
2) 美人蕉湿地TN去除率波动较大,9月份上半月和 11月份上半月处理效果较高,TN去除率均在90%以上,尤其 11月份上半月 TN去除率最高,为96.41%,但11月份下半月骤降至最低38.57%,两者之间存在极大差异(P<0.01)。
3) 风车草湿地对于TN的处理效果较好,8月至10月份TN的去除率保持在80%以上,大部分时间内可以保持在95%以上。进入11月份后,TN去除率出现明显下降趋势,去除率最低,达47.58%,与其他几种植物湿地相比,风车草湿地更适用于冬季人工湿地污水TN处理。
4) 水葱湿地对TN去除率普遍较低,9月份上半月去除率最高为68.73%,1月份去除效果最差,去除率仅为 25%,相比于其他 3种植物,不适合于 TN处理。
2.2 4种植物湿地N2O排放通量特征
2.2.1 下行池和上行池N2O排放通量特征
4种植物湿地上行池、下行池N2O排放通量如表1所示。从表1可见:菖蒲、水葱湿地的下行池排放通量分别为 137.56 μg/(m2·h)和 113.62 μg/(m2·h)),比上行池(分别为 61.13 μg/(m2·h)和 51.50 μg/(m2·h))的高,湿地下行池污水质量浓度较高,充足的碳源和氮源促进了硝化和反硝化过程,有利于N2O的排放[8];美人蕉湿地上行池排放通量(101.58 μg/(m2·h))比下行池(67.66 μg/(m2·h))的高,风车草湿地上、下行池相差不大(分别为 160.24 μg/(m2·h)和 165.37 μg/(m2·h))。这可能与各个植物根部释放的氧气量有关,根部会形成好氧、微好氧和厌氧区,为微生物提供各种适宜的微环境,从而影响根部N2O的排放。同时,N2O排放通量也与淹没水体中溶解氧有关,溶解氧过高,有机物氧化充分,反硝化反应就缺少有机碳,不利于反硝化反应的进行。氧浓度过低,微生物好氧硝化受影响,进而影响反硝化反应,影响N2O的释放[12]。4种植物湿地的下行池、上行池N2O排放通量如图3所示。从图3可见:菖蒲湿地下行池的N2O排放通量均比上行池的高,说明N2O产生及排放主要集中在菖蒲湿地的下行池;水葱复合垂直流人工湿地除9月份上半月和1月份之外,下行池的N2O排放通量均比上行池的高,尤其是在12月份湿地的上行池表现为N2O的吸收汇;8月份下半月、10月份和11月份上半月美人蕉湿地下行池 N2O排放通量比上行池的高;8~10月份上半月和12月份风车草湿地上行池的N2O排放通量比下行池的高,其余时间段下行池的N2O排放通量比上行池的高,上行池在12月份下半月高达365.33 μg/(m2·h),这是4种植物湿地中上行池排放通量最高的。下行池在11月份下半月同样达到4种植物湿地下行池的最高排放通量 378.81 μg/(m2·h)。

表1 4种植物上行池和下行池N2O排放通量Table 1 Emissions of N2O in downflow tanks and upflow tanks from four kinds of wetland plants μg/(m2·h)
2.2.2 N2O平均排放通量特征
如表1所示,4种植物N2O平均排放通量从大到小依次为风车草(162.80 μg/(m2·h))、菖蒲(99.35 μg/(m2·h))、美人蕉(84.62 μg/(m2·h))和水葱(82.56 μg/(m2·h)),这表明在此湿地系统中,水葱对温室气体N2O的贡献率最少,其次是美人蕉、菖蒲,风车草释放N2O排放通量最多。湿地系统中产生的N2O排放通量与植物类型有关,N2O主要通过液相传输和植物传输途径进入大气。不同植物群落之间的N2O传输量有较大差异[13],见图4。图4中,N2O排放通量随季节变化差异较大,植物湿地之间的N2O平均排放通量差异性显著(P<0.05),在植物不同生长期,植物的传输能力会有所变化[13]。这4种植物湿地的N2O平均排放通量在不同期间达到最高,水葱湿地在8月份上半月最高(227.19 μg/(m2·h)),菖蒲湿地在 9 月份上半月最高(234.51 μg/(m2·h)),风车草湿地在11月份下半月最高(312.69 μg/(m2·h)),美人蕉湿地在12月份上半月最高(198.13 μg/(m2·h))。平均排放通量最低值也出现在不同期间:风车草湿地 10月份上半月最低(89.71 μg/(m2·h)),菖蒲湿地和美人蕉湿地在 11月份上半月最低(分别为 20.81 μg/(m2·h)和 36.99 μg/(m2·h)),水葱湿地在 12 月份下半月最低(−16.87 μg/(m2·h))。

图3 4种植物湿地的下行池、上行池N2O排放通量Fig. 3 N2O emissions in downflow tanks and upflow tanks from four kinds of wetland plants
水葱湿地N2O平均排放通量和温度呈显著正相关(相关系数P<0.01),其余 3种植物湿地 N2O平均排放通量和温度所呈现的相关性不显著(P>0.05),因此,复合垂直流人工湿地系统的N2O平均排放通量受气温影响不大,水葱湿地受气温影响可能与水葱植物本身特性有关。表面流人工湿地的N2O排放通量与温度没有显著相关性[13]。

图4 4种植物湿地的N2O平均排放通量Fig. 4 N2O emissions from four kinds of plant wetland systems
4种复合垂直流人工湿地N2O排放通量为−16.88~312.69 μg/(m2·h)。复合垂直流人工湿地系统总体上表现为大气中N2O的排放源,仅水葱湿地在12月份下半月 N2O 平均排放通量低至−16.88 μg/(m2·h),表现为N2O的弱吸收汇。通过与其他生态系统N2O排放通量相关研究结果对比发现,复合垂直流人工湿地的N2O排放通量基本上与草原(−19~23 μg/(m2·h))[14]、天然湿地(25~110 μg/(m2·h))[15]、旱作农田(46~110 μg/(m2·h))[16]和水田生态系统(231 μg/(m2·h))[17]的接近。本实验结果与瑞典(−346.7~1 831.7 μg/(m2·h))[18]、日本(0~158.3 μg/(m2·h))[5]、挪威(−32~7 195.8 μg/(m2·h))[4]等的人工湿地系统N2O排放通量相当。
2.2.3 4种植物湿地N2O排放通量与TN去除负荷的对比
TN去除负荷即去除面积负荷,是指单位面积上每小时污染物的去除量。设KTN/N2O为TN去除负荷与N2O平均排放通量的比值,其值越高,表示此湿地在这个时间段内处理相同量的TN所排放出的N2O量较少。植物湿地KTN/N2O如图5所示。从图5可见:菖蒲、美人蕉和水葱湿地KTN/N2O随时间变化较大;菖蒲和美人蕉湿地的 KTN/N2O呈现下降—上升—下降—上升变化趋势,到12月下半月菖蒲KTN/N2O继续上升,美人蕉 KTN/N2O开始下降;水葱湿地在 9月份上半月、10月份上半月和12月份上半月分别达到极大值,且12月份上半月达到最大,说明水葱湿地在12月份上半月处理相同量 TN所排放的 N2O较少。风车草湿地KTN/N2O变化平缓,且较低,这说明处理相同TN负荷时,风车草湿地 N2O排放量较高,故不适用于处理TN含量较高的污水;菖蒲、美人蕉湿地在秋季(11月份上半月),水葱植物在冬季(12月份上半月)KTN/N2O较高,即在这些时间段内人工湿地去除污水中相同量的TN,排放的N2O较少。具体而言,在夏季(8月份和9月份),这4种植物湿地KTN/N2O相差不大;在秋季(10月份和11月份),菖蒲湿地KTN/N2O最高,美人蕉湿地其次,水葱湿地和风车草湿地的KTN/N2O没有差异;在冬季(12月份和1月份),水葱湿地的KTN/N2O最高,其余3种湿地类型的KTN/N2O相差不大。

图5 4种植物湿地的KTN/N2OFig. 5 KTN/N2O from four kinds of plant wetland systems
在复合垂直流人工湿地污水处理植物选种中,就处理TN指标、减少温室气体N2O排放而言,菖蒲和美人蕉植物较合适。
3 结论
1) 菖蒲、美人蕉、风车草和水葱这4种湿地植物中,对 TN去除率最高的是风车草(77.98%),其次分别是美人蕉(69.99%)、菖蒲(64.64%)和水葱(45.78%)。这4种植物湿地的TN去除率随着季节的变化趋势基本相同,即初期上升,然后波动下降;12月份和1月份下降明显,去除率较低。
2) 菖蒲、水葱湿地的下行池排放通量比上行池的高,美人蕉湿地上行池排放通量比下行池的高,风车草湿地上下行池排放量差异不显著。上行池植物的N2O排放量从小到大依次为水葱、菖蒲、美人蕉和风车草;下行池植物的N2O排放量从小到大依次为美人蕉、水葱、菖蒲和风车草;上、下行池平均排放通量从小到大依次为水葱、美人蕉、菖蒲以及风车草。复合垂直流人工湿地系统表现为大气中N2O的排放源,仅水葱湿地在12月份下半月表现为N2O的弱吸收汇,故建议在湿地植物的选种上,就减少N2O排放而言,可以考虑将水葱种植于上行池,美人蕉种植于下行池。
3) 菖蒲和美人蕉复合垂直流人工湿地更适宜处理TN质量浓度较高的污水,同时温室气体N2O排放较少。
[1] INAMORI R, WANG Y, YAMAMOTO T, et al. Seasonal effect on N2O formation in nitrification in constructed wetlands[J].Chemosphere, 2008, 73(7): 1071−1077.
[2] JIA Wenlin, ZHANG Jian, LI Peizhi, et al. Nitrous oxide emissions from surface flow and subsurface flow constructed wetland microcosms: effect of feeding strategies[J]. Ecological Engineering, 2011, 37(11): 1815−1821.
[3] TEITER S, MANDER Ü. Emission of N2O, N2, CH4, and CO2from constructed wetlands for wastewater treatment and from riparian buffer zones[J]. Ecological Engineering, 2005, 25(5):528−541.
[4] SØVIK A K, KLØVE B. Emission of N2O and CH4from a constructed wetland in southeastern Norway[J]. Science of the Total Environment, 2007, 380(1/2/3): 28−37.
[5] INAMORI R, GUI P, DASS M, et al. Investigating CH4and N2O emissions from eco-engineering wastewater treatment processes using constructed wetland microcosms[J]. Process Biochemistry,2007, 42(3): 363−373.
[6] STRÖM L, LAMPPA A, CHRISTENSEN T R. Greenhouse gas emissions from a constructed wetland in southern Sweden[J].Wetlands Ecology and Management, 2007, 15(1): 43−50.
[7] MA W K, BEDARD-HAUGHN A, SIEILIANO S D, et al.Relationship between nitrifier and denitrifier community composition and abundance in predicting nitrous oxide emissions from ephemeral wetland soils[J]. Soil Biology and Biochemistry, 2008, 40(5): 1114−1123.
[8] BELINE F, MARTINEZ J, MAROL C, et al. Application of the 15N technique to determine the contributions of nitrification and denitrifieation to the flux of nitrous oxide from aerated pig slurry[J]. Water Research, 2001, 35(11): 2774−2778.
[9] MANDER Ü, MADDISON M, SOOSAAR K, et al. The impact of pulsing hydrology and fluctuating water table on greenhouse gas emissions from constructed wetlands [J]. Wetlands, 2011,31(6): 1023−1032.
[10] CZEPIEL P, CRILL P, HARRISS R. Nitrous oxide emissions from municipal wastewater treatment[J]. Environmental Science& Technology, 1995, 29(9): 2352−2356.
[11] SÜMER E, WEISKE A, BENEKISER G, et al. Influence of environmental conditions on the amount of N2O released from activated sludge in a domestic waste water treatment plant[J].Experientia, 1995, 51 (4): 419−422.
[12] 郭冬艳, 李多松, 孙开蓓, 等. 同步硝化反硝化生物脱氮技术[J]. 安全与环境工程, 2009, 16(3): 41−45.GUO Dongyan, LI Duosong, SUN Kaibei, et al. Simultaneous nitrification and denitrification technology[J]. Safety and Environmental Engineering, 2009, 16(3): 41−45.
[13] WU Juan, ZHANG Jian, JIA Wenlin, et al. Impact of COD/N ratio on nitrous oxide emission from microcosm wetlands and their performance in removing nitrogen from wastewater[J].Bioresource Technology, 2009, 100(12): 2910−2917.
[14] 刘实, 王传宽, 许飞. 4种温带森林非生长季土壤二氧化碳、甲烷和氧化亚氮通量[J]. 生态学报, 2010, 30(15): 4075−4084.LIU Shi, WANG Chuankuan, XU Fei. Soil effluxes of carbon dioxide, methane and nitrous oxide during non-growing season for four temperate forests in northeastern China[J]. Acta Ecologica Sinica, 2010, 30(15): 4075−4084.
[15] 王毅勇, 郑循华, 宋长春, 等. 三江平原典型沼泽湿地氧化亚氮通量[J]. 应用生态学报, 2006, 17(3): 493−497.WANG Yiyong, ZHENG Xunhua, SONG Changchun, et al. N2O flux in typical wetlands of Sanjiang Plain[J]. Chinese Journal of Applied Ecology, 2006, 17(3): 493−497.
[16] 王重阳, 郑靖, 顾江新, 等. 辽河平原几种旱作农田N2O排放通量及相关影响因素的研究[J]. 农业环境科学学报, 2006,25(3): 657−663.WANG Chongyang, ZHENG Jing, GU Jiangxin, et al. N2O emission flux from several dry crops and impact factors in the lower reaches of Liaohe Plain[J]. Journal of Agro-environment Science, 2006, 25(3): 657−663.
[17] 邹建文, 黄耀, 宗良纲, 等. 稻田CO2、CH4和N2O排放及其影响因素[J]. 环境科学学报, 2003, 23(6): 758−764.ZOU Jianwen, HUANG Yao, ZONG Lianggang, et al. A field study on CO2, CH4and N2O emissions from rice paddy and impact factors[J]. Acta Scientiae Circumstantiae, 2003, 23 (6):758−764.
[18] JOHANSSON A E, KASIMIR K Å, KLEMEDTSSON L, et al.Nitrous oxide exchanges with the atmosphere of a constructed wetland treating wastewater[J]. Parameters and Implications for Emission Factors, 2003, 55(3): 737−750.
Effect of four kinds of wetland plants on N2O emission from integrated vertical constructed wetland
JIANG Xuyao1, TIAN Yunfei1, HUANG Deying2, ZHENG Xiaowei1, ZHU Donglin3, ZHANG Jibiao1
(1. Department of Environmental Science and Engineering, Fudan University, Shanghai 200433, China;2. Department of Chemistry, Fudan University, Shanghai 200433, China;3. Jiangsu Engineering Consulting Center, Nanjing 210003, China)
Four kinds of wetland plants named Acorus calamus L, Canna indica L, Scirpus validus Vahl and Cyperus alternifolius L were cultivated to evaluate N2O from integrated vertical constructed wetlands with static chamber-gas chromatograph. The results show that TN removal efficiencies for four plants are basically similar. TN removal efficiency increases from August and then decreases. The lowest TN removal efficiency is obtained in December and January. The best TN removal efficiency of these four kinds of wetlands is 77.98% when planted with Cyperus alternifolius L.N2O emissions from Acorus calamus L, and Scirpus validus Vahl are higher from downflow tanks than that from upflow tanks.But N2O emissions from Canna indica L is lower from downflow tanks than that from upflow tanks. Cyperus alternifolius L has the highest average N2O emission of 162.80 μg/(m2·h), followed by Acorus calamus L of 99.35 μg/(m2·h), Canna indica L of 84.62 μg/(m2·h) and Scirpus validus Vahl of 82.56 μg/(m2·h). The integrated verticalconstructed wetland is the resource of N2O emission, and integrated vertical constructed wetland planted with Scirpus validus Vahl shows weak absorption in the second half of December. KTN/N2O(the ratio of TN removal efficiency to N2O average flux) of Acorus calamus L, Canna indica L and Scirpus validus Vahl changes significantly with time compared to Cyperus alternifolius L, which shows the lower KTN/N2O. KTN/N2Ois lower when Acorus calamus L and Canna indica L are in the first half of November, Scirpus validus Vahl in the first half of December, which means they release lower N2O than that in other time when they remove the same TN content. Acorus calamus L and Canna indica L are more favorable for the integrated vertical constructed wetland.
integrated vertical constructed wetland; wetland plant; N2O emission
X703.1
A
1672−7207(2017)11−2859−07
10.11817/j.issn.1672-7207.2017.11.003
2016−11−10;
2017−01−15
国家自然科学基金资助项目(51308127) (Project(51308127) supported by the National Natural Science Foundation of China)
张继彪,博士,副教授,从事生态修复与治理技术研究;E-mail: jbzhang@fudan.edu.cn
(编辑 陈灿华)
