STAT3荧光素酶报告基因检测系统的构建及其检测STAT3活化能力的研究
2017-12-01王林玉江山娇蔡永松李琰清侯卫坤
王 博,张 英,王林玉,江山娇,蔡永松,周 艳,李琰清,侯卫坤
(1西安交通大学第一附属医院转化医学中心,西安 710061;2陕西省肿瘤精准医学重点实验室;3西安交通大学第一附属医院消化内科;4西安交通大学第一附属医院骨科;5西安交通大学第一附属医院皮肤科;6西安交通大学第一附属医院检验科;7西安交通大学医学部附属红会医院关节病医院骨坏死与关节重建病区;*通讯作者,E-mail:houweikun@xjtu.edu.cn)
STAT3荧光素酶报告基因检测系统的构建及其检测STAT3活化能力的研究
王 博1,2,张 英3,王林玉1,2,江山娇1,2,蔡永松4,周 艳5,李琰清6,侯卫坤7*
(1西安交通大学第一附属医院转化医学中心,西安 710061;2陕西省肿瘤精准医学重点实验室;3西安交通大学第一附属医院消化内科;4西安交通大学第一附属医院骨科;5西安交通大学第一附属医院皮肤科;6西安交通大学第一附属医院检验科;7西安交通大学医学部附属红会医院关节病医院骨坏死与关节重建病区;*通讯作者,E-mail:houweikun@xjtu.edu.cn)
目的 构建STAT3荧光素酶报告基因检测系统并检测STAT3活化能力,为筛选STAT3活性调控相关药物提供实验基础。 方法 基因合成STAT3反应元件序列,退火形成含酶切位点的双链DNA,内切酶XhoⅠ和HindⅢ双酶切报告基因载体pGL6-TA,T4 DNA连接酶将STAT3反应元件插入pGL6-TA载体多克隆位点,将该载体转染HeLa细胞,G418筛选STAT3荧光素酶报告基因稳定表达的单克隆HeLa细胞株。5,10,20 ng/ml不同浓度激动剂IL-6和20,40,80 μmol/L抑制剂S3I-201刺激单克隆HeLa-STAT3-Luc细胞,检测荧光素酶对应的发光值验证STAT3荧光素酶报告基因检测系统的检测能力。 结果 测序和比对结果显示,STAT3荧光素酶报告基因系统pGL6-STAT3-Luc中STAT3反应元件序列正确;G418成功筛选出稳定表达STAT3荧光素酶报告基因的单克隆HeLa细胞株;5,10和20 ng/ml浓度IL-6可刺激HeLa-STAT3-Luc细胞中荧光素酶的活性显著升高(P<0.001),且分别升高5.4,10.3和20.0倍;不同时间点检测1 ng/ml和5 ng/ml浓度IL-6刺激HeLa-STAT3-Luc细胞,其荧光素酶的活性呈现线性增长趋势;40 μmol/L和80 μmol/L浓度的抑制剂S3I-201与10 ng/ml浓度IL-6共刺激HeLa-STAT3-Luc细胞,其荧光素酶的活性显著降低(P<0.001),STAT3活化的抑制率分别为18.9%和43.7%。 结论 成功构建STAT3荧光素酶报告基因检测系统,该系统具有有效检测STAT3活化水平的能力。
荧光素酶; 报告基因; JNK-STAT信号通路; STAT3
STAT3是STAT(signal transducer of activators of transcription)家族转录因子的重要成员,属于JAK(Janus kinase)-STAT信号通路特异性调节因子,在免疫、炎症、细胞自噬以及肿瘤等生理病理过程中发挥重要的调控作用[1]。酪氨酸激酶JAK磷酸化STAT3使STAT3形成二聚体,随后磷酸化的STAT3入核参与下游基因的转录调控。已有的研究表明,在高免疫球蛋白E综合征中STAT3功能缺失性突变,且与复发性感染和骨骼、牙齿的发育相关[2];STAT3基因功能获得型(GOF)突变导致多器官早发性自身免疫性疾病,包括类风湿性关节炎、糖尿病、甲状腺疾病以及肠道炎症[3];同时STAT3在多种肿瘤中的活化预示着不良的预后[4]。因此,研究STAT3在不同疾病发生发展过程中的作用对疾病的预防和治疗具有重要的意义。
报告基因(reporter gene)主要编码易于鉴定和检测的基因,从而起到报告和筛选性标记物的作用。研究人员通常将报告基因与目的基因相连形成融合基因,通过检测该报告基因的表达,定性和定量检测对目的基因;也可以在报告基因上游插入基因调控序列形成嵌合基因,进而通过检测该报告基因的表达来反映基因调控序列的调控作用。目前,常见的报告基因有lacZ、cat、gfp、rfp以及luc等,其对应的编码产物分别为β-半乳糖苷酶、氯霉素乙酰转移酶、绿色荧光蛋白、红色荧光蛋白和荧光素酶(luciferase)[5]。本研究选择荧光素酶作为报告基因,其可以催化虫荧光素氧化成氧化荧光素释放生物荧光[6]。同时以荧光素酶作为报告基因的体系检测极其灵敏,是高效检测基因表达和转录因子调控目的基因的常用方法。因此,构建STAT3报告基因检测系统是深入研究并快速检测STAT3活性的基础,为高通量筛选STAT3活性调控相关药物提供关键的研发工具。
本研究通过对现有报告基因载体pGL6-TA的改造,构建含有特异性STAT3反应元件的STAT3报告基因载体,在通过该载体构建的稳定表达STAT3报告基因的单克隆细胞,最终在该STAT3报告基因检测系统中通过STAT3激动剂和抑制剂检验该系统的有效性和检测能力,为STAT3的活性检测提供方法和思路,也为STAT3活性调控相关的药物研发和筛选提供实验基础。
1 材料和方法
1.1 质粒、菌株和细胞系
报告基因质粒pGL6-TA购自上海碧云天生物技术有限公司,该载体在pGL6-basic基础上添加TA promoter使得luc基因的基础转录水平提高。宿主菌E.coliDH5α购自天根生化科技(北京)有限公司;人宫颈癌细胞系(HeLa细胞)由西安交通大学第一附属医院转化医学中心保存,用含10% FBS高糖DMEM培养基,置于37 ℃、5% CO2培养箱中培养。
1.2 主要试剂
STAT3反应元件基因序列由苏州金唯智生物科技有限公司合成;DNA凝胶回收试剂盒购自北京天根生化科技有限公司;无内毒素质粒小量提取试剂盒购自美国Omega公司;高保真PCR酶Buffer购自北京全式金生物技术有限公司;限制性内切酶XhoⅠ和HindⅢ、T4 DNA连接酶均购自大连宝生物工程有限公司;高糖DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;转染试剂X-tremeGENE HP DNA Transfection Reagent购自瑞士Roche公司;遗传霉素(G418)购自美国Sigma-Aldrich公司;双荧光素酶报告系统试剂盒Dual-Luciferase Reporter Assay System购自美国Promega公司;人源白细胞介素6(IL-6)购自美国Peprotech公司;STAT3通路抑制剂S3I-201购自美国Selleck公司。
1.3 pGL6-STAT3-Luc报告基因质粒载体的构建
在报告基因载体pGL6-TA的多克隆位点区插入STAT3反应元件序列,从而形成STAT3反应元件、TA启动子、荧光素酶Luc基因序列和筛选抗性Neo基因的结构(见图1)。将基因合成的STAT3反应元件序列(序列见表1,两端含酶切位点XhoⅠ和HindⅢ)退火形成双链DNA。退火反应体系:上游和下游合成序列各2 μl,5×FastPfu Buffer 10 μl,ddH2O补至50 μl;退火反应条件:98 ℃ 3 min;98 ℃ 10 s,-0.1 ℃/循环,730个循环。将报告基因载体pGL6-TA质粒用限制性内切酶XhoⅠ和HindⅢ双酶切,酶切产物经0.8%琼脂糖凝胶电泳分析,使用DNA凝胶回收试剂盒纯化双酶切载体产物。按照退火产物4 μl和载体100 ng的量使用T4 DNA连接酶将STAT3反应元件序列连接在报告基因载体pGL6-TA上。将连接产物转化E.coliDH5α感受态细胞,同时以ddH2O和对照质粒作为阴性和阳性对照进行转化,涂布在含有氨苄青霉素(Amp)的LB平板上,37 ℃倒置培养14~16 h。挑取部分单克隆菌落进行菌落PCR鉴定(上游引物:5′- CTAGCAAAATAGGCTGTCCC -3′;下游引物为STAT3下游合成序列),将菌落PCR产物经1.5%琼脂糖凝胶电泳,阳性克隆送苏州金唯智生物科技有限公司进行测序鉴定。测序结果与合成STAT3反应元件序列比对分析,比对系列完全相同的质粒命名为pGL6-STAT3-Luc。

图1 pGL6-STAT3-Luc结构示意图Figure 1 Schematic representation of the construction of pGL6-STAT3-Luc
表1STAT3反应元件和TA启动子序列
Table1SequenceofSTAT3responseelementandTApromoter

Sequencename大小(bp)序 列 STAT3反应元件67CTCGAGTGCTTCCCGAACGTTGCTTCCCGAACGTTGCTTCCCGAACGTTGCTTCCGAACGTAAGCTT TA启动子23TAGAGGGTATATAATGGAAGCTC
1.4 pGL6-STAT3-Luc质粒转染
将pGL6-STAT3-Luc对应的菌液按照1 ∶100转接含Amp的LB培养液中,37 ℃振荡培养至细菌达到对数生长期,使用无内毒素质粒提取试剂盒提取用于转染的高质量pGL6-STAT3-Luc质粒,并使用Nano Drop对其进行定量。将人宫颈癌细胞HeLa以4×105/孔接种于细胞培养6孔板中,用含10% FBS高糖DMEM培养基,置于37℃、5% CO2培养箱中无菌培养。细胞接种后24 h弃培养基换为无抗生素的高糖DMEM培养基,按照转染试剂X-tremeGENE HP DNA Transfection Reagent说明书将构建的pGL6-STAT3-Luc和对照质粒pGL6-TA分别转染HeLa细胞,其中质粒和转染试剂的质量体积比在预实验后选择转染效果最好的1 ∶3。细胞转染后6 h弃培养基换为无抗生素的完全培养基,继续置于37℃、5% CO2培养箱中无菌培养。
1.5 稳定表达单克隆细胞的筛选
质粒转染后48 h,向HeLa细胞培养基中加入800 μg/ml G418进行细胞筛选。2 d换一次含G418的筛选培养基,持续筛选14 d。筛选结束后将活细胞进行消化计数,按照0.6个细胞/孔接种于96孔细胞培养板中。2周后将其中的单克隆细胞扩大培养,将其与对照单克隆细胞分别命名为HeLa-STAT3-Luc和HeLa-TA-Luc。
1.6 稳定表达单克隆细胞有效性的检验
将上述构建好的HeLa-STAT3-Luc和HeLa-TA-Luc细胞分别进行细胞计数,再按照2×104/孔接种于细胞培养96孔板中,用含DMEM完全培养基,置于37 ℃、5% CO2培养箱中无菌培养。细胞接种后24 h加入STAT3信号通路激动剂IL-6,设置不同浓度0,5,10,20 ng/ml,每组5个复孔。加入IL-6刺激后24 h,按照双荧光素酶报告系统试剂盒说明书,使用Promega发光检测仪只检测荧光素酶对应的发光值。将HeLa-STAT3-Luc细胞同样按照2×104/孔接种于细胞培养96孔板中,细胞接种后24 h分别加入0.1,1,5 ng/ml的IL-6刺激分别在刺激后0,3,6,9,12,24 h按照上述方法检测发光值。
1.7 STAT3抑制剂对稳定表达单克隆细胞的抑制作用检测
将HeLa-STAT3-Luc细胞按照2×104/孔接种于细胞培养96孔板中,用含DMEM完全培养基,置于37 ℃、5% CO2培养箱中无菌培养。细胞接种后24 h加入10 ng/ml IL-6刺激细胞6 h,再分别加入0,20,40,80 μmol/L的STAT3抑制剂S3I-201后共刺激12 h,按照上述方法检测发光值。
1.8 统计学分析
2 结果
2.1 报告基因载体pGL6-STAT3-Luc的构建及鉴定
将STAT3反应元件序列退火产物连接到双酶切的报告基因质粒pGL6-TA上,转化DH5α感受态细胞,涂布在含有Amp抗性的LB平板上,37 ℃倒置培养过夜,分别挑取单克隆菌落进行菌落PCR鉴定。使用载体上游通用引物和退火的下游序列进行菌落PCR,PCR产物经1.5%琼脂糖凝胶电泳,可见1条大小为138 bp与理论大小相一致的条带(见图2)。将构建成功的质粒1和2号送公司测序,测序结果与合成的STAT3反应元件序列进行比对,结果表明其序列完全一致,STAT3反应元件序列已成功插入pGL6-TA中,故已成功构建报告基因载体pGL6-STAT3-Luc。
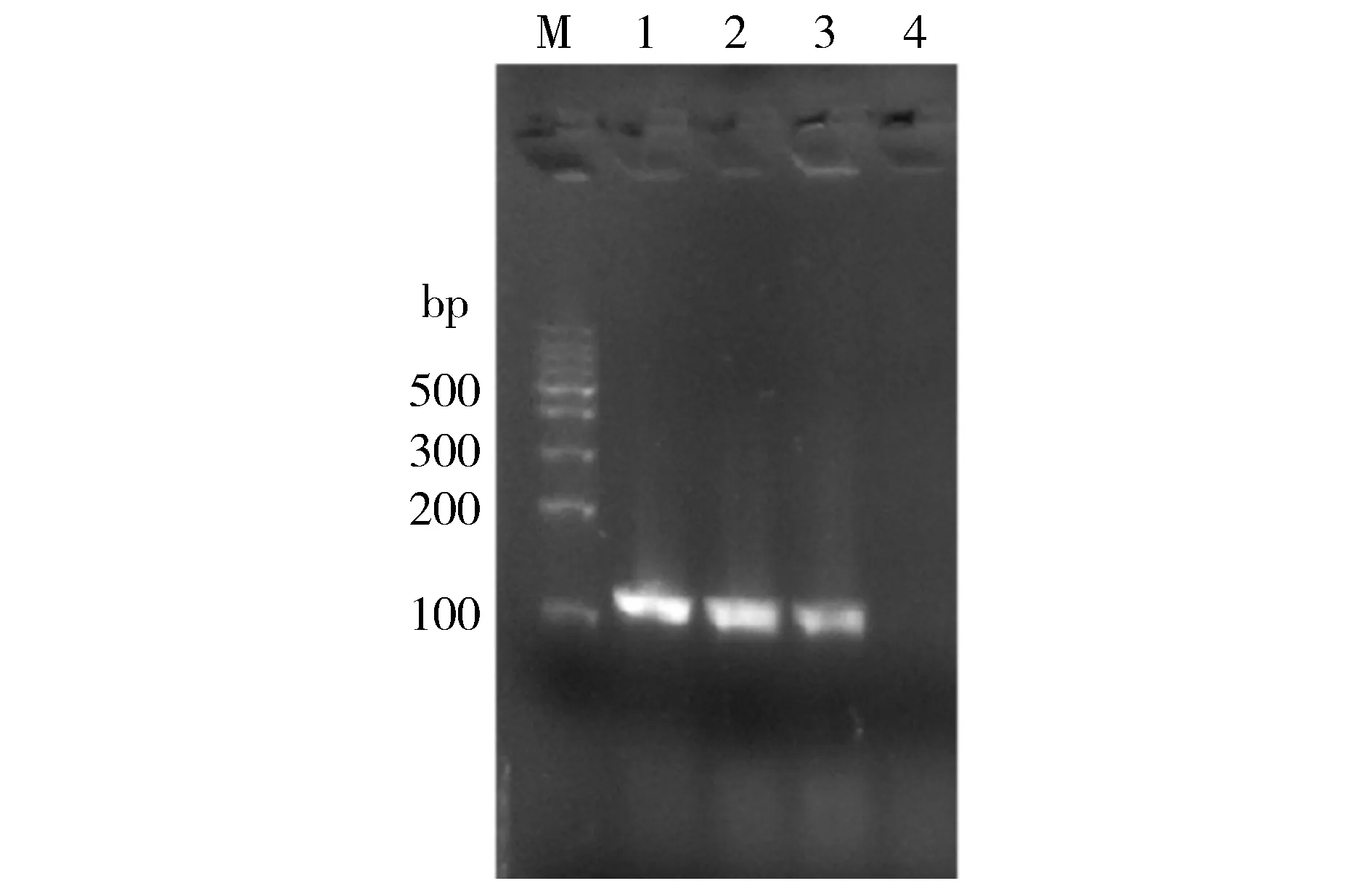
M.100 bp marker;1-4.构建的pGL6-STAT3-Luc载体单克隆菌落PCR产物图2 重组pGL6-STAT3-Luc质粒的菌落PCR鉴定Figure 2 Identification of recombinant plasmid pGL6-STAT3-Luc by colony PCR
2.2 pGL6-STAT3-Luc稳定表达单克隆细胞系的构建
将已构建的报告基因载体pGL6-STAT3-Luc和对照载体pGL6-TA分别转染HeLa细胞,随后经过G418筛选以及单克隆细胞的分离,最终成功得到稳定表达报告基因的单克隆细胞株,HeLa-STAT3-Luc和HeLa-TA-Luc。使用不同浓度的STAT3信号通路激动剂IL-6(0,5,10,20 ng/ml)对两组细胞进行刺激24 h,检测荧光素酶的活性。结果显示在5,10,20 ng/ml的IL-6刺激下,HeLa-STAT3-Luc细胞中荧光素酶的活性显著升高,相对0 ng/ml的IL-6刺激HeLa-STAT3-Luc组荧光素酶的活性分别升高5.4,10.3和20.0倍,差异有统计学意义(P<0.001,见表2)。其中对照细胞HeLa-TA-Luc在不同浓度IL-6刺激下荧光素酶的活性相比无显著变化,组间没有统计学差异。该结果说明HeLa-STAT3-Luc可以有效检测STAT3的活化,故已成功筛选出检测STAT3活化的荧光素酶报告基因系统HeLa-STAT3-Luc细胞。



IL⁃6浓度HeLa⁃TA⁃LucHeLa⁃STAT3⁃Luc0ng/ml133.00±5.16 1.05×106±8.07×1045ng/ml136.50±5.31 5.68×106±3.14×105∗∗∗10ng/ml146.17±7.65 1.08×107±8.02×105∗∗∗20ng/ml140.67±8.52 2.10×107±5.10×105∗∗∗
RLU(relative light unit)是相对光单位;以0 ng/ml的IL-6刺激HeLa-STAT3-Luc为对照,与其相比,***P<0.001
2.3 STAT3荧光素酶报告基因系统检测能力的验证
将已筛选出检测STAT3活化的荧光素酶报告基因系统HeLa-STAT3-Luc细胞,选取不同浓度IL-6(0.1,1,5 ng/ml)对该细胞进行刺激,检测刺激后0,3,6,9,12,24 h的荧光素酶活性。结果表明,HeLa-STAT3-Luc细胞在1 ng/ml和5 ng/ml浓度IL-6刺激的不同时间下,呈现出较好的线性增长趋势(见图3)。该结果表明筛选出检测STAT3活化的荧光素酶报告基因系统HeLa-STAT3-Luc细胞,可以在不同浓度STAT3激动剂的刺激下检测STAT3的活性。

图3 不同浓度IL-6对HeLa-STAT3-Luc单克隆细胞在不同时间点的刺激作用Figure 3 Effect of different concentrations of IL-6 on HeLa-STAT3-Luc and HeLa-TA-Luc monoclonal cells at different time points
使用STAT3抑制剂S3I-201检验STAT3荧光素酶报告基因系统检测能力,将HeLa-STAT3-Luc细胞加入10 ng/ml IL-6预刺激后,再分别加入0,20,40,80 μmol/L的STAT3抑制剂S3I-201后共刺激12 h检测荧光素酶活性。结果表明,在10 ng/ml的IL-6预刺激下,各组相对未刺激组荧光素酶的活性显著升高,其中未加入STAT3抑制剂S3I-201组荧光素酶的活性升高7.1倍,而加入不同浓度S3I-201能够抑制STAT3活化促进的荧光素酶活性升高,在20 μmol/L浓度S3I-201的作用下,相比未加入S3I-201组荧光素酶的活性相有所下降但无显著性变化,组间没有统计学差异;在40 μmol/L和80 μmol/L浓度S3I-201组,荧光素酶活性显著降低,差异有统计学意义(P<0.001,见图4),STAT3活化的抑制率分别为18.9%和43.7%。通过检测L-6对HeLa-STAT3-Luc细胞的刺激作用和抑制剂S3I-201对其的抑制作用,结果说明STAT3荧光素酶报告基因系统HeLa-STAT3-Luc细胞可以有效地检测STAT3活化水平,故已成功构建STAT3荧光素酶报告基因检测系统。

以10 ng/ml IL-6刺激且未加抑制剂S3I-201处理的HeLa-STAT3-Luc为对照,与其相比,***P<0.001图4 STAT3抑制剂S3I-201对HeLa-STAT3-Luc单克隆细胞的抑制作用Figure 4 Inhibition of HeLa-STAT3-Luc monoclonal cells by STAT3 inhibitor S3I-201
3 讨论
JNK-STAT信号通路是一条细胞外因子调控细胞相关基因表达的信号转导通路,参与细胞的增殖、凋亡、分化以及免疫调节等众多细胞重要的生物学过程[7]。这条信号通路是细胞内相对简单,从细胞膜到细胞核的转导过程,其主要由酪氨酸激酶JAK相关受体、酪氨酸激酶JAK和转录因子STAT组成。酪氨酸激酶JAK相关受体主要介导细胞外信号,包括不同的细胞因子、干扰素、生长因子和集落刺激因子等[8]。该受体的胞内段具有酪氨酸激酶JAK的结合位点,当细胞外信号刺激后JAK磷酸化,从而磷酸化其下游靶蛋白导致细胞内信号的传导[9]。酪氨酸激酶JAK属于非跨膜型酪氨酸激酶,该家族拥有4个成员即JAK1、JAK2、JAK3和TYK2,它们虽然在结构上具有7个JAK同源结构域,但由于受体结合结构域的不同而特异性结合不同的JAK相关受体[10]。转录因子STAT在该信号通路中发挥着关键性的转录激活功能,其家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6,在结构上具有N端保守序列、DNA结合区、SH2和SH3结构域以及C端转录激活区[11]。细胞外信号结合相应受体,酪氨酸激酶JAK相关受体上结合的酪氨酸激酶JAK通过交互的酪氨酸磷酸化作用从而活化,催化结合在受体上的转录因子STAT磷酸化,磷酸化的STAT形成同源二聚体进入细胞核,通过DNA结合区调节特异的靶基因转录[12]。
STAT3最早作为IL-6信号转导中的急性期反应因子被发现,其SH2结构域的酪氨酸残基(Tyr705)被氨酸激酶JAK磷酸化后,形成同源二聚体,进入细胞核参与DNA结合的定位,该过程是导致STAT3转录活性激活的主要机制[13,14]。同时STAT3的丝氨酸残基(Ser727)可以被MAPK以及mTOR信号通路磷酸化,从而增强其转录活性[15,16]。正常的STAT3转录调控参与脊椎动物的发育以及通过调控炎症和免疫从而影响正常组织的功能。STAT3可以通过被抑制的PI3K信号通路或EIF2AK2/PKR信号通路抑制性调节细胞自噬[17,18]。STAT3通过控制胚胎干细胞的增殖与稳态,从而调控线粒体相关基因的表达和线粒体的呼吸作用,且线粒体的STAT3可以调控γ谷氨酰循环以及调节谷胱甘肽和活性氧(ROS)的产生[19,20]。特别是线粒体的STAT3参与Ras基因介导的致癌性转化过程,由于Ras功能获得型突变刺激MEK-Erk信号通路以及STAT3的Ser727磷酸化[21,22]。同时,在Ras介导自发的骨髓增殖性和胰腺肿瘤动物模型中证实STAT3参与肿瘤形成[23,24]。由于STAT3在肿瘤形成过程中扮演着转导促癌相关基因转录的重要节点分子,目前已研发STAT3小分子抑制剂ISIS-STAT3Rx、OPB-51062和OPB-31121并进行临床试验[7]。如前所述,研制并快速筛选出针对JAK-STAT信号通路中STAT3分子的抑制剂,在众多疾病特别是肿瘤的治疗和预防中具有重要的价值和应用前景。
本研究通过对报告基因载体pGL6-TA进行快速改造,在载体的多克隆位点插入STAT3反应元件序列,成功构建STAT3报告基因载体pGL6-STAT3-Luc。将载体转染HeLa细胞再通过G418进行筛选最终得到HeLa-STAT3-Luc稳定表达单克隆细胞株。5,10和20 ng/ml浓度IL-6刺激HeLa-STAT3-Luc细胞24 h,荧光素酶的活性显著升高,分别升高5.4,10.3和20.0倍;且该细胞在IL-6刺激的不同时间下,呈现出较好的线性增长趋势;在10 ng/ml的IL-6预刺激下,分别加入40和80 μmol/L浓度STAT3抑制剂S3I-201共刺激12 h,荧光素酶活性显著降低,对STAT3活化的抑制率分别为18.9%和43.7%。该结果说明本研究成功构建STAT3荧光素酶报告基因检测系统,且该系统可以在不同浓度STAT3的激动剂和抑制剂刺激下检测STAT3的活性。本研究构建的STAT3报告基因检测系统不仅提供了一种快速准确针对STAT3活性检测的系统,而且为STAT3新药抑制剂的研发和高通量筛选提供了关键的实验基础。
[1] Huynh J, Etemadi N, Hollande F,etal. The JAK/STAT3 axis: A comprehensive drug target for solid malignancies[J]. Semin Cancer Biol, 2017, 45:13-22.
[2] Levy DE, Loomis CA. STAT3 signaling and the hyper-IgE syndrome[J]. N Engl J Med, 2007, 357 (16):1655-1658.
[3] Milner JD, Vogel TP, Forbes L,etal. Early-onset lymphoproliferation and autoimmunity caused by germline STAT3 gain-of-function mutations[J]. Blood, 2015, 125 (4):591-599.
[4] Klampfer L.Signal transducers and activators of transcription(STATs): Novel targets of chemopreventive and chemotherapeutic drugs[J]. Curr Cancer Drug Targets,2006,6(2):107-121.
[5] Koo J, Kim Y, Kim J,etal. A GUS/luciferase fusion reporter for plant gene trapping and for assay of promoter activity with luciferin-dependent control of the reporter protein stability[J]. Plant Cell Physiol, 2007, 48(8):1121-1131.
[6] Fraga H, Fernandes D, Novotny J,etal. Firefly luciferase produces hydrogen peroxide as a coproduct in dehydroluciferyl adenylate formation[J]. Chembiochem, 2006, 7(6):929-935.
[7] O'Shea JJ, Schwartz DM, Villarino AV,etal. The JAK-STAT pathway: impact on human disease and therapeutic intervention[J]. Annu Rev Med, 2015, 66:311-328.
[8] O'Shea JJ, Holland SM, Staudt LM. JAKs and STATs in immunity, immunodeficiency, and cancer[J]. N Engl J Med, 2013, 368(2):161-170.
[9] Schindler C, Darnell JE, Jr. Transcriptional responses to polypeptide ligands: the JAK-STAT pathway[J]. Annu Rev Biochem, 1995, 64:621-651.
[10] Casanova JL, Holland SM, Notarangelo LD. Inborn errors of human JAKs and STATs[J]. Immunity, 2012, 36(4):515-528.
[11] Villarino AV,Kanno Y,O’Shea JJ. Mechanisms and consequences of Jak-STAT signaling in the immune system[J]. Nat Immunol,2017,18(4):374-384.
[12] Banerjee S, Biehl A, Gadina M,etal. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: current and future prospects[J]. Drugs, 2017, 77(5):521-546.
[13] Zhong Z, Wen Z, Darnell JE, Jr. Stat3: a STAT family member activated by tyrosine phosphorylation in response to epidermal growth factor and interleukin-6[J]. Science, 1994, 264(5155):95-98.
[14] Yu CL, Meyer DJ, Campbell GS,etal. Enhanced DNA-binding activity of a Stat3-related protein in cells transformed by the Src oncoprotein[J]. Science, 1995, 269(5220):81-83.
[15] Wen Z, Zhong Z, Darnell JE Jr. Maximal activation of transcription by Stat1 and Stat3 requires both tyrosine and serine phosphorylation[J]. Cell, 1995, 82(2):241-250.
[16] Shen Y, Schlessinger K, Zhu X,etal. Essential role of STAT3 in postnatal survival and growth revealed by mice lacking STAT3 serine 727 phosphorylation[J]. Mol Cell Biol, 2004, 24(1):407-419.
[17] Lipinski MM, Hoffman G, Ng A,etal. A genome-wide siRNA screen reveals multiple mTORC1 independent signaling pathways regulating autophagy under normal nutritional conditions[J]. Dev Cell, 2010, 18(6):1041-1052.
[18] Niso-Santano M, Shen S, Adjemian S,etal. Direct interaction between STAT3 and EIF2AK2 controls fatty acid-induced autophagy[J]. Autophagy, 2013, 9(3):415-417.
[19] Carbognin E, Betto RM, Soriano ME,etal. Stat3 promotes mitochondrial transcription and oxidative respiration during maintenance and induction of naive pluripotency[J]. EMBO J, 2016, 35(6):618-634.
[20] Garama DJ, Harris TJ, White CL,etal. A synthetic lethal interaction between glutathione synthesis and mitochondrial reactive oxygen species provides a tumor-specific vulnerability dependent on STAT3[J]. Mol Cell Biol, 2015, 35(21):3646-3656.
[21] Gough DJ,Corlett A,Schlessinger K,etal.Mitochondrial STAT3 supports Ras-dependent oncogenic transformation[J]. Science, 2009, 324(5935):1713-1716.
[22] Gough DJ, Koetz L, Levy DE. The MEK-ERK pathway is necessary for serine phosphorylation of mitochondrial STAT3 and Ras-mediated transformation[J]. PLoS One, 2013, 8(11):e83395.
[23] Gough DJ, Marie IJ, Lobry C,etal. STAT3 supports experimental K-RasG12D-induced murine myeloproliferative neoplasms dependent on serine phosphorylation[J]. Blood, 2014, 124(14): 2252-2261.
[24] Corcoran RB, Contino G, Deshpande V,etal. STAT3 plays a critical role in KRAS-induced pancreatic tumorigenesis[J]. Cancer Res, 2011, 71(14):5020-5029.
EstablishmentofSTAT3luciferasereportergeneassaysystem
WANG Bo1,2,ZHANG Ying3,WANG Linyu1,2,JIANG Shanjiao1,2,CAI Yongsong4,ZHOU Yan5,LI Yanqing6,HOU Weikun7*
(1CenterforTranslationalMedicine,FirstAffiliatedHospitalofXi'anJiaotongUniversity,Xi’an710061,China;2KeyLaboratoryforTumorPrecisionMedicineofShaanxiProvince;3DepartmentofGastroenterology,FirstAffiliatedHospitalofXi’anJiaotongUniversity;4DepartmentofOrthopaedics,FirstAffiliatedHospitalofXi’anJiaotongUniversity;5DepartmentofDermatology,FirstAffiliatedHospitalofXi’anJiaotongUniversity;6DepartmentofLaboratoryMedicine,FirstAffiliatedHospitalofXi’anJiaotongUniversity;7OsteonecrosisandJointReconstructionWard,JointSurgery,Xi'anHonghuiHospital,HealthScienceCenter,Xi’anJiaotongUniversity;*Correspondingauthor,E-mail:houweikun@xjtu.edu.cn)
ObjectiveTo construct STAT3 luciferase reporter gene assay system, and verify the capability of STAT3 activation for screening STAT3 activity-related drugs.MethodsThe sequence of STAT3 response element was synthesized, and annealed to form double-stranded DNA containing the restriction endonuclease sites. The vector pGL6-TA was digested with restriction endonucleaseXhoⅠandHindⅢ.The STAT3 response element was inserted into vector pGL6-TA with T4 DNA ligase. The vector was transfected into HeLa cells and G418 was used to screen the monoclonal cell line stably expressing STAT3 luciferase reporter gene. The monoclonal HeLa-STAT3-Luc cells were stimulated with different concentrations of agonist IL-6 and inhibitor S3I-201, and the luminescence values were detected to verify the detection capability of STAT3 luciferase reporter assay system.ResultsThe results of sequencing and alignment results showed that the sequence of STAT3 response element in vector pGL6-STAT3-Luc was correct. The monoclonal HeLa cell line, stably expressing STAT3 luciferase reporter gene, was successfully screened with G418. Compared with 0 ng/ml IL-6, the activity of luciferase in HeLa-STAT3-Luc cells treated with 5, 10, 20 ng/ml IL-6 was significantly increased by 5.4, 10.3 and 20.0 times, respectively(P<0.001).The luciferase reaction showed a linear increasing trend in HeLa-STAT3-Luc cells treated with 1 ng/ml and 5 ng/ml IL-6 at different time points.The activity of luciferase in HeLa-STAT3-Luc cells co-stimulated with 40 μmol/L or 80 μmol/L S3I-201 and 10 ng/ml IL-6 was significantly decreased compared with 10 ng/ml IL-6(P<0.001), and the inhibition rates of STAT3 activation were 18.9% and 43.7%, respectively.ConclusionThe STAT3 luciferase reporter gene assay system can be successfully constructed, and this system has the ability to effectively detect the activation level of STAT3.
luciferase; reporter gene; JNK-STAT signaling pathway; STAT3
国家自然科学基金资助项目(81201373;81703130);陕西省社会发展科技攻关项目(2016SF-238);西安交通大学第一附属医院院基金资助项目(2016QN-13)
王博,男,1987-12生,硕士,实习研究员,E-mail:realwbo@163.com
2017-08-11
Q78
A
1007-6611(2017)11-1108-06
10.13753/j.issn.1007-6611.2017.11.005
