IAA改善PEG处理下白三叶幼苗叶片抗氧化保护和渗透调节能力
2017-11-29李亚萍
李亚萍,彭 燕
(四川农业大学动物科技学院,四川 成都 611130)
IAA改善PEG处理下白三叶幼苗叶片抗氧化保护和渗透调节能力
李亚萍,彭 燕
(四川农业大学动物科技学院,四川 成都 611130)
以‘Pixie’白三叶(Trifoliumrepenscv. ‘Pixie’)为试材,通过PEG(聚乙二醇-6000)模拟干旱胁迫,研究植物生长素(IAA)对白三叶幼苗抗旱性的影响。结果表明,1 μmol·L-1IAA能够显著(Plt;0.05)提高15% PEG(-0.3 MPa)干旱胁迫下白三叶幼苗的抗旱性;外源IAA不同程度地提高了白三叶幼苗叶片超氧化物歧化酶、过氧化物酶、过氧化氢酶和抗坏血酸过氧化物酶活性,以及还原型ASA和GSH的含量,降低相对电导率、丙二醛、超氧阴离子和过氧化氢含量,有效缓解了叶片膜质损伤和氧胁迫伤害;外源IAA亦可显著提高白三叶叶片总氨基酸和游离脯氨酸含量,有效降低了渗透势,提高叶片相对含水量。相似地,干旱条件下外源1 μmol·L-1IAA提高了离体叶片相对含水量并有效缓解了膜质损伤,但60 μmol·L-1极性运输抑制剂(NPA)以及60 μmol·L-1合成抑制剂(L-AOPP)不同程度地加剧了叶片失水和膜质损伤。以上结果表明:1 μmol·L-1IAA通过提高干旱胁迫下白三叶抗氧化保护能力和渗透调节能力,改善了白三叶幼苗的抗旱性。
白三叶;干旱胁迫;生长素;膜质损伤;抗氧化保护;渗透调节
植物激素在响应外界刺激和内部信号中扮演着关键角色,植物激素IAA及其分配比率调控了植物的生长模式和发展过程,包括顶端优势、向光性、向重力性以及胚胎的形成发展、器官的形态发生、维管组织的分化和向性生长等[1-2]。研究表明,IAA与植物逆境胁迫反应关系密切,且通过调控生长素响应基因的表达,改善植物对环境胁迫的忍耐性。目前的研究主要发现了3个家族的早期IAA信号响应基因,分别为Aux/IAA(Auxin/indoleacetic)、GH3(Gretchen Hagen 3)以及SAUR(Small auxin up RNA)[3-4]。研究证明,水稻(Oryzasativa)中鉴定出的31个Aux/IAA基因,其中有些基因受干旱、盐以及冷胁迫的诱导[5-6];Feng等[7]研究发现,盐、干旱以及重金属(Cd)胁迫等调控了13个玉米(Zeamays)zmGH3基因的表达水平。外源添加NAA提高了ABA、IAA含量以及抗氧化酶的活性,增强了大豆(Glycinemax)的抗旱性[8]。外源IAA处理诱导ROS的瞬时增加[9-10],并增加了玉米细胞过氧化氢酶的活性[11];提高拟南芥(Arabidopsisthaliana)幼苗抗氧化酶的活性,增加了抗旱性[12];转入生长素合成基因iaaH和超表达OSIAA6基因促进生长素合成,增强植株的抗旱性[13-14],因此,IAA可能通过含量的变化调控植物对干旱的响应。
目前,IAA与植物逆境胁迫的关系已成为研究的重点,但大多研究主要集中在拟南芥、玉米、水稻等模式植物。白三叶(Trifoliumrepens)是一种优良的豆科牧草,同时也是一种常见的园林地被植物,因其调控蒸腾能力低,根系不发达等原因,易遭受干旱胁迫。因此,本研究以白三叶品种‘Pixie’为材料,通过根施IAA和采用IAA极性运输抑制剂(NPA)[15]、生物合成抑制剂(L-AOPP)[15]处理离体叶片,来探索PEG干旱胁迫下,IAA对白三叶品种‘Pixie’抗旱性的影响,旨在为研究IAA与植物抗逆性影响提供理论依据,也为改善白三叶抗旱性寻找新方法。
1 材料与方法
1.1供试材料
供试种子白三叶‘Pixie’购自北京猛犸种业有限公司,IAA购自Sigma公司。
1.2试验设计
1.2.1材料培养 称取籽粒饱满、大小均一的白三叶种子0.8 g,先经5%的NaClO消毒洗净后,均匀撒播于装有等量石英砂的培育盆中(深9 cm,宽18 cm,长24 cm),培育盆置于光照培养箱内,条件为白天23 ℃/16 h,夜间19 ℃/8 h,光照强度为500 mmol·(m2·s)-1,相对湿度为75%,前7 d每天补充蒸馏水,待种子发芽后用Hoagland全营养液培养幼苗,每2 d更换一次营养液,每天按一定次序轮换材料的位置,至植株长出两片成熟叶片(约30 d)时,用于试验处理。
1.2.2外源IAA处理与干旱胁迫 将上述培育的材料进行如下3个处理:1)对照(CK),以Hoagland全营养液正常培养材料;2)PEG处理 (D),使用含有15% PEG-6000的Hoagland全营养液进行干旱胁迫处理;3)IAA预处理后再进行PEG处理(IAA+D),Hoagland全营养液中加入1 μmol·L-1的IAA预处理7 d后,再用15% PEG-6000,渗透势为-0.3 MPa进行干旱胁迫处理,每个处理设4个生物学重复。分别于PEG处理0、7、14 d时取样测定各处理白三叶叶片的相关生理指标。
1.2.3离体叶片的IAA及其合成与极性运输抑制剂处理 材料培养同1.2.1,剪取白三叶幼苗的第2片成熟叶在蒸馏水中浸泡1 h,以消除机械损伤。然后放入50 mL离心管中分别进行以下处理:1)CK(对照),用蒸馏水浸泡叶片;2)D,用15%的PEG溶液浸泡叶片;3)D+IAA,用含有1 μmol·L-1IAA的15%PEG溶液浸泡叶片;4)D+NPA,用含有60 μmol·L-1Naptalam(NPA,IAA极性运输抑制剂)的15%PEG溶液浸泡叶片;5)D+L-AOPP用含有60 μmol·L-1L-2Aminooxy-3-pheny propionic acid (L-AOPP, IAA合成抑制剂)的15%PEG溶液浸泡叶片,处理时间为12 h,每个处理设6个生物学重复,每个重复有16片叶。
1.3指标测定及方法
相对含水量(relative water content,RWC)采用烘干法测定[16];电解质渗透率(relative electrolytic leakage,EL)采用电导率仪测定[17];丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸比色法测定[18];超氧化物歧化酶(superoxide dismutase,SOD)活性采用核黄素-NBT法测定[19];过氧化氢酶(catalase,CAT)采用紫外吸收法进行测定[20]; 过氧化物酶(peroxidase,POD)采用愈创木酚显色法法测定[20];抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性参照Nakano 和Asada[21]的方法测定;超氧阴离子(oxygen free radical,O2-)含量和过氧化氢(H2O2)含量用酶标仪法测定,试剂盒由苏州科铭生物技术有限公司提供;还原型抗坏血酸含量(ascorbic acid,ASA)和还原型谷胱甘肽含量(reduced glutathione,GSH)以及氨基酸(amino acid,AA)采用苏州科铭生物技术有限公司提供的试剂盒测定;游离脯氨酸含量采用茚三酮比色法[18];可溶性糖含量采用蒽酮乙酸乙酯比色法测定[18];叶片渗透势采用露点渗透压仪(Vapro Pressure Osmometer,Wescor,Inc.,Logan,UT 84321,USA)测定。
1.4数据分析
采用Excel 2003进行绘图与数据处理;采用SPSS 19.0软件对全文数据进行ANOVA方差分析和显著性检验。
2 结果与分析
2.1IAA对干旱胁迫下白三叶幼苗外观表现的影响
正常水分条件下(0 d),各处理白三叶长势良好,叶片外观表现没有差异(图1)。PEG处理7 d时,经IAA预处理的白三叶植株萎蔫程度较轻,而直接进行PEG处理的白三叶植株出现明显萎蔫,说明外源IAA预处理对白三叶遭遇的干旱胁迫有缓解作用。

图1 IAA对干旱胁迫下白三叶叶片外观表现的影响
2.2IAA对干旱胁迫下白三叶幼苗RWC、EL以及MDA含量的影响
白三叶叶片的RWC随着干旱胁迫时间的延长而不断下降,而外源 IAA预处理则减缓了干旱胁迫下叶片RWC的降低,在处理7和14 d时,IAA预处理白三叶的RWC比直接干旱胁迫分别显著高出26.45%和26.01%(Plt;0.05)(图2)。与此同时,白三叶叶片的EL、MDA含量在干旱胁迫下迅速升高,与直接干旱胁迫相比,在7和14 d时,IAA预处理的EL和MDA含量分别比直接干旱胁迫显著低26.29%、11.79%(图2B)和21.60%、15.89%(图2C)(Plt;0.05),说明外源添加IAA可减轻干旱胁迫对白三叶叶片细胞的损伤。
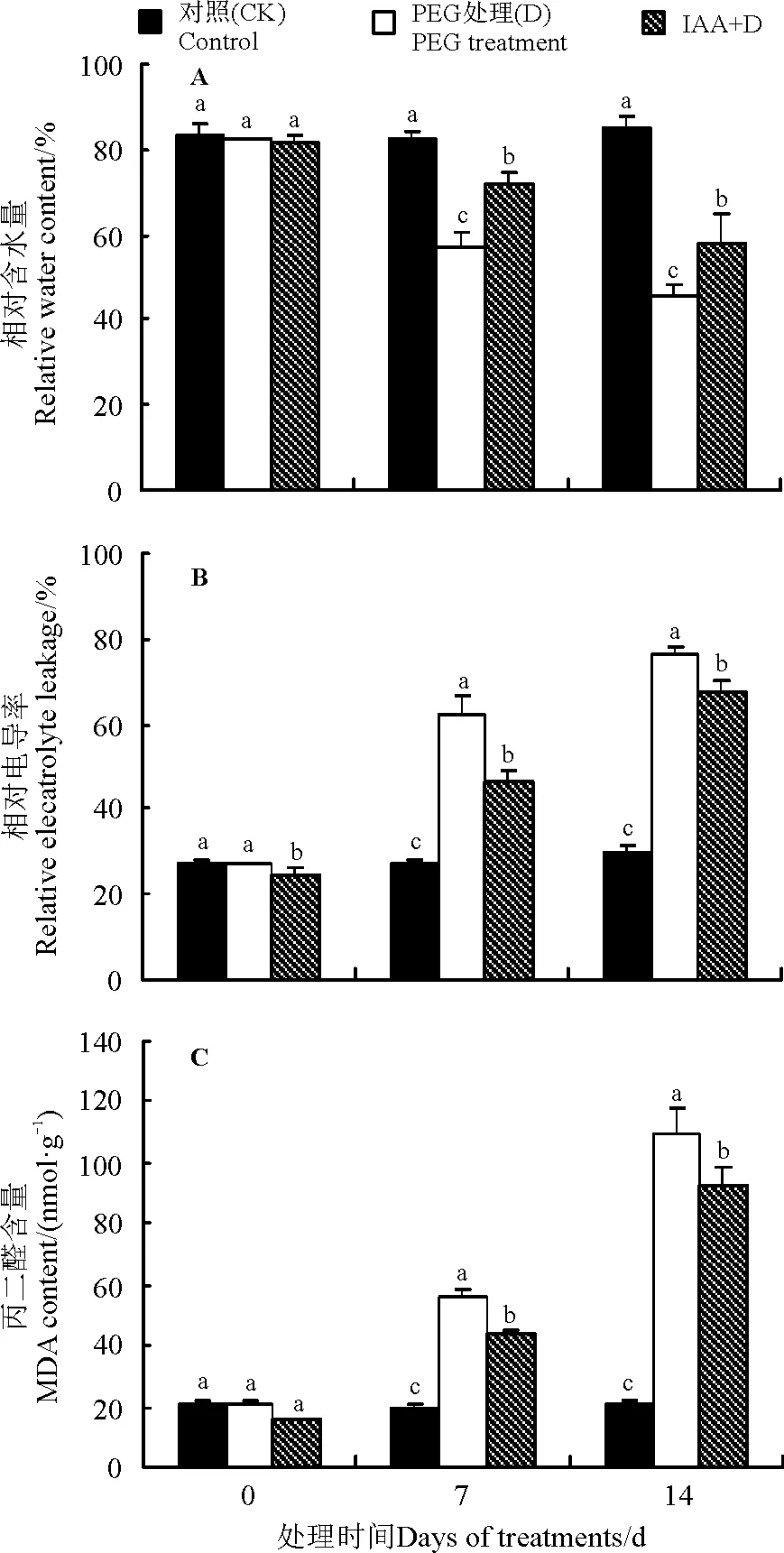
图2 IAA对干旱胁迫下白三叶叶片RWC、EL和MDA含量的影响
注:图中不同小写字母表示同一时间不同处理间差异显著(Plt;0.05)。下同。
Note: Different lowercase letters indicate significant difference among treatments at the same time at the 0.05 level; similarly for the following figures.
2.3IAA对干旱胁迫下白三叶叶片O2-和H2O2含量的影响
15%PEG干旱胁迫诱导O2-和 H2O2在叶片中不断积累,但IAA处理在胁迫7和14 d时维持了较低的O2-含量,分别低于直接干旱胁迫条件下18.15%和41.51%(Plt;0.05)(图3)。在干旱胁迫下,白三叶的 H2O2含量逐渐增高,但IAA处理以后, H2O2含量显著降低。在干旱胁迫7和14 d时,D处理 H2O2含量分别比IAA+D处理显著高49.37%和36.22%。
2.4IAA对干旱胁迫下白三叶叶片抗氧化酶活性的影响
干旱胁迫下,白三叶叶片SOD、APX活性随时间延长而持续升高,IAA预处理进一步提高了SOD、APX活性,在7和14 d时,IAA预处理叶片SOD活性比直接干旱处理分别高出44.05%和36.90%(Plt;0.05)(图4),APX活性分别显著高出41.55%和22.46(Plt;0.05)。随着干旱胁迫时间的延长,CAT和POD活性呈先升高后下降的趋势,但在7、14 d, IAA预处理的CAT和POD活性分别是直接干旱处理的1.41、1.69倍和1.51、1.47倍(Plt;0.05)。
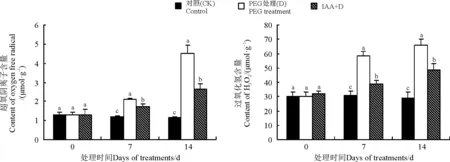
图3 IAA对干旱胁迫下白三叶叶片超氧阴离子和过氧化氢含量的影响
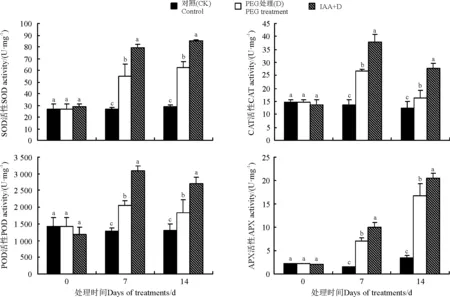
图4 IAA对干旱胁迫下白三叶叶片抗氧化酶活性的影响
2.5IAA对干旱胁迫下白三叶叶片抗氧化剂含量影响
白三叶幼苗叶片ASA含量随干旱胁迫时间的延长而降低。在干旱胁迫7和14 d时,与直接干旱胁迫处理相比,外源IAA预处理的ASA含量分别显著高出28.92%、53.44%(Plt;0.05)(图5);干旱胁迫下,白三叶叶片的GSH含量有所增加,7 d时达到最高,然后略有下降。在处理7和14 d时,IAA+D处理比D处理的GSH含量分别显著高出68.52%和94.28%。
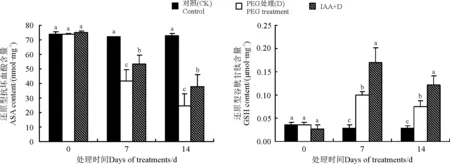
图5 IAA对干旱胁迫下白三叶叶片ASA和GSH含量的影响
2.6IAA对干旱胁迫下白三叶叶片氨基酸、游离脯氨酸、可溶性糖含量和渗透势的影响
干旱胁迫下,白三叶叶片总氨基酸和游离脯氨酸含量显著增加,而外源IAA预处理进一步提高了其含量。在干旱胁迫7、14 d时,IAA预处理的氨基酸和游离脯氨酸较直接胁迫处理分别显著高出32.70%、31.58%和20.32%、9.04%(Plt;0.05)(图6)。干旱胁迫下,D处理和IAA+D处理可溶性糖含量7 d时显著高于对照,14 d时则显著低于对照,IAA预处理的可溶性糖含量仅在7 d时高出直接干旱胁迫12.30%,14 d时,干旱胁迫两处理间差异不显著(Pgt;0.05)。干旱胁迫下,白三叶叶片的渗透势逐渐降低,在处理7和14 d时,IAA预处理的渗透势均显著低于直接干旱处理,说明IAA预处理具有增强干旱胁迫下白三叶的渗透调节能力。
2.7IAA、NPA、L-AOPP对干旱胁迫下离体白三叶叶片相对含水量和电导率的影响
为进一步验证白三叶叶片的内源IAA水平与其抗旱性有关,分别采用极性运输抑制剂NPA和生物合成抑制剂L-AOPP以改变和减少IAA在白三叶叶片中的分布及含量并测定叶片的抗旱性。与CK相比,PEG处理显著降低了白三叶叶片的相对含水量(Plt;0.05),D+NPA、D+L-AOPP处理的相对含水量则进一步降低,且D+L-AOPP处理显著低于D处理(Plt;0.05),IAA+D处理的相对含水量则与CK间差异不显著(Pgt;0.05)(图7);在15%PEG溶液中处理12 h后,D、D+L-AOPP、D+NPA处理的相对含水量均显著低于CK,较CK分别下降了11.7%、16.59%、12.52%。与此同时,D、IAA+D、D+L-AOPP、D+NPA处理的MDA含量均显著高于CK(Plt;0.05),且D+L-AOPP处理最高,显著高于其余处理(Plt;0.05)(图7),这说明白三叶叶片内IAA含量降低或运转受阻则会降低其抗旱性。
3 讨论与结论
干旱诱导活性氧(ROS)大量积累,超过植物自身清除能力时,细胞发生过氧化反应,严重损伤细胞膜系统[22]。为维持细胞活性氧平衡,植物进化出酶类和非酶类抗氧化防御系统。酶系统包括SOD、CAT、POD、APX等,非酶类包括ASA和GSH等抗氧化剂。IAA提高逆境胁迫下抗氧化酶活性和抗氧化剂含量,从而减轻氧胁迫的报道较多。外源IAA通过提高抗氧化酶SOD、CAT、POD等的活性降低了超氧阴离子和过氧化氢含量,从而增强拟南芥幼苗的抗旱性[12]。盐胁迫下,外源IAA通过提高黄瓜(Cucumissativus)幼苗还原性ASA和GSH的含量,进而增加抗氧化保护能力[23]。在本研究中,外源添加IAA显著提高白三叶幼苗抗氧化酶SOD、POD、CAT、APX活性和还原性ASA、GSH含量,降低了O2-含量和H2O2含量,从而验证了IAA在白三叶抗氧化防御系统中的促进作用。这与Cha等[24]在研究转入生长素合成酶基因的植株ROS清除能力增强的结果相似。相对电导率(EL)和丙二醛(MDA)反映了植物细胞膜的损伤程度,二者含量越低说明受到胁迫的影响越小[25]。在本研究根施和离体试验均表明,外源IAA处理的白三叶叶片EL和MDA含量低于直接干旱胁迫,而NPA和L-AOPP处理MDA含量高于直接干旱胁迫,这进一步说明IAA在应对植物干旱胁迫时发挥着重要作用。
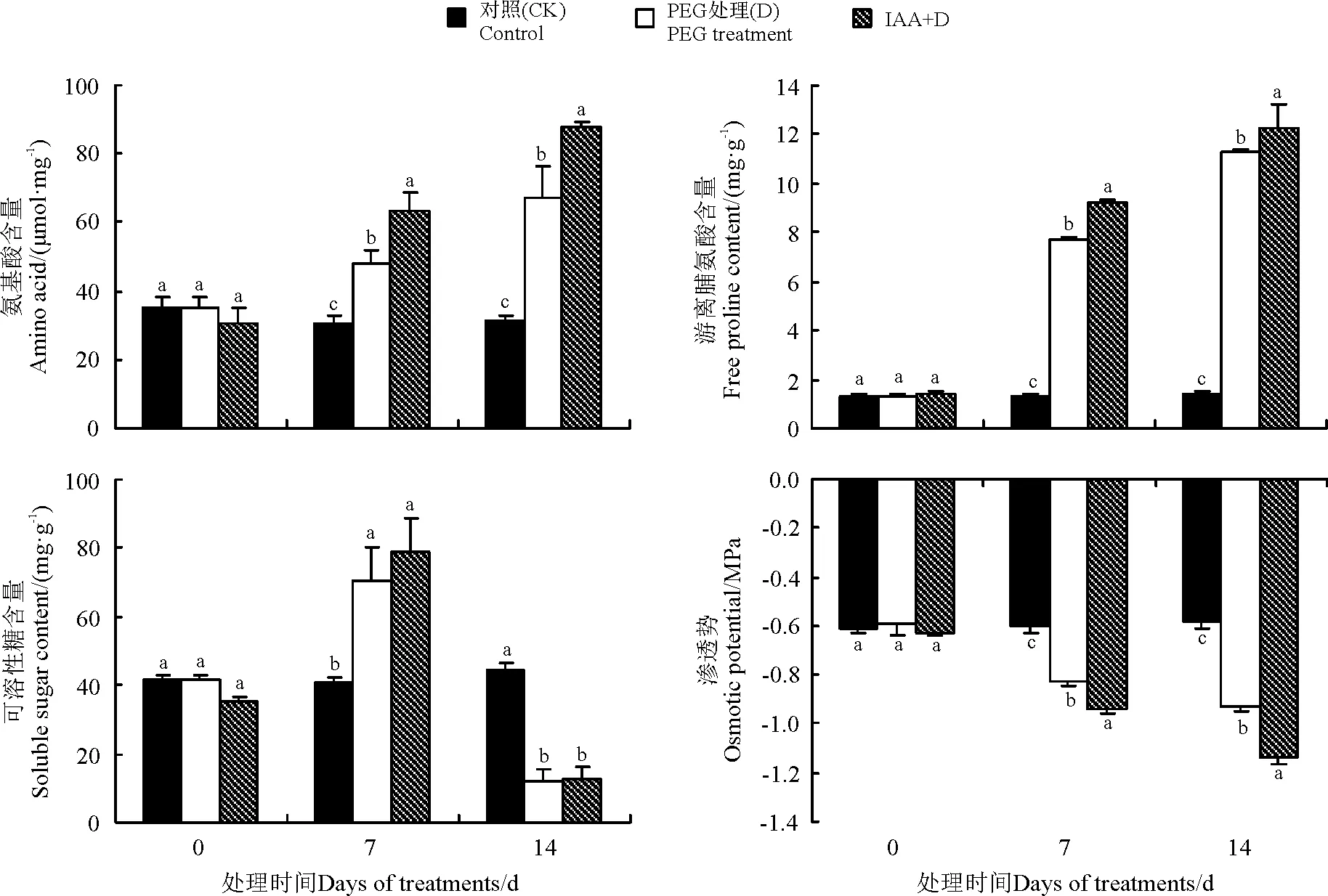
图6 IAA处理对干旱胁迫下白三叶叶片总氨基酸、脯氨酸和可溶性糖含量和渗透势的影响
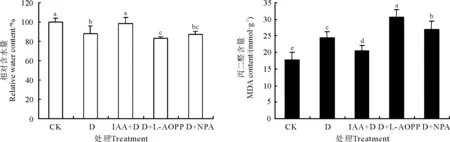
图7 D、D+IAA、D+L-AOPP、D+NPA处理对白三叶离体叶片相对含水量和MDA含量的影响
干旱条件下植物通过累积可溶性糖、游离氨基酸、有机酸等可溶性小分子渗透物质来调控细胞渗透势,防止水分散失并维持水分平衡;其次这些有机渗透调节物质能够保护细胞膜的结构和功能,发挥渗透保护的作用[26]。研究表明,逆境胁迫诱导氨基酸含量增加,主要作用在于增强渗透调节能力、调节铁离子的运输、调控气孔开放等[27]。本研究发现,干旱诱导氨基酸含量增加,但外源IAA进一步诱导了氨基酸含量的增加,说明氨基酸代谢参与了IAA改善的白三叶抗旱性。脯氨酸在响应逆境胁迫中不仅发挥渗透调节和渗透保护的功能,而且还能作为氮的来源维持碳氮平衡[28],本研究表明,外源IAA减缓了干旱胁迫对白三叶幼苗的伤害,同时增强了脯氨酸合成,暗示了IAA可能参与逆境胁迫下脯氨酸的代谢调控。干旱诱导可溶性糖含量的增加不仅提高了植物的吸水和保水能力,而且维持了蛋白质的特定结构与功能[29],本研究显示,干旱胁迫下可溶性糖前期增加,后期降低,外源IAA提高了轻度水分胁迫下可溶性糖含量的增加,但差异未达到显著。由此说明,干旱胁迫诱导游离总氨基酸、脯氨酸以及可溶性糖含量的增加调控了白三叶的渗透调节能力,降低渗透势值,但氨基酸含量的增加可能是外源IAA渗透渗值降低和渗透调节能力增强的主要原因,这可能也是IAA处理相对含水量高于直接干旱处理的主要原因。
4 结论
IAA参与众多植物生长发育过程,本研究结果发现,适宜浓度的IAA(1 μmol·L-1)能够有效提高白三叶幼苗对干旱环境的适应能力,主要通过以下两方面的机制:1)外源添加IAA促进抗氧化酶活性以及ASA、GSH含量的升高,提高了白三叶抗氧化能力,有效降低膜质损伤和氧伤害;2)外源添加IAA诱导了游离氨基酸含量的升高,提高叶片保水能力,从而提高了植株的耐旱性。
References:
[1] McSteen P.Auxin and monocot development.Cold Spring Harbor Perspectives in Biology,2010,2(3):1-17.
[2] 朱永超,李彬,廖伟彪.3种生长素对蓝叶忍冬枝条扦插生根的影响.草业科学,2016,33(1):61-66.
Zhu Y C,Li B,Liao W B.Effects of three auxins treatments on cutting rooting ofLonicerakorolkowi‘Zabclii’.Pratacultural Science,2016,33(1):61-66.(in Chinese)
[3] Guilfoyle T J.Auxin-regulated genes and promoters.New Comprehensive Biochemistry,1999,33:423-459.
[4] Chen Y,Hao X,Cao J.Small auxin upregulated RNA (SAUR) gene family in maize:Identification,evolution,and its phylogenetic comparison withArabidopsis,rice,and sorghum.Journal of Integrative Plant Biology,2014,56(2):133-150.
[5] Du H,Liu H,Xiong L.Endogenous auxin and jasmonic acid levels are differentially modulated by abiotic stresses in rice.Frontiers in Plant Science,2013,4:397.
[6] Song Y,Wang L,Xiong L.Comprehensive expression profiling analysis ofOsIAAgene family in developmental processes and in response to phytohormone and stress treatments.Planta,2009,229(3):577-591.
[7] Feng S G,Yue R Q,Sun T,Shen C J.Genome wide identification,expression analysis of auxin responsive GH3family genes in maize (ZeamaysL.) under abiotic stresses.Journal of Integrative Plant Biology,2015,57(9):783-795.
[8] Xing X H,Jiang H Q,Zhou Q,Xing H,Jiang H D,Wang S H.Improved drought tolerance by early IAA- and ABA-dependent H2O2accumulation induced by α-naphthaleneacetic acid in soybean plants.Plant Growth Regulation,2016,80(3):303-314.
[9] Joo J H,Bae Y S,Lee J S.Role of auxin-induced reactive oxygen species in root gravitropism.Plant Physiology,2001,126(3):1055-1060.
[10] Joo J H,Yoo H J,Hwang I,Lee J S,Nam K Y.Auxin-induced reactive oxygen species production requires the activation of phosphatidylinositol 3-kinase.FEBS Letters,2005,579(5):1243-1248.
[11] Guan L M,Scandalios J G.Catalase gene expression in response to auxin-mediated developmental signals.Physiologia Plantarum,2002,114(2):288-295.
[12] Shi H T,Chen L,Ye T T,Liu X D,Ding K J,Chan Z L.Modulation of auxin content inArabidopsisconfers improved drought stress resistance.Plant Physiology and Biochemistry,2014,82:209-217.
[13] 李静.拟南芥IAM路径合成的IAA及其与逆境胁迫响应.哈尔滨:哈尔滨师范大学硕士学位论文,2012.
Li J.IAA from IAM pathway and its response to stress inArabidopsis.Master Thesis.Harbin:Harbin Normal University,2012.(in Chinese)
[14] Jung H,Lee D K,Do Choi Y,Kim J K.OsIAA6,a member of the riceAux/IAAgene family,is involved in drought tolerance and tiller outgrowth.Plant Science,2015,236:304-312.
[15] Soeno K,Goda H,Ishii T,Tachikawa T,Sasaki E.Auxin biosynthesis inhibitors,identified by a genomics-based approach,provide insights into auxin biosynthesis.Plant and Cell Physiology,2010,51(4):524-536.
[16] Barrs H D,Weatherley P E.A re-examination of the relative turgidity technique for estimating water deficits in leaves.Australian Journal of Biological Science,1962,15(3):413-428.
[17] Blum A,Ebercon A.Cell membrane stability as a measure of drought and heat tolerance in wheat.Crop Science,1981,21(1):43-47.
[18] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:169-172.
Li H S.Principle and Technology of Plant Physiological and Biochemical Experiments.Beijing:Higher Education Press,2000:169-172.(in Chinese)
[19] Giannopolitis C N,Ries S K.Superoxide dismutase I.Occurrence in higher plants.Plant Physiology,1977,59(2):309-314.
[20] Chance B,Maehly A C.Assay of catalase and peroxidase.Methods Enzymol,1955,2:764-775.
[21] Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts.Plant and Cell Physiology,1981,22(5):867-880.
[22] 崔碧霄,韩刚,李凯荣,王波.土壤石油污染下柠条生长反应与抗氧化保护响应.草业科学,2014,31(4):632-640.
Cui B X,Han G,Li K R,Wang B.Response of growth and antioxidant protection system ofCaraganakorshinskiito oil-contaminated soil.Pratacultural Science,2014,31(4):632-640.(in Chinese)
[23] 苗丽,巩彪,聂文倩,王秀峰,魏珉,李岩,杨凤娟,史庆华.外源IAA对NaHCO3胁迫下黄花幼苗光合特性和抗氧化系统影响.植物生理学报,2014,50(6):765-771.
Miao L,Gong B,Nie W Q,Wang X F,Wei M,Li Y,Yang F J,Shi Q H.Effects of exogenous IAA on photosynthetic characteristics and antioxidative system inCucumissativusseedlings under NaHCO3stress.Plant Physiology Journal,2014,50(6):765-771.(in Chinese)
[24] Cha J Y,Kim W Y,Kang S B,Im K J,Baek D,Jung I J.A novel thiol-reductase activity ofArabidopsisYUC6 confers drought tolerance independently of auxin biosynthesis.Nature Communications,2015,6:8041.
[25] 高婷婷,毛培春,田小霞,孟林,刘汉云.10个白三叶品种苗期耐寒性评价.草业科学,2014,31(9):1724-1731.
Gao T T,Mao P C,Tia X X,Meng L,Liu H Y.Cold tolerance assessment of 10Trifoliumrepenscultivars at the seedlings stage.Pratacultural Science,2014,31(9):1724-1731.(in Chinese)
[26] 李艳博,张蕴薇,哈依霞,杜金鸿,刘源,陈果,王佺珍.须芒草、虉草、柳枝稷对干旱和盐胁迫的生理响应.草业科学,2014,31(5):905-914.
Li Y B,Zhang Y W,Hayixia,Du J H,Liu Y,Chen G,Wang Q Z,Physiological responses of bluestem,reed canarygrass and switchgrass unber drought and salinity stress.Pratacultural Science,2014,31(5):905-914.(in Chinese)
[27] Rai V K.Role of amino acids in plant responses to stresses.Biologia Plantarum,2002,45(4):481-487.
[28] Trovato M,Mattioli R,Costantino P.Multiple roles of proline in plant stress tolerance and development.Rendiconti Lincei,2008,19:325-346.
[29] 魏志刚,王玉成.植物干旱胁迫响应机制.北京:科学出版社,2015:44-47.
Wei Z G,Wang Y C.Mechanism of Plant Response to Drought Stress.Beijing:Science Press,2015:44-47.(in Chinese)
(责任编辑 武艳培)
Improvementofoxidationresistanceandosmoticregulationofwhitecloverseedlingsbyexogenousauxinunderpolyethyleneglycolstress
Li Ya-ping, Peng Yan
(College of Animal Science and Technology, Sichuan Agricultural University, Chengdu 611130, China)
This research was conducted to investigate the effect of auxin (IAA) on the drought tolerance of white clover (Trifoliumrepenscv. ‘Pixie’) under drought stress induced by polyethylene glycol-6000(PEG-6000) nutrient solution. The results showed that 1 μmol·L-1IAA significantly improved the drought tolerance of white clover fed with a nutrient solution containing 15% PEG (-0.3 MPa). Exogenous IAA improved the activities of antioxidant enzymes including superoxide dismutase, peroxidase, catalase, and ascorbate peroxidase to varying degrees, increased the contents of ascorbate and glutathione, decreased electrolyte leakage, and decreased the contents of malondialdehyde, superoxide anions, and H2O2. These observations indicated that IAA effectively reduced oxidative damage and lipid modifications. Exogenous IAA also significantly increased the contents of total amino acids and proline, and efficiently decreased the osmotic potential, which was associated with an increased relative water content. Similarly, under drought conditions, the treatment with exogenous IAA (1 μmol·L-1) significantly improved the relative water content and alleviated lipid injury in detached leaves, but treatments with auxin biosynthesis inhibitors (60 μmol·L-1naphthylphthalamic acid and 60 μmol·L-1amino-oxyphenylpropionic acid) decreased the relative water content and lipid injury in detached leaves. In conclusion, the results indicated that IAA can effectively increase the capacities of white clover for antioxidant protection and osmoregulation, thereby leading to an improved drought tolerance.
Trifoliumrepens; drought stress; IAA; membrane damage; antioxidant enzyme; osmotic adjustment
Peng Yan E-mail:pengyanlee@163.com
10.11829/j.issn.1001-0629.2017-0048
李亚萍,彭燕.IAA改善PEG处理下白三叶幼苗叶片抗氧化保护和渗透调节能力.草业科学,2017,34(11):2295-2302.
Li Y P,Peng Y.Improvement of oxidation resistance protection and osmotic adjustment ability regulation of white clover seedlings by exogenous IAA under PEG stress.Pratacultural Science,2017,34(11):2295-2302.
S541+.203.4;Q945.79
A
1001-0629(2017)11-2295-08
2017-01-21接受日期2017-04-21
国家自然科学基金(31372371)
李亚萍(1989-),女,甘肃定西人,在读硕士生,主要从事牧草和草坪草抗逆生理研究。E-mail:m18349237779@163.com
彭燕(1970-),女,四川成都人,教授,博士,主要从事草坪草牧草逆境生理研究。E-mail:pengyanlee@163.com
