陕西线辣椒炭疽病原菌的鉴定及生物学特性研究
2017-11-29杨佳文赵尊练张管曲谢芳琴姜长岳张永香韩晓萍徐乃林
杨佳文 ,赵尊练,张管曲,谢芳琴,姜长岳,张永香,韩晓萍,徐乃林
(1.西北农林科技大学 园艺学院,陕西杨凌 712100;2.西北农林科技大学 植物保护学院,陕西杨凌 712100; 3.富平县农业技术推广中心,陕西富平 711700;4.宝鸡市农业技术推广服务中心,陕西宝鸡 721001)
陕西线辣椒炭疽病原菌的鉴定及生物学特性研究
杨佳文1,赵尊练1,张管曲2,谢芳琴2,姜长岳1,张永香1,韩晓萍3,徐乃林4
(1.西北农林科技大学 园艺学院,陕西杨凌 712100;2.西北农林科技大学 植物保护学院,陕西杨凌 712100; 3.富平县农业技术推广中心,陕西富平 711700;4.宝鸡市农业技术推广服务中心,陕西宝鸡 721001)
为了搞清陕西省线辣椒主产区炭疽病的致病菌类型及其主要生物学特性,对采自陕西省宝鸡市线辣椒主产区具有炭疽病症状的80份线辣椒果实样品进行致病病原菌分离、鉴定、主要生物学特性研究及多基因联合分析。结果表明,从80份病样中共鉴定出4种不同的炭疽菌,即尖孢炭疽菌(Colletotrichumacutatum)、大豆炭疽菌(Colletotrichumtruncatum)、菠菜炭疽菌(Colletotrichumspinaciae)和博宁炭疽菌(Colletotrichumboninense),4种炭疽菌所占比率依次为83.75%、13.75%、1.25%和1.25%;尖孢炭疽菌对线辣椒的致病力最强,其次是大豆炭疽菌,菠菜炭疽菌对线辣椒致病力较弱,博宁炭疽菌对线辣椒没有致病力。生物学特性研究表明,温度25 ℃、连续光照、pH=6、碳源葡萄糖、氮源酵母浸膏最适合尖孢炭疽菌菌丝生长,温度30 ℃、连续光照、pH为5~6、碳源麦芽糖、氮源酵母浸膏最适合尖孢炭疽菌菌株产孢;温度30 ℃、连续光照、pH为7、碳源果糖、氮源蛋白胨最适合大豆炭疽菌菌丝生长,温度30 ℃、连续黑暗、pH为5~6、碳源麦芽糖、氮源脯氨酸最适合大豆炭疽菌菌株产孢;温度30 ℃、连续光照、pH为9~11、碳源麦芽糖、氮源蛋白胨最适合菠菜炭疽菌菌丝生长;温度30 ℃、连续黑暗、pH为5~6、碳源麦芽糖、氮源蛋白胨最适合菠菜炭疽菌菌株产孢。在陕西省线辣椒上发现尖孢炭疽菌,为首次报道;在辣椒上发现菠菜炭疽菌,亦为首次报道。
线辣椒;炭疽病;病原鉴定;多基因联合分析;生物学特性
辣椒是茄科辣椒属植物,原产自南美洲[1]。线辣椒属于一年生辣椒种(CapsicumannuumL.),是中国加工辣椒的一种重要类型[2],在陕西、新疆、四川、湖南、甘肃、河北等省(市、自治区)有较大面积的种植,年种植面积稳定在40 000~50 000 hm2[3]。陕西的线辣椒主要分布在陕西省关中地区,目前关中西部的宝鸡地区是陕西省线辣椒的传统主产区。近几年来,这一产区的炭疽病呈现逐年加重的趋势,到2013年前后,少数区域病害的损失达到90%左右,已经上升为当地线辣椒的首要病害。
辣椒炭疽病由子囊菌门内的有丝分裂孢子真菌炭疽菌引起,炭疽病菌感染辣椒最早在印度发现[4]。有资料认为,引起辣椒炭疽病的真菌共有12 种,分别是胶孢炭疽菌(C.gloeosporioides)、黑色炭疽菌(C.coccodes)、黑点炭疽菌(C.capsici)、黑线炭疽菌(C.dematium)、壳皮炭疽菌(C.crassipes)、C.brevispora、博宁炭疽菌(C.boninense)、大豆炭疽菌(C.truncatum)、君子兰炭疽菌(C.cliviae)、喀斯特炭疽菌(C.karstii)、C.fructicola和尖孢炭疽菌(C.acutatum)[5]。但在中国大部分辣椒产区以胶孢炭疽菌(C.gloeosporioides)和黑点炭疽菌(C.capsici)侵染比较普遍[6]。关于炭疽病病原菌的分类鉴定,目前应用比较普遍的方法有传统分类指标(分生孢子,附着孢,分生孢子梗和产孢细胞,刚毛、菌核和厚垣孢子,纯培养特征,寄主专一性,无性型与有性型之间的联系及配对型)鉴定、分子生物学鉴定(核糖体转录间隔区序列即ITS,多基因系统学分析)和次生代谢特异性鉴定[7]。
关于陕西省辣椒炭疽病的病原菌,迄今为止,只有巩振辉等[8]于24 a前做过简单的形态学及致病力鉴定。一方面,只凭形态学鉴定难以准确地区分一些相似菌种;另一方面,时隔20多年,也很有可能产生新的菌种。因此,本研究通过分离、回接、传统的形态学鉴定、多基因联合分析等手段,鉴定陕西省线辣椒主产区炭疽病的致病菌类型,同时对其生物学特性进行研究,以期为这一病害的防控提供理论支持和技术借鉴。
1 材料与方法
1.1 病原菌的采集、分离和纯化
2015年10月,在陕西省线辣椒炭疽病高发季节,分别在陕西省线辣椒主产区的凤翔县、陇县、岐山县、千阳县等地采集具有炭疽病症状的线辣椒果实样品80份。按常规组织分离法分离、纯化病原菌[9]。在线辣椒病健交界处剪取大小为4 mm×4 mm的组织块,将组织块放入φ=70%酒精中消毒30 s,再放入φ=5% NaClO中消毒3~5 min,然后用无菌水清洗3次。将清洗后的组织块放在无菌滤纸上吸干,再转移到PDA培养基中,每皿3块,置于25 ℃的培养箱中培养。经纯化和斜面培养后的菌株保存于4 ℃冰箱中,备用。
1.2 病原菌的形态学鉴定
病原菌在PDA培养基上纯化培养7 d后,观察菌落的形态、大小、颜色等特征;挑取菌丝在光学显微镜下观察分生孢子的形态、大小和刚毛有无情况;在产孢的菌落中加入50 mL无菌水,借助血球计数板调整成数量密度为1×105mL-1的孢子悬浮液 ,滴在凹玻片上,放入垫有湿润滤纸的培养皿里,在25 ℃的培养箱中保湿培养,24 h后观察附着孢的形态、大小。
1.3 病原菌的致病性测定
用移液枪将已配制的数量密度为1×105mL-1孢子悬浮液通过针刺法接种到健康线辣椒,每个线辣椒果实接种3~4个点,并用无菌水处理作对照。接种后的线辣椒放入垫有滤纸的托盘中,覆盖保鲜膜,在25 ℃的培养箱中加水保湿培养。逐日观察发病情况,7 d后再次分离病原菌。
1.4 病原菌DNA的提取
用灭菌枪头挑取新鲜菌丝于研钵中,倒入液氮充分研磨并采用天根生化科技(北京)有限公司的DNA提取试剂盒提取菌丝总DNA。
1.5 病原菌的PCR扩增及电泳检测
选择形态学鉴定出的炭疽菌代表菌株,扩增各代表菌株的DNA核糖体转录间隔区(ITS)序列,几丁质合成酶Ⅰ(CHSⅠ)序列、3-磷酸甘油醛脱氢酶(GAPDH)序列、肌动蛋白(ACT)序列。扩增所用引物分别为核糖体转录间隔区(ITS) 通用引物对ITS4:5′-TCCTCCGCTTATTGATATGC-3′和ITS5:5′-GGAAGTAAAAGT- CGTAACAAGG-3′[10];几丁质合成酶Ⅰ基因(CHSⅠ) 通用引物对CHSⅠ-79F:5′-TGGG-GCAAGGATGCTTG-GAAGAAG-3′和CHSⅠ-354R:5′-TGGAAGAACCATCTGTGAGAGT-TG-3′[11];3-磷酸甘油醛脱氢酶基因(GAPDH)通用引物对GDF1:5′-GCCGTCAACGACCCCTTCATTGA-3′[12]和GDR1:5′-GGGTGGAG-TCGTACTTGAGCATGT-3′[13];肌动蛋白基因(ACT)通用引物对ACT-512F:5′-ATGTGCAAGGCCGGTTTCGC-3′和ACT-783R:5′-TACGAGTCCTTCTGGCCCAT-3′[11]。
PCR扩增体系(50 μL)设定为:10×PCR Buffer 5 μL,dNTPs 1 μL,TaqDNA聚合酶1 μL,通用引物各2 μL,模板DNA 2 μL,ddH2O 37 μL。扩增条件设定为:94 ℃预变性5 min,94 ℃变性30 s,48 ℃(ITS通用引物对)、56 ℃(GHSⅠ、GDPH通用引物对)、57 ℃(ACT通用引物对)退火30 s,72 ℃延伸50 s,共30个循环,最后72 ℃延伸7 min。得到的PCR扩增产物用0.01 g/mL的琼脂糖凝胶电泳检测,经培清JS-2000凝胶成像仪拍照后委托生工生物工程(上海)股份有限公司测序。
1.6 多基因联合分析
在NCBI网站的GenBank数据库中,将所测基因序列进行Blast对比,选择含有ITS、ACT、CHSⅠ、GAPDH4个基因的相似序列菌株作为模式菌株,将每个基因结合模式菌株的参考序列用Clustal W进行排序、切除两端,按照ITS、ACT、CHSⅠ、GAPDH的顺序首尾串联,最后引入外类群菌株,用MEGA 6.0软件中的Neighbor-Joining(N-J)法建立系统发育树。
1.7 病原菌的生物学特性研究
1.7.1 不同光照周期下菌株生长量和产孢量的测定 将直径为5 mm的菌饼接入PDA培养基中央,分别在24 h持续光照、24 h持续黑暗、12 h/12 h光暗交替的培养箱中25 ℃恒温培养,每处理3次重复。培养5 d后,用游标卡尺对供试菌株菌落的直径进行测量,取3次测量的平均值。培养12 d后,取培养基中央的10块菌饼放入无菌烧杯中,加入10 mL无菌水,压碎菌饼并不断搅拌菌液,使得分生孢子充分混匀于无菌水中,再用血球计数板测定每毫升菌液的产孢量。
1.7.2 不同温度下菌株生长和产孢量的测定 将直径为5 mm的菌饼接入到PDA培养基中央,分别放置在温度为5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃ 的培养箱中12 h光暗交替培养,每处理3次重复。供试菌株直径、产孢量的测量方法同上。
1.7.3 不同pH条件下菌株生长和产孢量的测定 灭菌后的培养基用1 mol/L HCl和1 mol/L NaOH将pH调为4、5、6、7、8、9、10、11等。将直径为5 mm菌饼接入不同pH的培养基中央,每处理3次重复,放置在25 ℃培养箱中培养。供试菌株直径、产孢量的测量方法同上。
1.7.4 不同碳、氮源条件下菌株生长和产孢量的测定 以察氏培养基为基础培养基和对照。替换其中的碳源和氮源,将直径为5 mm菌饼接入不同碳、氮源的培养基中央,每处理3次重复,放置在25 ℃培养基中培养。供试碳源为:蔗糖、果糖、葡萄糖、麦芽糖、淀粉。供试氮源为:硝酸钠、蛋白胨、酵母浸膏、甘氨酸、脯氨酸、苯丙氨酸。供试菌株直径、产孢量的测量方法同上。
2 结果与分析
2.1 病原菌分离结果
通过病原菌形态学鉴定及致病性测定,从80个线辣椒样本中共鉴定出4种不同的炭疽菌。每种炭疽菌选取代表菌株进行后续试验,根据采集地名的首字母和分离的顺序,将代表菌株分别命名为LX1、LX2、QY3、QS3。从表1可以看出,在80个线辣椒炭疽病样本中,LX2分离出的比率最高,为83.75%;其次是LX1,比率为13.75%。QY3和QS3仅分离到1株,比率各为1.25%。
2.2 形态学鉴定结果
从图1可以看出,菌株LX2培养初期菌中央呈橘色,后期菌落为墨绿色,背面浅灰色至深灰色,菌丝白色绒毛状,致密;菌落圆形,边缘整齐;菌落生长速度中等,PDA上25 ℃培养5 d,直径为38.72 mm;PDA上产孢快,5 d左右产孢;分生孢子盘稀少,不产刚毛;不产菌核;分生孢子直,无色单孢,长椭圆形,一端尖,有的两端略尖,大小为(8.1~17.9) μm×(2.1~4.0) μm;分生孢子团橘红色;附着胞浅褐色至浅黑色,较小,球形,大小为(5.4~6.6) μm×(4.1~6.2) μm。参照真菌手册以及植物病原真菌学[14-15],初步将菌株LX2鉴定为尖孢炭疽菌(C.acutatum)。
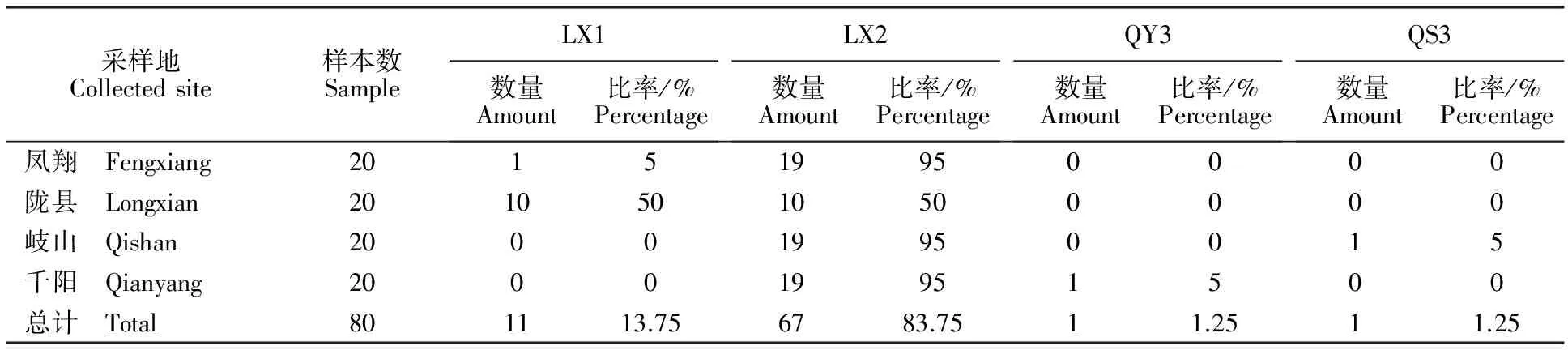
表1 陕西线辣椒炭疽菌分离结果Table 1 The isolated Colletotrichum from Xianlajiao chili pepper in Shaanxi rovince

A.菌落 Colony;B.分生孢子盘 Acervulus;C.分生孢子 Conidia;D.附着孢 Appressorium
从图2可以看出,菌株LX1菌丝稀少,绒毛状,背面深灰色至黑色;培养初期菌落中央墨绿色呈放射状,其上密生黑色小点,为分生孢子盘;菌落圆形生长,边缘整齐;有黄色轮纹,后期轮纹消失,菌落全变墨绿色;菌落生长速度快,PDA上25 ℃培养5 d,直径为53.15 mm;PDA上产孢慢,15 d左右产孢;分生孢子盘产生大量刚毛,浅褐色至深褐色,1~3个隔;不产菌核;分生孢子团乳白色;分生孢子月牙形,单孢,两端较弯,大小为(14.4~23.8) μm×(2.7~3.7) μm;附着孢浅褐色至浅黑色,椭圆形,大小为(6.4~12.5) μm×(5.0~7.2) μm。参照真菌手册以及植物病原真菌学[14-15],初步将菌株LX1鉴定为大豆炭疽菌(C.truncatum)。
从图3可以看出,菌株QY3菌落墨绿色,背面深灰色,粘附水珠,绒毛状,圆形生长,边缘菌丝白色;菌落始终无色素变化,生有黑色突起粒状物;菌落生长速度慢,PDA上25 ℃培养5 d,直径为22.24 mm;PDA上产孢慢,20 d左右产孢;喜碱性,pH为10时,培养5 d菌落直径为36.62 mm;分生孢子盘产生大量刚毛,浅褐色至深褐色,2~3个隔;不产菌核;分生孢子近直,无色单孢,纺锤形;一侧直,另一侧略弯,大小为(14.7~19.0) μm×(3.4~4.5) μm;附着孢浅褐色至浅黑色,棍棒形或椭圆形,部分边缘不规则,大小为(6.7~16.4) μm×(4.6~7.0) μm。与Damm等[16]、Kurt等[17]对菠菜炭疽菌的描述相似,初步将菌株QY3鉴定为菠菜炭疽菌(C.spinaciae)。

A.菌落 Colony;B.分生孢子盘及刚毛 Acervulus and setae;C.分生孢子 Conidia;D.附着孢 Appressorium
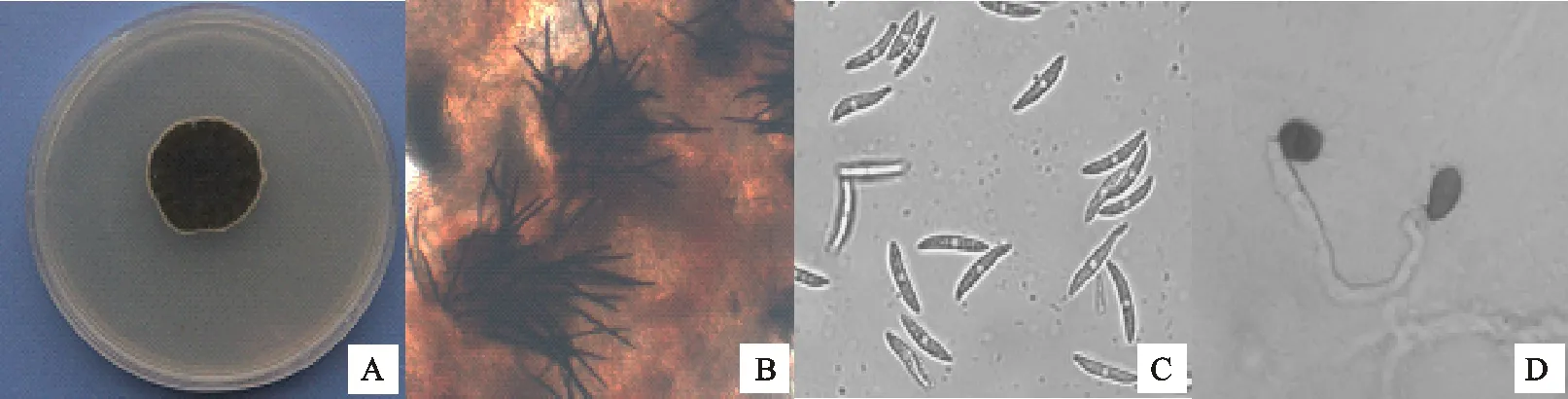
A.菌落 Colony;B.刚毛 Setae;C.分生孢子 Conidia;D.附着孢 Appressorium
从图4可以看出,菌株QS3菌落淡黄色,背面白色,绒毛状,圆形生长,边缘整齐;后期分泌黄色色素,产生子囊壳,形成黑色产孢器;分生孢子团粉红色;菌落生长速度快,PDA上25 ℃培养5 d,直径为48.32 mm;PDA上产孢慢,30 d左右产孢;不产生刚毛;能观察到有性态,子囊长棍状,由8个子囊孢子构成,子囊孢子纺锤形,大小为(12.3~17.5) μm×(3.3~6.3)μm;分生孢子盘不产刚毛;不产菌核;分生孢子椭圆形,无色单孢,两端钝圆,有的基部平截呈脐状;含有1~3个油滴,大小为(10.5~17.7) μm×(5.4~7.4) μm;附着孢浅褐色至浅黑色,边缘不规则,大小为(5.3~11.4) μm×(5.8~8.9)μm。其有性态及无性态特征与张陶等[18]对博宁炭疽菌的描述相似,初步将菌株QS3鉴定为博宁炭疽菌(C.boninense)。
2.3 多基因联合分析结果
以Colletotrichumlindemuthianum(CBS131.57)为外类群,将形态学鉴定出的炭疽菌代表菌株以N-J法构建的多基因系统发育树见图5。从图5可知,菌株QY3与3株编号为CBS150.35、CBS125374、CBS128.57的菠菜炭疽菌在100%水平上聚为一支;菌株LX1与编号为CBS151.35的大豆炭疽菌在100%水平上聚为一支;菌株LX2与编号为CBS144.29的尖孢炭疽菌在100%水平上聚为一支;菌株QS3与编号为CBS128526的博宁炭疽菌在100%水平上聚为一支。
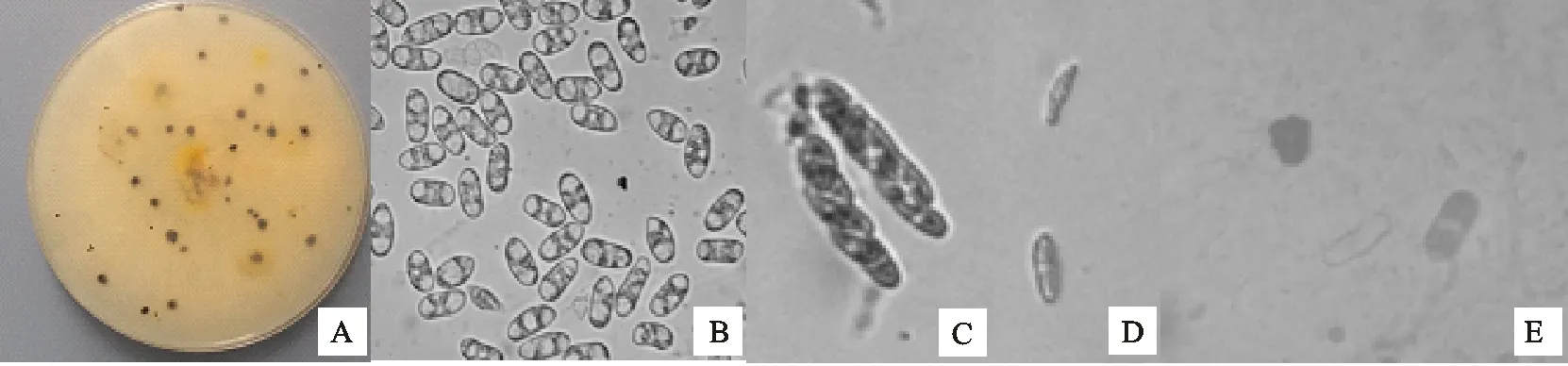
A.菌落 Colony;B.分生孢子 Conidia;C.子囊 Ascus;D.子囊孢子 Ascospore;E.附着孢 Appressorium

图5 基于ITS、ACT、CHSⅠ、GAPDH合并序列以N-J法构建的炭疽菌系统发育树Fig.5 The N-J phylogenic tree of Colletotrichum based on the sequences of ITS,ACT,CHSⅠ and GAPDH
2.4 致病性鉴定结果
4种炭疽菌回接线辣椒的致病性鉴定结果见图6。从图6可以看出,LX2、LX1和QY3接种的线辣椒均长出病斑,再次分离后得到和接种时相同的病原菌。QS3接种的线辣椒没有病斑,但能再次分离到和接种相同的病原菌。由此可见,4种炭疽菌均具有在线辣椒果实上定殖的能力。同时从图6可知,尖孢炭疽菌对线辣椒的致病力最强,其次是大豆炭疽菌,菠菜炭疽菌对线辣椒致病力较弱,博宁炭疽菌对线辣椒果实没有致病力。
2.5 病原菌的生物学特性
将对线辣椒果实有致病力的尖孢炭疽菌、大豆炭疽菌和菠菜炭疽菌进行生物学特性研究,测定3种菌株在不同处理下5 d后的菌落直径,12 d 后的产孢量。经观察,大豆炭疽菌和菠菜炭疽菌在PDA培养基上产孢慢,12 d时分生孢子无或极少,故将大豆炭疽菌和菠菜炭疽菌产孢量的测定时间分别定为17 d和22 d。
2.5.1 光照对菌株生长和产孢的影响 尖孢炭疽菌、大豆炭疽菌在24 h连续光照下菌落生长直径最大;光照条件对菠菜炭疽菌菌丝生长的影响不大。大豆炭疽菌在24 h连续黑暗下产孢最好;尖孢炭疽菌在24 h连续光照下产孢最好;菠菜炭疽菌在光暗交替下产孢最好(表2);光照能促进尖孢炭疽菌分泌色素。连续光照加快尖孢炭疽菌橘色色素的分泌(图7),大豆炭疽菌和菠菜炭疽菌无此现象。
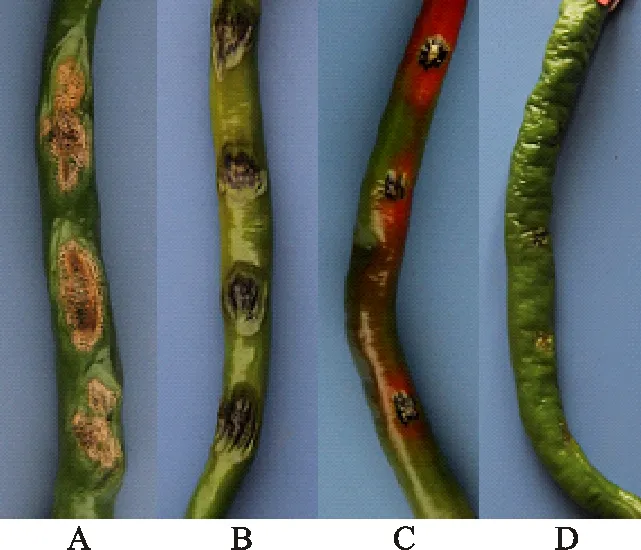
A .LX2(尖孢炭疽菌C.acutatum);B.LX1(大豆炭疽菌C.truncatum);C.QY3(菠菜炭疽菌C.spinaciae);D.QS3(博宁炭疽菌C.boninense)
图6分离到的4种炭疽菌回接青线辣椒6d时的发病状况
Fig.6ThediseasesymptomsofXianlajiaochilipepperinfectedbydifferentColletotrichumatthe6thdayaftervaccination
表2 光照条件对3种线辣椒致病炭疽菌菌丝生长和产孢的影响Table 2 The effects of light conditions on mycelium growth and sporulation of different Xianlajiao chili pepper Colletotrichum
注:数据以“平均数±标准差”表示,不同字母表示差异显著(Plt;0.05),下同。
Note:The data were shown as the mean±standard deviation,and different letters indicated significant difference atPlt;0.05.The same below.
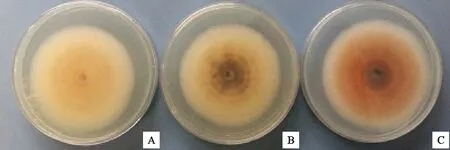
A.连续黑暗 Continuous dark;B.光暗交替 Alternation of light and dark;C.连续光照 Continuous light
2.5.2 温度对菌株生长和产孢的影响 从表3可以看出,大豆炭疽菌的生长温度范围为10~35 ℃,最适宜菌丝生长的温度为30 ℃;尖孢炭疽菌和菠菜炭疽菌的生长温度范围为10~30 ℃,最适宜菌丝生长的温度均为25 ℃;在5~25 ℃, 3种菌株菌丝的生长速度随着温度的升高加快。超过最适宜温度后,3种菌株菌丝的生长速度随着温度的升高而减慢。大豆炭疽菌、尖孢炭疽菌和菠菜炭疽菌均在30 ℃时产孢最好。
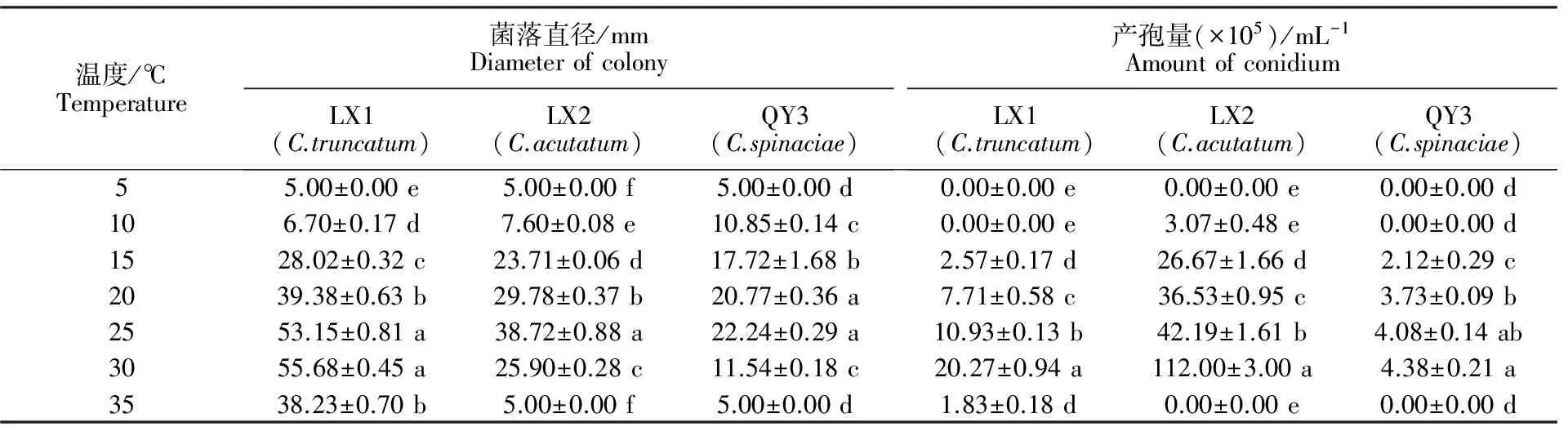
表3 温度对不同线辣椒炭疽菌菌丝生长和产孢量的影响Table 3 The effects of temperature on mycelial conidial production of different Xianlajiao chili pepper Colletotrichum
2.5.3 pH对菌株生长和产孢的影响 从表4可知,3种炭疽菌的菌丝生长和产孢pH都为4~11;尖孢炭疽菌和大豆炭疽菌最适宜菌丝生长的pH为6~7;菠菜炭疽菌喜碱性,菌丝生长最适宜的pH为9~11。3种炭疽菌均在弱酸条件下易产孢,最适宜的产孢pH均为5~6。
2.5.4 碳源对菌株生长和产孢的影响 大豆炭疽菌在以淀粉和麦芽糖为碳源的培养基上菌丝稀疏,在以果糖为碳源的培养基上菌丝洁白致密,菌落直径最大,但在不同碳源的培养基上菌落直径大小差异不显著,仅在以麦芽糖为碳源的培养基上能大量产孢。尖孢炭疽菌在以淀粉为碳源的培养基上菌落直径最大,但菌丝稀疏,在以麦芽糖为碳源的培养基上菌株产孢最好。菠菜炭疽菌在以麦芽糖为碳源的培养基上菌落直径最大,产孢最好,在其余碳源上产孢极少(表5)。
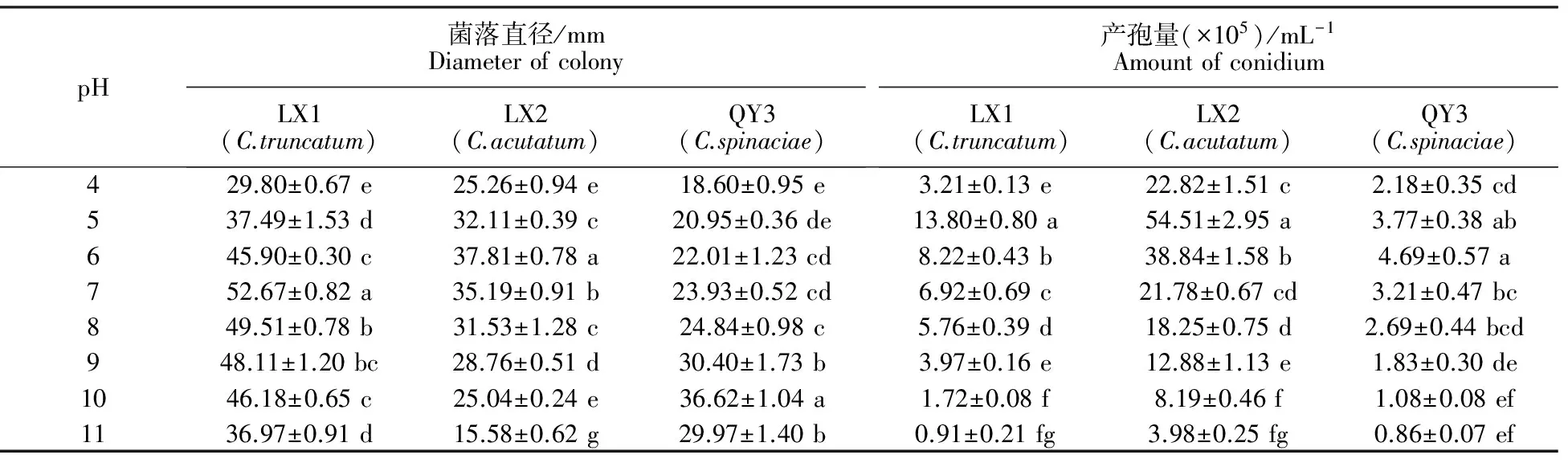
表4 pH对不同线辣椒炭疽菌菌丝生长和产孢量的影响Table 4 The effects of pH value on mycelial conidial production of different Xianlajiao chili pepper Colletotrichum
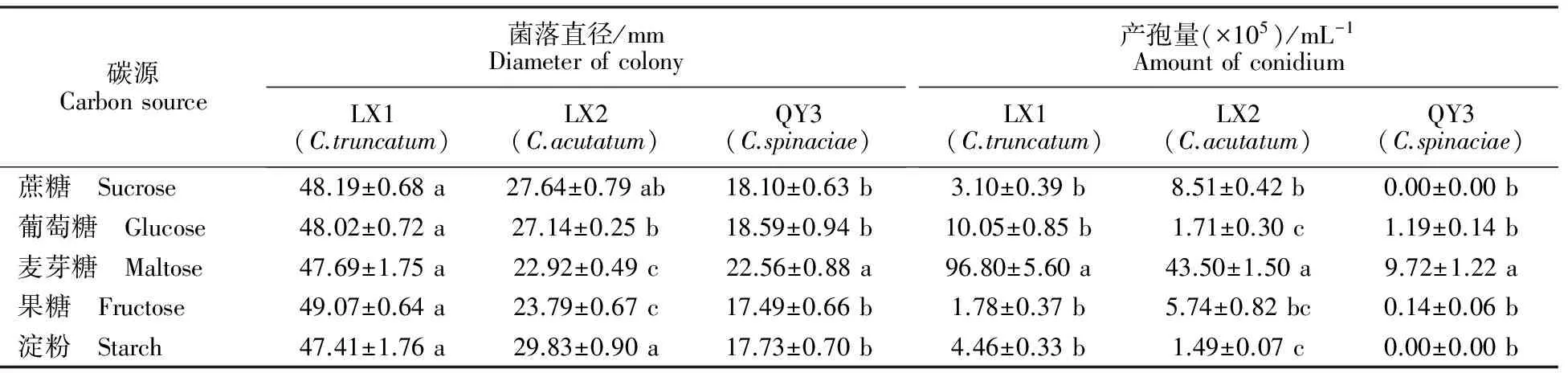
表5 碳源对不同线辣椒炭疽菌菌丝生长和产孢量的影响Table 5 The effects of carbon source on mycelium growth and sporulation of different Xianlajiao chili pepper Colletotrichum
2.5.5 氮源对菌株生长和产孢量的影响 大豆炭疽菌在以蛋白胨为氮源的培养基上菌落直径最大,在以脯氨酸为氮源的培养基上产孢最好。尖孢炭疽菌在以酵母浸膏为氮源的培养基上菌落直径最大,产孢最好。菠菜炭疽菌在以甘氨酸为氮源的培养基上菌丝最浓密,在以蛋白胨为氮源的培养基上菌落直径最大,在以酵母浸膏为氮源的培养基上产孢最好,而在以硝酸钠和苯丙氨酸为氮源的培养基上几乎不产孢(表6)。
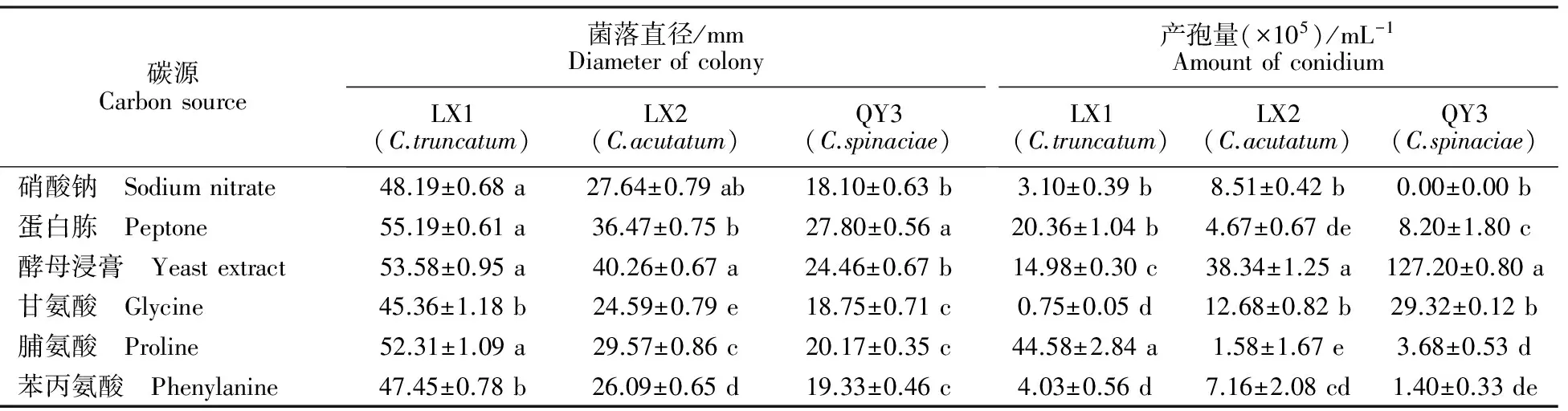
表6 氮源对不同线辣椒炭疽菌菌丝生长和产孢量的影响Table 6 The effects of nitrogen source on mycelium growth and sporulation of different Xianlajiao chili pepper
3 讨 论
炭疽病是辣椒上常见的真菌病害之一,主要发生在成熟的辣椒果实上,也在未成熟的辣椒果实、叶片和茎杆上发生[19]。经形态学鉴定和多基因序列分析,陕西省线辣椒主产区发生的炭疽病主要由尖孢炭疽菌(C.acutatum)和大豆炭疽菌(C.truncatum)引发,它们对线辣椒有很强的侵染力。特别是尖孢炭疽菌,发病快,传染力极强,其形态特征与夏花等[20]在湖南省芷江县的辣椒上发现的尖孢炭疽菌基本相同。尖孢炭疽菌的寄主范围很广,具有很强的寄主组织专化性,能够专一地危害草莓、苹果、辣椒、枇杷、芒果、银杏等的果实及甜橙花[21]。但在陕西省内活体辣椒上发现尖孢炭疽菌(C.acutatum)尚属首次。关于尖孢炭疽菌生物学特性的研究报道很少,本研究结果与夏花[22]的研究结果基本一致,与唐景美[23]的部分研究结果有出入。本研究结果与夏花[22]的研究结果均表明尖孢炭疽菌在24 h连续光照下菌丝生长和产孢最好,而唐景美[23]的研究结果却是在黑暗条件下菌丝生长最好,在光暗交替下产孢最好。产生这种差异的原因有待进一步研究。
大豆炭疽菌同样是寄主范围广泛的一种重要病原菌,和辣椒炭疽菌、葱炭疽菌等弯孢类炭疽菌在形态上相似,其形态特征与Ramdial等[24]在印度特立尼亚青椒上分离出比例高达72%的大豆炭疽菌形态特征基本一致。曾大兴等[25]曾运用RAPD技术对38个不同寄主来源的弯孢类炭疽菌菌株的系统发育及分类进行研究,结果显示辣椒炭疽菌、大豆炭疽菌有很高的遗传相似性,可能是同一个种,而国际上也普遍认为大豆炭疽菌和辣椒炭疽菌同物异名。本研究以多基因系统分析建立的系统发育树的结果为主要依据,结合形态学鉴定,将菌株LX1最终鉴定为大豆炭疽菌。关于大豆炭疽菌生物学特性的研究报道也很少。本研究结果表明,该菌菌丝生长的最适条件为30 ℃、24 h连续光照、pH 6~7,产孢的最适条件为30 ℃、24 h连续黑暗、pH 5~6,与孙志峰[26]对浙江大豆上的大豆炭疽菌的研究结果(菌丝生长的最适条件为30 ℃、24 h连续光照、pH 5~7,最佳碳氮源蔗糖、酵母粉)基本一致,其中一些小的差异,可能是地域差异造成。夏花等[22]对尖孢炭疽菌的研究结果就表明,该菌菌丝生长的最适温度在湖南为28 ℃,在湖北则为22 ℃ 。
菠菜炭疽菌(C.spinaciae)最初被当作黑线炭疽菌的小变体[27],直到2009年Damm等[16]分离来自草本植物的97种弯孢类炭疽菌,采用多基因联合分析方法,才将菠菜炭疽菌确认为一个独立的种,该种与葱类炭疽菌遗传关系最近。本研究通过ITS、ACT、CHSⅠ和GPDH等4个基因联合分析并结合形态学观察,将分离自陕西千阳县线辣椒上的菌株QY3鉴定为菠菜炭疽菌。通过回接试验,证实菠菜炭疽菌对线辣椒具有侵染力。这是首次在辣椒上发现菠菜炭疽菌。关于菠菜炭疽菌的生物学特性国内尚未见报道。本研究结果表明,该菌在PDA上25 ℃培养20 d左右产孢,菌落生长直径很小;碱性环境可刺激菌丝的生长,麦芽糖能促进菌株产孢。此生理特征是由某种原因导致,还是菠菜炭疽菌具有的普遍特征,有待进一步研究。
博宁炭疽菌具有典型的分生孢子基部脐状平截的特征,最初被鉴定为胶孢炭疽菌种群中的一种。2003年,Moriwaki等[28]首次在日本分离到博宁炭疽菌,通过ITS序列分析将其与胶孢炭疽菌区分,建立新的分类单元。2006年,云南昆明植物园兰科植物上分离到的博宁炭疽菌并成为当年中国新记录的炭疽菌种[29]。该菌寄主广泛,能够危害油茶、春兰、墨兰、猕猴桃等作物[30-33],尤其对石蒜科、兰科、山龙眼科和茄科类作物有突出的侵染力[34]。2010年,Farr等[35]在巴西首次报道博宁炭疽菌能侵染辣椒。同年,国内杨友联[36]在贵州、云南、广西等地采集的辣椒上也分离到1株博宁炭疽菌。杨友联将该菌在PDA上培养,未能观察到分生孢子基部脐状平截的特征。本研究在陕西岐山县采集的线辣椒上分离到1株博宁炭疽菌菌株,在PDA上培养能观察到该特征。将该菌株以有伤方式接至健康的线辣椒,线辣椒果实无病斑,但分离病原菌时,有较少几率能分离到与接种相同的病原菌。说明博宁炭疽菌对线辣椒的果实没有致病力,但在线辣椒果实上有一定的定殖能力。
Reference:
[1] 邹学校.中国辣椒[M].北京:中国农业出版社,2002:358.
ZOU X X.Chinese Chili[M].Beijing:China Agriculture Press,2002:358(in Chinese).
[2] 庄灿然,吕金殿,梁耀琦.中国干制辣椒[M].北京:中国农业科技出版社,1995:223.
ZHUANG C R,LÜ J D,LIANG Y Q.Chinese Dried Pepper[M].Beijing:China Agriculture Science and Technique Press,1995:233(in Chinese).
[3] 赵尊练,严小良.中国线辣椒产业发展的思路与对策[J].中国农学通报,2003,19(5):176-179.
ZHAO Z L,YAN X L.The developing strategy and countermeasure of line pepper industry in China[J].ChineseAgricultureScienceBulletin,2003,19(5):176-179(in Chinese with English abstact).
[4] SYDOW H.Beitrage zur kenntnis der pilzHora des siidlichen ostindiens-I [J].AnvMyc,XI,1913:329.
[5] 张国芝,赵 霞,杨海艳,等.四川辣椒炭疽病菌鉴定及育种材料抗性筛选[J].西南农业学报,2013,26(3):1026-1029.
ZHANG G ZH,ZHAO X,YANG H Y,etal.Identification of pepper anthracnose and resistant screen of breeding materials in Sichuan[J].SouthwestChinaJournalofAgriculturalSciences,2013,26(3):1026-1029(in Chinese with English abstact).
[6] 孙春英,毛胜利,张正海,等.辣椒抗炭疽病遗传与育种研究进展[J].园艺学报,2013,40(3):579-590.
SUN CH Y,MAO SH L,ZHANG ZH H,etal.Progress on genetics and breeding of resistance to anthracnose(Colletotrichumspp.) in pepper[J].ActaHorticulturaeSinica,2013,40(3):579-590(in Chinese with English abstact).
[7] 杨友联,刘永翔,刘作易.炭疽菌属真菌分类学研究进展[J].贵州农业科学,2011,39(1):152-157.
YANG Y L,LIU Y X,LIU Z Y.Research progress on fungus taxonomy ofColletotrichum[J].GuizhouAgriculturalSciences,2011,39(1):152-157(in Chinese with English abstact).
[8] 巩振辉,王 鸣,周新民,等.辣椒炭疽病病原菌及致病力差异[J].北方园艺,1992,16(1):4-6.
GONG ZH H,WANG M,ZHOU X M,etal.Pepper anthracnose pathogen and difference in pathogenicity[J].NorthernHorticulture,1992,16(1):4-6(in Chinese).
[9] 方中达.植病研究方法[M].北京:中国农业出版社,1998:427.
FANG ZH D.The Research Methods on Plant Diseases[M].Beijing:China Agriculture Science and Technique Press,1998:427(in Chinese).
[10] WHITE T J,BRUNS T,LEE S.Analysis of phytogenetic relationships by amplification and direct sequencing of ribosomal RNA genes [C]//Innis M A,PCR Protocols:A guide to methods and applications.New York Academic,1990:315-322.
[11] CARBONE I,KOHN L M.A method for designing primer sets for speciation studies in filamentous ascomycetes[J].Mycologia,1999,91(3):553-556.
[12] GUERBER J C,LIU B,JOHNSTON P,etal.Characterization of diversity inColletotrichumacutatumsensu lato by sequence analysis of two introns,mtDNA and Intron RFLPs,and mating compatibility[J].Mycologia,2003,95(5):872-895.
[13] TEMPLETON M D,RIKKERINK E H,SOLON S L,etal.Cloning and molecular characterization of the glyceraldehyde-3-phosphate dehydrogenase-encoding gene and cDNA from the plant pathogenic fungusGlomerellacingulata[J].Gene,1992,122(1):225-230.
[14] 魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979:780.
WEI J CH.Identification Manual of Fungi[M].Shanghai:Shanghai Scientific and Technical Publishers,1979:780(in Chinese).
[15] 张中义.植物病原真菌学[M].成都:四川科学技术出版社,1988:517.
ZHANG ZH Y.Plant Pathogenic Mycology[M].Chengdu:Sichuan Science and Technology Press,1988:517(in Chinese ).
[16] DAMM U,WOUDENBERG J H C,CANNON P F,etal.Colletotrichumspecies with curved conidia from herbaceous hosts[J].FungalDiversity,2009,12(39):45-87.
[17] KURT,UYSAL A,AKGL D S.First report of anthracnose caused byColletotrichumspinaciaeon spinach in the Mediterranean Region of Turkey[J].PlantDisease,2016,100(1):219-221.
[18] 张 陶,张 荣,兰建强,等.中国炭疽菌属(Colletotrichum)的分类研究Ⅲ[J].云南大学学报(自然科学版),2008,30(S1):9-11.
ZHANG T,ZHANG R,LAN J Q,etal.Taxonomy ofColletotrichumCorda in China Ⅲ[J].JournalofYunnanUniversity(NaturalScienceEdition),2008,30(S1):9-11(in Chinese with English abstact).
[19] PARK K S,KIM C H.Identification,distribution,and etiological characteristics of anthracnose fungi of red pepper in Korea[J].KoreanJournalofPlantPathology,1992,8:61-69.
[20] 夏 花,朱宏建,周 倩,等.湖南芷江辣椒上一种新炭疽病的病原鉴定[J].植物病理学报,2012,42(2):120-125.
XIA H,ZHU H J,ZHOU Q,etal.Pathogen identification of a new anthracnose of pepper in Zhijiang[J].ActaPhytopathologicaSinica,2012,42(2):120-125(in Chinese with English abstact).
[21] 陈国庆.中国柑橘炭疽病病原种类及种群遗传多样性研究[D].杭州:浙江大学,2010:73.
CHEN G Q.Species of citrus anthracnose pathogens and the population genetic diversity of dominant speciesColletotrichumgloeosporioidesin China[D].Hangzhou:Zhejiang University,2010:73(in Chinese with English abstact).
[22] 夏 花.辣椒上一种新病害病原鉴定及尖孢炭疽菌株比较研究[D].长沙:湖南农业大学,2012:62.
XIA H.Pathogen identification of a new disease on pepper and comparative study ofColletotrichumacutatum[D].Changsha:Hunan Agricultural University,2012:62(in Chinese with English abstact).
[23] 唐景美.广西辣椒果实炭疽病病原菌鉴定及其生物学特性研究[D].南宁:广西大学,2009:65.
TANG J M.A study on pathogens identification of pepper fruit anthracnose and their biological characteristics in Guangxi[D].Nanning:Guangxi University,2009:65(in Chinese with English abstact).
[24] RAMDIAL H,RAMPERSAD S N.Characterization ofColletotrichumspp.causing anthracnose of bell pepper(CapsicumannuumL.) in Trinidad[J].Phytoparasitica,2015,43(1):37-49.
[25] 曾大兴,戚佩坤,姜子德.弯孢类炭疽菌菌株的RAPD分析与分类研究[J].菌物学报,2004,23(2):188-194.
ZENG D X,QI P K,JIANG Z D.RAPD analysis and taxonomy of falcate-spored species ofColletotrichum[J].Mycosystema,2004,23(2):188-194(in Chinese with English abstact).
[26] 孙志峰.大豆豆荚炭疽病的发病因子及其防治研究[D].杭州:浙江大学,2008:58.
SUN ZH F.Study on disease factors of soybean pod anthracnose and its control[D].Hangzhou:Zhejiang University,2008:58(in Chinese with English abstact).
[27] ARX J A.Die Arten der GattungColletotrichumCda[J].PhytopathologischeZeitschrift,1957,29:413-468.
[28] MORIWAKI J,SATO T,TSUKIBOSHI T.Morphological and molecular characterization ofColletotrichumboninensesp.nov.from Japan[J].Mycoscience,2003,44(1):47-53.
[29] 曹文广,秦 芸,刘云龙,等.中国炭疽菌属(Colletotrichum)的分类研究Ⅱ[J].中国食用菌 ,2006,25(增刊):149-151.
CAO W G,QIN Y,LIU Y L,etal.Studies on the taxonomy of ChineseColletotrichumⅡ[J].EdibleFungiofChinaSupplement,2006,25(S):149-151(in Chinese with English abstact).
[30] 汤铱泠,周国英,李 河,等.多基因序列鉴定油茶炭疽病原Colletotrichumboninense新种[J].热带作物学报,2015,36(5):972-977.
TANG Y L,ZHOU G Y,LI H,etal.Identification of a new anthracnose ofCamelliaoleiferabased on multiple-gene phylogeny [J].ChineseJournalofTropicalCrops,2015,36(5):972-977(in Chinese with English abstact).
[31] 周平兰,唐新科,龙岳林,等.春兰炭疽病致病菌Colletotrichumboninense的鉴定及生物学特性分析[J].园艺学报,2015,42(10):1993-2001.
ZHOU P L,TANG X K,LONG Y L,etal.Identification of pathogenColletotrichumboninensefromCymbidiumgoeringiiand its biological characteristics[J].ActaHorticulturaeSinica,2015,42(10):1993-2001(in Chinese with English abstact).
[32] 施祖荣,张云霞,黄江华,等.广东地区墨兰和大花蕙兰炭疽病菌的鉴定[J].仲恺农业工程学院学报,2013,26(2):22-25.
SHI Z R,ZHANG Y X,HUANG J H,etal.Identification of anthracnose onCymbidiumsinenseandCymbidiumhybridumin Guangdong province[J].JournalofZhongkaiUniversityofAgricultureandEngineering,2013,26(2):22-25(in Chinese with English abstact).
[33] 张美芳,何 玲,张美丽,等.‘秦美’猕猴桃贮藏期病原真菌的鉴定[J].西北农业学报,2015,24(6):132-137.
ZHANG M F,HE L,ZHANG M L,etal.Identification of pathogene on ‘Qinmei’ kiwi fruit during storage[J].ActaAgricultureBoreali-occidentalisSinica,2015,24(6):132-137(in Chinese with English abstact).
[34] DAMM U,CANNON P F,WOUDENBERG J H C,etal.TheColletotrichumboninensespecies complex[J].StudiesinMycology,2012,73(1):1-36.
[35] FARR D F,ROSSMAN A Y.Fungal databases,ystematic myeology and microbiology laboratory,ARS,USDA [DB/OL].Retrieved October 20,2010,http://nt.ars-grin.gov/fungaldatabases/.
[36] 杨友联.中国贵州、云南、广西炭疽菌属真菌多基因分子系统学研究[D].武汉:华中农业大学,2010:129.
YANG Y L.Multi-locus phylogeny ofColletotrichumspecies in Guizhou,Yunnan and Guanxi,China[D].Wuhan:Huazhong Agricultural University,2010:129(in Chinese with English abstact).
CorrespondingauthorZHAO Zunlian,male,research fellow.Research area:pepper breeding and cultivation,E-mail:jimzhao@nwsuaf.edu.cn
(责任编辑:郭柏寿Responsibleeditor:GUOBaishou)
IdentificationandBiologicalCharacterizationofAnthraxBacteriainXianlajiaoChiliPepperinShaanxiProvince
YANG Jiawen1,ZHAO Zunlian1,ZHANG Guanqu2,XIE Fangqin2, JIANG Changyue1,ZHANG Yongxiang1,HAN Xiaoping3and XU Nailin4
(1.College of Horticulture,Northwest Aamp;F University,Yangling Shaanxi 712100,China; 2.College of Plant Protection,Northwest Aamp;F University,Yangling Shaanxi 712100,China; 3.Fuping Agricultural Technology Extension Centre,Fuping Shaanxi 711700,China; 4.Baoji Agricultural Technology Extension Centre,Baoji Shaanxi 721001,China)
In order to determine the types and biological characteristics of anthrax bacteria in Xianlajiao chili pepper in Shaanxi province,80 pepper fruit samples with anthracnose symptoms were collected from Baoji,the main production area of Xianlajiao Chili pepper in Shaanxi province and the pathogens were isolated and identified biological characteristics and sequence analyzed using Multi-gene combination method .The results showed that four different types of anthrax strain were identified from 80 samples,includingColletotrichumacutatum,Colletotrichumtruncatum,Colletotrichumspinaciae,andColletotrichumboninense,and their proportion were 83.75%,13.75%,1.25% and 1.25% respectively,C.acutatumpresented the strongest virulence to Xianlajiao pepper fruit,followed byC.truncatumandC.spinaciaewith weak pathogenicity,butC.boninensewas avirulence.The study of the biological characteristics analysis displayed the optimal environment and medium conditions for the hypha growth and spore production for every type of anthrax bacteria.ForC.acutatum,the optimal conditions for hypha growth included environment condition of 25 ℃ temperature,continuous illumination,and medium with pH 6,glucose for carbon source,yeast extract for nitrogen source,the optimal conditions for spore production included environment condition of 30 ℃ temperature,continuous illumination,and medium with pH 5-6,maltose for carbon source,yeast extract is for nitrogen source.ForC.truncatum,the optimal conditions for hypha growth and spore production were 30 ℃,continuous illumination,pH 7,fructose,peptone,and 30 ℃,continuous darkness,pH 5-6,maltose,proline,respectively.ForC.spinaciae,the optimal conditions for hypha growth and spore production were 30 ℃,continuous illumination,pH 9-11,maltose,peptone,and 30 ℃,continuous darkness,pH 5-6,maltose,peptone,respectively.This is the first report about the identification ofC.acutatumin Xianlajiao chili pepper in Shaanxi province,and the infection ofC.spinaciaeto Xianlajiao chili pepper is firstly reported in the world.
Xianlajiao chili pepper; Anthracnoses; Pathogen identification; Multi-gene combination analysis; Biological characteristics
2016-10-07
2017-04-14
Shaanxi Innovation Project of Science and Technology(No.2015KTCL02-20); Shaanxi Major Agro-technique Extension Service Pilot Project(No.2016SC-00).
YANG Jiawen,female,master student.Research area:pepper breeding and biotechnology,E-mail:jwyang10@163.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.034.html
2016-10-07
2017-04-14
陕西省科技统筹创新工程计划(2015KTCL02-20);陕西省重大农技推广服务试点项目(2016SC-00)。
杨佳文,女,硕士研究生,研究方向为辣椒育种与生物技术。E-mail:jwyang10@163.com
赵尊练,男,博士,研究员,研究方向为辣椒育种与栽培。E-mail:jimzhao@nwsuaf.edu.cn
S436.418
A
1004-1389(2017)11-1695-11
