内生木霉P3.9菌株的多功能性及其枇杷根腐病的盆栽防效
2017-11-29鲁海菊沈云玫陶宏征王传铭
鲁海菊,沈云玫,陶宏征,江 涛,王传铭
(红河学院 生命科学与技术学院,云南蒙自 661199)
内生木霉P3.9菌株的多功能性及其枇杷根腐病的盆栽防效
鲁海菊,沈云玫,陶宏征,江 涛,王传铭
(红河学院 生命科学与技术学院,云南蒙自 661199)
为明确内生木霉P3.9菌株多功能性及其生防潜力,采用菌丝生长速率法、透明圈法、农艺性状观测法、组织分离法、土壤梯度稀释法和盆栽法,分别测定其对不同植物病原菌的抑制率、不同化学农药的耐药性、纤维素及磷的降解能力、促生作用、在枇杷植株及其根际土壤中的定殖能力和枇杷根腐病的防治效果。结果表明,内生木霉P3.9菌株对7种植物病原菌有不同程度的抑菌作用,其中,对枇杷根腐病菌的抑制作用最强,抑菌率达93%;对5种化学农药有不同程度的耐药性,其中,对硫磺三唑酮的耐药性最高;对纤维素及磷有极强的降解能力;对枇杷植株有促生作用,能定殖于枇杷植株及其根际土壤中,盆栽防治枇杷根腐病效果可达80%。
内生木霉;拮抗作用;耐药性;降解纤维素能力;解磷能力;促生作用;定殖能力
木霉(Trichoderma)是重要的生防因子,近年来,由于大量持续使用化肥和农药,使土壤环境发生很大变化。施入土壤的木霉受到土壤因子的影响,包括残留农药(多数为有机磷农药)的抑制作用,导致木霉菌剂在田间防效不稳定。研究发现有些木霉同时具有耐药[1-4]、降解纤维素[5]、解磷[6-12]、促生[13-16]等多种功能。耐药性菌株更容易定殖于植物的根际土壤及其植株中[17],另外,内生木霉受到宿主的良好保护,较其腐生木霉,更具有生防优势。因此,本研究检测枇杷内生木霉P3.9菌株的抗菌、耐药、解磷、降解纤维素、促生等多功能特性,并研究其对枇杷根腐病的盆栽防治效果,为枇杷根腐病的安全可持续防控提供理论依据及菌种资源。
1 材料与方法
1.1 材 料
1.1.1 供试菌株 内生木霉P3.9菌株(Trichodermaatroviride)、石榴干腐病菌(Zythiaversoniana)、枇杷根腐病菌(Pestalotiopsismicrosopora)、辣椒黄萎病菌(Verticilliumdahliae)、辣椒黑斑病菌(Alternariaalternata)、万寿菊叶斑病菌(Alternariabrassicicola)、康乃馨根腐病菌(Fusariumsp.)和石榴枯萎病菌(Ceratocystisfimbriata)均保存于红河学院生命科学与技术学院植物病理学标本室。
1.1.2 供试培养基 PDA培养基:马铃薯200 g、葡萄糖18 g、琼脂13.5 g、蒸馏水1 L。
1.2 内生木霉P3.9菌株多功能性的测定
1.2.1 对不同植物病原菌的抑制作用 将供试植物病菌和内生木霉P3.9菌株在PDA平板培养基中,28 ℃恒温扩大培养5 d,采用对峙培养法[18],在培养基同一半径周围,用打孔器取直径为5 mm的菌饼,将木霉与病菌两两组合,同时接种于无菌PDA平板(直径90 mm)中,两接种点相距45 mm,以不接种木霉菌株作对照, 设3次重复,在28 ℃下恒温培养,第7天测定病菌的菌落直径,计算其生长抑制率。
抑制率=[(dCK-dB)/dCK]×100%
式中,dCK表示对照病菌菌落直径,dB表示处理病菌菌落直径。
1.2.2 抗化学农药特性 培养基:K2HPO45.71 g、KH2PO41.7 g、(NH4)2SO42.63 g、MgSO4·7H2O 0.095 g、MnSO40.05 g、FeSO40.05 g、CaCl20.003 g、琼脂13 g,蒸馏水定容至1 L。
将木霉菌株接种于分别含有终质量浓度为100 mg/L的甲基硫菌灵、甲硫异菌脲、多菌灵、扑海因、硫磺三唑酮、甲霜灵锰锌、苯醚甲环唑、戊唑醇和百菌清的固体基础培养基上,于培养箱中28 ℃培养7 d,观察其生长状况以判定是否具有抗药性。若是产孢,用蒸馏水冲洗孢子,制成孢子液(1×107L-1)在200 r/min摇床上震荡20 min,备用,用血球计数板在显微镜下统计孢子数。
1.2.3 降解纤维素能力 CM固体培养基:(NH4)2SO42.5 g、K2HPO42.0 g、NaH2PO41.0 g、MgSO4·7H2O 0.5 g、微晶纤维素5.0 g、琼脂13.0 g,蒸馏水定容至1 L,pH=7.4。
将木霉菌株接种至CM固体培养基,28 ℃恒温培养,每隔48 h观察菌落形态,并通过十字交叉法测量菌落直径,每处理设3次重复。培养6 d后,用1 g/L的刚果红溶液浸泡平板10 min,用 8 g/L 的NaCl水溶液漂洗15 min,观察平板上是否出现透明降解圈,以验证纤维素是否被有效降解。
1.2.4 解无机磷能力 解磷培养基:葡萄糖10.00 g、(NH4)2SO40.50 g、NaC1 0.30 g、KC1 0.30 g、MgSO4·7H2O 0.30 g、FeSO4·7H2O 0.03 g、MnSO4·H2O 0.03 g、Ca3(PO4)25.00 g,pH 7.0~7.5,固体培养基的琼脂粉。
将木霉菌株接种于解磷固体培养基上,于培养箱中28 ℃培养5 d,观察有无透明水解圈以判定其是否具有解无机磷的能力。
1.2.5 对枇杷植株的促生作用 枇杷嫁接苗种植于营养袋(23 mm×18 mm)中,常规肥水管理,苗龄为1 a时做接种试验。将内生木霉P3.9菌株在PDA平板上28 ℃培养3 d,用5 mm直径的打孔器打取菌饼,备用,同时用同一规格的打孔器将枇杷苗主干韧皮部打出孔,去除韧皮部,每株枇杷苗主干打10个孔。将上述菌饼放置于除去韧皮部的枇杷主干孔中,用保鲜膜密封保湿。以接种PDA圆饼做对照。设10个重复。第180天统计枇杷叶片数量,用游标卡尺测量叶面积及株高。用携式叶绿素检测仪测定叶片叶绿素质量分数。
1.2.6 在枇杷植株及根际中的定殖能力 枇杷苗栽种及木霉P3.9菌株接种方法同“1.2.5”,第180天,随机取枇杷苗根、茎、叶组织,根、茎切成1 cm左右的小段,叶切成0.5 mm×0.5 mm的小块,用φ=70%的酒精漂洗1 min,再用次氯酸钠溶液浸泡5 min,无菌水冲洗3次,用灭菌滤纸吸干水分后,接种于PDA平板,每个培养皿接5块组织,置于28 ℃培养5~7 d,观察是否分离到木霉。分离未接木霉的枇杷组织做对照。木霉选择性培养基配方[19]: MgSO4·7H2O 0.2 g、K2HPO40.9 g、KCl 0.15 g、(NH4)2SO41.0 g、葡萄糖 3.0 g、玫瑰红四氯四碘萤素钠盐(C20H2O5Cl4I4Na2) 0.033 g、琼脂粉20 g,五氯硝基苯(w=75%可湿性粉剂) 0.2 g、水1 L,pH 6.0 (灭菌前调节),五氯硝基苯在培养基冷却至45 ℃左右时,于倒平板前加入到三角瓶中,并充分摇匀。
在云南省蒙自市枇杷根腐病病区采集根际土样,每个样地分别选取3个样点,在每个样点(1 m×1 m)按五点取样法取深度0~15 cm的枇杷根际土样。装袋密封带回实验室,利用四分法将土样充分混匀,分别称取400 g装入2个浅盘中,高压蒸汽连续灭菌。将1×107mL-1木霉孢子悬浮液100 mL施入其中一个浅盘中,另外一个撒等量清水为对照,置于28 ℃下保湿培养。设3个重复。于木霉接种第30天取10 g土样配制成10-5g/mL的土壤悬浮液10 μL,加入木霉选择性培养基中,采用稀释涂布平板法计数,28 ℃培养3 d,测定木霉菌落数。
1.2.7 对枇杷根腐病的盆栽防效 枇杷内生木霉P3.9菌株接种方法同“1.2.5”。设3个处理,处理1为同时接种枇杷内生木霉P3.9菌株及枇杷根腐病病菌,处理2为枇杷内生木霉P3.9菌株接种7 d后接种枇杷根腐病病菌,处理3为枇杷内生木霉P3.9菌株接种7 d前接种枇杷根腐病病菌,以接种PDA圆饼为对照。每个处理设5个重复。每天观察枇杷苗长势及发病情况。
1.2.8 数据统计 采用 SPSS 19.0统计软件Duncan’s多重比较法统计分析处理间的差异显著性。
2 结果与分析
2.1内生木霉P3.9菌株对不同植物病原菌的抑制作用
由表1可知:内生木霉P3.9菌株对供试的7种植物病菌均有抑制作用,抑菌率均高于60%。其中,对枇杷根腐病菌、石榴干腐病菌、辣椒黄萎病菌和辣椒黑斑病菌4种病菌的抑菌率高于80%。相比较而言,对枇杷根腐病菌和石榴干腐病菌的抑菌率最大,分别为93%和88%。与其他病菌差异极显著。说明内生木霉P3.9菌株对这2种病害的生防潜力最大。P3.9菌株分离自枇杷主干韧皮部,理论上更容易定殖于枇杷根际及其植株中,生防潜力更大。
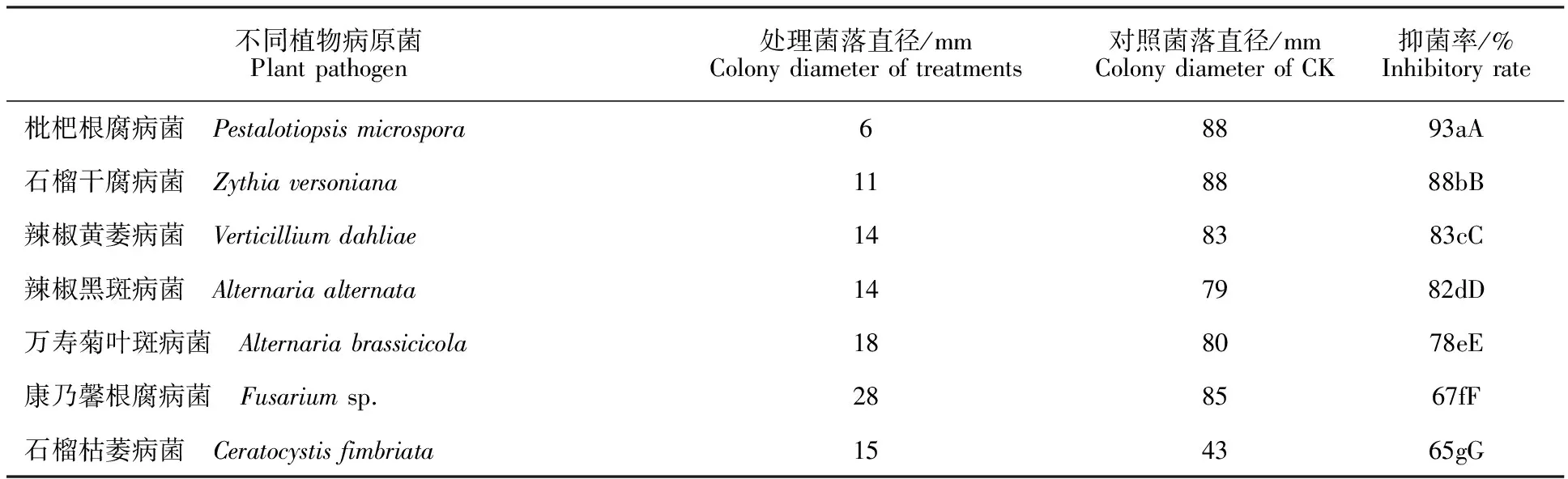
表1 内生木霉P3.9菌株对不同植物病原菌的抑菌作用Table 1 Inhibitory effect of endophytic Trichoderma P3.9 strain to different plant pathogens
注:不同小写字母代表在Plt;0.05水平差异显著;不同大写字母代表在Plt;0.01水平差异极显著。下同。
Note:Different lowercase letter means significant difference(Plt;0.05),different capital letter means difference(Plt;0.01).The same below.
2.2 内生木霉P3.9菌株的抗化学农药特性
由表2可知:内生木霉P3.9菌株能被甲基硫菌灵、甲硫异菌脲、多菌灵和扑海因4种化学农药100% 抑制,说明此菌株对上述4种化学农药不具抗药性。百菌清、戊唑醇、苯醚甲环唑、甲霜灵锰锌和硫磺三唑酮5种化学农药能不同程度地抑制P3.9菌株生长。其中,在含硫磺三唑酮的培养基中,P3.9菌株产孢量与其余农药差异极显著,产孢量最多,与对照产孢量在同一个数量级(107mL-1)。而且此农药不能抑制P3.9菌株的菌丝生长,说明内生木霉P3.9菌株对硫磺三唑酮具有极强的抗药性。另外,对百菌清、戊唑醇、苯醚甲环唑和甲霜灵锰锌4种化学农药也具有不同程度的抗药性。其中,甲霜灵锰锌对P3.9菌株的菌丝生长与其他农药差异极显著,菌落直径最大,与对照菌落直径相等。说明内生木霉P3.9菌株对甲霜灵锰锌的抗药性也很强。
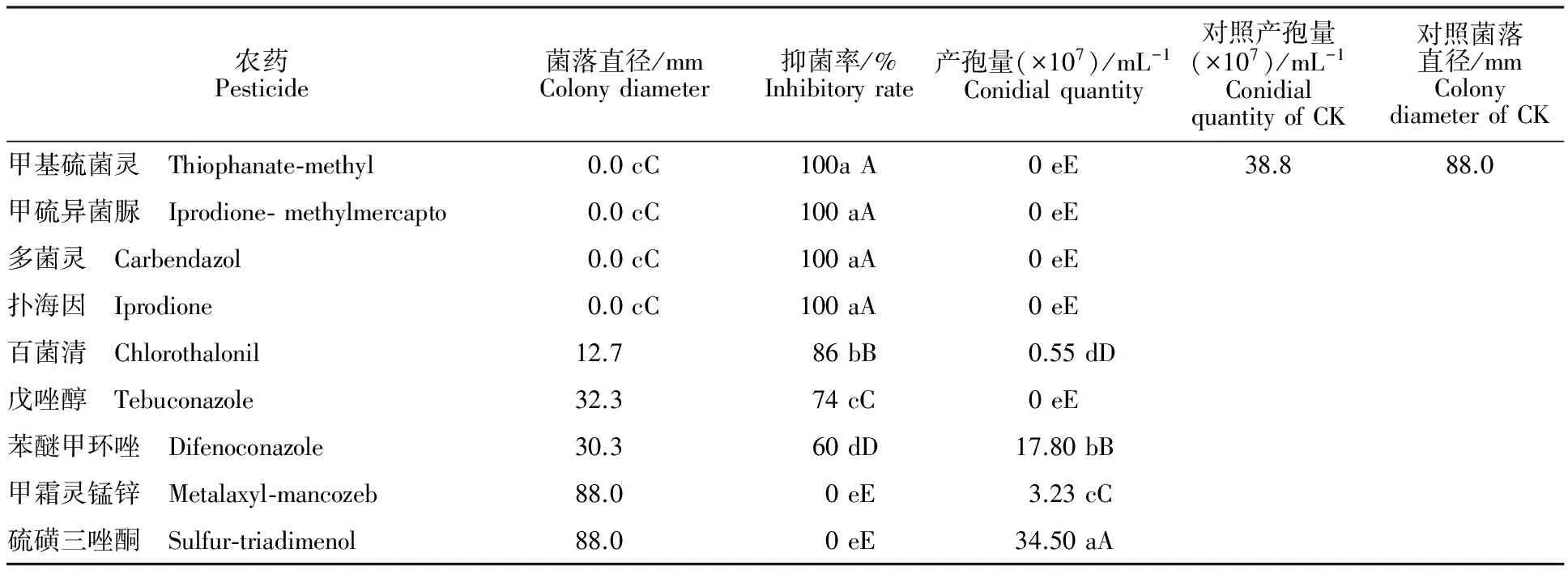
表2 内生木霉P3.9菌株的抗化学农药特性Table 2 Characteristics of endophytic Trichoderma P3.9 strain resistant to chemical pesticide
2.3 内生木霉P3.9菌株降解纤维素的能力
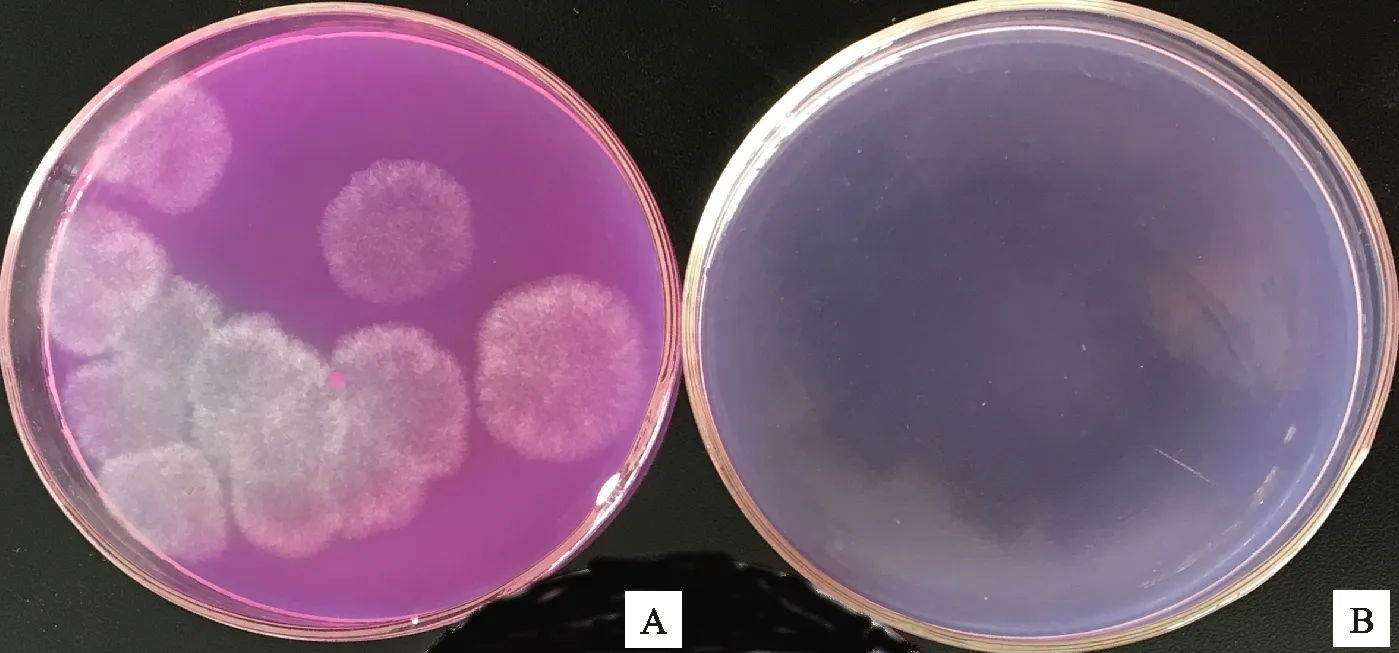
内生木霉P3.9菌株在含有微晶纤维素的培养基上生长良好,菌落直径达88.0 mm。使培养基变透明(图1-A),含微晶纤维素的培养基混浊(图1-B)。说明内生木霉P3.9菌株对纤维素有极强的降解能力。
2.4 内生木霉P3.9菌株的解磷能力
内生木霉P3.9菌株在含有磷酸钙的培养基上生长良好,菌落直径达88.0 mm。使培养基变透明(图2-A),含磷酸钙的培养基混浊(图2-B)。说明内生木霉P3.9菌株对难溶磷有极强的降解能力。
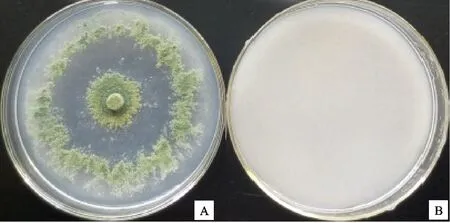
A.被降解 Degraded;B.未降解 Undegraded cellalose
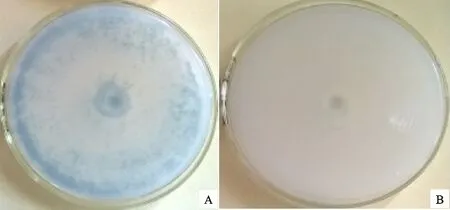
A.被降解 Degraded;B.未降解 Undegraded cellalose
2.5 内生木霉P3.9菌株对枇杷植株的促生作用
由表3及图3可知:枇杷内生木霉P3.9菌株在接种于枇杷主干韧皮部第30天(图3-B),其叶片数量、叶面积、叶绿素质量分数及株高与接种第3天(图3-A)差异极显著,各项指标均高于对照。叶片数量比对照每株多6片,叶面积每片叶比对照大39.8 cm2,叶绿素质量分数每片叶比对照大0.01 mg/g,株高每株比对照大5 mm。说明此菌株对枇杷植株有促生作用。
2.6内生木霉P3.9菌株在枇杷根际及其植株中的定殖能力
枇杷内生木霉P3.9菌株在枇杷植株及其根际中接种第30天,同时能再次分离到木霉菌株(图4-B,图5-A),而未接种木霉的对照中未分离到木霉(图4-A,图5-B)。说明此菌株能在枇杷根际及其植株中定殖。

表3 内生木霉P3.9菌株对枇杷植株的促生作用Table 3 Growth-promoting effect of endophytic Trichoderma P3.9 strain on loquat
2.7内生木霉P3.9菌株对枇杷根腐病的盆栽防效
由表4可知,只接种PDA圆饼的对照植株(图6-a)不发病。只接种枇杷根腐病病菌的枇杷植株(图6-g)最后整株枯死。枇杷根腐病病菌接种第7天接种枇杷内生木霉P3.9菌株(图6-b,6-c)、木霉P3.9菌株接种第7天接种根腐病病菌(图6-d,6-e)、同时接种木霉P3.9菌株及根腐病病菌(图6-f)的植株,其病害控制百分比差异极显著。其中,病原菌接种前7天接种木霉的防治效果优于病原菌接种7 d后接种木霉的防治效果,前者防治效果达80%,后者防治效果为40%。病原菌与木霉同时接种,防治效果为60%。说明在病菌入侵之前,提前活体接种木霉P3.9菌株能起到预防控制病害的作用。

A:接种时枇杷植株生长状况 Growth status of loquat plant before inoculation; B:第30天时枇杷植株生长状况 Growth status of loquat plant inoculated by endophyticTrichodermaP3.9 strain for 30 days;a~c.接种内生木霉P3.9菌株的枇杷植株 Loquat plants inoculated by endophyticTrichodermaP3.9 strain; d~f.对照枇杷植株 Loquat plants of CK
图3枇杷内生木霉P3.9菌株促进枇杷植株生长状况
Fig.3LoquatplantgrowthpromotedbyendophyticTrichodermaP3.9strain
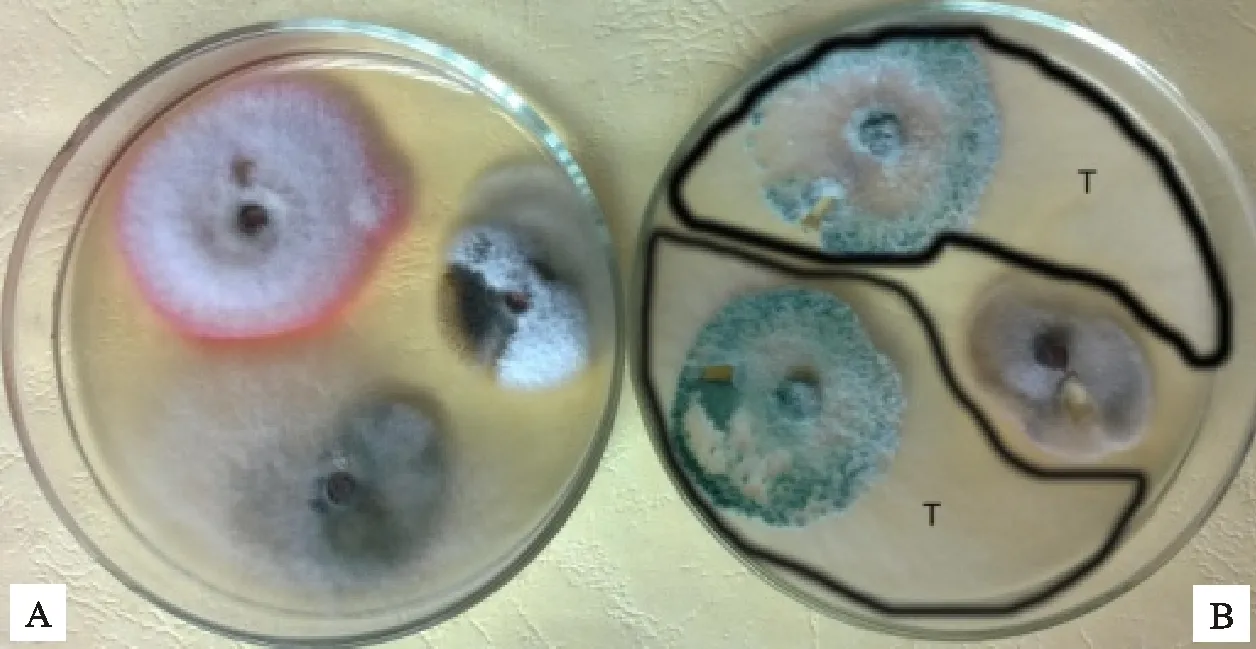
A.不接种内生木霉P3.9菌株的枇杷韧皮部组织上分离的枇杷内生菌株 Endophytic fungi isolated from phloem tissue of loquat without inoculating endophyticTrichodermaP3.9 strain; B.接种内生木霉P3.9菌株的枇杷韧皮部组织分离的木霉菌株和其他枇杷内生菌株 EndophyticTrichodermastrains isolated from phloem tissue of loquat inoculated by endophyticTrichodermaP3.9 strain and the other endophytic fungi
图4枇杷内生木霉P3.9菌株在枇杷植株中的定殖状况
Fig.4ColonizationofendophyticTrichodermaP3.9straininloquatplant
A.接种内生木霉P3.9菌株的枇杷根际土壤中再次分离到木霉菌株 EndophyticTrichodermastrains isolated again from rhizospere soil of loquat plant inoculated by endophyticTrichodermaP3.9 strain; B.不接种内生木霉P3.9菌株的枇杷根际土壤中未分离到木霉菌株 NoTrichodermastrain isolated from rhizospere soil of CK
图5内生木霉P3.9菌株在枇杷根际土壤中的定殖状况
Fig.5ColonizationofendophyticTrichodermaP3.9straininrhizosperesoilofloquatplant
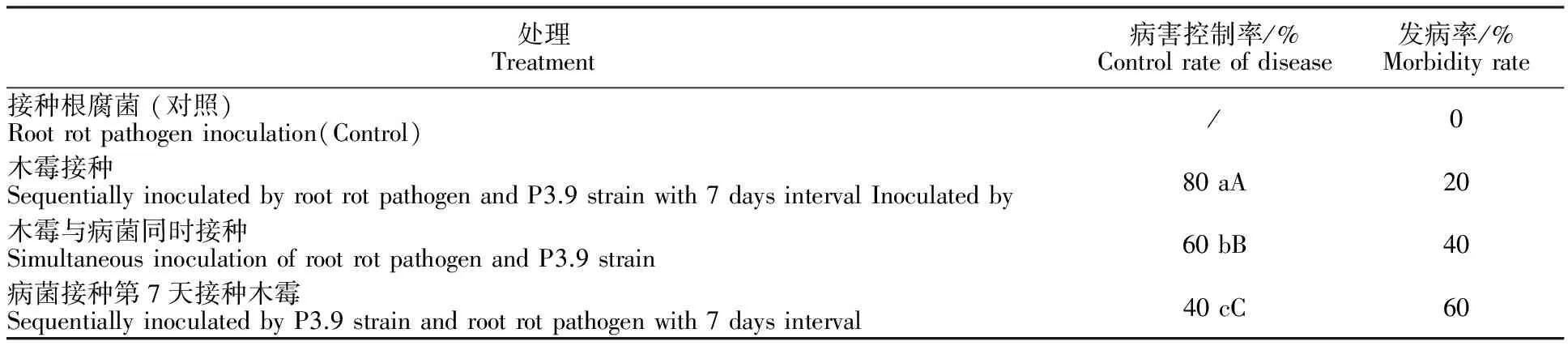
表4 木霉P3.9菌株对枇杷根腐病的防治效果Table 4 Effect of endophytic Trichoderma P3.9 strain to control loquat root rot

A:a.PDA圆饼接种枇杷植株对照 Loquat plant inoculated by PDA disc of root rot pathogen; b、c.病菌接种第7天接种木霉枇杷植株 Loquat plant inoculated sequentially by root rot pathogen and P3.9 strain with 7 days interval inoculation; d、e.木霉接种第7天接种病菌枇杷植株 Loquat plant inoculated sequentially by P3.9 strain and root rot pathogen with 7 days interval;B:f.同时接种木霉与病菌接种枇杷植株 Loquat plant inoculated simultaneously by root rot pathogen and P3.9 strain;g.只接种病原菌枇杷植株对照 Loquat plant inoculated only by root rot pathogen
图6木霉P3.9菌株对盆栽枇杷根腐病的防治效果
Fig.6EffectofendophyticTrichodermaP3.9straintocontrolofloquatrootrot
3 讨 论
本研究结果表明,枇杷内生木霉P3.9菌株对枇杷根腐、石榴干腐、辣椒黄萎病、辣椒黑斑病、万寿菊叶斑病、康乃馨根腐病和石榴枯萎病7种植物病原菌有不同程度的抑菌作用,抑菌率均高于60%。其中,对枇杷根腐病菌的抑制作用最强,抑菌率达93%。与前人的报道一致[20]。对硫磺三唑酮、甲霜灵锰锌、苯醚甲环唑、戊唑醇和百菌清5种化学农药有不同程度的耐药性,其中,对硫磺三唑酮耐药性最高,其菌丝生长及产孢能力几乎不受影响。与前人的报道一致[1-4]。对纤维素及磷具有极强的降解能力。能增加枇杷叶片数量及叶面积、株高和叶绿素质量分数,对枇杷促生作用明显,与前人的报道[6-12]一致[13-16,21]。能定殖于枇杷植株及其根际土壤中,对枇杷根腐病的防效可达80%,与前人的报道一致[17,19]。此菌株分离自枇杷主干韧皮部[22],抗菌谱广[23],对枇杷根际土壤真菌[24]和枇杷内生真菌[25]有极强的抑制作用,其固体发酵工艺[26]简单。这种集抗菌、耐药、解磷、降解纤维素和促生5种功能于一身的木霉菌株,尚属首次报道。可防治多种植物病害,降解土壤不可溶或难溶的无机磷,供作物吸收,减少磷肥的使用量,也可帮助降解有机堆肥,促进作物生长,甚至与化学农药混配使用,提高病害防治效果,减少农药使用量。因此,枇杷内生木霉P3.9 菌株具有广阔的开发应用前景。
Reference:
[1] 尹 婷,徐秉良,梁巧兰,等.耐药性木霉T2菌株的筛选、紫外诱变与药剂驯化[J].草业学报,2013,22(2):117-122.
YIN T, XU B L, LIANG Q L,etal.UV mutagenesis and screening for fungicide resistant strains ofTrichodermaaureovirideT2[J].ActaPrataculTuraeSinica,2013,22(2):117-122(in Chinese with English abstract).
[2] 梁志怀,魏 林,安哲宇,等.生防木霉菌耐三唑类杀菌剂菌株的选育[J].中国生物防治),2010,26(1):60-65.
LIANG ZH H,WEI L,AN ZH Y,etal.Selection ofTrichodermamutants resistant to triazole fungicides[J].ChineseJournalofBiologicalControl,2010,26(1):60-65(in Chinese with English abstract).
[3] 戚玮真,赵 蕾.一株生防木霉菌的农药降解特性[J].山东农业科学,2012,44(3):81-83.
QI W ZH,ZHAO L.Study on degradation characteristic of pesticides by biologicalTrichodermaspp.[J].ShandongAgricultralSciences,2012,44(3):81-83(in Chinese with English abstract).
[4] 田连生,陈 菲.木霉对多菌灵的生物降解特性研究[J].土壤学报,2009,46(6):1127-1131.
TIAN L SH, CHEN F.Carbendazim biodegradation characteristics ofTrichoderma[J].ActaPedologicaSinica,2009,46(6):1127-1131(in Chinese with English abstract).
[5] 宋贤冲,邓小军,唐 健,等.3个木霉菌株对马尾松松针的分解作用[J].广西林业科学,2014,43(1):66-68,74.
SONG X CH,DENG X J,TANG J,etal.Decomposition of threeTrichodermaspecies on pine needles ofPinusmassoniana[J].GuangxiForestryScience,2014,43(1):66-68,74(in Chinese with English abstract).
[6] ANUSUYA D,JAYARJAN R.Solubilization of phosporus byTrichodermaviride[J].CurrentScience,1998,74(5):464-465.
[7] SPATNEKAR H G,RASAL P H, PATIL P L.Occurrence of phosphate solubilizing fungi in black soils of Maharashtra[J].MaharashtraAgriculturalUniversities,2003,28(2):164-165.
[8] RUDRESH D L,SHIVAPRAKASH M K,PRASAD R D.Tricalcium phosphate solubilizing abilities ofTrichodermaspp.in relation to puptake and growth and yield parameters of chickpea (CicerarietinumL.)[J].CanadianJournalofMicrobiology,2005,51(3):217-222.
[9] GABER Z,HEBA A M.Bio-production of compost with low pH and high soluble phosphorus from sugar cane bagasse enriched with rock phosphate[J].MicrobiologyandBiotechnology,2005,21(5):747-752.
[10] SUNANTAPONGSUK V,NAKAPRAVES P,PIRIYAPRIN S,etal.Protease production and phosphate solubilization from potential biological agentsTrichodermavirideandAzomonasagilisfrom vetiver rhizosphere[C].Beijing:International Workshop on Sustained Management of the Soil-rhizosphere System for Efficient Crop Production and Fertilizer Use,2006:16-20.
[11] 营丽萍,刘力行,陈云鹏,等.木霉菌REMI转化子解磷筛选及其解磷效果分析[J].安徽农业科学,2007,35(20):6179-6180,6191.
YING L P,LIU L X,CHEN Y P,etal.Phosphate-dissolving screening and effective analysis ofTrichodermaREM transformant[J].JournalofAnhuiAgriculturalScience,2007,35(20):6179-6180,6191(in Chinese with English abstract).
[12] 杨合同,于雪云,魏艳丽,等.多功能植病生防木霉的分离筛选与鉴定[J].山东科学,2009,22(5):27-30.
YANG H T,YU X Y,WEI Y L,etal.Isolation, screening and identification of multifunctionalTrichodermaspp.with antipathogenic biocontrol capacity[J].ShandongScience,2009,22(5):27-30(in Chinese with English abstract).
[13] CHANG Y C,BAKER R,CHET I.Increased growth of plant with the biological control agentTrichodermaharzianum[J].PlantDisease,1991,12(2):95-99.
[14] 曾华兰,叶鹏盛,李琼芳,等.哈茨木霉T23对花生的促生增产作用[J].云南农业大学报,2005,20(1):145-146.
ZENG H L,YE P SH, LI Q F,etal.Effects ofTrichodermaharzianumT23 on peanut yield[J].JournalofYunnanAgricultrualUniversity,2005,20(1):145-146(in Chinese with English abstract).
[15] 李卫平,林福呈.绿色木霉对蔬菜苗期病害的防治和促生作用[J].浙江农业学报,2000,12(2):106-107.
LI W P, LIN F CH.The diseases control and growth enhancement of vegetable seedlings withTrichodermaviride[J].ActaAgriculturaeZhejiangensis,2000,12(2):106-107(in Chinese).
[16] 刘云龙,何永宏,张旭东.哈茨木霉对辣椒生长的影响[J].云南农业大学学报,2002,17(4):345-346.
LIU Y L,HE Y H,ZHANG X D.Effects of biocontrol agentsTrichodermaharzianumon plant growth inCapsicum[J].JournalofYunnanAgricultrualUniversity,2002,17(4):345-346(in Chinese with English abstract).
[17] 鲁海菊,刘云龙.哈茨木霉强根际定殖能力菌株的筛选[J].中国生物防治,2008,24(2):138-142.
LU H J,LIU Y L.Screening ofTrichodermaharzianumstrains for the enhanced ability to colonize in rhizosphere[J].ChineseJournalofBiologicalControl,2008,24(2):138-142(in Chinese with English abstract).
[18] 鲁海菊,全舒舟,李香香,等.枇杷内生真菌中拮抗石榴干腐病菌菌株的筛选[J].热带农业科学2013,33(7):58-62.
LU H J,QUAN SH ZH,LI X X,etal.Screening of strains of antifungal activity to pathogen of pomegranate fruit rot from loquat endophytic fungus[J].ChineseJournalofTropicalAgriculture,2013,33(7):58-62(in Chinese with English abstract).
[19] 何月秋,和志娇,杨艳丽,等.哈茨木霉Th_A和Th_B的存活力与定殖能力的测定[J].云南农业大学学报,2004,19(3):279-282,303.
HE Y Q, HE ZH J,YANG Y L,etal.Detection on survival and colonization abilities ofTrichodermaharzianumTh-A and Th-B[J].JournalofYunnanAgricultrualUniversity,2004,19(3):279-282,303(in Chinese with English abstract).
[20] 张海军,李泽方.绿色木霉GY20对棉花枯萎病菌的抑菌作用[J].西北农业学报,2012,21(3):193-197.
ZHANG H J,LI Z F.Biocontrol mechanismTrichodermavirideGY20 againstFusariumoxysporumf.sp.vasinfectumF12[J].ActaAgriculturaeBoreali-occidentalisSinica,2012,21(3):193-197(in Chinese with English abstract).
[21] 陆宁海,吴利民,田雪亮,等.哈茨木霉对番茄幼苗促生作用机理的初步研究[J].西北农业学报,2007,16(6):192-194.
LU N H,WU L M,TIAN X L,etal.The effect ofTrichodermaharzianumon tomato seedling growth[J].ActaAgriculturaeBoreali-occidentalisSinica, 2007,16(6):192-194(in Chinese with English abstract).
[22] 鲁海菊,董 梅,崔同敏,等.从枇杷内生真菌中筛选抗枇杷根腐病菌的活性菌株[J].江苏农业科学,2014,42(1):95-97.
LU H J,DONG M,CUI T M,etal.Screening of active strains resistant to pathogen of loquat root rot from loquat endophytic fungi[J].JiangsuAgricultralSciences,2014,42(1):95-97(in Chinese).
[23] 鲁海菊,张建春,杞敬香,等.枇杷内生木霉P3.9菌株抗菌谱研究[J].北方园艺,2014,37(24):103-107.
LU H J,ZHANG J CH,QI J X,etal.Study on antimicrobial spectrum ofTrichodermaP3.9 strain of endophytic fungus from loquat[J].NorthernHorticulture,2014,37(24):103-107(in Chinese with English abstract).
[24] 沈云玫,张建春,李 河,等.枇杷根际土壤真菌对生防木霉菌株P3.9的影响[J].江苏农业科学,2014,42(4):106-108.
SHEN Y M,ZHANG J CH,LI H,etal.Effects of fungi from loquat rhizosphere soil on biological controlTrichodermaP3.9 strain[J].JiangsuAgricultralSciences,2014,42(4):106-108(in Chinese).
[25] 鲁海菊,张建春,沈云玫,等.枇杷内生真菌对P3.9生防木霉菌株的抑菌作用[J].湖北农业科学,2014,53(11):2547-2550.
LU H J,ZHANG J CH,SHEN Y M,etal.Antifungal activity of endophytic fungi from loquatTrichodermasp.(P3.9) strain[J].HubeiAgriculturalSciences,2014,53(11):2547-2550(in Chinese with English abstract).
[26] 鲁海菊,王 波,潘柳君,等.深绿木霉P3.9生防菌株固体发酵条件优化筛选[J].北方园艺,2014,37(14):119-123.
LU H J,WANG B,PAN L J,etal.Screening on conditions of solid fermentation for biocontrol strain P3.9 ofTrichodermaatroviride[J].NorthernHorticulture,2014,37(14):119-123(in Chinese with English abstract).
(责任编辑:顾玉兰Responsibleeditor:GUYulan)
MultifunctionofEndophyticTrichodermaP3.9StrainandControlEffectonLoquatRootRot
LU Haiju, SHEN Yunmei, TAO Hongzheng, JIANG Tao and WANG Chuanming
(Department of Life Science and Technology, Honghe College, Mengzi Yunnan 661199, China)
In order to determine the multifunction characteristics and biocontrol potential of endophyticTrichodermaP3.9 strain,Abilities of inhibiting different plant pathogens,resistance to different fungicides,degradation of cellulose and calcium phosphate,growth-promoting,colonization and control of loquat root rot were tested by methods of mycelial growth rates,transparent zone,observation of agronomic trait,tissue isolation of plant,gradient dilution of soil and pot-culture.The results showed that the P3.9 strain had inhibiting effect on seven kinds of plant pathogens.Moreover, the strongest inhibiting effect was detected on loquat root rot, with the inhibition rate of 93%.The P3.9 strain had also a degree of resistance to seven kinds of fungicides, and the best resistance effect was detected on sulfur-triadimenol.It had strong ability of degrading cellulose and calcium phosphate, promoting growth of loquat plant.The P3.9 strain was colonize in loquat plant and rhizospere soil.Control effect of P3.9 strain on loquat root rot was 80%.
EndophyticTrichoderma;Antagonism;Resistance to fungicide;Cellulose degradation;Calcium phosphate degradation;Growth-promoting effect; Colonization ability
2016-12-20
2017-03-12
The National Natural Science Foundation of China(No.31660147 );Yunnan Applied Basic Research Projects(No.2016FB066);the Key Project of Applied Scientific Research of Honghe College(No.XJY15Z06).
LU Haiju,female,professor,Ph.D.Research area: plant diseases caused by fungi and biological control.E-mail:luhaiju2011@126.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.032.html
2016-12-20
2017-03-12
国家自然科学基金(31660147);云南省应用基础研究计划(2016FB066);红河学院应用型科学研究重点项目(XJY15Z06)。
鲁海菊,女,教授,博士,主要从事植物真菌病害及其生物防治研究。E-mail:luhaiju2011@126.com
S667.3
A
1004-1389(2017)11-1681-08
