ABCB1基因多态性与癌痛感知及癌痛病人阿片需求量的关联性分析*
2017-11-22潘志强陈立平
朱 敏 潘志强 张 璐 张 慧 陈立平 许 恒 申 文,△
(1江苏省麻醉学重点实验室,徐州 221000;2 江苏省麻醉与镇痛应用技术重点实验室,徐州 221000;3 徐州医科大学附属医院麻醉与疼痛科,徐州221000)
ABCB1基因多态性与癌痛感知及癌痛病人阿片需求量的关联性分析*
朱 敏1,2潘志强1,2张 璐1,2张 慧1,2陈立平3许 恒3申 文1,2,3△
(1江苏省麻醉学重点实验室,徐州 221000;2江苏省麻醉与镇痛应用技术重点实验室,徐州 221000;3徐州医科大学附属医院麻醉与疼痛科,徐州221000)
目的:探讨ABCB1 C3435T、G2677A/T与癌痛病人疼痛感知的相关性,并研究ABCB1 C3435T、G2677A/T对癌痛病人阿片需求量的影响。方法:应用三维聚丙烯酰胺凝DNA芯片技术检测148例癌痛病人和105例无疼痛恶性肿瘤病人的ABCB1 C3435T、G2677A/T基因分型。应用卡方检验比较不同癌痛程度病人间基因型分布,应用两样本t检验、非参数检验及单因素方差分析比较不同基因型病人疼痛评分和24 h-阿片需求量。结果:253例病人中3435T、2677A/T等位基因频率分别为42.9%、9.1%和40.5%;ABCB1 C3435T、G2677A/T 基因分型在癌痛组和无痛组间无差异(P= 0.371和0.507);不同C3435T、G2677A/T基因分型病人的疼痛程度及疼痛数字评分(numerical rating scale,NRS)没有差异;ABCB1 C3435T、G2677A/T不同基因型癌痛组病人间24 h-阿片药物需求量没有统计学差异(P> 0.05);TT-TT单倍体型病人体重-24 h-阿片剂量、体重-体表面积-24 h-阿片需求量明显低于CG-CG、CG-TT单倍体型(P= 0.043和0.015)。结论:尚不能认为ABCB1 C3435T、G2677A/T影响癌痛病人的疼痛感知,但ABCB1 C3435T、G2677A/T可能会影响癌痛病人24 h-阿片需求量,可能是阿片用量个体差异的因素之一。
单核苷酸多态性;癌痛;阿片需求量;ABCB1基因;癌痛感知;癌痛治疗
根据WTO数据统计,约60%~90%晚期癌症病人在遭受着不同程度癌痛的折磨,多数终末期癌症病人往往需用强阿片类药物镇痛治疗,然而因病人在疼痛敏感性、不良反应、耐受与依赖等方面的个体差异限制了阿片药物的临床应用[1]。大量的生物医学研究表明,绝大部分的药物反应个体差异是由遗传因素造成的,从基因学角度来考量个体化用药方案具有更确切的基础依据[2~4]。近年来研究表明,ABCBl (ATP-binding cassette sub-family B member-1) 基因多态性与阿片药物需求量及镇痛效应间具有相关性[5~8]。P-糖蛋白是由ABCB l基因所编码的定位于细胞膜上的依赖ATP的外排泵,其广泛表达于人体组织,可以外转运多种临床常用的镇痛药物,如吗啡、羟考酮、芬太尼等[9],可阻止阿片药物透过血脑屏障降低对中枢神经系统的镇痛作用,从而影响药物的临床疗效[10~13]。Hoffmeyer及其同事[14]首次对ABCBl基因多态性进行了系统筛查,到目前为止,在不同人群中共发现了近50个多态性位点 (single nucleotide polymorphism SNP),其中一些SNP位点可影响ABCB1基因转录与翻译进程,最终会影响到P-gp的功能[15,16],因而ABCB1 SNP可能会对药物的临床效应和所需药物剂量产生影响,这可能会是应用阿片药物疗效个体差异的因素之一。然而癌症病人疼痛感知状况同样存在明显的个体差异,研究显示基因可能会影响到疼痛的敏感性,越来越多与疼痛相关的不同层面上的遗传基因被发现。近期有研究发现ABCBl基因的改变可能与疼痛感知相关[17~19]。实验观察到ABCBl C3435T不同基因型的血清β-内啡肽水平具有性别差异性,可能影响疼痛的敏感性[20]。因此本研究以分析ABCB1 SNP与癌痛感知相关性为前提,进一步探究ABCB1 SNP及其单倍体对癌痛病人阿片药物需求量 (opioid requirements) 的影响,可规避不同基因型病人因疼痛差异导致的阿片药物用量差别,从而为癌痛病人镇痛个体化治疗提供新的思路。
方 法
1.一般资料
来自江苏省徐州医院大学附属医院及徐州市肿瘤医院资料完整的154例癌痛病人和105例无痛的晚期恶性肿瘤住院病人。通过医院伦理委员会批准,且所有入组病人或其家属均已签署知情同意书。两组病人录入与排除标准一致,均无新发病例,应答率为100%。排除标准包括:患有严重精神疾病者;患有严重心、脑血管疾病;有酒精成瘾或药物滥用史;肝、肾功能严重损害者;肠梗阻或其他胃肠道系统疾病病人;合并其他慢性疼痛病人;不能进行疼痛评估者;用药过程中自行退出者。
2.评估
应用数字评价量表(numerical rating scale, NRS)进行疼痛评估,根据评分分为癌痛组与无痛组。初始疼痛评分为上一个24小时的平均疼痛评分,评分在镇痛治疗开始前进行,评估结束后严格按照NCCN成人癌痛临床实践指南进行镇痛治疗。给予镇痛药物起效后应用NRS评分量表评估病人疼痛程度和舒适度,良好的镇痛效应应达到NRS评分≤4分,以满足病人对舒适度及功能需求的期望目标。若疼痛尚未得到有效控制,按照指南予以相应增加药物剂量,并再次进行NRS评分,以病人NRS评分≤4分时所需阿片药物剂量为对比剂量。
根据疼痛程度不同给予相应的镇痛药物,如吗啡、羟考酮、芬太尼透皮贴、曲马多及布桂嗪等。鉴于吗啡是所有阿片类药物中的金标准镇痛药,所以应用吗啡当量(即将每位病人所用阿片类药物统一按照其与吗啡的转换比率换算成吗啡等效剂量)进行比较病人间药物剂量。现有阿片药物需求量的计算方法主要有三种:24 h-阿片剂量 (24 h-opioids doses)、体重-24 h-阿片剂量 (weight-adjusted-24 h-opioids doses)、体重-体表面积-24 h-阿片剂量(weight-surface area-adjusted-24 h-opioids doses)。在本研究中以这三种方式分别计算研究对象的阿片药物需求量。
3.基因分型
抽取病人2 ml外周静脉血,采用树脂型TM基因组DNA提取试剂盒(上海赛百盛)提取DNA,用紫外光光度计检验DNA浓度与纯度,之后应用三维聚丙烯酰胺凝胶DNA芯片方法进行ABCB1C3435T (rs1045642)、G2677A/T (rs2032582)位点多态性分型:主要包括PCR扩增、PCR产物的固定、杂交及杂交后处理、扫描与分型四个步骤。C3435T、G2677A/T位点PCR扩增所需引物序列如下:正向为5'-Acr-CCAGGAGCCCATCCTGTTTGA-3'、5'-Acr-AGCAATTGTACCCATCATTGC-3',反向为5'-CATTAGGCAGTGACTCGATG-3'、5'-ATAGTAAGCAGTAGGGAGTAAC-3'。杂交时所用探针如下:rs1045642c 5'- Cy3-CCTCACgATCTCT-3'、rs1045642t 5'-Cy5-CCTCACaATCTCT-3'、rs2032582g 5'- Cy3-TCCCAGcACCTTC-3'、rs2032582t 5'-Cy5-TCCCAGcACCTTC-3'、rs2032582a 5'-Cy5/3-TCCCAGtACCTTC-3'。并随机选取不同基因型标本PCR扩增,送至凯基生物公司测序,以验证DNA芯片分型结果(见图1)。分别表示3435CC、3435TT、3435CT以及2677GG、2677GA/T、2677AA/TT基因型。
4.统计分析
计数资料及分析基因型分布是否符合Hardy-Weinberg平衡用X2检验。应用SHEsis软件包分析两位点间连锁不平衡关系,PHASE2软件构建单倍体型。计量资料采用均数±标准差(±SD)表示。正态分布资料应用两样本t检验或单因素方差分析;偏态分布资料则采用非参数检验。P< 0.05表示差异有统计学意义。
结 果
1.所有病人临床信息和多态性分布
此次研究共纳入253例病人(男138例,女115例),平均身高、体重、年龄为:163.8±7.5 cm(150 ~ 183 cm);62.6±10.5 kg (40 ~ 93 kg);60.2±11.7岁 (22~85岁)。两组病例间身高、体重、年龄、性别及肿瘤原发部位间均没有差异(见表1)。
全体病人3435/2677位点野生型、杂合型、突变型数目分别为76/64、137/127、40/62,3435T等位基因频率为42.9%,2677A、T等位基因频率为9.1%、40.5%(见表2)。癌痛组及无痛组中3435T频率分别为45.3%、39.5%,癌痛组2677A、T频率分别为8.8%、42.9%,无痛组2677A、T频率分别为9.5%、37.1%(见表3)。两组病例中C3435T、G2677A/T基因型分布均服从遗传平衡定律(hardyweinberg)。癌痛组和对照组间C3435T、G2677A/T基因型分布没有差异(X2值P=0.371和0.507)。
运用SHEsis软件包分析对照组病人基因型分布发现两位点间具有连锁不平衡关系(D'=0.720/r2=0.462),同时癌痛组及无痛组两组间单倍体型频率的分布无明显差异(见表4),应用PHSAE2.1软件构建出每一病人的可能单倍体型,展开进一步分析研究。

图1 C3435T、G2677A/T测序结果图Fig.1 Sequencing results of C3435T and G2677A/T
2.不同疼痛程度间的基因型分布
依据NRS评分不同将253例病人分为4组:0分:无痛,1~3分:轻度疼痛,4~6分:中度疼痛,7~10分:重度疼痛。不同程度疼痛组间C3435T、G2677A/T基因型分布没有统计学差异(见表5),同时,单独对癌痛组148例病人(分为轻度、中度、重度疼痛三组)进行分析,两位点基因型分布没有统计学差异(数据未显示)。研究的目的是探索疼痛评分是否与ABCB1 SNP具有相关关系,癌痛组不同基因型病人间NRS评分相比较没有差异(见表6),且疼痛评分分布较为均衡,未见明显趋势,因而未进行单倍体相关性分析。
3.癌痛组病人阿片药物用量
应用三种方式计算阿片药物用量,分析ABCB1 C3435T、G2677A/T基因型与阿片用量的关联性。阿片药物用量在年龄、性别、ΔNRS及肿瘤原发部位间没有统计学差异(见表7)。
癌痛组148例病人中,C3435T、G2677A/T位点野生型、杂合子、变异型数目分别为41/35、80/73、27/40。C3435T、G2677A/T不同基因型病人间24 h-阿片药物需求量未发现统计学差异(见表8)。相比于CC/CT基因型,3435TT变异型的病人往往需要更低剂量的阿片药物;单独比较C、T两等位基因,T等位基因携带者所需24 h-阿片剂量低于C等位基因携带者;2677野生型病人所需体重-体表面积校正-24 h-阿片剂量高于杂合子及变异型病人,但均未达到统计学差异(见表9)。鉴于两位点间具有连锁不平衡关系,比较癌痛组CGCG、CG-TT、TT-TT单倍体型病人阿片需求量,发现三种单倍体型病人体重校正-24 h-阿片剂量、体重-体表面积校正-24 h-阿片剂量间具有统计学差异(P=0.043和0.015,见表10)。TT单倍体型携带者体重校正-24 h-阿片剂量、体重-体表面积校正-24 h-阿片需求量远低于CG单倍体型,具有统计学意义(P< 0.05,见表10)。
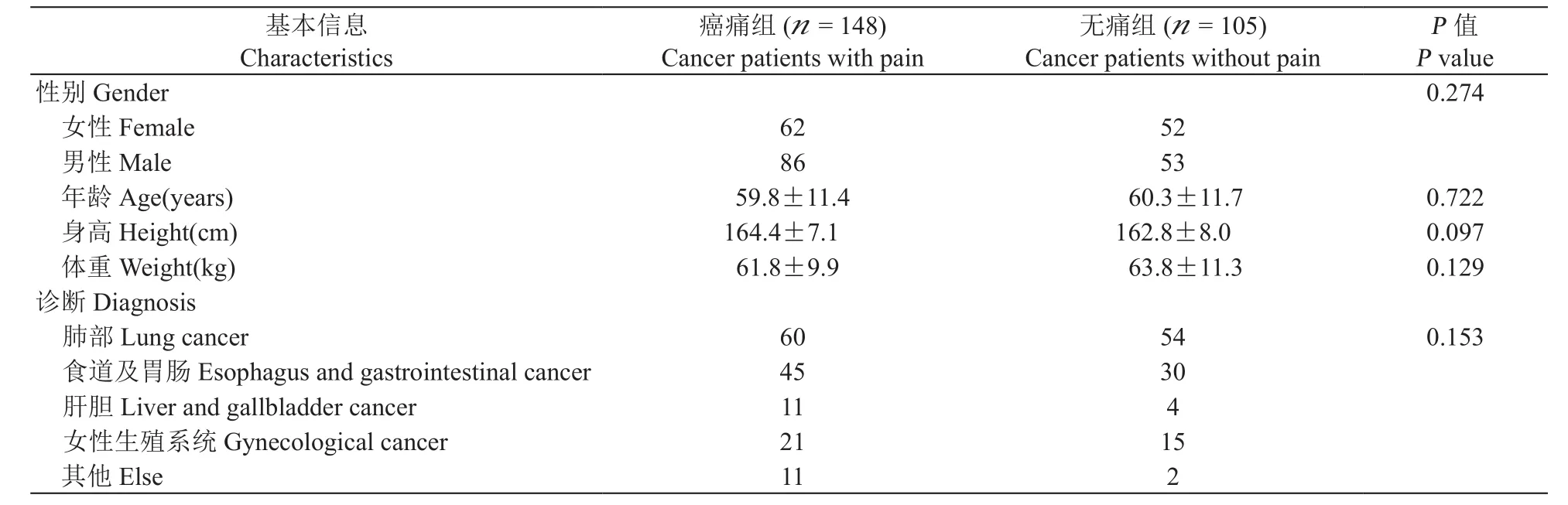
表1 病人人口学资料Table 1 Demographics of patients

表2 病人C3435T基因多态性分布频率Table 2 Distribution of frequencies of C3435T gene polymorphisms of cancer patients

表3 病人G2677A/T基因多态性分布频率Table 3 Distribution of frequencies of G2677A/T gene polymorphisms of cancer patients
讨 论
随着基因研究的深入,更多关于疼痛的研究开始从基因层面切入,越来越多与疼痛相关的基因被发现[20],其中以离子通道SCN9A[22]、转运蛋白P-gp、阿片受体基因OPRM1[23]、药物代谢酶基因儿茶酚O-甲基转移酶COMT[24]、炎症细胞因子IL-1[25]等遗传基因研究较多,与疼痛关系较密切。疼痛是一种复杂的病理生理现象,且起因多样,癌性疼痛与其他疾病所致疼痛的起因多有不同[26]。基因多态性在癌性疼痛中起着重要且复杂的角色。P-糖蛋白由ABCB1基因所编码,其组织分布广泛,作用底物种类繁多,其功能是将进入细胞内的底物,包括药物及化学物质等泵出细胞外,进而可影响药物疗效,如Hamabe等研究发现,P-gp缺如小鼠较野生型小鼠可获得更佳的吗啡和芬太尼镇痛效果[13]。现已发现50余个ABCB1 SNPs位点,其中以C3435T、G2677A/T两位点最受关注,其中G2677A/T位于ABCB1基因21号外显子区域,其多态性可导致Ala893Ser/Thr的氨基酸互换。C3435T位点位于26号外显子区域,其多态性是同义突变,不会引起编码氨基酸序列的改变,有报道认为该同义突变通过改变密码子的选择和使用,影响核糖体停转及蛋白质折叠过程[14],导致P-gp局部构象变化,最终影响P-糖蛋白功能。

表4 癌痛组及无痛组的单倍体频率Table 4 Haplotype frequency of patients with cancer pain or not
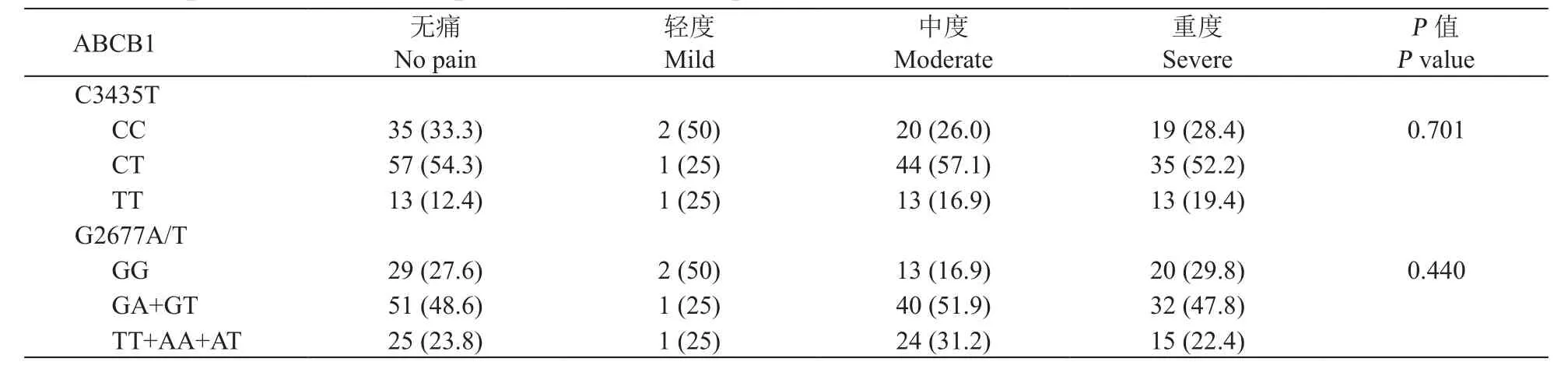
表5 不同程度疼痛病人的ABCB1基因型分布(n%)Table 5 Frequencies of ABCB1 in patients with different pain intensities [n (%)]

表6 癌痛组不同基因型间NRS评分Table 6 Pain score of carriers with different genotypes in cancer pain patients

表7 癌痛组病人阿片药物用量与性别、年龄、ΔNRS之间的相关性Table 7 Association of opioid doses with gender, age, and ΔNRS in cancer pain patients
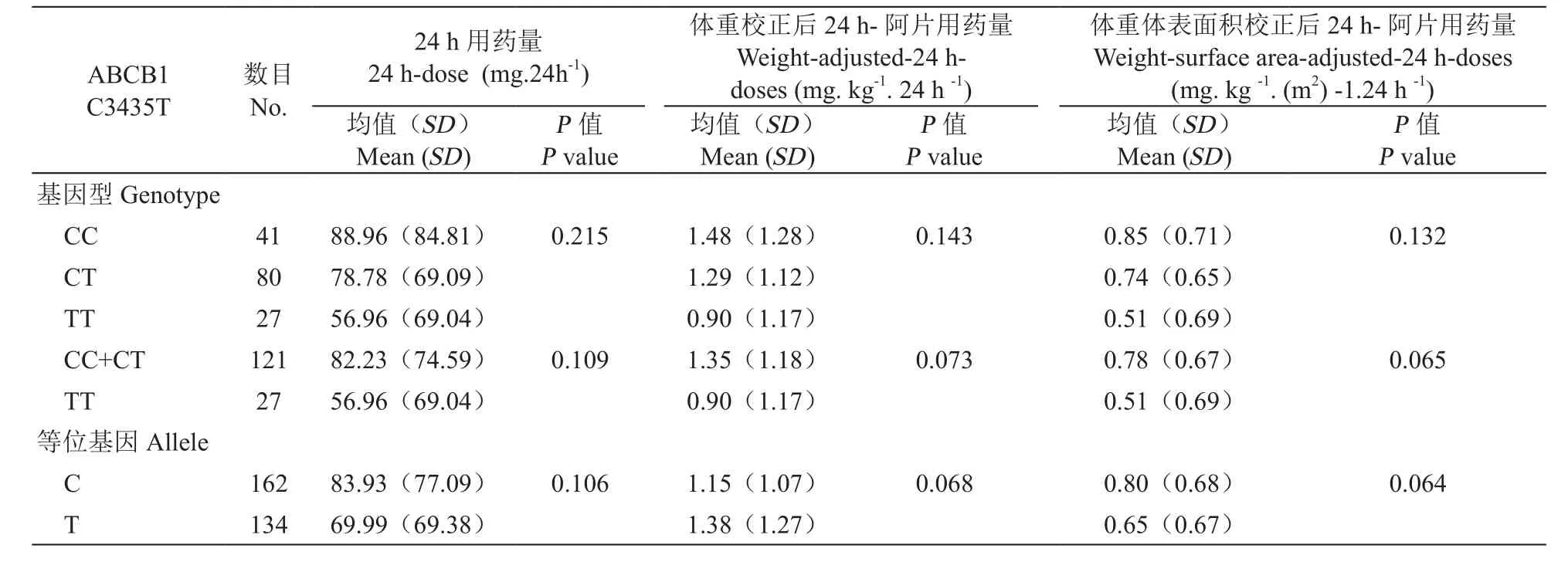
表8 癌痛组病人阿片药物用量与性别、年龄、ΔNRS之间的相关性Table 8 Association of opioid doses with gender, age, and ΔNRS in cancer pain patients
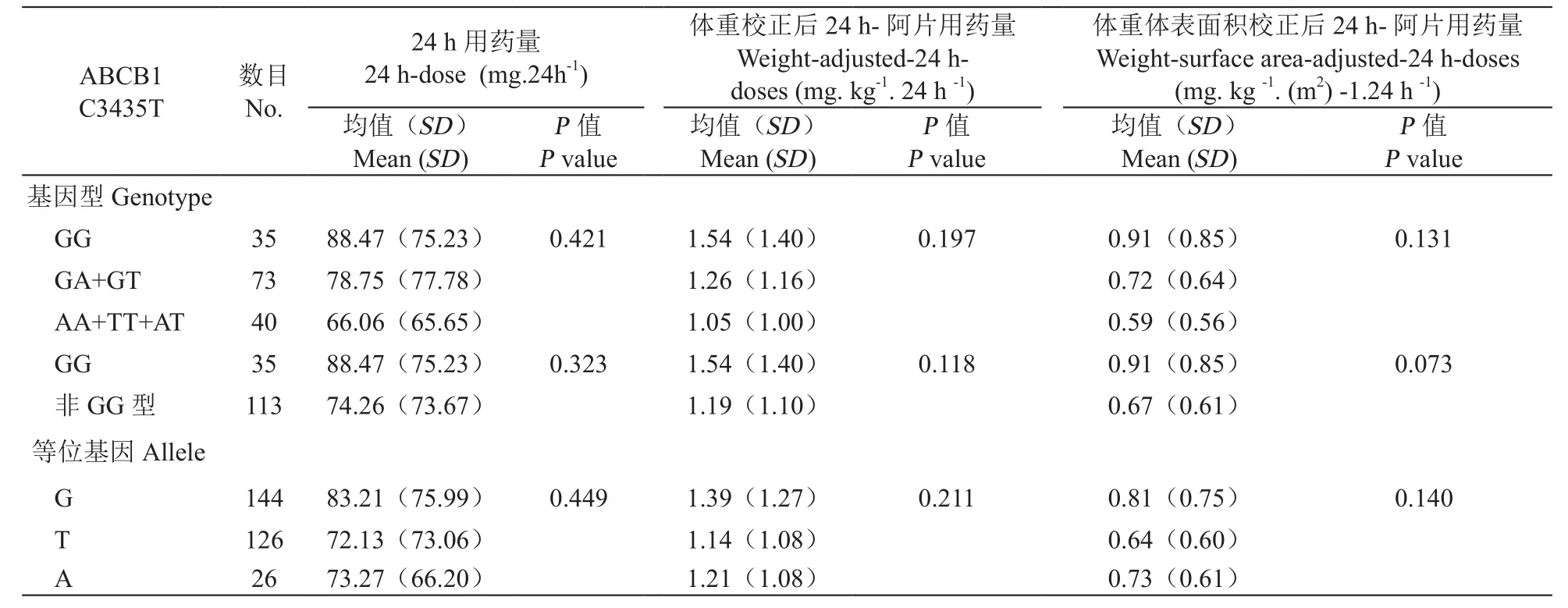
表9 癌痛组病人G2677A/T基因分型与药物需求量的相关性Table 9 Association of G2677A/T polymorphism with opioid doses in cancer pain patients

表10 癌痛组病人单倍体型与药物需求量的相关性。Table 10 Association of haplotypes with opioid doses in cancer pain patients
我们此项研究中从癌痛的有无、疼痛程度及疼痛NRS评分三个角度进行比较,并没有发现ABCB1 C34345T、G2677A/T与癌痛感知具有相关性。Sia等对剖宫产手术的女性进行ABCBl SNP位点检测,研究发现3435T等位基因的女性容易患有时间超过3个月的腹部手术后疤痕疼痛,TT基因型持续性疼痛时间长于CT和CC基因型[17]。对骨科或腹部手术后的儿童C3435T基因型分析,CC基因型的儿童术后疼痛评分大于6分的比例高于CT/TT基因型,但未进行统计学分析[18]。目前来看,ABCB1基因多态性与疼痛的关系并未明确,尚不能认为C3435T、G2677A/T与癌痛感知具有相关性。
有研究认为ABCB1 C3435T可影响P-gp转录和翻译进程,对P-gp功能状态产生作用,可造成药物疗效和使用剂量方面的差异[5~8]。Campa等比较不同C3435T基因分型的癌痛病人,发现TT变异型病人疼痛缓解程度优于CC野生型病人,NRS评分降低程度更佳,而CT基因组与CC基因组间无差异[7]。Keith等研究认为控制术后疼痛,TT基因型个体在术后24 h所需的阿片药物剂量少于CC基因型个体,并且术后疼痛评分较CC基因型偏低[6]。Coller等研究得出ABCB1 SNP单倍体基因型可影响美沙酮维持治疗时的药物剂量,携带由G2677T/A及C3435T位点所构成突变单倍体TT的病人所需要的美沙酮戒断剂量少于完全野生基因型[27]。Nojkov发现3435CC基因型大肠癌手术病人术后24h所需阿片镇痛药剂量高于CT及TT基因型,术后若干时间段疼痛评分TT基因型最低,呕吐及镇静评分等药物不良反应方面三组间没有统计学差异[28]。Lee等对儿童术后急性期吗啡镇痛疗效及术后疼痛评分进行分析得出类似结论[29]。而Kye-Min等研究发现术后24h/48h所需镇痛药芬太尼的剂量与手术种类、术后疼痛评分及病人体重相关,然而基因因素未对其剂量需求产生影响[30]。本文分析比较不同基因型体重-体表面积-24 h-阿片剂量,3435TT变异型病人所需剂量低于CC/CT基因型,2677GG野生型病人所需剂量明显高于杂合子及变异型病人,但尚未达到统计学差异。统计分析发现两位点间具有连锁不平衡关系,构成的单倍体型与所需剂量间相关关系似乎更值得深究,本研究中分析了高频率单倍体型与剂量间关系,研究发现CG-CG、CG-TT、TTTT三种单倍体型病人所需体重-24 h-阿片剂量、体重-体表面积-24 h-阿片剂量间具有统计学差异(t值P= 0.043和0.015),且呈现递减趋势。TT单倍体型携带者所需体重-24 h-阿片剂量、体重-体表面积校-24 h-阿片剂量远低于CG单倍体型,具有明显统计学差异(t值P= 0.021和0.012)。分析其机制可能与ABCB1基因多态性改变使P-gp空间构象发生变化有关,从而降低了P-gp与药物底物的亲和力,外转运作用降低,胞内药物浓度较野生型升高,药物生物利用度与药效增加,所需剂量减少。基因层面作用广泛、机制复杂,不排除其他可能机制存在,且ABCB1 SNP位点多样,与其他SNP位点结合分析可能更有意义。
ABCB1 C3435T、G2677A/T对癌症病人疼痛感知的影响尚未得到证实,不同基因型病人对药物疗效与剂量需求方面的差异可能来自基因变异对药物作用的改变,而非因不同基因型病人间的疼痛差异所致,本实验设计规避了此处研究漏洞,并且对阿片药物需求量的计算涉及病人身高、体重等影响因素,对制定个体化医疗方案更具有意义。关于ABCB1 SNP对药物疗效方面的探索尚有很大的空间,有益于癌症病人个体化治疗方案的制订,以及临床阿片药物的合理使用。
[1]Smith K, Hopp M, Muundin G,et al. Low ansolute bioavailability of oral naloxone in healthy subjects. J Clin Oncol, 2012 , 19: 2542 ~ 2554.
[2]Manworren RC. Multimodal pain management and the future of a personalized medicine approach to pain. Aorn J, 2015, 101(3): 308 ~ 314.
[3]Stamer U, Bayerer B, Stüber F. Genetics, pain and analgesia. Anaesthesist, 2006, 55(7): 746 ~ 752.
[4]基因导向阿片类药物个体化用药新模式.中国疼痛医学杂志 , 2007, 13(1): 49 ~ 51.
[5]Lloret linares C, Hajj A, Poitou C,et al. Pilot study examining the frequency of several gene polymorphsims in morphine pharmacodynamics and pharmacokinetics in a morbidly obese population. Obes Surg, 2011, 21: 1257 ~1264.
[6]Keith Candiotti, MD, Zhe Yang,et al. Single-Nucleotide Polymorphism C3435T in the ABCB1 Gene is Associated with Opioid Consumption in Postoperative Pain. Pain Med, 2013, 14: 1977 ~ 1984.
[7]Campa D, Gioia A, Tomei A,et al. Association of ABCB1/MDR1 and OPRM1 Gene Polymorphisms With Morphine Pain Relief. Clin Pharmacol Ther, 2008, 83:559 ~ 566.
[8]Gong XD, Wang JY, Liu F,et al. Gene polymorphisms of OPRM1 A118G and ABCB1 C3435T may influence opioid requirements in Chinese patients with cancer pain.Asian Pac J Cancer Prev, 2013, 14(5): 2937 ~ 2943.
[9]Susan L, Mercer, Andrew Coop. Opioid Analgesics and P-glycoprotein Ef fl ux Transporters: A Potential Systems-Level Contribution to Analgesic Tolerance. urr Top Med Chem, 2011, 11(9): 1157 ~ 1164.
[10]Fernandez Robles CR, Degnan M, Candiotti KA. Pain and genetics. Curr Opin Anaesthesthiol, 2012, 25: 444 ~449.
[11]Fujita K, Ando Y, Yamamoto W,et al. Association of UGT2B7 and ABCB1 genotypes with morphine-induced adverse drug reaction in Japanese patients with cancer.Cancer Chemother Pharmacol, 2010: 65, 251 ~ 258.
[12]Trescot AM, Faynboym S. A review of the role of genetic testing in pain medicine. Pain Physician, 2014, 17(5):425 ~ 445.
[13]Hamabe W, Maeda T, Fukazawa Y,et al. P-glycoprotein ATPase activating effect of opioid analgesics and their P-glycoprotein-dependent antinociception in mice.Pharmacol Biochem Behav, 2006, 85, 629 ~ 636.
[14]Hoffmeyer S, Burk O, von Richter O,et al. Functional polymorphisms of the human multidrug-resistance gene:multiple sequence variations and correlation of one allele with P-glycoprotein expression and activity in vivo. Proc Natl Acad Sci U S A, 2000, 97: 3473 ~ 3478.
[15]Baldissera VD, de Mattos AA, Coral GP,et al. Evaluation of the C3435T polymorphism in the MDR1 gene in patients with hepatocellular carcinoma. Ann Hepatol,2012, 11: 421 ~ 427.
[16]Fung KL, Gottesman MM. A synonymous polymorphism in a common MDRl (ABCBl) haplotype shapes protein function. Biochimica et biophysica acta, 2009, 1794:860 ~871.
[17]Sia AT, Sng BL, Lim EC,et al. The influence of ATP-binding cassette sub-family B member-l (ABCB1) genetic polymorphisms on acute and chronic pain after intrathecal morphine for caesarean section: a prospective cohort study. International journal of obstetric anesthesia, 2010,19: 254 ~ 260.
[18]Mamie C, Rebsamen MC, Morris MA,et al. First evidence of a polygenic susceptibility to pain in a pediatric cohort. Anesthesia and analgesia, 2013, 116: 170 ~ 177.
[19]Ren ZY, Xu XQ, Bao YP,et al. The impact of genetic variation on sensitivity to opioid analgesics in patients with postoperative pain: a systematic review and metaanalysis. Pain Physician, 2015, 18(2): 131 ~ 152.
[20]Rhodin A, Gronbladh A, Ginya H,et al. Combined analysis of circulating beta-endorphin with gene polymorphisms in OPRM1, CACNAD2 and ABCB1 reveals correlation with pain, opioid sensitivity and opioid-related side effects. Molecular brain, 2013, 6: 8.
[21]Fernandez Robles CR, Degnan M, Candiotti KA. Pain and genetics.Curr Opin Anaesthesiol, 2012, 4: 444 ~449.
[22]Stephen G Waxman, Ingemar S J Merkies, Monique M Gerrits,et al. Sodium channel genes in painrelated disorders: phenotype-genotype associations and recommendations for clinical use. Lancet Neurol, 2014, 13: 1152 ~1160.
[23]Wei SY, Chen LF, Lin MW,et al. The OPRM1 A118G polymorphism modulates the descending pain modulatory system for individual pain experience in young women with primary dysmenorrhea. Sci Rep, 2017, 7: 39906.
[24]Khaill H, Sereika SM, Dai F,et al. OPRM1 and COMT gene-gene interaction is associated with postoperative pain and opioid consumption after orthopedic trauma.Biol Res Nurs, 2016.
[25]Solovieva S, Leino-Arjas P, Saarela J,et al. Possible association of interleukin 1 gene locus polymorphisms with low back pain. Pain, 2004, 109: 8 ~ 19.
[26]Warm R, Abernethy AP, Anghelescu DL,et al. Adult cancer pain. J Natl Compr Canc Netw, 2010, 8(9): 1046 ~ 1086.
[27]Coller JK, Barratt DT, Dahlen K,et al. ABCB1 genetic variability and methadone dosage requirements in opioid dependent individuals. Clin Pharmacol Ther, 2006, 80:682 ~ 690.
[28]Dzambazovska-Trajkovska V, Nojkov J, Kartalov A,et al.Association of Single-Nucleotide Polymorhism C3435T in the ABCB1 Gene with Opioid Sensitivity in Treatment of Postoperative Pain. Pril, 2016, 37: 73 ~ 80.
[29]Mi Geum Lee, Hyun Jung Kim, Keun Hwa Lee. The Influence of Genotype Polymorphism on Morphine Analgesic Effect for Postoperative Pain in Children.Korean J Pain, 2016, 29: 34 ~ 39.
[30]Kye-Min Kim, Ho-Sook Kim, Se Hun Lim,et al. Effect of genetic polymorphisms of OPRM1, ABCB1, CYP3A4/5 on postoperative fentanyl consumption in Korean gynecological patients. Int J Clin Pharm Th, 2013, 51:383 ~ 392.
ASSOCIATION OF SINGLE NUCLEOTIDE POLYMORPHISMS OF ABCB1 WITH PAIN PERCEPTION AND OPIOID REQUIREMENTS IN PATIENTS WITH CANCER PAIN*
ZHU Min1,2, PAN Zhi-Qiang1,2, ZHANG Lu1,2, ZHANG Hui1,2, CHEN Li-Ping3, XU Heng3, SHEN Wen1,2,3Δ
(1Jiangsu Province Key Laboratory of Anesthesiology, Xuzhou Medical University, Xuzhou 221000, China;2Jiangsu Province Key Laboratory of Anesthesia and Analgesia Application Technology, Xuzhou Medical University, Xuzhou 221000, China;3Department of Anesthesiology and Pain Medicine, The Affiliated Hospital of Xuzhou Medical University, Xuzhou 221000, China)
Objective:To investigate the association of the genotypes of ABCB1 C3435T and G2677A/T with pain perception and opioid requirements in cancer patients.Methods:A total of 148 cancer patients with pain and 105 cancer patients without pain were included to determine their genotypes for the ABCB1 C3435T and G2677A/T on a three-dimensional polyacrylamide gel-based DNA microarray. Chi-square test was used to compare the genotype distribution between groups with different pain intensities. T-test, nonparametric tests and chi-square test were used to compare pain scores with 24 hour opioid requirements between groups with different genotypes.Results:In the 253 subjects, the frequency of variant 3435T and 2677A/T allele was 42.9%, 9.1%, and 40.5%, respectively. No signi fi cant difference in the genotype distribution of ABCB1 C3435T and G2677A/T was observed between cancer pain group and control group (P= 0.371 and 0.507).The genotypes of ABCB1 C3435T and G2677A/T were not associated with the intensities of pain and NRS score in cancer patients. No significant differences were observed between ABCB1 C3435T and G2677A/T genotypes with opioids consumptions, even though all three calculation methods of drug doses were used(P> 0.05). Compared with the CG-CG and CG-TT haplotype, patients with TT-TT haplotype
lower weight-adjusted-24h-opioids and weight-surface area-adjusted-24h-opioids (P= 0.043 and 0.015).Conclusions:Evidence does not support that the SNPs of ABCB1 C3435T and G2677A/T in fl uence the pain perception in Chinese cancer patients. The ABCB1 C3435T and G2677A/T may affect the opioid requirements in cancer pain patients, which may be a key contributor for the inter-individual variability in opioid consumption.
Single nucleotide polymorphism (SNP); Cancer pain; Opioid requirements; ABCB1; Pain perception; Pain treatment
10.3969/j.issn.1006-9852.2017.06.006
省重点研发计划社会发展一面上项目(BE2015626)
△通讯作者 shenwen1598@sina.com
