骨髓间充质干细胞和干细胞因子在老年炎症性肠病的实验研究
2017-11-21辛国荣吉志武于海涛朱晓文陈福军
辛国荣 倪 健 刘 洋 吉志武 赵 斌 于海涛 朱晓文 杨 泽 陈福军※
作者单位:1.佳木斯大学附属第一医院 肛肠科 154002 2.北京医院 北京老年医学研究所 100730
骨髓间充质干细胞和干细胞因子在老年炎症性肠病的实验研究
辛国荣#1倪 健#1刘 洋1吉志武1赵 斌1于海涛1朱晓文1杨 泽2陈福军1※
作者单位:1.佳木斯大学附属第一医院 肛肠科 154002 2.北京医院 北京老年医学研究所 100730
目的探索骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMMSCs)和干细胞因子(Stem Cell Factor,SCF)促进肠黏膜细胞分化增殖和再生的机制,提供治疗老年炎症性肠病的认识。方法①建立动物模型:由吲哚美辛诱导的胃肠黏膜损害,供体雄性SD老年大鼠皮下注射吲哚美辛处理(7.5mg/kg在5%碳酸氢钠)24小时连续3天,取4只吲哚美辛处理的SD老年大鼠使用戊巴比妥麻醉条件下处死(50mg/kg,腹腔注射)细胞组织学评估和确认老年炎症性肠病模型成功建立。②成功建立的老年炎症性肠病模型动物被分成4组,每组16只:BMMSCs-SCF治疗组,BMMSCs治疗组,SCF治疗组和生理盐水对照组。③使用PKH26荧光染色标记骨髓间充质基质细胞,输入炎症性肠病受试SD老年大鼠实验模型中,通过形态学观察测定肠黏膜的修复及再生,采用Western blot和PCR技术对动物模型体内骨髓间充质基质细胞中PKH26的表达情况。结果在受体老鼠胃肠黏膜中发现PKH26荧光染色标记的骨髓间充质基质细胞,如增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),干细胞标记物(Lgr5,Musashi-1,ephrin-B3)等。在BMMSCs治疗组的SD老年大鼠肠黏膜中mRNA,PCNA的蛋白水平,Lgr5,Musashi-1和ephrin-B3增高,在BMMSCs-SCF混合治疗组中显著提高。在BMMSCs治疗组肠黏膜层和隐窝层浓度较高,更明显的在BMMSCs-SCF 混合治疗组。结论在吲哚美辛诱导的肠道损伤实验中BMMSCs和SCF可能参与黏膜细胞再生并发挥协同作用。BMMSCs和SCF可能具有治疗价值。
髓间充质基质细胞 干细胞因子 炎症性肠病
炎症性肠病(Inflammatory Bowel Disease,IBD)是常见的胃肠病在小儿和成人之中[1]。该疾病是一种慢性、复发性或恢复缓解的肠道疾病,常有如腹泻、直肠出血、腹部绞痛,可导致营养不良、乏力、电解质紊乱和延迟增长,特别是在儿童[2]。在小肠和大肠可能会发生组织病变、炎症、细胞退化、溃疡和造瘘术。值得注意的是,过度的细胞再生似乎也是一个长期的致病过程的一部分,表现为激活/增殖隐窝细胞和血管新生[3]。炎症性肠病的病因和发病机理基础仍然很大程度上是很难解释的。自身免疫在遗传倾向、细菌感染和环境侵袭的病原相互作用中可能扮演重要角色[4,5],在炎症性肠病中血清学和其他非胃肠道自身免疫特征性侵害常见,特别在是溃疡性结肠炎和克罗恩病[6]。
胃肠道黏膜平均每2~7天可生理性再生,在病理条件下可能增强[7]。干细胞前体细胞主要位于隐窝,是正常的细胞代谢或病理性再生的主要场所。这些部位的干细胞增殖和分化为上皮和黏膜腺状的细胞[8]。值得注意的是,最近的研究表明,BMMSCs可能参与胃肠黏膜再生特别是在病理条件下,包括在炎症性肠病[9]。然而,在受损小肠中BMMSCs的分化和早期形成较少被证明。了解血液干细胞和可溶性因子在胃肠道组织学和功能修复的作用,在炎症性肠病的临床研究进行新的阐述。本研究中,在老年雄性SD大鼠我们使用亲脂性的红色荧光染料PKH26单独标记BMMSCs,这些被标记的BMMSCs被移植到由吲哚美辛诱导的胃肠道黏膜损伤的炎症性肠病受试SD大鼠实验模型中。从形态学和生物化学方面研究了移植骨髓间充质基质细胞在受损的胃肠道黏膜中参与细胞修复及再生。研究BMMSCs和SCF治疗潜在的协同作用有益于我们临床治疗的研发及应用。
1.材料和方法
1.1 动物模型的建立及分组 ①健康雄性SD大鼠10月龄(n=72)在哈尔滨医科大学第二附属医院动物实验中心购买。动物被安置在恒定的温度和湿度环境,与12/12小时日光照明/黑暗循环周期,食物和水自由索取。所有实验过程都经由哈尔滨医科大学实验动物管理审批。根据先前的报道在成年SD大鼠建立了吲哚美辛诱导的炎症性肠病的实验模型[10]。取4只SD大鼠皮下注射吲哚美辛处理(7.5mg/kg在5%碳酸氢钠)24小时连续3天,使用戊巴比妥麻醉条件下处死(50mg/kg,i.p.),细胞组织学评估和确认炎症性肠病模型。②动物模型分组:成功建立的炎症性肠病模型动物被分成四组,BMMSCs-SCF组(n=16),BMMSCs组(n=16),SCF组(n=16)和生理盐水对照组(n=16)。在第1周、2周、3周和4周后检验治疗效果。
1.2 骨髓间充质干细胞的处理 BMMSCs分离、培养和荧光标记参照文献[11]。2月龄SD大鼠(n=4)在戊巴比妥钠麻醉下移除股骨(50mg/kg,i.p.)。股骨腔使用肝素生理盐水(50U/ml)浸泡,骨髓抽出和悬浮在淋巴细胞分离培养基,然后离心机2000转离心20分钟。细胞随后被DMEM/F12培养液稀释(DMEM/F12,15%FBS,100000U/L青霉素,pH=7.4)浓度超过5×107cells/ml。使用离心机1000转10分钟离心后收集细胞。BMMSCs在体外培养10~15天。培养细胞使用红色荧光的亲脂性的染料PKH26标记根据制造商说明书[12]。将PKH26标记的细胞悬液浓度调整到3×107cells/ml左右。随后,使用台盼蓝染色测量细胞存活率大于95%后收集细胞用于移植研究。
1.3 试验动物治疗后的观察和检测
1.3.1 病理观察用的组织制备:动物通过升主动脉灌注PBS过量(戊巴比妥钠100mg/kg,i.p.)。将整个小肠、阑尾和结肠从腹腔移除目测组织样本。小肠分四段,每段大约2mm,近端邻近阑尾,每段间隔大约20cm。使用冷的PBS缓冲液清洗肠段,然后在4%多聚甲醛浸泡24小时。前段肠样本嵌入石蜡切片约6mm厚度,用于组织学和免疫组织化学。以每个动物为例,至少有一组条平行的部分(约60um)石蜡切片(10段固定在载玻片)被用于组织学和免疫组织化学染色。第一和第二采样剩下部分在液态氮冷藏用于免疫印迹分析和聚合酶链反应(PCR)分析。
1.3.2 流式细胞分析:培养细胞样本用于流式细胞(FACS)分析,以确定各种骨髓间充质干细胞标志性抗原的表达。大约1×106个细胞培养在2%胎牛血清在0.01M磷酸盐缓冲溶液(PBS,pH=7.2)在4℃30分钟,加入1μl特异性单克隆抗体CD29,CD34,CD44,CD45,CD90。阴性对照处理培育细胞没有抗体。免疫荧光分析使用CellQuest软件。
1.3.3 组织学和免疫组织化学:使用H&E和免疫荧光法染色肠片段。切片进行上蜡,乙醇孵育染色后再水化。免疫荧光检查使用PKH26双荧光标记的细胞是否在肠黏膜,切片脱蜡在含有5%正常驴血清的PBS中预培养30分钟。然后使用鼠增殖细胞抗原(PCNA)孵育,兔anti-Lgr5,兔anti-Msiv1和eprhin-B3抗体,分别在4℃过夜。特异性免疫反应性信号通过DyLight488山羊鼠抗或兔IgG(H+L)在室温下1小时。部分然后用DAPI复染色,使用激光共焦扫描显微镜观察前洗涤和防褪色媒介。
1.3.4 Western blot:冷冻肠样本使用包含蛋白酶抑制剂混合物的提取缓冲液均匀(1×4w/v),和由此产生的溶解产物离心10000×g在4℃10分钟。收集上清液,蛋白质浓度参照DC蛋白定量试剂盒。提取含有50μg的蛋白质加载在每个5% SDS-PAGE凝胶泳道上。多肽是由电泳分离,进一步转移到硝酸纤维素。硝化纤维膜进一步孵育前面提及的抗体β-actin(1:4000),PCNA(1:200),Lgr5(1:200),Msi-1(1:250)和ephrin-β3(1:200)。结合蛋白是通过HRP-conjugated山羊鼠抗或兔IgG可视(1:20000,Bio-Rad Laboratories)和Western-Bright ECL。免疫印迹图像捕获使用Omega-Lum G成像系统。
1.3.5 Real-time PCR:RNA提取使用试剂盒提取工具根据制造商说明书,纯化RNA样本存储-70℃直至使用。cDNAs逆行转录使用Accupower RocketScript和RT预混料试剂盒。特定DNA片段扩增使用RealMasterMix(探针)和miRcute miRNA与聚合酶环。以下正向(F)和反向(R)引物使用qRT-PCR扩增。

GeneSequence5’→3’TemperatureprofileaLGR5⁃FTGCCATTATTCACCCCAACDenaturation95℃-15sAnnealing62℃-30sExtension72℃-30sLGR5⁃RCACAGCACTGGTAAGCGTATGDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sephrin⁃B3⁃FGCTGCTGTTAGGTTTTGCGDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sephrin⁃B3⁃RCCCCGATCTGAGGGTAAAGDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sMsi⁃1⁃FAGGGGTTTCGGCTTCGTDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sMsi⁃1⁃RTGACCATCTTAGGCTGTGCTCDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sPCNA⁃FGGTGAAGTTTTCTGCGAGTGDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30sPCNA⁃FGGTGAAGTTTTCTGCGAGTGDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30s鼠β⁃actin⁃FGTCAGGTCATCACTATCGGCAATDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30s鼠β⁃actin⁃RAGAGGTCTTTACGGATGTCAACGTDenaturation95℃-15sAnnealing60℃-30sExtension72℃-30s

图1 组织学检测吲哚美辛诱导动物模型肠道损伤

2.结果
2.1 评价吲哚美辛诱导老鼠的肠道损伤 我们建立了一个吲哚美辛诱导炎症性肠病大鼠模型研究[10]。证实吲哚美辛可引起胃肠道损伤的发生,大鼠(n=4)在使用吲哚美辛后4天被处死(图1)。通过目视检查,伊文思蓝染色显示吲哚美辛诱导的老鼠小肠和大肠出现深蓝色(图1A),而健康组老鼠的小肠显示粉红色(图1B)。吲哚美辛诱导的老鼠小肠的总长度(127±9.5cm)与正常老鼠(171.4±4.4cm)相比缩短(t测试、P<0.05)。吲哚美辛诱导组小肠直径有明显的扩增(图1A、图1B)。苏木精和伊红染色显示组织学破坏、黏膜萎缩和绒毛稀疏,溃疡性损伤穿透肌层。在吲哚美辛诱导组中也出现了水肿、上皮细胞剥落和浸润的白细胞(图1D、图1E)。
2.2 肠黏膜受损的老鼠中BMMSCs移植的归巢和分化 体外培养、描述和荧光标记BMMSCs参照文献[11]描述。在本研究中使用FACS分析研究并证实供体标记的骨髓间充质干细胞特异性抗原的表达。因此,98.83%的分离细胞表达CD29,98.22%表达CD34;骨髓祖细胞抗原存在于内皮细胞和成纤维细胞;34.88%的表达CD44,干细胞标记;和85.30%表达CD45,造血和白细胞标记[13];38.79%表达CD90。总的来说,骨髓间充质干细胞获取将从大鼠股骨中获取[14]。
使用PKH26荧光标记的BMMSCs在体外进行扩增10~15天(图2)。在体内应用前使用显微镜下确认每批处理的细胞被成功标记(图2B)。移植后3周红色荧光细胞可能发现在小肠和大肠壁原处。在对照动物组正常肠组织,只有少数荧光细胞(数据未显示)。相比之下,在吲哚美辛诱导老鼠组中大量的红色荧光细胞存在于受伤的肠道中,主要在绒毛区域(图2C,图2D)。

图2 免疫组化检测动物模型体内BMMSCs移植的归巢
我们评估了一个潜在可能性,移植后2~3周通过PKH26双标记内源性增殖标记物PCNA,证实BMMSCs移植并增殖在胃肠道黏膜的原位。PKH26跟踪标记发现PCNA细胞在同区域的两个生存点(图3A-D)。在四只(生存两周)动物的每个动物小肠部分使用10倍标记进行细胞计数。PKH26标记细胞发现PCNA测量平均率(50.1±12.2)%(137/235,204/327,131/354和114/267,分别在4只不同的动物)。
探索移植骨髓细胞可能分化转移到肠道黏膜细胞,我们检查了同区域被PKH26-标记的胃肠道不成熟的隐窝细胞,包括Msi-1,Lgr5和ephring B3[15~17]。吲哚美辛诱导组老鼠在生存2~3周后输注PKH26标记的骨髓细胞,PKH26-l标记细胞亚种群发现共同表达Msi-1(图3E-H),Lgr5(图3I-L)和ephrin-B3(图3M-P)。吲哚美辛诱导组老鼠,在细胞移植后生存三周对双标记小肠切片进行细胞计数。PKH26标记细胞发现Msi-1测量平均率(53.3±14.5)%(101/231,119/304,221/314和166/277,分别在4只不同的动物,下面格式相同);Lgr5测量平均率(45.2±7.5)%(125/244,102/253,125/244和87/233);和ephring-B3平均率为(58.3±9.2)%(153/237,112/217,153/237和165/244)。
2.3 BMMSCs和SCF治疗在肠道mRNA表达的影响 实验使用实时定量PCR分别检测肠道组织1周、2周、3周和4周后mRNA增殖水平和黏膜分子标记(图4)。使用双因素方差分析检测不同的两组间ephrin-B3 mRNA水平表达(P=0.002,F=7.53,DF=9,3,3,32,以下相同统计检测),表现出治疗(P<0.0001,F=63.4,DF=3,32)和时间(P<0.0001,F=22.3,DF=3,32)依赖的整体差异。因果分析表明,生理盐水组与其他每一组之间存在差异在所有时间点,除了生理盐水组与SCF组在一周。SCF组与BMMSCs组比较发现在3周有显著统计学差异,然而SCF组与BMMSCs-SCF组在不同时间点表达不同。BMMSCs组与BMMSCs-SCF组在1周、3周和4周表达不同(图4A、图4B)。Lgr5mRNA表达水平显示治疗(P<0.0001;F=73.4;DF=3,32)和时间(P<0.0001,F=18.6;DF=3,32)依赖性差异,显著差异存在于生理盐水组相对于其他组在各个时间点上,SCF组相对于BMMSCs以及BMMSCs-SCF组在各个时间点上。BMMSCs相对于BMMSCs-SCF组,差异存在于第一周(图4C)。Msi-1 mRNA表达水平显示整体治疗(F=56.8,P<0.0001)和时间(F=26.6,P<0.0001)依赖性差异(P<0.0001,F=13.6,DF=9,3,3,32)。Posthot测试显示统计学差异,生理盐水组和BMMSCs组、生理盐水和BMMSCs-SCF组,BMMSCs和SCF组,SCF组和BMMSCs-SCF之间,在所有时间点(P<0.0001到P<0.001成对平均值比较)。BMMSCs组与BMMSCs-SCF组相比,在2周和4周存在显著差异(图4D)。
小肠组织溶菌产物中增殖细胞核抗原mRNA表达的水平也受到BMMSCs和SCF治疗的影响。各组之间有一个整体的差别(P<0.0001,F=7.27,DF=9,3,3,32),与有效治疗(P<0.0001,F=57.0;DF=3,32)和时间(P<0.0001;F=32.5;DF=3,32)变化相关。Posthot测试表明生理盐水组相对于其他组的每个时间点之间的显著差异(P<0.05到P<0.0001)。SCF组和BMMSCs组除了3周其他时间点均存在差异(P<0.0001)。BMMSCs组和BMMSCs-SCF组之间在所有时间点均不同(P<0.0001)(图4E)。β-actin家族基因的mRNA水平含量测定作为内部控制通过实时定量PCR定量上述分子标记物。通过双向方差分析并没有显示各组之间存在整体差别(P=0.95,F=2.35,DF=9,3,3,32)。不存在非治疗依赖显著差异(P=0.55,F=1.59,DF=3,32),虽然有一个时间依赖差异(P<0.0001,F=72.2,DF=3,32)。然而,多重检测测试后表明,在任何时间点每两个治疗组之间没有显著差异(图4F)。

图3 免疫组化检测动物模型体内BMMSCs移植的分化
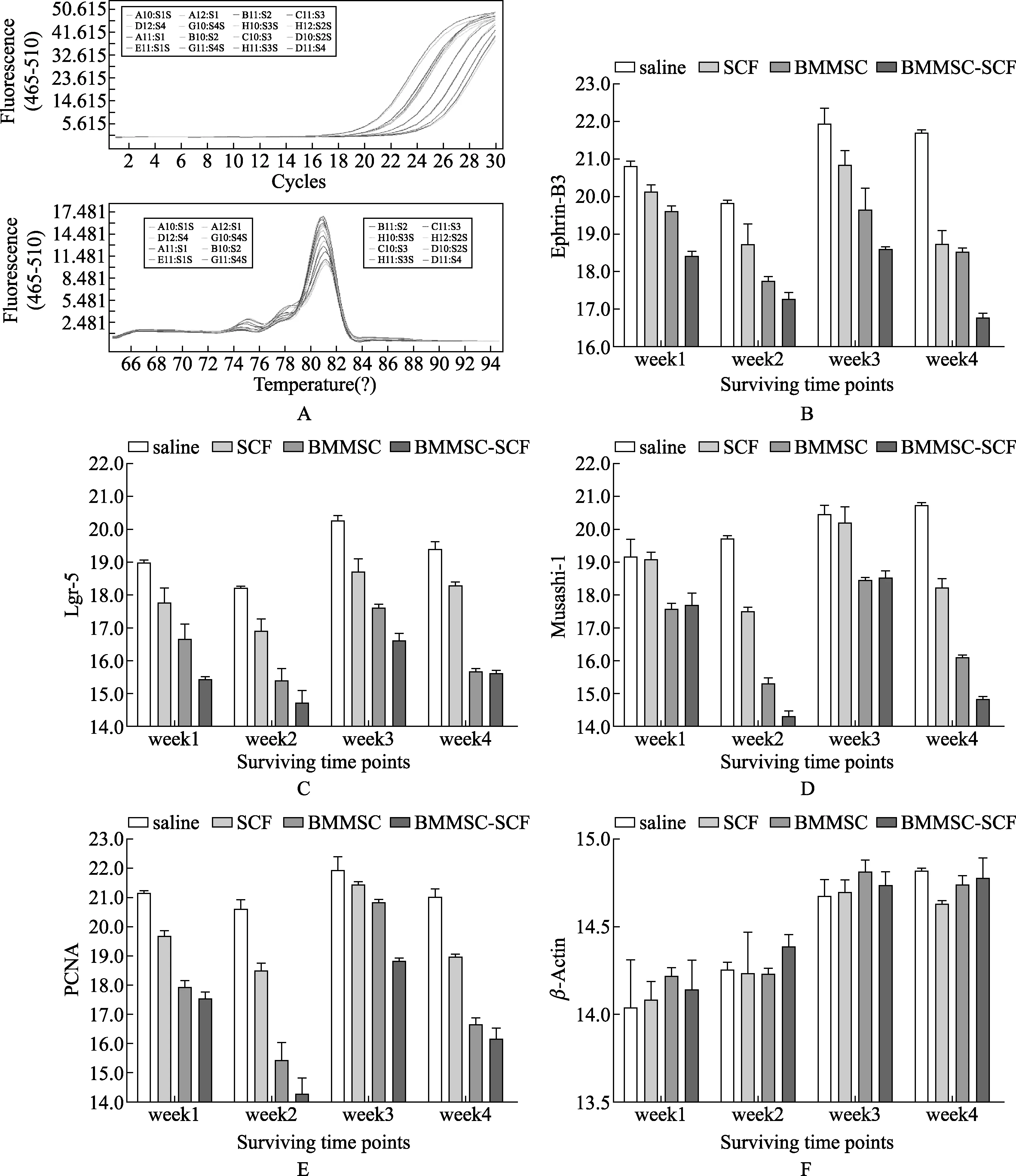
图4 BMMSCs和SCF mRNA在肠道中的表达情况
2.4 BMMSCs和SCF对肠道蛋白表达的影响 通过测定蛋白质表达进一步证实实验治疗的效果,我们定量分析PCNA和肠道标记物蛋白质表达蛋白免疫印迹在4周组织生存组(图5A)。在各组间PCNA蛋白含量明显不同(P<0.001,F=20.8,DF=3,12,单向方差分析),多重检测表明盐水组相对于SCF组和BMMSCs组之间存在差异,BMMSCs组相对于其他组之间存在差异(图5B)。在4组之间Msi-1蛋白水平明显不同(P=0.001,F=10.5,DF=3,12,单向方差分析)。Posthoc测试显示生理盐水组相对于BMMSCs和BMMSCs-SCF组存在显著的统计学差异(图5C)。Lgr5水平显示总体差异在各个组间(P=0.0001,F=16.8,DF=3,12,单向方差分析)。Posthoc测试表明显示生理盐水组相对于其他各组,BMMSCs-SCF组相对于其他各组,和BMMSCs组与BMMSCs-SCF组存在显著的统计学差异(图5D)。ephrin-B3蛋白水平在各组间存在整体差异性(P<0.0001,F=26.4,DF=3,12,单向方差分析)。明确的,统计上的显著差异发生生理盐水组与其他各组间,BMMSCs-SCF相对于SCF组和BMMSCs组之间(图5E)。
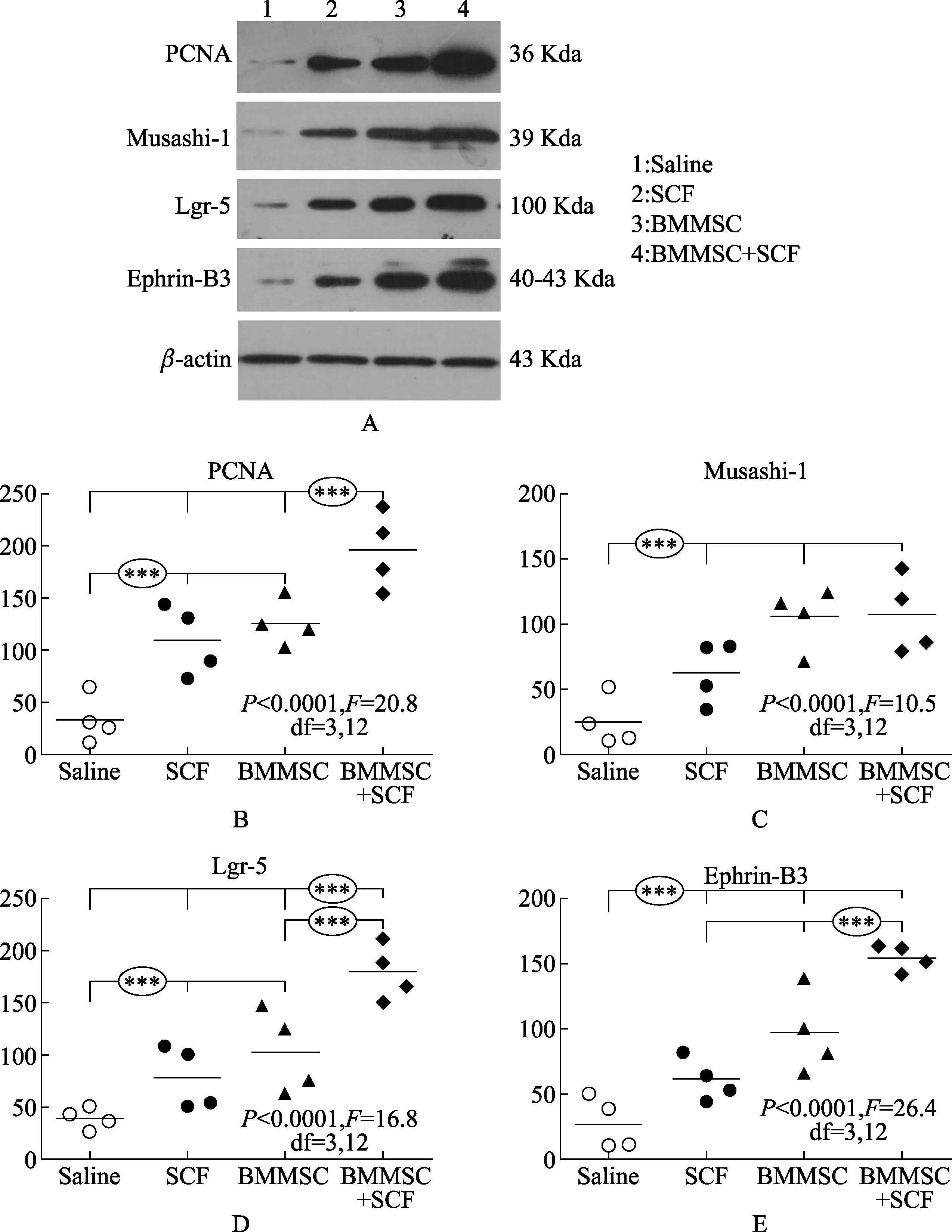
图5 BMMSCs和SCF 蛋白在肠道中的表达情况
2.5 骨髓间充质干细胞移植后增进组织学恢复 假定移植骨髓间充质干细胞主要存在于黏膜(绒毛和隐窝),我们判定治疗是否可能提高受伤肠道的组织学恢复。分析生存组在4周进行(图6)。小肠横断面黏膜区域和外周长分别取4点位置以同样的距离(图6A-H)。黏膜面积除以周长的比值计算每个样本,相对黏膜面积指数(图6I)。各组间相对黏膜面积有显著性差异(P<0.0001,F=23.8,df=3,12,单向方差分析)。因果检验表明生理盐水组相对于BMMSCs组和BMMSCs-SCF组相对黏膜面积显著减少。BMMSCs-SCF组相对于SCF组和BMMSCs组相对黏膜面积显著增加(图6I)。考虑到隐窝是黏膜再生的主体增殖基础,在每个样本中我们进一步计算隐窝占据的面积与黏膜总面积的比值(图6E-H)。隐窝占总黏膜面积的比值SCF组和BMMSCs治疗组相对于生理盐水组增高(图6J),通过单向方差分析显示显著差异(P<0.0001,F=18.3,df=3,12)。特别是,多重比较测试表明生理盐水组相对于其他组存在统计学差异,SCF组和BMMSCs-SCF组之间(图6J)。

图6 组织学骨髓间充质干细胞移植后的恢复情况
3.讨论
骨髓干细胞可能作为自体移植的一种形式,具有潜在的组织再生及器官修复治疗效用。研究证据表明,BMMSCs移植促进急性或慢性损伤后中心或边缘系统的组织再生和提高功能恢复[18,19]。骨髓干细胞移植被认为是治疗炎症性肠病和某些退行性胃肠道疾病[20,21]。例如,早前的研究表明,BMMSCs移植使用5-溴脱氧尿嘧啶核苷(BrdU)标记,逆转录病毒或Y染色体归巢到消化道[22]。一些研究还表明,移植骨髓干细胞可能与一些胃肠道细胞共区域化标记,如Lgr5和Ascl-2[23]。
在目前的研究中,我们观察到SD大鼠用吲哚美辛处理后显示恶劣的解剖外观、组织学变化和胃肠道炎症性肠病的症状。因此,实验大鼠的小肠和大肠有显著的黏膜变性由组织学评估。绒毛的高度和面积在使用吲哚美辛治疗后显著缩减。这些组织学和功能数据符合先前研究,吲哚美辛有效诱导炎症性肠病啮齿动物实验模型[10]。
探讨骨髓干细胞移植治疗炎症性肠病的潜在可能性,当前的研究中,BMMSCs排除成年标准偏差大鼠和扩展在体外研究。培养细胞被证实的造血性质与一组特定的膜标记的骨髓干细胞,包括CD29,CD34,CD44,CD45和CD90[13]。在体外扩展骨髓间充质干细胞为了有效追踪PKH26标记的这些细胞体内移植后的几个星期。
PKH26标记细胞被发现存在于受伤的肠道区域,主要显示在在隐窝和肠绒毛。这些细胞显示相当大程度上与PCNA共区域化,影响肠道原位置的增殖。重要的是,移植骨髓干细胞可能共同表达几种分子标记的前体细胞或不成熟的肠黏膜细胞包括Lgr5,Msi-1,ephrin-B3。Lgr5表达在肠道分泌细胞的前体细胞[24]。Msi-1是一个RNA结合蛋白,在干细胞不对称分裂中是关键的调控因子。Msi-1表达在早期肠道干细胞和他们的子代。Ephrin B3强烈表达在隐窝细胞的底部,峰值在细胞定位4~6(假定的肠道干细胞的位置)。因此,ephrin B3在研究肠道干细胞细胞表面标记是有意义的[25]。同时,这些组织学和形态学数据表明,在SD大鼠模型中移植BMMSCs可能使受伤的肠道转化和转移分化为干细胞样肠道干细胞。BMMSCs移植的转化和早期分化转移在受损肠道黏膜再生中发挥有益作用。与未经治疗的对照组相比,BMMSCs移植导致小肠隐窝区域的黏膜整体厚度增加。黏膜的隐窝被认为是黏膜恢复的增生位点。因此,我们的研究结果支持了这样的观点,即BMMSCs移植可能有效的治疗炎症性疾病[26,27]。
某些可溶性生长因子在靶器官/组织对多能干细胞的转移、存活和成功整合循环中可能起着至关重要的作用,在干细胞治疗退行性疾病也存在价值[28]。辅助使用干细胞营养因子被证明能改善并增进BMMSCs治疗一些疾病的效果,因此建议干细胞治疗在临床试验。在本研究中,我们证明干细胞因子仅在一定程度上改善吲哚美辛诱导的炎症性肠病的肠道黏膜再生。同时干细胞因子在BMMSCs移植治疗肠道恢复中显示出协同的有益效果。这种效应包括刺激细胞增殖的抗原的表达(PCNA)以及特定分子的黏膜干细胞或前体细胞(包括Msi-1 Lgr5 ephrin-β3)。此外,在肠损伤后黏膜和隐窝区域骨髓间充质干细胞治疗组得到了最大范围的增加。
4.结论
本研究显示在体外增加骨髓间充质干细胞重置,显示在炎症性肠病老鼠模型中肠的局部增殖。在移植前一周他们也似乎分化转移为肠黏膜细胞。骨髓间充质干细胞治疗与改善吲哚美辛引起的炎症性肠病大鼠的黏膜再生相关。重要的是,在这个模型中干细胞因子在促进骨髓间充质干细胞因子治疗炎症性肠病肠道黏膜再生起增进协同作用。
1 Benchimol EI,Guttmann A,Griffiths AM,et al. Increasing incidence of paediatric inflammatory bowel disease in Ontario,Canada:evidence from health administrative data[J]. Gut,2009,58(11):1490-1497. DOI:10.1136/gut.2009.188383.
2 Heyman MB,Kirschner BS,Gold BD,et al. Children with early-onset inflammatory bowel disease (IBD):analysis of a pediatric IBD consortium registry[J]. J Pediatr,2005,146(1):35-40. DOI:10.1016/j.jpeds.2004.08.043.
3 Saurer L,Mueller C. T cell-mediated immunoregulation in the gastrointestinal tract[J]. Allergy,2009,64(4):505-519. DOI:10.1111/j.1398-9995.2009.01965.x.
4 Bernstein CN,Blanchard JF. Viruses and inflammatory bowel disease:is there evidence for a causal association[J]. Inflamm Bowel Dis,2000,6(1):34-39.
5 Danese S,Sans M,Fiocchi C. Inflammatory bowel disease:the role of environmental factors[J]. Autoimmun Rev,2004,3(5):394-400. DOI:10.1016/j.autrev.2004.03.002.
6 Thoree VC,Golby SJ,Boursier L,et al. Related IgA1 and IgG producing cells in blood and diseased mucosa in ulcerative colitis[J]. Gut,2002,51(1):44-50. DOI:10.1136/gut.51.1.44.ulcerative colitis. Gut 51:44-50.
7 Woltman AM,de Fijter JW,Zuidwijk K,et al. Quantification of dendritic cell subsets in human renal tissue under normal and pathological conditions[J]. Kidney Int,2007,71(10):1001-1008. DOI:10.1038/sj.ki.5002187.
8 Atuma C,Strugala V,Allen A,et al. The adherent gastrointestinal mucus gel layer:thickness and physical state in vivo[J]. Am J Physiol Gastrointest Liver Physiol,2001,280(5):G922-G929.
9 Mimeault M,Batra SK. Great promise of tissue-resident adult stem/progenitor cells in transplantation and cancer therapies[J]. Adv Exp Med Biol,2012,741:171-186. DOI:10.1007/978-1-4614-2098-9_12.
10 Wang L,Li J,Li Q,et al. Morphological changes of cell proliferation and apoptosis in rat jejunal mucosa at different ages[J]. World J Gastroenterol,2003,9(9):2060-2064.DOI:10.3748/wjg.v9.i9.2060.
11 Sauerzweig S,Baldauf K,Braun H,et al. Time-dependent segmentation of BrdU-signal leads to late detection problems in studies using BrdU as cell label or proliferation marker[J]. J Neurosci Methods,2009,177(1):149-159.DOI:10.1016/j.jneumeth.2008.10.009.
12 Qi S,Wu D. Bone marrow-derived mesenchymal stem cells protect against cisplatin-induced acute kidney injury in rats by inhibiting cell apoptosis[J]. Int J Mol Med,2013,32(6):1262-1272. DOI:10.3892/ijmm.2013.1517.
13 Ohishi M,Schipani E. Bone marrow mesenchymal stem cells[J]. J Cell Biochem,2010,109(2):277-282. DOI:10.1002/jcb.22399.
14 Suh KT,Kim SW,Roh HL,et al. Decreased osteogenic differentiation of mesenchymal stem cells in alcohol-induced osteonecrosis[J]. Clin Orthop Relat Res,2005(431):220-225.
15 Leedham S J,Brittan M,McDonald S A C,et al. Intestinal stem cells[J]. Journal of Cellular and Molecular Medicine,2005,9(1):11-24. DOI:10.1111/j.1582-4934.2005.tb00333.x.
16 Shaker A,Rubin DC. Intestinal stem cells and epithelial-mesenchymal interactions in the crypt and stem cell niche[J]. Transl Res,2010,156(3):180-187. DOI:10.1016/j.trsl.2010.06.003.
17 Markel T A,Crisostomo P R,Lahm T,et al. Stem cells as a potential future treatment of pediatric intestinal disorders[J]. Journal of Pediatric Surgery,2008,43(11):1953-1963. DOI:10.1016/j.jpedsurg.2008.06.019.
18 Kim BC,Yoon JH,Choi B,et al. Mandibular reconstruction with autologous human bone marrow stem cells and autogenous bone graft in a patient with plexiform ameloblastoma[J]. J Craniofac Surg,2013,24(4):e409-e411. DOI:10.1097/SCS.0b013e318292c91d.
19 Telukuntla KS,Suncion VY,Schulman IH,et al. The advancing field of cell-based therapy:insights and lessons from clinical trials[J]. J Am Heart Assoc,2013,2(5):e000338. DOI:10.1161/JAHA.113.000338.
20 Brittan M,Alison MR,Schier S,et al. Bone marrow stem cell-mediated regeneration in IBD:where do we go from here[J]. Gastroenterology,2007,132(3):1171-1173. DOI:10.1053/j.gastro.2007.01.064.
21 Tayman C,Uckan D,Kilic E,et al. Mesenchymal stem cell therapy in necrotizing enterocolitis:a rat study[J]. Pediatr Res,2011,70(5):489-494. DOI:10.1203/PDR.0b013e31822d7ef2.
22 Lin YT,Chern Y,Shen CK,et al. Human mesenchymal stem cells prolong survival and ameliorate motor deficit through trophic support in Huntington’s disease mouse models[J]. PLoS ONE,2011,6(8):e22924. DOI:10.1371/journal.pone.0022924.
23 van der Flier L G,van Gijn M E,Hatzis P,et al. Transcription Factor Achaete Scute-Like 2 Controls Intestinal Stem Cell Fate[J]. Cell,2009,136(5):903-912. DOI:10.1016/j.cell.2009.01.031.
24 Buczacki SJ,Zecchini HI,Nicholson AM,et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5[J]. Nature,2013,495(7439):65-69. DOI:10.1038/nature11965.
25 Giannakis M,Stappenbeck TS,Mills JC,et al. Molecular properties of adult mouse gastric and intestinal epithelial progenitors in their niches[J]. J Biol Chem,2006,281(16):11292-11300. DOI:10.1074/jbc.M512118200.
26 Ditschkowski M,Einsele H,Schwerdtfeger R,et al. Improvement of inflammatory bowel disease after allogeneic stem-cell transplantation[J]. Transplantation,2003,75(10):1745-1747. DOI:10.1097/01.TP.0000062540.29757.E9.
27 Duijvestein M,Vos AC,Roelofs H,et al. Autologous bone marrow-derived mesenchymal stromal cell treatment for refractory luminal Crohn’s disease:results of a phase I study[J]. Gut,2010,59(12):1662-1669. DOI:10.1136/gut.2010.215152.
28 Cook D,Genever P .Regulation of Mesenchymal Stem Cell Differentiation[J].Springer Netherlands,2013,786 (786):213-229.
29 Hoggatt J,Pelus LM.New G-CSF agonists for neutropenia therapy[J].Expert Opinion On Investigational Drugs,2014,23(1):21-35
Bonemarrowmesenchymalstemcellsandstemcellfactorintheexperimentalstudyofinflammatoryboweldisease
(XINGuorong1,NIJian1,LIUYang,JIZhiwu,ZHAOBin,YUHaitao,ZHUXiaowen,YANGZe,CHENFujun※.
Departmentofgeneral,FirstaffiliatedhospitalofJiamusimedicalUniversity,Jiamusi154000,China.)
ObjectivesTo explore the mesenchymal stromal cells and stem cell factor in the treatment of inflammatory bowel disease mechanism of bone marrow.MethodsUse the PKH26 fluorescent dye labeled bone marrow mesenchymal stromal cells,input by indomethacin induced gastric mucosal damage of donor mice.The effects of bone marrow mesenchymal stromal cells transplantation were detected by the method of PKH26.The expression of PKH26 in bone marrow stromal cells in vivo was detected by blot Western and PCR.ResultsPKH26 fluorescent staining labeled MSCs were found in the gastrointestinal mucosa of rats,such as proliferating cell nuclear antigen (PCNA),stem cell marker (Lgr5),Musashi-1 and tyrosine protein kinase B3 (ephrin-B3).MRNA,Lgr5,Musashi-1,ephrin-B3 and BMMSCs-SCF increased in the intestinal mucosa of the mice treated with bone marrow mesenchymal stromal cells.In the BMMSCs treatment group rats were significantly higher in the small intestine mucosal layer and the crypt layer,and more significantly in the BMMSCs-SCF mixed treatment group.Results:PKH26 fluorescent staining labeled MSCs were found in the gastrointestinal mucosa of rats,such as proliferating cell nuclear antigen (PCNA),stem cell marker (Lgr5),Musashi-1 and tyrosine protein kinase B3 (ephrin-B3).MRNA,Lgr5,Musashi-1,ephrin-B3 and BMMSCs-SCF increased in the intestinal mucosa of the mice treated with bone marrow mesenchymal stromal cells.In the BMMSCs treatment group rats were significantly higher in the small intestine mucosal layer and the crypt layer,and more significantly in the BMMSCs-SCF mixed treatment group.Conclusionin the indomethacin induced intestinal injury in experimental bone marrow mesenchymal stromal cells and their soluble stem cell factor may participate in the mucosal cell regeneration and play a synergistic effect.Bone marrow stem cell therapy and stem cell factor management may be of therapeutic value.
marrow mesenchymal stromal cells, stem cell factor, inflammatory bowel disease
国家自然科学基金(81460203,8321120527,81370265,8147108,81400710),卫生部公益性研究基金(201192008),国家科技部十二五支撑计划(2012BAI10B01),黑龙江省中医药科研项目(ZHY12-Z190),佳木斯大学科学技术面上项目(L2012-049)和黑龙江省卫生厅项目(2012-222)。
#为共同第一作者辛国荣,倪健,※为通讯作者
10.3969/j.issn.1672-4860.2017.05.001
2017-7-15
