冠心病患者体内循环微粒对血管舒张功能的影响研究*
2017-11-13李红文王旭兰王群让刘新宏常凤军
李红文, 张 炜,李 喆,王旭兰,王群让,刘新宏,邢 坤,常凤军△
1.陕西省人民医院心血管内三科 (西安 710068),2. 咸阳职业技术学院医学院(咸阳 712000),3. 陕西中医药大学附属医院心内科(咸阳 712000)
冠心病患者体内循环微粒对血管舒张功能的影响研究*
李红文1, 张 炜1,李 喆1,王旭兰2,王群让3,刘新宏1,邢 坤1,常凤军1△
1.陕西省人民医院心血管内三科 (西安 710068),2. 咸阳职业技术学院医学院(咸阳 712000),3. 陕西中医药大学附属医院心内科(咸阳 712000)
目的:研究冠心病患者体内循环微粒(MPs)对血管舒张功能的影响。方法:选取稳定型心绞痛冠心病患者45例(实验组)和健康体检的健康志愿者20例(对照组),分别抽取两组患者的空腹静脉血,采用两步离心法提取MPs;然后用两组MPs孵育离体SD大鼠胸主动脉,并检测分析二者对血管舒张功能的影响及对一氧化氮(NO)含量的影响。结果:与对照组MPs比较,实验组MPs明显抑制了内皮依赖的血管舒张功能和离体血管NO的产生。结论: 冠心病患者体内的MPst通过抑制NO的产生损害内皮依赖的血管舒张功能,提示MPs有作为内皮功能受损标志物的潜能。
冠状动脉性心脏病(Coronary heart disease,CHD)的发生发展与内皮功能障碍及血小板的激活密切相关,内皮细胞结构和功能的改变是CHD的早期共同病理变化。已有研究证实CHD患者的内皮功能均受到不同程度的损害[1-2]。循环微粒(Circulating microparticles,MPs)是内皮细胞、血小板等细胞激活或凋亡时以“出泡”的方式释放到体内的微小囊泡状颗粒[3-4]。研究发现,MPs具有:促炎症反应、氧化应激、促血栓反应、影响血流动力学等作用[5-6]。MPs是否参与和影响了CHD的发生发展及可能的作用机制尚不明确。本研究将通过比较正常志愿者及CHD患者的MPs多血管舒张功能及其相关的自由基的影响的差异,初步探讨MPs在CHD发生发展中的作用。
资料与方法
1 一般资料 选取2016年3-9月就诊于陕西中医药大学附属医院心内科的CHD患者45例(45例),男23例,女22例,年龄42~68(50.53±12.37)岁,体重指数(22.26±0.93)kg/m2。排除患有高血压、2型糖尿病、肾功能衰竭、严重感染性疾病等可能会影响MPs含量疾病的患者。另外选取陕西中医药大学附属医院健康体检20例,男10例,女10例,年龄40~ 60( 48.62±10.4)岁,体重指数(21.63±0.89)kg/m2;两组一般资料比较无统计学差异(P>0.05),具有可比性。所有参与者均自愿签署知情同意书。
2 MPs提取 入院当天抽两组空腹静脉血,按照文献[7]提取MPs:将空腹静脉血低温离心(4℃ 4000 rpm,10 min),提取上层血浆再次离心(4℃ 11000 g ,2 min),上层血浆为乏血小板血浆。取2 ml 乏血小板血浆进行最后一次离心(4℃ 13000 g ,45 min),将沉淀于离心管底部的MPs 用100 μl 的RPMI1640 培养基(美国,GIBCO公司)重悬,经BCA蛋白浓度进行测定(试剂盒:美国,Thermo Scientific 公司)其浓度,存放于4℃冰箱备用。
3 血管舒张功能检测 配置Kreb’s平衡液(NaCl 119.0 mmol/L,NaHCO325.0 mmol/L glucose 11.1 mmol/L,CaCl21.6 mmol/L,KCl 4.7 mmol/L,KH2PO41.2 mmol/L,MgSO41.2 mmol/L,pH 7.4,所用试剂均为国产分析纯)。经斩头处死大鼠(陕西中医药大学动物实验中心提供)后,迅速开胸取其胸主动脉,并放置于预冷、通气(95% O2与 5% CO2的混合气)Kreb’s平衡液中,仔细剔除动脉周围脂肪组织后将动脉平均剪为3 ~ 4 mm血管环。将血管环连接至含有Kreb’s平衡液(37℃,通气)的BL-420E+生物机能试验系统(中国,成都泰盟科技有限公司)内。让血管环在仪器内平衡90 min后进行血管舒张功能检测。经等量的两组MPs孵育血管环30 min后,首先用苯肾上腺素(10-6mol/L,美国,Sigma公司)刺激血管收缩至平台期,然后依次加入10-7~ 10-4mol/L 的乙酰胆碱(美国,Sigma公司)检测MPs对血管舒张功能的影响(设空白对照组,不做任何药物孵育,其余处理与对照组、实验组一致)。
4 NO检测 经斩头处死大鼠后迅速开胸取大鼠胸主动脉,将取出的胸主动脉放置于预冷并通气的Kreb’s平衡液中,仔细剔除动脉周围脂肪组织后将血管纵行剖开并放入DMEM培养基(美国,GIBCO公司)的6孔板内,将6孔板放入细胞培养箱内稳定1 h后分别加入等量的两组MPs孵育30 min(设空白对照组,不做任何药物孵育;设阳性对照组,血管内皮舒张因子(VEGF,50 ng/ml)孵育30min)。孵育结束后取培养基进行NO检测(试剂盒:南京建成生物科技公司),将各孔内血管环烘干称重用于计算NO含量(μmol/g 蛋白)。

结 果
1 两组血脂及MPs含量情况 实验组血脂及MPs含量较对照组高,分别比较均有明显统计学差异(P均<0.05),见表1。
2 两组MPs对血管舒张功能的影响 与空白组组比较, 对照组MPs不影响血管舒张功能,实验组MPs一定程度上抑制了血管舒张功能(图1)

表1 两组临床资料比较
注:与对照组比较,*P<0.05
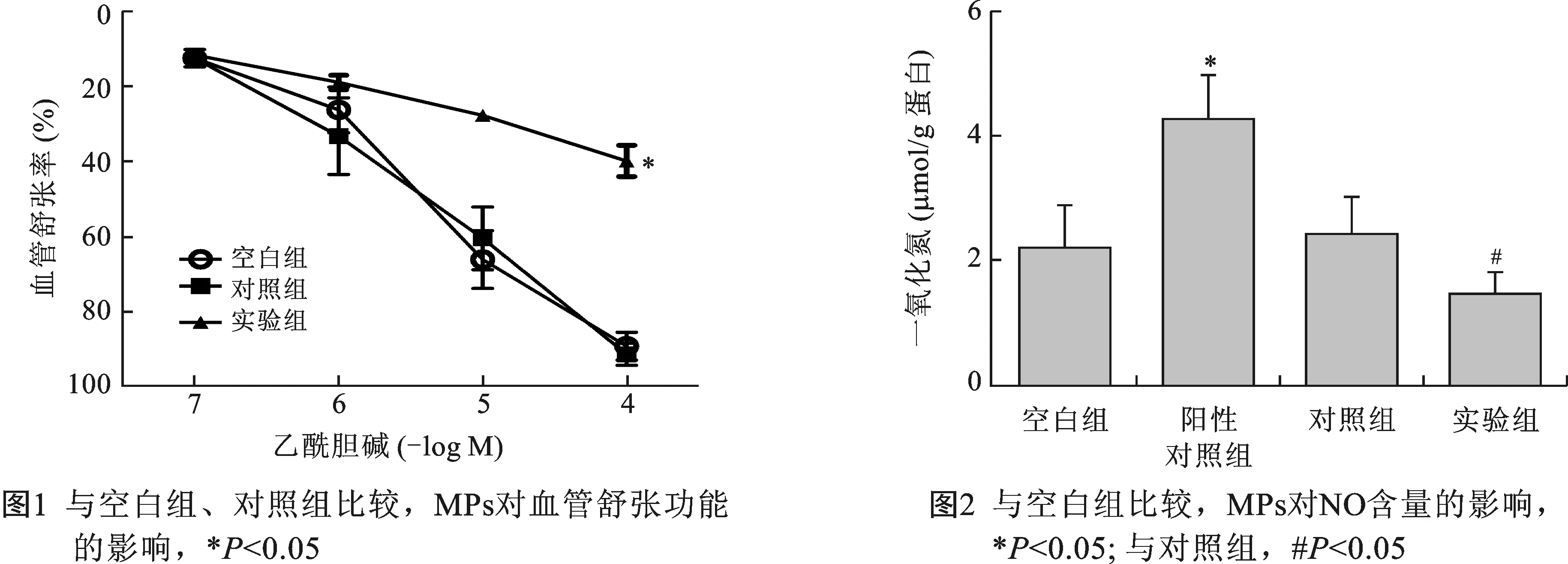
3 两组对一氧化氮含量的影响 与空白组比较,阳性对照组(VEGF组)明显离体血管刺激NO产生(提示实验操作有效);对照组MPs对离体血管NO的产生无影响,实验值MPs一定程度上抑制了离体血管NO的产生(图2)。
讨 论
冠心病的发生发展是一个多因素参与的级联损伤反应,也涉及到血管内皮细胞损伤后细胞形态学的改变[8]。本研究通过比较CHD患者的MPs和健康志愿者的MPs对血管舒张功能的影响发现:与对照组MPs比较,实验组MPs抑制了离体血管NO的产生和血管舒张功能。我们的研究一定程度上阐明了MPs参与CDH发生发展的分子生物学机制。
近年来,CHD的发生率、致死率和致残率逐年身高。研究发现,冠心病的发生发展危险因素有:血脂异常、高血压病史、吸烟史、炎症因子、凝血激活、内皮功能紊乱等[9-10]。临床研究显示,狼疮抗凝物(LA)、多发性硬化症(MS)、血栓性血小板减少性紫癜(TTP)、高血压、先兆子痫和糖尿病患者血浆中MPs水平升高,MPs数量及功能的检测可以为评估和监测血栓性及炎症性疾病中的内皮损伤情况[3-4]。研究认为,MPs不仅是内皮功能受损的标志物,更在凝血状态、炎症反应、血管功能障碍等方面起到重要作用[11]。还有研究显示,MPs通过抑制内皮型一氧化氮合酶的表达影响离体心脏血管新生[12]。研究发现,重度主动脉瓣狭窄患者体内MPs水平较正常人升高,而其原因在于瓣膜口狭窄所形成的切应力以及血流动力学改变所致[6]。研究认为,MPs不仅仅是内皮损伤的产物,同时MPs又反过来加重心脏瓣膜损伤,进而形成“恶性循环”[13]。鉴于MPs的上诉作用,本研究选取正常人和CHD患者为研究对象,以血管舒张及与血管舒张密切相关的NO为研究手段检测MPs在CHD发生发展中的作用。我们的研究发现CHD患者体内的MPs含量较正常对照组明显升高,而且这一升高的MPs抑制了血管舒张功能,我们的结果不仅验证了前人的理论,而且用实验证实了MPs可以抑制血管内皮舒张功能。
NO 由血管内皮细胞产生和释放,可以阻断血管内皮损伤和舒张血管,NO 生物学活性降低意味着内皮细胞功能出现损伤或障碍[14]。内皮功能的异常主要表现为 NO 水平下降和氧化应激反应增强。既往研究已经证实 MPs 可以降低内皮细胞 NO 释放[15]。Chang JP和 Corradi D研究表明氧化应激反应在二尖瓣疾病的内皮功能损伤起重要作用。 eNOS 脱耦联是导致 NO 水平下降和 O2-水平升高的重要机制[16]。本研究显示,来自CHD患者的MPs抑制了离体大鼠胸主动脉NO的产生,进一步检验了MPs抑制血管舒张功能的分子生物学机制:CHD患者体内的MPs可能是通过抑制血管内皮细胞产生NO而抑制了血管内皮舒张功能,而血管内皮功能的受损可能会反过来进一步增加MPs的释放,最终形成“恶性循环”而参与了CHD的发生发展。由于MPs来源的广泛性(内皮源、血小板源、白细胞源等), 而目前尚无方法可以从血液中分离出不同来源的MPs,所以此次研究所用的MPs为混合型的,将来分离提存MPs新方法的出现将有利于更深入的研究MPs与CHD及内皮功能的关系。
[1] Marti CN,Gheorghiade M,Kalogeropoulos AP,etal. Endothelial dysfunction,arterial stiffness,and heart Failure [J]. J Am Coll Cardiol,2012,60(16):1455-1469.
[2] Moens AL,Claeys MJ,Timmermans JP,etal. Myocardial ischemia/reperfusion-injury,a clinical view on a complex pathophysiological process [J]. Int J Cardiol,2005,100(2):179-190.
[3] Horstman LL,Jy W,Jimenez JJ,etal. Endothelial microparticles as markers of endothelial dysfunction [J]. Front Biosci,2004,9:1118-1135.
[4] Chironi GN,Boulanger CM,Simon A,etal. Endothelial microparticles in diseases [J]. Cell Tissue Res,2009,335(1):143-151.
[5] Peterson DB,Sander T,Kaul S,etal. Comparative proteomic analysis of pai-1 and TNF-αlphaderived endothelial microparticles [J]. Proteomics,2008,8(12):2430-2446.
[6] Diehl P,Nagy F,Sossong V,etal. Increased levels of circulating microparticles in patients with severe aortic valve stenosis [J]. Thromb Haemost,2008,99(4):711- 719.
[7] Sutherland WH,de Jong SA,Hessian PA,etal. Ingestion of native and thermally oxidized polyunsaturated fats acutely increases circulating numbers of endothelial microparticles [J]. Metabolism,2010,59(3): 446- 453.
[8] 仇卫峰,刘 佳,向宗兴.加味丹参饮对冠心病血管内皮细胞损伤后细胞形态学的影响[J].陕西中医,2016,37(8):1042- 1043.
[9] Toth PP,Davidson MH. High-density lipoproteins: Marker of cardiovascular risk and therapeutic target [J]. Journal of Clinical Lipidology,2010,4:359-364.
[10] 李栓荣.冠心病危险因素对冠状动脉病变的影响[J].陕西医学杂志,2005,34(10):1310.
[11] Nagy JA,Benjamin L,Zeng H,etal. Vascular permeability,vascular hyperpermeability and angiogenesis [J]. Angiogenesis,2008,11(2):109-119.
[12] Ou ZJ,Chang FJ,Luo D,etal. Endothelium-derived microparticles inhibit angiogenesis in the heart and enhance the inhibitory effects of hypercholesterolemia on angiogenesis [J]. Am J Physiol Endocrinol Metab,2011,300(4):E661- E668.
[13] Ahn YS,Jy W,Horstman LL,etal. Cell-derived microparticles: a mediator of inflammation in aortic valve stenosis? [J] Thromb Haemost,2008,99(4):657-658.
[14] Ou ZJ,Wei W,Huang DD,etal. L-arginine restores endothelial nitric oxide synthase-coupled activity and attenuates monocrotaline-induced pulmonary artery hypertension in rats [J]. Am J Physiol Endocrinol Metab,2010,298(6): E1131-1139.
[15] 张 涛,王恩漫,王群让,等. 肺动脉高压防治机制探讨[J].陕西医学杂志,2015,44(9):1116-1117,1120.
[16] Chang JP,Chen MC,Liu WH,etal. Atrial myocardial nox2 containing NADPH oxidase activity contribution to oxidative stress in mitral regurgitation: potential mechanism for atrial remodeling [J]. Cardiovasc Pathol,2011,20(2):99-106.
Effectofcirculatingmicroparticlesonvasodilatationincoronaryheartdisease
Li Hongwen,Zhang Wei,Li Zhe,et al.
Department of Cardiology,Shaanxi People's Hospital(Xi’an 710068)
Objective: To study the effect of circulating microparticles (MPs) from patients with coronary heart disease (CHD) on vasodilatation. Methods: Fasting venous blood from healthy volunteer (n=20) and stable angina pectoris patients (n=45) were obtained. Two steps’ centrifugation was used to get MPs from CAHD patients (experimental group) and normal volunteers (control group). Then,effect of MPs on vasodilatation,generation of nitric oxide (NO) of isolated thoracic aorta from SD rats were performed. Results: Compared with control group,MPs from experimental group inhibited the endothelial-depentmend vasodilatation,reduced the generation of NO. Conclusion: MPs from CHD patients inhibited vasodilatation by reduction NO,which indicated that MPs maybe a potential marker of endothelial dysfunction.
Coronary disease/physiopathology @Circulating microparticles Nitric oxide Vasodilatation
*国家自然科学基金专项基金资助项目(81341112)
△通讯作者
冠状动脉疾病/病理生理学 循环微粒 内皮细胞 一氧化氮 血管舒张
R363.2
A
10.3969/j.issn.1000-7377.2017.11.007
(收稿:2017-05-10)
