2株石油降解菌的分离鉴定
2017-11-13詹亚斌马立安陶兴玲何山文王鹏宇邓刚
詹亚斌,马立安,陶兴玲 何山文,王鹏宇,邓刚
长江大学生命科学学院,湖北 荆州 434025
江涛
(长江大学动物科学学院,湖北 荆州 434025)
2株石油降解菌的分离鉴定
詹亚斌,马立安,陶兴玲 何山文,王鹏宇,邓刚
长江大学生命科学学院,湖北 荆州 434025
江涛
(长江大学动物科学学院,湖北 荆州 434025)
为了筛选高效石油降解菌株,通过富集驯化培养,从江汉油田石油污染土样中筛选能以石油为唯一碳源生长的菌株。经过划线培养获得单菌落,并通过形态观察、生理生化及分子生物学分析对菌株进行了初步鉴定和系统分类。结果分离获得2株石油降解效率较高的菌(分别记为G-40和G-94),初步鉴定G-40为侧孢芽孢杆菌(Brevibacilluslaterosporus),G-94为热带假丝酵母菌(Candidatropicalis)。
石油;降解菌;分离;鉴定
石油在开采、运输、加工、储存过程中不可避免地会发生石油泄漏事故,造成土壤及水体的严重污染,直接或间接危害人类健康。石油污染日益严重,对其治理已经刻不容缓[1]。
由于生物修复技术具有环境友好、成本低廉、操作简单、对操作人员危害小、作用彻底等特点,越来越引起人们的重视,被广泛应用到环境污染治理领域[2~4],成为一种替代化学和物理技术的修复石油污染土壤的新技术。
土壤中存在着许多可以利用有机物的微生物,主要有细菌、真菌、放线菌等,它们具有氧化分解有机物的能力。在许多条件下,降解菌驯化时间长、生长速度慢、代谢活性不高,并且很不稳定,因此筛选一些稳定高效降解污染物的菌种,是生物修复的必然要求[1]。
本课题组从江汉油田石油污染土壤中分离获得石油降解单菌,为后期研究其石油降解特性做准备,同时也为石油污染土壤生物修复提供微生物资源。
1 材料与方法
1.1材料
石油污染土样采自江汉油田作业油井及废弃老井附近,离地表20~25cm的土壤,多点采样后装入无菌袋中密闭保存备用。所有试剂均为分析纯或化学纯。
富集、驯化培养基制作方法参考文献[5],马铃薯蔗糖液体培养基、马铃薯蔗糖固体培养基、牛肉膏蛋白胨液体培养基、牛肉膏蛋白胨固体培养基、细菌选择性培养基、真菌选择性培养基(马丁-孟加拉红培养基)制作方法参考文献[6]。
1.2方法
1.2.1石油降解菌的富集、驯化与分离
称取新鲜的石油污染土壤样品约5g放入100mL无机盐培养基中,35℃、150r/min恒温摇床震荡培养5d,将菌液按照5%的接种量重新转接到新鲜的富集、驯化培养基中,以5d为1个周期,连续培养3个周期,获得能以石油作为唯一碳源和能源的混合菌群[5]。
菌株纯种分离:将混合菌群培养液稀释涂布于细菌/真菌选择性培养平板中,在35℃恒温培养箱中培养48h,根据菌落形态特征挑取不同单菌落,在细菌/真菌选择性培养基上多次划线纯化后,再挑选单菌落保种于牛肉膏蛋白胨/马铃薯蔗糖试管斜面中,同时采用终浓度20%灭菌甘油冻管法保存于-80℃条件下。
1.2.2石油降解率的测定
将分离纯化获得的细菌/真菌挑取一环,接种到牛肉膏蛋白胨液体培养基/马铃薯蔗糖液体培养基中,取生长在对数期的菌液,以5%(v/v)的接种量接入到石油培养基中,35℃、pH 7.0、150r/min恒温摇床震荡培养30d,测定石油降解率。
采用重量法测定石油降解率。向含油三角瓶中分4次加入80mL二氯甲烷,萃取出石油,经过无水硫酸钠柱除水后,室温晾干直至有机溶剂完全挥发。将石油放置真空干燥箱40℃,真空度0.04MPa下保持30min后,取出置于干燥器中30min,称重,重复3次[5]。石油降解率按如下公式计算:石油降解率=[(空白石油烃浓度-培养液石油烃浓度)/空白石油烃浓度]×100%。
1.2.3菌体形态与培养特征的观察
菌体染色后在显微镜下观察细胞形态。在牛肉膏蛋白胨/马铃薯蔗糖琼脂培养平板上观察菌落特征。
1.2.4生理生化性质测定
按照文献[6]的方法,对该菌株进行生理生化性质测定,分别包括:明胶液化试验、吲哚试验、过氧化氢酶试验、柠檬酸盐试验、甲基红试验、乙酰甲基甲醇试验(V.P.)、淀粉水解试验、油脂水解试验、产氨试验、硝酸盐还原试验、苯丙氨酸脱氢酶试验、产硫化氢试验。重复3次,每次做3组,记录结果。
1.2.5分子生物学鉴定
细菌总DNA提取采用煮沸法[7],真菌总DNA的提取采用CTAB法[8]。
以提取到的细菌DNA为模板,采用通用引物扩增16S rDNA,上游引物27F: 5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′,扩增反应于Bio-Rad PCR仪上进行。PCR反应体系为25μL,其体系为 2×PCR 12.5μL,27F(10μmol/L)1μL,1492R(10μmol/L)1μL,DNA模板2μL,双蒸水8.5μL。PCR 扩增程序为:94℃预变性4min;94℃变性1min,55℃退火1min,72℃延伸1min 30s,30个循环;72℃终延伸10min。
以提取得到的真菌DNA为模板,采用通用引物扩增ITS rDNA,上游引物ITS 5:5′-GGAAGTAAAAGTCGTAACAAGG-3′,下游引物ITS 4:5′- TCCTCCGCTTATTGATATGC-3′;扩增反应于Bio-Rad PCR仪上进行。PCR反应体系为25μL,其体系为 2×PCR 12.5μL,ITS 5(10μmol/L)1μL,ITS 4(10μmol/L)1μL,DNA模板2μL,双蒸水8.5μL。PCR 扩增程序为:94℃预变性5min;94℃变性30s,57℃退火30s,72℃延伸30s,30个循环;72℃终延伸7min。
扩增产物经1%琼脂糖凝胶电泳,产物和Mark上样量均为5μL,电泳结果于Bio-Rad凝胶成像系统成像。PCR产物经AxyPrep PCR清洁试剂盒纯化;纯化后的PCR产物送生工生物(武汉)股份有限公司测序。测序结果在NCBI中进行BLAST比对分析,并通过软件MEGA 5.0构建系统发育树。
2 结果与分析

图1 2株菌株的石油降解率
2.1菌株分离结果
从污染土壤中分离获得2株石油降解单菌,分别记为G-40和G-94。
2.2分离菌株的石油降解率
从图1可以看出,G-40和G-94在35℃、pH7.0、油浓度2%、盐浓度0.5%、150r/min的条件下,石油降解率分别为21.59%和37.03%,两者之间具有显著差异(P<0.05)。
2.3菌体形态与培养特征
将2株菌分离培养后(G-40培养2d,G-94培养8d),G-40和G-94的菌落形态分别见图2和图3,菌落特征见表1。

图2 G-40菌落和菌体(1000×) 图3 G-94菌落和菌体(1000×)

菌编号菌落形态颜色质地突起 边缘直径/mm面积/mm2G⁃40圆形米黄色光滑凸透镜状完整201313G⁃94圆形乳白色光滑脐突状完整155018521
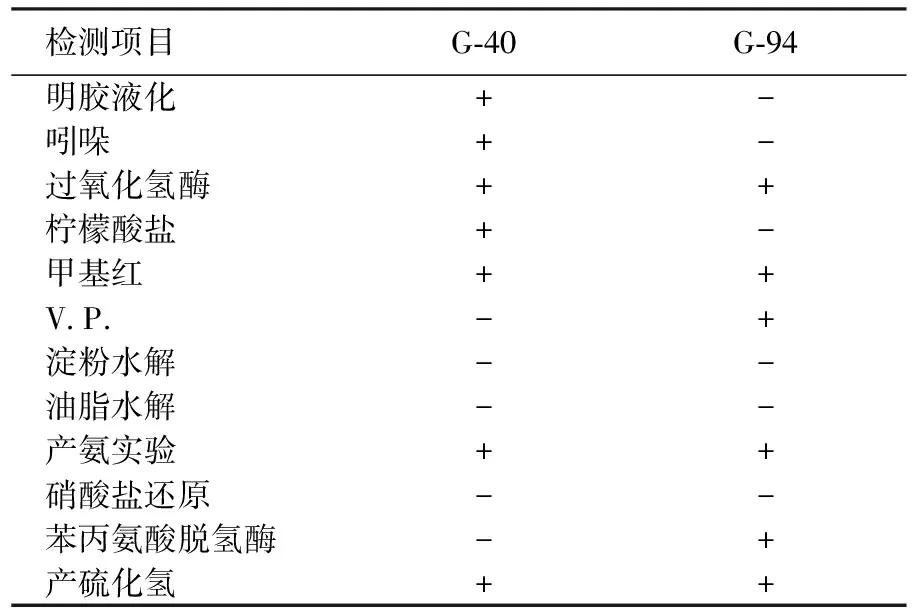
表2 2株菌株的生理生化试验结果
注:-代表阴性;+代表阳性。
2.4生理生化性质测定
分离获得的2株菌生理生化试验结果如表2。
2.5分子生物学鉴定
对降解菌株G-40的16S rDNA基因片段进行PCR扩增,最终获得长度约为1500bp的基因序列;对G-94的ITS rDNA基因片段进行PCR扩增,最终获得长度约为750bp的基因序列。将其与NCBI数据库中的已知序列进行BLAST比对分析发现,G-40与Brevibacilluslaterosporus的序列相似度达到99%,G-94与Candidatropicalis的序列相似度达到99%。根据结果进行2株菌株的系统发育分析如图4和图5所示。

图4 G-40菌株系统发育树
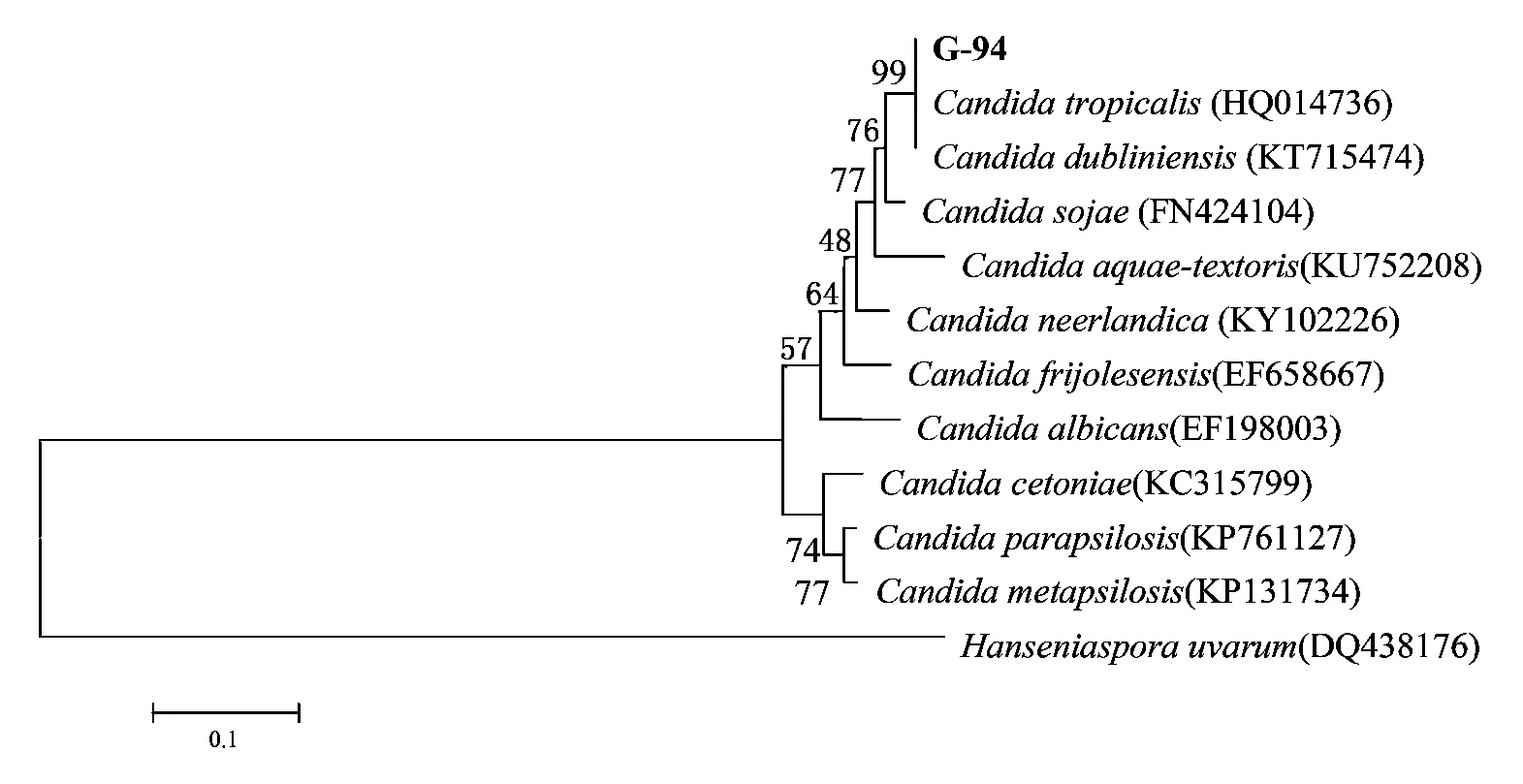
图5 G-94菌株系统发育树
3 结论
从石油污染土壤中筛选获得2株菌,经菌落、菌体形态观察、生理生化检测及分子生物学进行初步鉴定,确定G-40为侧孢芽孢杆菌,G-94为热带假丝酵母菌。
G-40和G-94在35℃、pH7.0、油浓度2%、盐浓度0.5%、150r/min的条件下石油降解率分别为21.59%和37.03%,两者之间具有显著性差异。
[1]詹亚斌,马立安.生物修复石油污染土壤研究进展[J].长江大学学报(自科版),2016,13(33):52~56.
[2] 涂书新,韦朝阳.我国生物修复技术的现状与展望[J].地理科学进展,2004,23(6):20~23.
[3] 范俊,沈树宝,杨维本,等.高效符合生态链微生物菌群处理污水的研究:城市综合污水的处理[J].南京工业大学学报(自然科学版),2003,25(4):10~13.
[4] 陈晓,王丹丹,李栋芸,等.生物絮凝剂产生菌的培养条件优化及其应用[J].南京工业大学学报(自然科学版),2009,31(2):20~24.
[5] 詹亚斌,张桥,陈凯伦,等.石油降解菌群的筛选、构建及其降解特性研究[J].环境污染与防治,2017,39(8):860~864,868.
[6] 赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[7] 姜晓宇.绿肥轮作水稻种子内生菌多样性及土壤微生物数量研究[D].哈尔滨:东北农业大学,2013.
[8] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucl Acid Res, 1980, 8: 4321~4326.
2017-06-23
詹亚斌(1991-),男,硕士生,研究方向为环境微生物。通信作者:江涛,jiangtao@yangtzeu.edu.cn。
[引著格式]詹亚斌,马立安,陶兴玲,等.2株石油降解菌的分离鉴定[J].长江大学学报(自科版),2017,14(18):61~64.
TE991;Q939.99
A
1673-1409(2017)18-0061-04
[编辑] 余文斌
