外施γ-聚谷氨酸对蚜虫胁迫辣椒叶片叶绿素和两种氧化还原酶的分析
2017-11-10巩雪峰闫志英宋占锋李跃建张丹琴秦睆雪苗明军
巩雪峰 闫志英 宋占锋* 李跃建 张丹琴 秦睆雪 苗明军 罗 旭
(1.四川省农业科学院园艺研究所, 成都 610066; 2.中国科学院成都生物研究所, 成都610041; 3.四川省农业科学院, 成都 610066; 4.四川农业大学园艺学院, 成都 611130)
外施γ-聚谷氨酸对蚜虫胁迫辣椒叶片叶绿素和两种氧化还原酶的分析
巩雪峰1闫志英2宋占锋1*李跃建3张丹琴4秦睆雪4苗明军1罗 旭1
(1.四川省农业科学院园艺研究所, 成都 610066; 2.中国科学院成都生物研究所, 成都610041; 3.四川省农业科学院, 成都 610066; 4.四川农业大学园艺学院, 成都 611130)
为探索新型无公害抗蚜方法,测试了外源施入γ-聚谷氨酸高分子聚合物的盆栽辣椒植株叶片在蚜虫胁迫后叶绿素含量、过氧化物酶、过氧化氢酶活性的变化。外施γ-聚谷氨酸的植株叶片叶绿素a和b的含量在受胁迫后随时间增加其下降趋势较对照降低;过氧化物酶和过氧化氢酶在蚜虫胁迫期间的活性较对照高。表明了外施γ-聚谷氨酸的辣椒植株叶片能够缓解由蚜虫胁迫导致的叶绿素降低的趋势并增强过氧化物酶和过氧化氢酶活性。
辣椒;γ-聚谷氨酸;蚜虫胁迫;叶片;叶绿素;过氧化物酶;过氧化氢酶
引言
近年来,我国大部分辣椒种植区病虫害的发生有愈演愈烈的趋势。目前,辣椒病虫害的发生,受传统防治措施的限制,再加上规模化的种植因素,病虫的发生面积呈现规模化发展,并且不易受控。特别是蚜虫为害辣椒作物的现象发生严重。蚜虫不仅通过口器吸食叶片及茎尖汁液,直接导致植株的生理生化胁迫响应,对植物造成伤害,还传播病毒病,包括黄瓜花叶病毒和烟草花叶病毒等。为有效防治蚜虫,我国辣椒产区主要防治技术除了应用抗虫品种外,广泛采用化学药剂法,多使用高效低毒低残留农药,如吡虫啉、莫比朗乳油、氯虫·高氯氟、苦参碱、溴氰虫酰胺等[1]。然而,常规喷施农药的方法是在蚜虫发生时期对作物进行全株喷雾处理。虽然该方法能高效治蚜,但由于化学药剂为低毒并非无毒,在长久以来形成的过度不合理喷施农药的现状下,产生了不良的副作用,不仅杀伤蚜虫天敌,还致使蚜虫具有抗药性[2],同时造成环境污染,导致农药残留,影响辣椒果实质量和品质。随着国民生活水平的提高,市场上对辣椒的质量和品质需求都越来越高[3]。虽然辣椒是我国栽培面积最大的蔬菜作物之一,其种植面积和产量都已跃居世界第一[4],但是作为世界产椒大国,辣椒单位面积产量相对发达国家处于较低的水平,质量和品质在对外出口贸易、国际市场开拓上并不占优势。因此,在辣椒生产中迫切需要更加有效、安全、无毒、无公害的防治措施来取代或辅助化学药剂防治。
国内外科学工作者在探索蚜虫的新型防控技术研究中已取得了大量的研究进展,对蚜虫的防治,提出以生态高效、可持续性的综合防治为理念;以利用天敌防治(瓢虫、寄生蜂等)、昆虫激素(反-β-法尼烯 EβF)、微生物农药开发(蚜虫病原性微生物)、植物源杀虫剂及昆虫生长调节剂等为防控方法[5-6]。为获得更有效和无公害的辣椒抗蚜防控方法,笔者首次引用了一种新型微生物有机材料—γ-聚谷氨酸。γ-聚谷氨酸或多聚谷氨酸(γ-PGA,全称γ-poly glutamic acid)是自然界微生物菌株产生的一种水溶性的高分子氨基聚合物,对人体和生态环境无毒且可降解。目前,γ-PGA已广泛应用在食品工业、化妆品、医药保健、水处理以及水凝胶等领域。在农业领域,近年来γ-PGA也受到了研究者的广泛关注,农业中所应用的γ-PGA是由谷氨酸作为合成底物,通过芽孢杆菌属(Bacillus)微生物发酵而获得[7]。该微生物材料对作物生长、发育及抗性等方面的作用研究报道也越来越多:γ-PGA在粮油作物如小麦、油菜、玉米及甜椒作物中均有研究及应用的报道,研究发现γ-PGA提高了小麦产量[8];增加了玉米幼苗的生物量和根系活力[9];增强了植物对病害的抗性[10],以及对盐胁迫[11]、冷胁迫[12]等逆境下的抗逆作用。本研究以前人对增产、多抗型微生物高分子聚合物—γ-PGA的基础研究为科学依据,通过外施γ-PGA分析蚜虫为害辣椒作物的叶片光合生理及酶活的胁迫响应反应。
1 材料与方法
1.1 供试材料及生长条件
该试验在四川省农业科学院园艺研究所辣椒课题组室内温室培养间中进行,平均温度为25℃、相对湿度60%,光照采用T5全光谱荧光灯(上海,鼎铎)为光源。以四川省农科院园艺所育成品种川腾6号(Capsicum annuum L.)为供试材料。种子通过暗期,28℃催芽,待根长至2~ 3 cm后移至改良Hoagland’s营养液试管(10 mL)中,待辣椒苗长至4叶1心时移至高温灭菌后的土壤基质(珍珠岩:腐殖土质量比为1∶4)中种植,每盆盆土经称量,使质量保持一致。盆栽辣椒也用改良Hoagland’s营养液浇灌,其含量为 0.625 mM KNO3、1 mM Ca(NO3)2·4H2O、0.5 mM MgSO4·7 H2O、1 mM KH2PO4、1 mM NH4NO3、1 μM Fe·NaEDTA(pH 值 5.5)、3.5 μM MnCl2·4H2O、0.125 μM CuSO4·5 H2O、0.25 μM ZnSO4·7 H2O、17.5 μM H3BO3、0.05 μM(NH4)2MoO4、0.0025 uM CoCl2·6 H2O,最后调节营养液pH值至6.0。
供试蚜虫品种为桃蚜Myzus persicae (Sulzer),也是四川本地为害辣椒的主要蚜虫种类之一。桃蚜材料从野外辣椒种植区采集而来,在温度为25℃、相对湿度80%条件下饲养,选取2龄若虫作为待接种蚜虫(图1 a)。
1.2 处理及取样
待辣椒苗进入成熟开花期后,将盆栽苗分为3个处理组,分别为对照、L-谷氨酸(阳性对照)、γ-PGA。每个处理4盆辣椒。用于外施处理的γ-PGA是由中科院成都生物研究所闫志英副研究员合成提供[7];以L-谷氨酸 (分析纯 AR) 为阳性对照,其原因是γ-PGA的合成底物为谷氨酸,另外,有研究报道表明外施L-谷氨酸对植物叶绿素及相关生理特性具有显著改善的作用[13]。外施L-谷氨酸和γ-PGA分别按0.1g/L混入营养液中,等量浇灌在盆栽底部托盘内,每两天一次,以利于辣椒植株根系对各外施处理的吸收。试验共设3次重复。
待外施处理进行10 d后,辣椒植株苗龄120 d,每株植株自顶部往下第2、3片完全展开叶上接种预处理的蚜虫30头,于接虫后10 d、20 d、30 d分别对叶片取样进行叶绿素分析;对过氧化物酶和过氧化氢酶的分析,其叶片组织的获取结点为接虫后10 d。以未接种蚜虫的对照处理、L-谷氨酸处理、γ-PGA处理的辣椒盆栽植株为蚜虫胁迫对照。
蚜虫胁迫的叶片及蚜虫的图片均采用扫描仪(BenQ,K802)扫描获得。
1.2 叶绿素的分析
选择各株辣椒苗同等部位长势一致的叶片进行标记,每株标记3个叶片,用6 mm打孔器分别对标记好的叶片进行打孔取样,获得的叶片组织转至10 mL离心管内并加1.5 mL甲醇。然后置于室温、黑暗中静置48 h,待叶绿素萃取完成。再将离心管内甲醇萃取液的200 μL移至96孔板上。用酶标仪分别在A665和A652下扫描分析吸光值,并以200 μL甲醇的吸光值作为萃取液的空白值。计算公式参照Ritchie[14]的方法:A652 = ( A652萃取液吸光值-A652空白吸光值)/0.58;A665 =( A665萃取液吸光值-A665空白吸光值)/0.58。叶绿素a、叶绿素b的计算公式如下,叶绿素a (μg/mL) = -8.0962×A652 + 16.5169×A665;叶绿素b(μg/mL) = 27.4405×A652 - 12.1688×A665, 其中,0.58为通径长度[14]。叶绿素(a或b)含量FW(mg/g)=浓度(μg/mL)×提取液总量(mL) / (样品鲜质量 g×1 000)。
1.3 过氧化物酶和过氧化氢酶的分析
选取各植株上层顶端第1片成熟叶片,液氮保存。称取0.5 g(精度为0.000 1 g)叶片组织,用刀片切碎后加入预冷的20%组织匀浆介质(0.01 mol/L Tris-HCl, 0.000 1 mol/L EDTA-2Na, 0.01 mol/L蔗糖, 0.8%NaCl pH值7.8),置于5mL高速组织匀浆机的玻璃杯中,用高速组织匀浆机获取组织匀浆液,转速为2 200 r/s。通过冷冻离心机在3 500 r、4℃下离心10 min,获取上清液。过氧化物酶POD(A084-3)和过氧化氢酶CAT(A007-1)的测定均采用南京建成的生物试剂盒,共重复3次。反应液通过酶标仪获取吸光值,并根据试剂盒提供的公式进行计算。
2 结果与分析
2.1 外施γ-PGA、L-谷氨酸减缓蚜虫胁迫导致叶绿素呈下降趋势
叶绿素含量是影响植物光合作用的内部因素之一,在一定范围内叶绿素含量与光合速率呈正比关系,植物光合速率随着叶绿素含量的增加而增加,下降而下降。蚜虫胁迫处理10 d后,辣椒叶片总叶绿素含量相对于未受胁迫的对照植株叶片降低了44.7%(图1c)。从未受胁迫的辣椒叶片(图1d)与受蚜虫胁迫10 d后辣椒叶片(图1e)的图片对比中,直观反映了蚜虫胁迫的辣椒植株叶片由于叶绿素下降而导致的失绿现象。
外施L-谷氨酸和γ-PGA处理的辣椒植株,其叶绿素a和叶绿素b的含量在受蚜虫胁迫前(0 d)均已高于常规对照辣椒植株叶片的叶绿素含量(图1f、图1g)。对照处理辣椒叶片叶绿素a和b在蚜虫胁迫10 d后分别降低了50.0%和10.3%,而外施γ- PGA处理叶绿素a含量仅降低了4.5%,叶绿素b含量降低了18.1%;外施L-谷氨酸处理的植株叶片叶绿素a含量降低了21.1%,叶绿素b含量降低了16.3%。外施γ- PGA处理的植株叶片叶绿素a含量在蚜虫胁迫30 d的变化趋势线位于图1 f中相对最高的位置。其次是L-谷氨酸,常规对照叶绿素a变化趋势最低。在蚜虫胁迫30 d的周期中,L-谷氨酸处理的叶绿素b含量在未受胁迫的0 d为最高,达1.261 mg/g,随着蚜虫胁迫的发生,叶绿素b的降速也不断加大。γ-PGA叶绿素含量受胁迫也出现降低的趋势。相对于两个对照,外施γ- PGA的辣椒植株叶片叶绿素b含量的降幅趋势变化最小。图1 h、图1 i直观地反映了蚜虫胁迫10 d后使用对照处理、γ-PGA处理、L-谷氨酸处理辣椒叶片叶色变化。
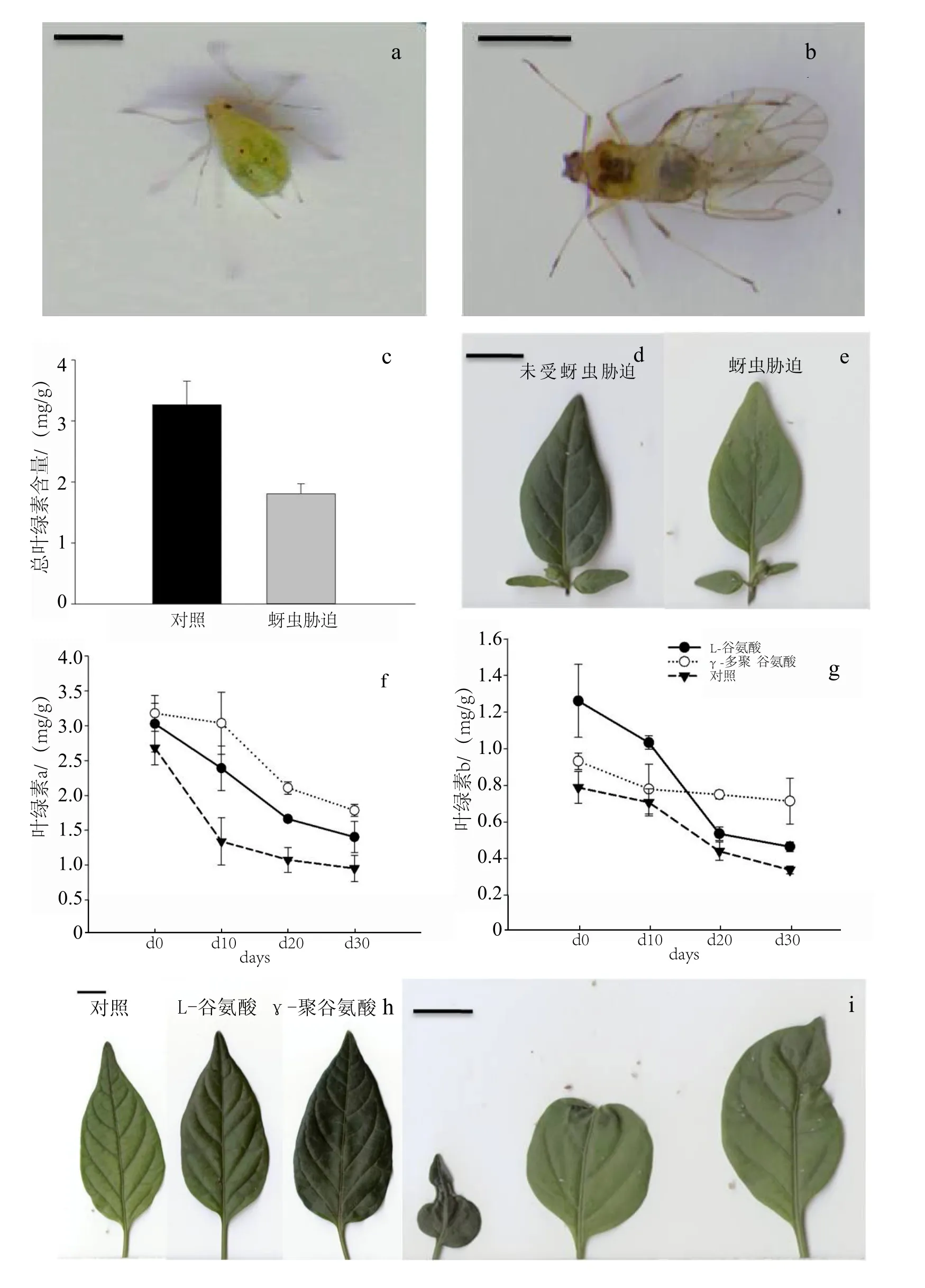
图1 外施γ-PGA的辣椒植株在蚜虫胁迫后叶绿素含量变化
2.2 辣椒叶片受蚜虫胁迫后过氧化氢酶和过氧化物酶活性的变化
对外施L-谷氨酸、γ-PGA以及对照处理的辣椒植株,受蚜虫胁迫后的叶片组织与未受蚜虫胁迫的这3个外施处理的叶片组织中的过氧化氢酶活性进行测定,结果发现在受蚜虫胁迫10 d后,外施γ-PGA、L-谷氨酸处理以及对照处理的辣椒叶片组织中过氧化氢酶的活性都较胁迫前高,分别升高了39.4%、14.2%以及36.4%(图2 a)。γ-PGA在蚜虫胁迫10 d后过氧化氢酶酶活性为最高,达11.711 U/mg prot。过氧化物酶的活性在蚜虫胁迫10 d后,外施γ-PGA、L-谷氨酸以及对照处理组的辣椒叶片组织较蚜虫胁迫前分别提高了2.9%、8.3%和 7.1%(图 2 b)。图2 a,b还揭示了外施γ-PGA、L-谷氨酸在受蚜虫胁迫前,在未受任何胁迫时,叶片中过氧化物酶和过氧化氢酶活性均高于对照处理。

图2 a.外施γ-PGA的辣椒植株在蚜虫胁迫后叶片过氧化氢酶和 b.过氧化物酶活性的变化
3 结论与讨论
叶片是植物进行光合作用的主要部位,而叶绿体是光合作用的重要器官。蚜虫通常能对寄主植物叶片造成深刻的伤害,不仅导致叶片畸形及虫瘿的形成(图1i)[15],而且对蚜虫取食的幼嫩叶片组织超微结构造成影响,抑制叶绿体等细胞器的发育[16]。因此推断,辣椒叶片叶绿素含量在受到蚜虫胁迫10 d后降低,可能是由于叶绿体在细胞内的合成受抑制而造成的。当植物在逆境胁迫下会导致其活性氧ROS和抗氧化系统间稳态平衡的破坏,ROS在植物细胞内的大量积累。而植物组织为了恢复这种稳态平衡,防止活性氧积累到高浓度造成毒害作用,需清除过量的ROS,抗氧化酶如CAT、POD等活性水平随之提高[17]。因此推断,本研究发现蚜虫胁迫造成辣椒叶片CAT、POD活性升高的结果是由于ROS在植物组织中的过量积累,是植物自身对逆境的一种适应性反应。Argandoña等[18]于2001年在蚜虫对大麦的胁迫研究结果中也表明,在接种蚜虫后植物组织的过氧化物酶活性有所升高,与本研究结果具有一致性。
通过对成熟期辣椒植株外施γ-PGA,受蚜虫胁迫后的叶片叶绿素变化的研究结果表明,外施γ-PGA的植株叶绿素a和b的含量在受胁迫期间其下降趋势较对照降低,揭示了外施γ-PGA能提高叶绿素含量。与本研究结果具有相似性的是孙忠刚在2012年研究γ-PGA对小白菜的生长与光合作用中发现,γ-PGA显著提高了小白菜叶片叶绿素含量[19]。本研究结果还表明,外施γ-PGA的植株无论过氧化氢酶和过氧化物酶活性在接种蚜虫后的上升幅度的大与小,其蚜虫胁迫前与后POD和CAT活性都有升高。与本文结果相似的是Lei等[12]在2015年研究γ-PGA对作物冷害胁迫和郝荣华等[20]在研究γ-PGA对绿豆萌发及幼苗的影响中发现,外施γ-PGA的植物组织中过氧化氢酶和过氧化物酶的活性都有明显的增强。
前人研究报道已指出抗蚜虫的品种在受到蚜虫胁迫后均表现出了相对较高的叶绿素含量[21];抗蚜虫的品种在受胁迫后氧化还原酶如过氧化物酶等有明显增高[22]。本研究通过外施γ-PGA的方法,提高了叶片中叶绿素的含量,增加了抗氧化物酶POD和CAT的活性,通过这两个重要的抗性指标说明在一定程度上外施γ-PGA处理提高了辣椒植株的抗蚜性。
[1]胡彬, 王晓青, 梁铁双. 辣椒主要病虫害化学防治技术[J]. 中国蔬菜, 2017(4): 87-92
[2]汤秋玲, 马康生, 高希武. 蔬菜蚜虫抗药性现状及抗性治理策略[J]. 植物保护, 2016, 42(6): 11-20
[3]耿三省, 陈斌, 张晓芬,杜和山. 我国辣椒品种市场需求变化趋势及育种对策[J]. 中国蔬菜, 2015, 1(3): 1-5
[4]FAO. FAO statistical database[EB/OL]. http://faostat3.fao.org/browse/Q/QC/E, 2013
[5]武宇鹏, 李友莲. 蚜虫防治技术与研究应用新进展[J].山西农业科学, 2003, 31(2):64-68
[6]范佳, 刘勇, 曾建国, 郭梅, 孙京瑞, 程辟, 陈巨莲. 小麦与蔬菜蚜虫新型防控技术研究进展[J]. 应用昆虫学报, 2014, 51(6): 1413-1434
[7]闫志英, 袁月祥, 许力山, 李志东, 代玉梅, 李东, 廖银章, 刘晓风. γ-聚谷氨酸产生菌及生产γ-聚谷氨酸有机肥的方法: CN105420169A[P]. 2016
[8]Xu Z, Wan C, Xu X, Feng X, Xu H. Effect of poly(γ-glutamic acid) on wheat productivity, nitrogen use ef fi ciency and soil microbes[J]. Journal of Soil Science &Plant Nutrition, 2013, 13(3): 744-755
[9]尹成红, 雍晓雨, 冉炜, 杨兴明, 沈其荣. 产γ-聚谷氨酸菌株的筛选及其对玉米幼苗生长的影响[J]. 南京农业大学学报, 2011, 34(2):91-96
[10]Ho G H, Yang J, Yang T H. Method for enhancing the growth of crops, plants, or seeds, and soil renovation: US,EP1886562[P]. 2008
[11]Lei P, Xu Z, Liang J, Luo X, Zhang Y, Feng X, Xu H.Poly(γ-glutamic acid) enhanced tolerance to salt stress by promoting proline accumulation in Brassica napus L.[J].Plant Growth Regulation, 2016, 78(2):1-9
[12]Lei P, Xu Z, Ding Y, Tang B, Zhang Y, Li H, Feng X, Xu H. Effect of poly(γ-glutamic acid) on the physiological responses and calcium signaling of rape seedlings (Brassica napus L.) under cold stress[J]. Journal of Agricultural &Food Chemistry, 2015, 63(48): 10399
[13]阎青云. 新型植物生长调节剂L-谷氨酸对荔枝的生理效应[D]. 武汉:华中农业大学, 2006
[14]Ritchie R J. Consistent sets of spectrophotometric chlorophyll equations for acetone, methanol and ethanol solvents[J]. Photosynthesis Research, 2006, 89(1):27-41
[15]Goggin F L. Plant-aphid interactions: molecular and ecological perspectives[J]. Current Opinion in Plant Biology, 2007, 10(4): 399-408
[16]刘林. 蚜虫取食对杏叶片细胞分化、果枝节间伸长和花芽形成量的影响[J]. 园艺学报, 2012, 39(4): 749-756
[17]简令成, 王红. 逆境植物细胞生物学[M]. 北京:科学出版社, 2009: 265-269
[18]Argandoña V H, Chaman M, Cardemil L, Muñoz O, Zuñiga E, Corcuera L J. Ethylene production and peroxidase activity in aphid-infested barley[J]. Journal of Chemical Ecology, 2001, 27(1): 53-68
[19]孙刚忠, 谭启玲, 胡承孝,陈守文, 郑苍松, 孙学成.聚-γ-谷氨酸对小白菜生长和光合作用的影响[J]. 华中农业大学学报(自然科学版), 2012, 31(2): 216-219
[20]郝荣华, 张晓元, 刘飞, 朱希强, 凌沛学, 王桂兰. 不同分子量γ-聚谷氨酸对绿豆萌发及幼苗的影响[J]. 江苏农业科学, 2016, 44(6): 169-171
[21]朱永峰, 陈明, 刘长仲. 蚜虫为害对五个燕麦品种苗期体内几种物质的影响[J]. 植物保护, 2011, 37(2): 55-58
[22]陈青, 张银东. 3种氧化酶与辣椒抗蚜性的相关性[J].热带作物学报, 2004, 25(3): 42-46
Analysis of Chlorophyll and Two Kinds of Oxidoreductase in Hot Pepper Leaves under Aphid Stress by Application of γ-PGA
GONG Xuefeng1YAN Zhiying2SONG Zhanfeng1*LI Yuejian3ZHANG Danqin4QIN Huanxue4MIAO Mingjun1LUO Xu1
(1.Horticulture Research Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China;2. Chengdu Institute of Biology, Chinese Academy of Sciences, Chengdu 610041, China;3. Sichuan Academy of Agricultural Sciences, Chengdu 610066, China; 4. College of Horticulture,Sichuan Agricultural University, Chengdu 611130, China)
In order to explore new pollution-free aphid control methods, the changes of chlorophyll content,peroxidase and catalase activities in the leaves with the application of γ-PGA (a polymer material) on potted hot pepper plants under aphid stress were tested in this study. It was shown that, with the time of aphid stress extending, the downtrends of chlorophyll a and b contents in γ-PGA treated pepper leaves were decreased compared with the non γ-PGA treatment control. The peroxidase and catalase activities in the γ-PGA treated pepper leaves during aphid stress were higher than in the non γ-PGA treatment control. The pepper plant leaves in the γ-PGA treatment could alleviate the trend of chlorophyll decrease caused by aphid stress and increase peroxidase and catalase activities.
hot pepper; γ-PGA; aphid stress; leaf; chlorophyll; peroxidase; catalase
2017-08-09
四川省农作物育种攻关项目“突破性蔬菜育种材料与方法创新”(2016NYZ0033);四川省财政创新能力提升工程专项资金(2016YPZ-023);青年基金项目(2016QNJJ-026)
巩雪峰(1983-),女,博士,助理研究员,主要从事辣椒环境胁迫育种研究;E-mail:xuefenggong@qq.com
*通信作者:宋占锋,男,副研究员,主要从事辣椒遗传育种研究;E-mail:289544274@qq.com
