靶向调控皮肤恶性黑素瘤潜在致病基因CCL18的miRNA预测及表达相关性分析
2017-11-07宋昊布文博倪娜娜温斯健熊竞舒戚金亮徐秀莲孙建方
宋昊 布文博 倪娜娜 温斯健 熊竞舒 戚金亮 徐秀莲 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(宋昊、倪娜娜、温斯健、熊竞舒、徐秀莲、孙建方),皮肤外科(布文博);南京大学生命科学学院 医药生物技术国家重点实验室(戚金亮)
靶向调控皮肤恶性黑素瘤潜在致病基因CCL18的miRNA预测及表达相关性分析
宋昊 布文博 倪娜娜 温斯健 熊竞舒 戚金亮 徐秀莲 孙建方
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所病理科(宋昊、倪娜娜、温斯健、熊竞舒、徐秀莲、孙建方),皮肤外科(布文博);南京大学生命科学学院 医药生物技术国家重点实验室(戚金亮)
目的探讨靶向调控皮肤恶性黑素瘤潜在致病基因CCL18的miRNA。方法 用miRanda和TargetScan在线软件进行生物信息学分析,预测靶向调控CCL18基因的miRNA。根据人基因序列分析构建CCL18基因3′UTR双荧光素酶报告载体及miRNA载体,共转染293T细胞48 h后裂解细胞并检测荧光素酶活性。其中,CCL18基因3′UTR双荧光素酶报告载体分3′UTR突变型组、3′UTR野生型组和空白对照组,miRNA载体携带筛选的miRNA。应用实时荧光定量PCR检测14例黑素瘤新鲜组织及瘤旁正常皮肤组织(对照)中CCL18和筛选miRNA的表达,并对其相关性进行分析。结果在线软件分析显示,CCL18⁃3′UTR具有miR⁃183、miR⁃128、miR⁃33a等miRNA的作用靶点。成功构建荧光素酶报告载体及miRNA载体,荧光素酶活性检测显示,miR⁃183、miR⁃128的3′UTR突变型组荧光素酶表达量(11.63±0.42;8.80±0.49)明显高于3′UTR野生型组(4.86±0.39;5.01±0.54)及空白对照组(2.41±0.13;2.39±0.05),差异有统计学意义(均P<0.01),而miR⁃33a的3′UTR突变型组荧光素酶表达量与3′UTR野生型组差异无统计学意义(6.41±0.47比6.16±0.22,P>0.05)。实时荧光定量PCR显示,14例黑素瘤肿瘤组织中CCL18基因的相对表达量(3.52±1.68)高于对照组织,而miR⁃183(0.49 ± 0.32)、miR⁃128(0.30 ± 0.20)、miR⁃33a(0.46 ± 0.40)的相对表达量均低于对照组织。CCL18表达水平与miR⁃128表达水平呈负相关(rs= ⁃0.548,P< 0.05),而与miR⁃183、miR⁃33a表达水平无相关性(P>0.05)。结论miR⁃128可能参与调控皮肤恶性黑素瘤潜在致病基因CCL18。
黑色素瘤;微RNAs;RNA,小分子干扰;趋化因子CCL18
皮肤恶性黑素瘤(MM)的发展与转移是肿瘤细胞与肿瘤浸润微环境通过细胞因子等分子信号相互作用的结果,肿瘤浸润微环境中的关键分子对肿瘤的诊断和靶向治疗具有重要意义[1]。CCL18是一种半胱氨酸残基⁃半胱氨酸残基型(CC)趋化性细胞因子,参与多种炎症和肿瘤的发病过程[2]。Chen等、Wang等、Lane等研究发现[3⁃5],CCL18在乳腺癌及卵巢癌中均表达升高,促进肿瘤侵袭转移,并与预后不良有关。本课题组辛崇美等[6]通过细胞学研究发现,CCL18促进A375黑素瘤细胞株侵袭,并促进肿瘤血管生成。进一步研究显示[7],CCL18在MM组织中表达升高,并与肿瘤厚度、转移呈正相关,表明CCL18在MM中具有促进肿瘤侵袭及转移的“促癌”作用。miRNA可通过与靶基因的mRNA⁃3′UTR结合调控基因的表达,多种miRNA参与调控黑素瘤的发生发展[8]。为发掘可能调控CCL18基因的miRNA分子,本研究通过生物信息学方法预测可能的miRNA,应用双荧光素酶报告基因筛选鉴定,并检测其在MM中的表达。
材料和方法
一、试剂与材料
1.主要试剂:高糖型DMEM培养基、胎牛血清、胰酶(美国Gibco公司),pMD18⁃T载体(日本Takara公司),T4 DNA连接酶(美国NEB公司),限制性内切酶XbaⅠ(美国MBI公司),DNA聚合酶、pGL3⁃promoter载体、Trizol试剂、miRNA载体包装系统(BLOCK⁃iT™ PolⅡmiR RNAi表达载体试剂盒)、设计合成寡聚单链(oligo)DNA和包装质粒(美国Invitrogen公司),双荧光素酶报告检测系统(美国Promega公司),Revert Aid First Strand cDNA Synthesis反转录试剂盒(美国Thermo Fisher Scientific公司),SYBR Green实时PCR试剂盒(南京诺唯赞生物科技有限公司),引物由生工生物工程(上海)股份有限公司合成。
2.实验标本与细胞:收集2013—2014年在中国医学科学院皮肤病医院经临床、组织病理学及免疫组化确诊并手术扩大切除的14例(男9例,女5例)MM肿瘤组织,其瘤旁正常皮肤组织作为对照。同时,收集患者临床和病理学资料,包括年龄、性别、部位、大小、有无溃疡及淋巴结转移、Breslow厚度、Clark分级和AJCC分期等,14例均为原发性黑素瘤。大肠杆菌感受态细胞DH5α为美国Invitrogen公司产品,293T细胞株由美国Life公司保存。
二、方法
1.靶向调控CCL18基因3′UTR的miRNA预测:利 用 miRanda(http://www.microrna.org/microrna/home.do)、Target Scan(http://www.targetscan.org/vert_71/)在线软件预测可能调控人CCL18 mRNA的靶miRNA。结合其热力学稳定性(mirSVR score)和保守性(Phast Cons score)等参数,筛选相关分数较高的miRNA(miR⁃183、miR⁃128和miR⁃33a)。
2.全基因合成及CCL18基因3′UTR双荧光素酶报告载体构建:根据基因库检索人CCL18 mRNA序列,设计分别针对miR⁃183、miR⁃128、miR⁃33a结合位点的CCL18⁃3′UTR突变序列。根据基因序列分析的结果,分别进行单链oligo的设计及合成,序列见表1。用PCR将合成的oligo拼接成完整的基因序列,将合成好的序列装入pMD18⁃T载体并转化至感受态细胞DH5α,测序验证重组克隆中插入序列与要求一致。基因合成质粒,用XbaⅠ分别将TA克隆质粒及pGL3⁃promoter质粒进行酶切,电泳并回收目的片段及载体片段,用T4 DNA连接酶连接回收的片段与载体,取10 μl连接产物转化感受态细胞DH5α,并对单克隆进行测序验证。

表1 针对各miRNA的CCL18⁃3′UTR突变序列
3.miRNA载体构建:根据miR ⁃183、miR⁃128、miR⁃33a成熟体序列,分别设计miRNA的表达序列并合成3对互补oligo DNA,序列见表2。将3对合成好的寡聚单链DNA用ddH2O溶解,互补单链混合后分别按一定体系进行退火、连接及转化感受态细胞DH5α。序列亚克隆到pcDNA6.2™⁃GW⁃miR载体中,测序验证。

表2 各miRNA载体中插入的oligo DNA序列
4.质粒共转染293T细胞:用胰酶消化293T细胞后,以5×105个细胞/孔接种于6孔培养板中。在细胞覆盖率90%左右时,以1∶3加入质粒pGL3⁃promoter和 pcDNA6.2⁃GW/miR,同 时 加 入lipofectamine 2000稀释液进行瞬时共转染。4~6 h后更换完全培养液继续培养至48 h。实验分为3′UTR突变型组、3′UTR野生型组和空白对照组:①3′UTR突变型组:pGL3⁃promoter载体含针对特定miRNA结合位点突变的CCL18⁃3′UTR序列;②3′UTR野生型组:pGL3⁃promoter载体含野生型CCL18⁃3′UTR序列;③空白对照组:空白pGL3⁃promoter载体。每组设3个复孔。miR⁃183、miR⁃128、miR⁃33a分别进行独立实验。
5.荧光素酶活性检测:收集转染48 h的293T细胞,每孔加入600 μl细胞裂解液,室温摇动裂解15 min。将裂解液移至离心管,12 000 r/min(离心半径10 cm)离心30 s,留取上清液。测量皿中加入100 μl荧光素酶检测试剂Ⅱ;加入20 μl细胞裂解液,用移液器混匀,置分光光度计读数值,记录数据;加入100 μl终止试剂,混匀,读值并记录数据,计算相对荧光强度。
6.实时荧光定量PCR检测CCL18及3种miRNA的表达情况:分别收集14例MM肿瘤组织及正常对照皮肤新鲜组织标本,Trizol法提取组织总RNA,使用Revert Aid First Strand cDNA Synthesis反转录试剂盒按照标准实验流程将总RNA反转录成cDNA,使用SYBR Green Real⁃time PCR试剂盒按其说明书扩增目的基因。反应体系如下:cDNA引物1 μl,上下游引物各0.4 μl,SYBR Green Mix 10 μl及去离子水8.2 μl,引物序列见表3。反应条件:95℃5 min;95 ℃ 10 s;60 ℃ 30 s,40个循环;95 ℃ 15 s,60℃1 min,95℃15 s。根据所得的Ct值,以3磷酸甘油醛脱氢酶(GAPDH)或U6为内参照,△Ct=(待测基因Ct-内参基因Ct),△△Ct=肿瘤组织△Ct-对照正常皮肤组织△Ct,计算2-△△Ct,得到肿瘤组织样品待测基因相对于正常皮肤组织的相对表达量。
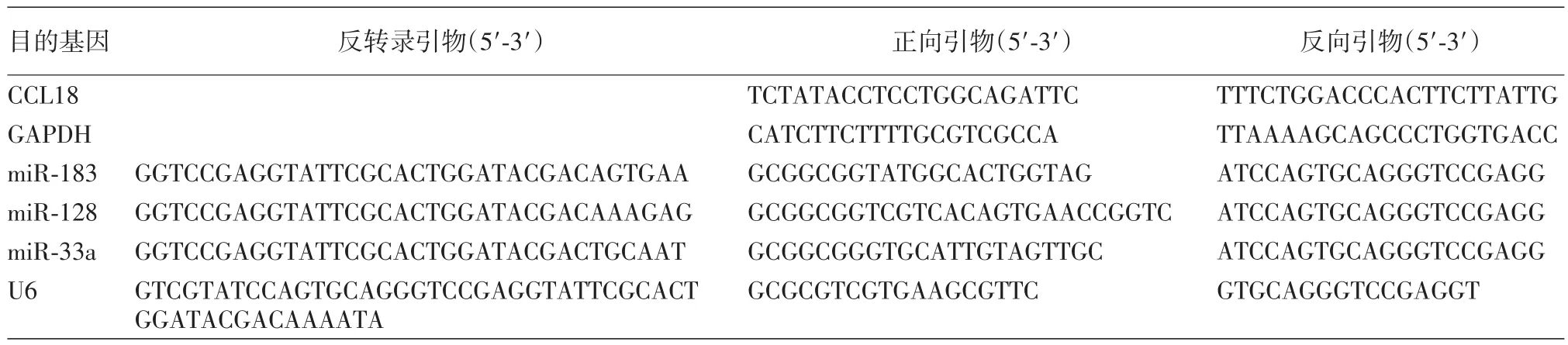
表3 待测基因及内参照的引物序列
7.统计学方法:用SPSS19.0统计软件,计量资料以±s表示,多组间比较采用单因素方差分析,多重比较采用LSD检验,相关性分析采用Spearman相关检验,P<0.05为差异有统计学意义。
结 果
一、靶向调控CCL18基因3′UTR的miRNA预测
根据miRanda和TargetScan对CCL18 mRNA⁃miRNA在线预测结果进行整合分析,CCL18基因(NM_002988,439 bp)的3′UTR 具有多条可能的miRNA靶向序列,其中mirSVR score和PhastCons score均较高的为miR⁃183、miR⁃128、miR⁃33a,并作为后续通过荧光素酶报告系统研究其结合特性的目标miRNAs。各miRNA与CCL18 3′UTR的序列示意图见图1。

图1 CCL18 3′UTR和miR⁃183、miR⁃128、miR⁃33a序列结合示意图 mirSVR score:热力学稳定性;PhastCons score:保守性
二、不同miRNA与CCL18 3′UTR结合的荧光素酶活性检测
miR⁃183(3组相对荧光强度:11.63± 0.42,4.86±0.39,2.41 ± 0.13)、miR⁃128(8.80 ± 0.49,5.01 ± 0.54,2.39 ± 0.05)、miR⁃33a(6.41 ± 0.47,6.16 ± 0.22,2.65 ±0.10)的3′UTR突变型、3′UTR野生型组及空白对照组间荧光素酶表达量差异均有统计学意义(F值分别为394.94、117.90、94.33,均P< 0.001)。两两多重比较显示,miR⁃183和miR⁃128的3′UTR突变型组荧光素酶表达量均显著高于3′UTR野生型组及空白对照组(均P<0.05),而miR⁃33a的3′UTR突变型和3′UTR野生型组荧光素酶表达量差异无统计学意义(P> 0.05)。
三、MM中CCL18 mRNA和不同miRNA的表达及相关性
14例MM患者的临床和病理学资料见表4。14例MM组织标本中CCL18 mRNA的表达高于正常对照皮肤组织,相对表达量为3.52±1.68。miR⁃183、miR⁃128、miR⁃33a
的表达均低于对照正常皮肤组织,相对表达量分别为0.49±0.32、0.30±0.20、0.46±0.40。经Spearman相关性分析,14例MM组织中CCL18 mRNA表达量与miR⁃128表
达量呈负相关(相关系数rs=-0.548,P< 0.05),而与miR⁃183、miR⁃33a表达量相关性均无统计学意义(rs分别为-0.367、-0.185,均P>0.05)。

表4 14例CMM患者的临床及病理学资料
讨 论
CCL18是一种主要由单核巨噬细胞及树突细胞产生的趋化性细胞因子,在乳腺癌、卵巢癌、皮肤T细胞淋巴瘤等多种肿瘤中发挥促进肿瘤细胞侵袭及转移的重要作用,并成为疾病诊断、预后判断及治疗的潜在靶点[2]。本课题组通过人类全基因组表达谱芯片首次发现CCL18基因在MM中表达显著升高,并通过组织学及细胞学研究证实CCL18促进肿瘤侵袭、转移,是MM潜在致病基因之一[6⁃7]。然而,肿瘤中CCL18基因的调控机制尚未明确,未确定其拮抗性受体。Wang等[9]发现,乳腺癌中上调miR⁃181b能抑制CCL18诱导的肿瘤细胞侵袭和转移,miR⁃181b可能通过下调NF⁃κB的表达发挥作用。此外,上调let7a也可逆转CCL18诱导的肿瘤细胞增殖和侵袭,let7a可能通过作用于靶基因Lin28 3′UTR发挥作用[10]。
miRNA是一类长度为20~22个核苷酸的非编码小RNA分子,通过调节靶基因的表达在多种肿瘤的发生发展中发挥作用。研究发现,在黑素瘤中miRNA主要作为癌基因或抑癌基因来调节黑素细胞及黑素瘤细胞的生物学行为、调节肿瘤免疫反应、影响黑素瘤细胞增殖及凋亡、迁移及侵袭、表观遗传等,如miR⁃211、miR⁃196a、miR⁃210、let⁃7b、miR⁃182、miR⁃205、miR⁃182、miR⁃29c等[11⁃13]。miRNA可通过与靶基因mRNA的3′UTR结合调节某些关键基因的表达,从而影响肿瘤的发生发展。Alderman等[14]发现,miR⁃15a直接靶向作用于细胞分裂周期相关蛋白4(CDCA4)基因抑制黑素瘤生长及侵袭。Xu等[15]发现,miR⁃9通过靶向作用于神经纤毛蛋白1(NRP1)基因发挥抑制黑素瘤细胞生长、迁移和侵袭的作用。Hao等[16]发现,miR⁃137靶向作用于p21激活激酶2(PAK2)抑制黑素瘤细胞增殖。
我们用生物信息学预测、双荧光素酶报告基因检测验证及在转录水平对MM组织中CCL18 mRNA与miRNA进行表达分析,发现miR⁃128能够靶向作用人MM组织中CCL18基因的3′UTR,并与CCL18表达具有显著的负相关,提示黑素瘤中miR⁃128可能通过参与调控CCL18的表达,进而调控肿瘤的发生发展。
[1]Villanueva J,Herlyn M.Melanoma and the tumor microenviron⁃ment[J].Curr Oncol Rep,2008,10(5):439⁃446.
[2]Schutyser E,Richmond A,Van Damme J.Involvement of CC chemokine ligand 18(CCL18) in normal and pathological processes[J].J Leukoc Biol,2005,78(1):14⁃26.DOI:10.1189/jlb.1204712.
[3]Chen J,Yao Y,Gong C,et al.CCL18 from tumor⁃associated macrophages promotes breast cancer metastasis via PITPNM3[J].Cancer Cell,2011,19(4):541⁃555.DOI:10.1016/j.ccr.2011.02.006.
[4]Wang Q,Tang Y,Yu H,et al.CCL18 from tumor⁃cells promotes epithelial ovarian cancer metastasis via mTOR signaling pathway[J].Mol Carcinog,2016,55(11):1688⁃1699.DOI:10.1002/mc.22419.
[5]Lane D,Matte I,Laplante C,et al.CCL18 from ascites promotesovarian cancer cell migration through proline⁃rich tyrosine kinase 2 signaling[J].Mol Cancer,2016,15(1):58.DOI:10.1186/s12943⁃016⁃0542⁃2.
[6]辛崇美,李光,孙建方,等.CCL18趋化性细胞因子对A375黑素瘤细胞株增殖和侵袭的影响[J].中华皮肤科杂志,2010,43(12):833⁃836.
[7]宋昊,王白鹤,邵雪宝,等.CCL18在恶性黑素瘤中的表达及其与血管内皮生长因子、Ki67表达的相关性研究[J].中华皮肤科杂志,2016,49(10):688⁃691.DOI:10.3760/cma.j.issn.0412⁃4030.2016.10.002.
[8]Mannavola F,Tucci M,Felici C,et al.miRNAs in melanoma:a defined role in tumor progression and metastasis[J].Expert Rev Clin Immunol,2016,12(1):79⁃89.DOI:10.1586/1744666X.2016.1100965.
[9]Wang L,Wang YX,Chen LP,et al.Upregulation of microRNA⁃181b inhibits CCL18⁃induced breast cancer cell metastasis and invasion via the NF⁃κB signaling pathway[J].Oncol Lett,2016,12(6):4411⁃4418.DOI:10.3892/ol.2016.5230.
[10]Wang L,Wang YX,Zhang DZ,et al.Let⁃7a mimic attenuates CCL18 induced breast cancer cell metastasis through Lin 28 pathway[J].Biomed Pharmacother,2016,78:301 ⁃307.DOI:10.1016/j.biopha.2016.01.028.
[11]Aftab MN,Dinger ME,Perera RJ.The role of microRNAs and long non⁃coding RNAs in the pathology,diagnosis,and management of melanoma[J].Arch Biochem Biophys,2014,563:60⁃70.DOI:10.1016/j.abb.2014.07.022.
[12]Sun V,Zhou WB,Majid S,et al.MicroRNA⁃mediated regulation of melanoma[J].Br J Dermatol,2014,171(2):234 ⁃241.DOI:10.1111/bjd.12989.
[13]Luo C,Weber CE,Osen W,et al.The role of microRNAs in melanoma[J].Eur J Cell Biol,2014,93(1⁃2):11⁃22.DOI:10.1016/j.ejcb.2014.02.001.
[14]Alderman C,Sehlaoui A,Xiao Z,et al.MicroRNA⁃15a inhibits the growth and invasiveness of malignant melanoma and directly targets on CDCA4 gene[J].Tumour Biol,2016,37(10):13941⁃13950.DOI:10.1007/s13277⁃016⁃5271⁃z.
[15]Xu D,Chen X,He Q,et al.MicroRNA⁃9 suppresses the growth,migration,and invasion of malignant melanoma cells via targeting NRP1[J].Onco Targets Ther,2016,9:7047⁃7057.DOI:10.2147/OTT.S107235.
[16]Hao S,Luo C,Abukiwan A,et al.miR⁃137 inhibits proliferation of melanoma cells by targeting PAK2[J].Exp Dermatol,2015,24(12):947⁃952.DOI:10.1111/exd.12812.
Prediction of miRNA regulating the potential cancer⁃promoting gene CCL18 in cutaneous malig⁃nant melanoma and correlation analysis between CCL18 mRNA and miRNA expression
Song Hao,Bu Wenbo,Ni Nana,Wen Sijian,Xiong Jingshu,Qi Jinliang,Xu Xiulian,Sun Jianfang
Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Song H,Ni NN,Wen SJ,Xiong JS,Xu XL,Sun JF);Department of Dermatologic Surgery,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Bu WB);State Key Laboratory of Pharmaceutical Biotechnology,School of Life Sciences,Nanjing University,Nanjing 210023,China(Qi JL)
s:Xu Xiulian,Email:xxlqjl@sina.com;Sun Jianfang,Email:fangmin5758@aliyun.com
ObjectiveTo explore the miRNA regulating the potential cancer⁃promoting gene CCL18 in cutaneous malignant melanoma.MethodsBioinformatics analysis was conducted by using online software miRanda and TargetScan,so as to predict the miRNA targeting CCL18 gene.Three kinds of CCL18 3′UTR dual⁃luciferase reporter vectors,including mutant 3′UTR vector(mutant 3′UTR group),wild⁃type 3′UTR vector(wild⁃type 3′UTR group)and empty vector(blank control group),as well as miRNA vectors carring selected miRNAs were constructed according to human gene sequence analysis,and then were used to co⁃transfect 293T cells.After 48⁃hour treatment,the cells were lysed for detection of luciferase activity.Real⁃time fluorescence⁃based quantitative PCR was performed to measure the expression of CCL18 and selected miRNA in 14 fresh malignant melanoma tissue specimens and 14 paracancerous normal skin tissue specimens(control tissues),and their correlations were analyzed.ResultsOnline software analysis showed that some miRNAs were identified to target the 3′UTR of CCL18 gene,including miR⁃183,miR⁃128 and miR⁃33a.Luciferase reporter vectors and miRNA vectors were constructed successfully.As luciferase activity assay showed,when miR ⁃183 and miR⁃128 were bound to the CCL18 3′UTR,the luciferase activities were significantly higher in their mutant 3′UTR groups(11.63 ± 0.42;8.80 ± 0.49)than in their wild⁃type 3′UTR groups(4.86 ± 0.39;5.01 ± 0.54;bothP< 0.05)and blank control groups(2.41 ± 0.13;2.39 ± 0.05;bothP< 0.01),while there were no significant differences between miR⁃33a⁃binding mutant 3′UTR group(6.41 ± 0.47)and miR⁃33a⁃binding wild⁃type 3′UTR group(6.16 ± 0.22,P> 0.05).Real⁃time fluorescence⁃based quantitative PCR revealed higher mRNA expression of the CCL18 gene(3.52 ± 1.68),but lower expression of miR⁃183(0.49 ± 0.32),miR⁃128(0.30 ± 0.20)and miR⁃33a(0.46 ± 0.40)in the malignant melanoma tissues compared with the control tissues.The mRNA expression of the CCL18 gene was negatively correlated with the expression of miR⁃128(rs=-0.548,P< 0.05),but showed no significant correlations with the expression of miR⁃183 and miR⁃33a(bothP> 0.05).ConclusionmiR⁃128 may play a role in regulating the potential malignant melanoma⁃promoting gene CCL18.
Melanoma;MicroRNAs;RNA,small interfering;Chemokine CCL18
徐秀莲,Email:xxlqjl@sina.com;孙建方,Email:fangmin5758@aliyun.com
10.3760/cma.j.issn.0412⁃4030.2017.09.003
国家自然科学基金(81772916);江苏省自然科学基金(BK2012505、BK20171132)
Fund programs:National Natural Science Foundation of China(81772916);Natural Science Foundation of Jiangsu Province of China(BK2012505,BK20171132)
2016⁃10⁃24)
(本文编辑:周良佳 颜艳)
