花姜酮对胃癌7901细胞株增殖凋亡的影响研究Δ
2017-11-06欧仁兵马德波冉红兵
欧仁兵,季 敏,马德波,杨 芳,黄 鲲,冉红兵
(荆州市第三人民医院药剂科,湖北 荆州 434001)
花姜酮对胃癌7901细胞株增殖凋亡的影响研究Δ
欧仁兵*,季 敏,马德波,杨 芳,黄 鲲,冉红兵#
(荆州市第三人民医院药剂科,湖北 荆州 434001)
目的:研究花姜酮对人胃癌7901细胞株增殖凋亡的影响及凋亡过程中B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)相关X蛋白(Bcl-2 associated X protein,Bax)和Bcl-2表达的变化。方法:胃癌7901细胞株培养接种,分为不给药的对照组和不同质量浓度花姜酮的给药组进行研究。通过四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)实验观察不同质量浓度花姜酮和时间对细胞增殖抑制的影响,不同花姜酮质量浓度下倒置显微镜观察7901细胞株细胞形态学变化,采用4′,6-二脒基-2-苯基吲哚染色法检测细胞凋亡情况,采用逆转录聚合酶链式反应检测Fas mRNA和FasL mRNA的表达,采用蛋白免疫印迹法(Western blot)检测Bax和Bcl-2的表达。结果:与对照组比较,不同质量浓度花姜酮均可抑制7901细胞的活性,且随着质量浓度和时间的增加,细胞增殖抑制率明显升高,具浓度依赖性;不同质量浓度花姜酮组中细胞形态均有明显改变,细胞逐渐皱缩、贴壁不牢,随着浓度增加其变化越明显,具浓度依赖性;不同质量浓度花姜酮组的细胞核染色质凝聚,逐渐出现凋亡,且随着浓度增加,细胞凋亡数目增多,具浓度依赖性;不同质量浓度花姜酮组中Fas、FasL mRNA的表达显著升高,且随着浓度增加,Fas mRNA、FasL mRNA的表达水平升高,具浓度依赖性;不同质量浓度花姜酮组中Bax的表达随花姜酮浓度增加显著升高,Bcl-2的表达随浓度增加显著下降,具浓度依赖性。结论:花姜酮可以抑制人胃癌7901细胞株增殖以及诱导7901细胞凋亡,其诱导细胞凋亡可能是通过上调Fas mRNA和FasL mRNA表达,并上调Bax的表达、下调Bcl-2的表达来实现的。
花姜酮; 人胃癌7901细胞株; 增殖凋亡; Bax; Bcl-2
目前,在我国恶性肿瘤中胃癌的病死率仅次于肺癌,在全球恶性肿瘤中胃癌的发病率已高居第4位[1-2]。临床对早期胃癌的治疗主要以手术为主,但大部分患者被查出时已达胃癌晚期,其主要治疗手段为以化疗为主的综合治疗。目前,临床对胃癌的化疗方案尚无统一标准,且化疗对晚期胃癌患者的生存率并没有显著改善,还会导致不良反应发生[3-5]。研究结果显示,中晚期尤其是伴有局部扩散或其他组织转移的胃癌患者,单纯手术治疗的效果并不理想[6]。因此,临床上对于胃癌的治疗已从单纯手术转变为手术合并放化疗,还包括近年来成为热点的靶向治疗,如使用注射用曲妥珠单抗等药物[7]。但不良反应较多且较严重,给患者带来了较大的痛苦,严重降低了患者的生活质量。中药因其有效成分具有高效、低毒等特点,广受国内外研究者的关注。文献报道,中药及其提取物中的有效成分在抑制肿瘤细胞增殖或诱导其凋亡、减少放化疗不良反应方面,发挥了很大作用[8]。研究结果显示,从球姜中提取的花姜酮具有抗肿瘤、抗炎等多种药理活性,其抗肿瘤作用及机制备受关注[9-10]。本实验旨在研究花姜酮对人胃癌细胞株7901增殖凋亡的影响及凋亡过程中可能的相关机制,为花姜酮治疗胃癌提供依据。
1 资料与方法
1.1材料与试剂
花姜酮(Sigma,New York,USA);胃癌7901细胞株(中国科学院细胞库,上海,中国);MTT(Sigma,Louis,MO,USA);B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)相关X蛋白(Bcl-2 associated X protein,Bax)、Bcl-2人一抗、辣根过氧化物酶标记二抗(武汉三鹰生物技术有限公司,武汉,中国);DMEM(Gibco,Carlsbad,CA,USA);Trizol、逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒(Invitr-ogen,Carlsbad,CA,USA),引物合成(TaKaRa,大连,中国)。
1.2细胞培养
胃癌7901细胞在孵箱中培养,培养细胞数量达85%融合时,胰酶消化处理后,用DMEM(含10%小牛血清)培养基稀释细胞悬液,最终将细胞目的浓度调整为2×108/L,计数后接种于对应的培养板中,备后续实验使用。
1.3检测细胞增殖抑制率
花姜酮处理细胞后采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)比色测定细胞活力:将细胞接种于96孔板中,浓度为1×105/ml,每孔100 μl。24 h后加入花姜酮(终质量浓度分别为20、30、40、50 μg/ml),每个质量浓度重复5个孔,独立重复6次,对照组不给药。在37 ℃、5%CO2的条件下培养孵育24、48、72 h,换去药液。每孔加入MTT 10 μl,质量浓度为5 mg/ml,24 h后通过酶标仪检测各孔570 nm波长处的光密度。
1.4细胞形态学观察
将培养好的细胞分组,分别给予质量浓度为30、40、50 μg/ml的花姜酮,各组作用48 h后用倒置显微镜观察并拍摄细胞形态变化。
1.54′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylin-dole,DAPI)染色
将培养好的细胞接种于6孔板,104个/孔,24 h后吸去上清液,分组给予质量浓度为30、40、50 μg/ml的花姜酮,各组作用48 h后,使用预冷的磷酸盐缓冲液清洗3次,每孔加入DAPI溶液(1 μg/ml),置于37 ℃温箱孵育5 min,使用预冷的磷酸盐缓冲液清洗后,在暗室中用荧光显微镜观察拍照。
1.6RT-PCR检测
将培养好的细胞接种于6孔板,104个/孔,24 h后吸去上清液,分组给予质量浓度为30、40、50 μg/ml的花姜酮,作用48 h后收集各组细胞,分别提取总RNA,以检测合格的总RNA为模板逆转录合成cDNA(具体反应条件:42 ℃孵育15 min;95 ℃孵育3 min后置于冰上冷却,置于-80 ℃冰箱中冻存以备后续实验使用)。根据凋亡相关因子(factor associated suicide,Fas)及其配体(Fas ligand,FasL)mRNA的RT-PCR引物序列(见表1)进行常规扩增。
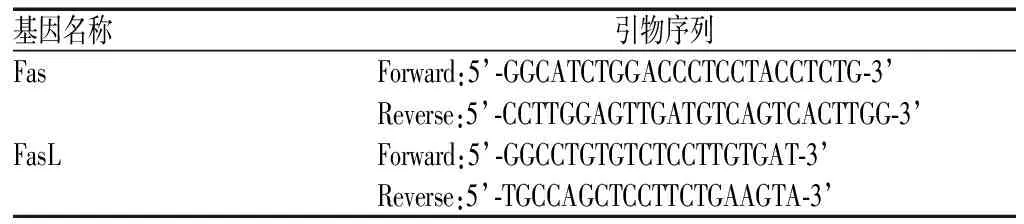
表1 Fas mRNA、FasL mRNA的RT-PCR引物序列Tab 1 RT-PCR primer sequence of Fas mRNA, FasL mRNA
1.7蛋白免疫印迹法(westernblot,WB)检测
将培养好的细胞接种于6孔板,104个/孔,24 h后吸去上清液,分组给予质量浓度为30、40、50 μg/ml的花姜酮,作用48 h后收集各组细胞,分别提取总蛋白,测定蛋白浓度,处理好待测样品后,取50 μg蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转膜,将分离的蛋白电转移至聚偏二氟乙烯膜上。封闭液室温(25 ℃)封闭1 h,经一抗孵育后,4 ℃过夜。TTBS充分洗膜后,加入二抗(1∶2 000)室温孵育1 h,TTBS清洗后显色液显色照相。
1.8统计学方法
2 结果
2.1不同质量浓度花姜酮对7901细胞的增殖抑制作用
与对照组比较,不同质量浓度花姜酮均可抑制7901细胞的活性,随着浓度和时间的增加,细胞增殖抑制率明显升高,具有明显的浓度依赖性,见表2。由于20 μg/ml的花姜酮诱导细胞凋亡的作用不明显,为突出对凋亡机制的探讨,后续实验中选取30、40、50 μg/ml的花姜酮进行研究,作用时间为48 h。
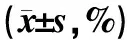
表2 不同质量浓度花姜酮对7901细胞的增殖抑制作用Tab 2 Inhibition of different concentrations of zerumbone on cell proliferation of gastric cancer 7901 cells(±s,%)
注:与对照组比较,*P<0.01
Note:vs.the control group,*P<0.01
2.2不同质量浓度花姜酮对7901细胞形态的影响
与对照组比较,不同质量浓度花姜酮中细胞形态明显改变,细胞逐渐皱缩、贴壁不牢,随浓度增加变化越明显,具有明显的浓度依赖性,见图1。
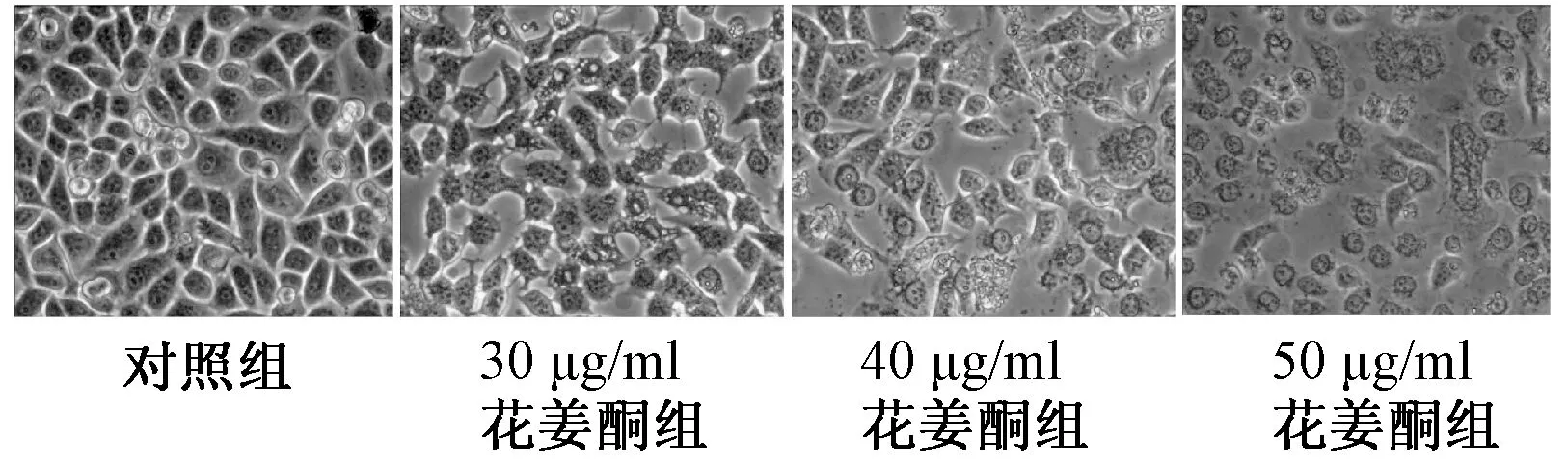
图1 不同质量浓度花姜酮对7901细胞形态的影响Fig 1 Effects of different concentrations of zerumbone on cellular morphology of gastric cancer 7901 cells
2.3不同质量浓度花姜酮对7901细胞凋亡的影响
与对照组比较,不同质量浓度花姜酮组中细胞核染色质凝聚,细胞逐渐开始出现凋亡,且随着浓度增加,细胞凋亡数目增多,具有明显的浓度依赖性,见图2。
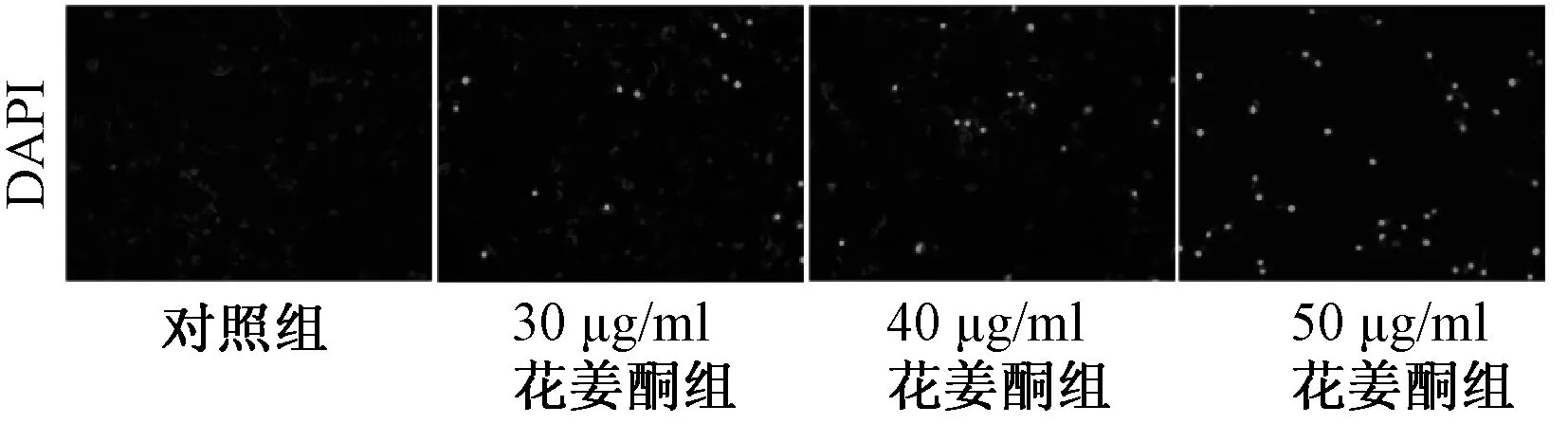
图2 不同质量浓度花姜酮对7901细胞凋亡的影响Fig 2 Effects of different concentrations of zerumbone on apoptosis of gastric cancer 7901 cells
2.4不同质量浓度花姜酮对FasmRNA、FasLmRNA表达的影响
与对照组比较,不同质量浓度花姜酮组中Fas mRNA、FasL mRNA的表达显著升高,且随着浓度增加,Fas、FasL mRNA的表达升高,具有明显的浓度依赖性,见图3。
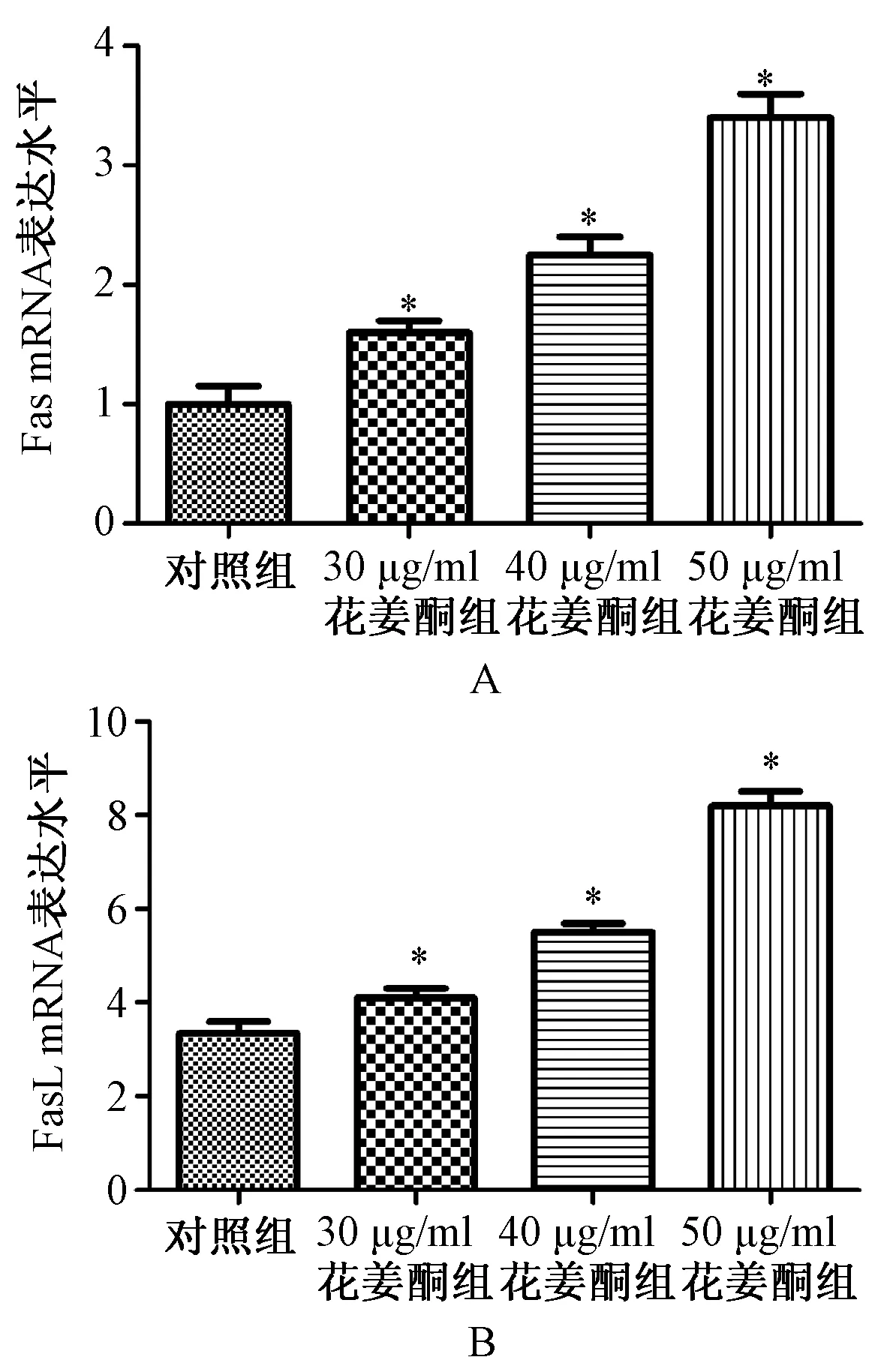
A. Fas mRNA;B.FasL mRNA;与对照组比较,*P<0.01A.Fas mRNA;B.FasL mRNA;vs.the control group, *P<0.01图3 不同质量浓度花姜酮对Fas mRNA、FasL mRNA表达的影响Fig 3 Effects of different concentrations of zerumbone on expression of Fas and FasL mRNA
2.5不同质量浓度花姜酮对Bax、Bcl-2表达的影响
与对照组比较,不同质量浓度花姜酮组中Bax的表达随浓度增加而显著升高,Bcl-2的表达随浓度增加而显著下降,具有明显的浓度依赖性,见图4。
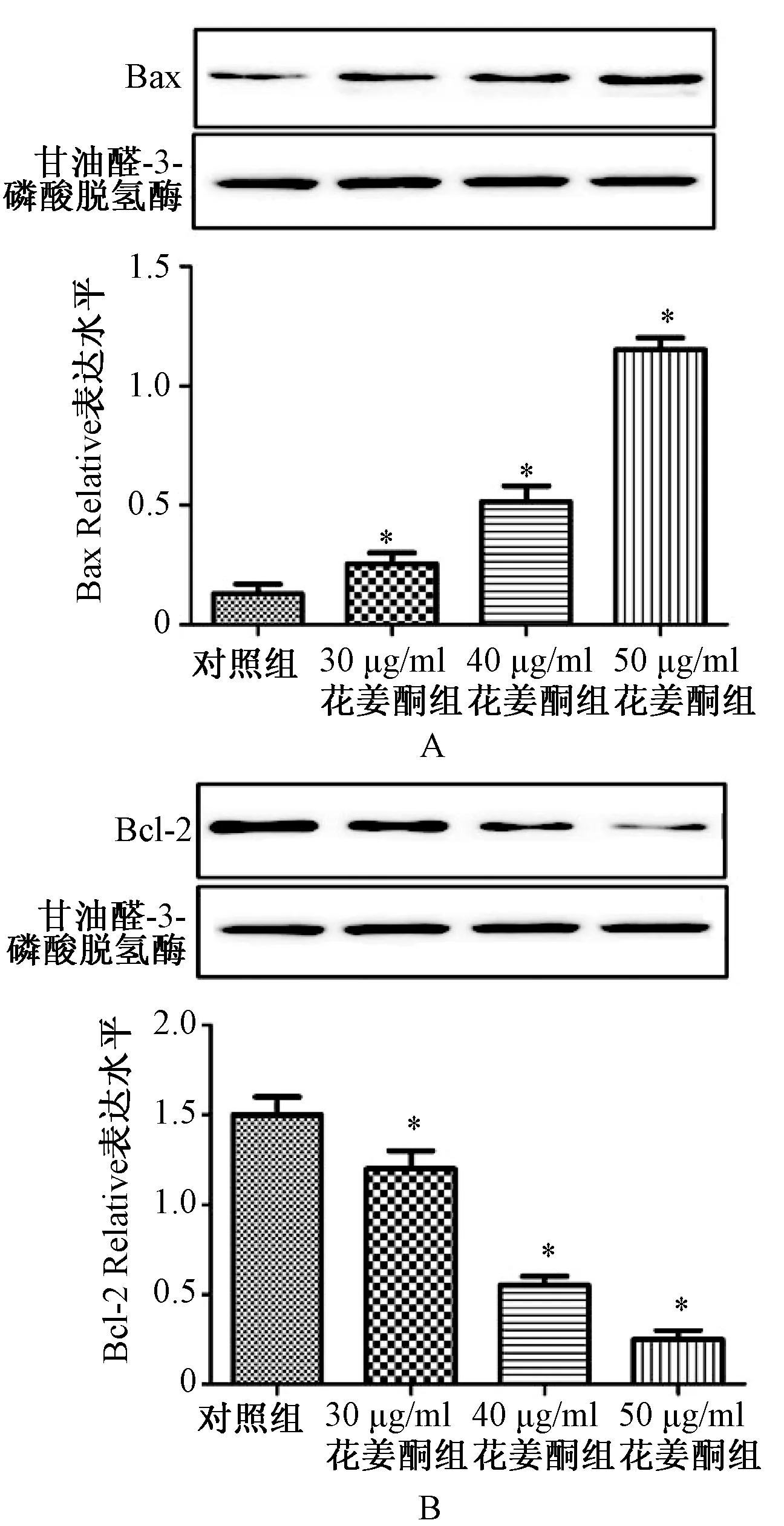
A. Bax;B.Bcl-2;与对照组比较,*P<0.01A.Bax;B.Bcl-2;vs.the control group, *P<0.01图4 不同质量浓度花姜酮对Bax、Bcl-2表达的影响Fig 4 Effects of different concentrations of zerumbone on expression of Bax and Bcl-2
3 讨论
亚洲、南美洲国家胃癌的发病率较美国和西欧国家高,虽然全球胃癌的发病率从20世纪50年代开始出现轻微下降趋势,但目前胃癌的发病率不断升高。化疗不仅有严重的不良反应,往往费用也让患者选择放弃治疗。因此,寻找高效低毒、价格合理的治疗手段十分必要。近年来,我国越来越关注利用科学化和现代化方式来推进中药的生产和研发,并开始利用先进的分子生物学手段大大了提高中医药在抑制肿瘤方面的研究水平,为中医院的临床应用开拓了更广阔的前景。花姜酮为从野生球姜的根茎中提取的倍半萜类物质,研究结果显示,其对多种恶性肿瘤细胞有效,如结肠癌、肺癌[11]、白血病[12]和肝癌[13],但关于花姜酮对胃癌细胞生物学活性的研究不多。本实验对花姜酮对人胃癌7901细胞株增殖凋亡的影响及凋亡过程中可能的相关机制做了初步研究。
Bcl-2基因有抑制细胞凋亡的生物功能,在细胞凋亡机制中发挥着重要作用,可以保护细胞免于多种形式的死亡,提高细胞的生存期,从而使细胞数目增加[14]。在一些肿瘤细胞中,当Bcl-2基因的表达上调时,会使肿瘤细胞免遭死亡或寿命延长,表明Bcl-2基因与肿瘤有着非常密切的关系。与Bcl-2基因相反,Bax基因则可以促进细胞凋亡,其与Bcl-2基因属于同族基因,不仅有对抗Bcl-2抑制细胞凋亡的作用,还可直接作用于细胞,促进细胞凋亡。当Bcl-2的存在形式是同源二聚体时,就会起到抑制细胞凋亡的作用;当Bax蛋白表达增多且与Bcl-2聚合成二聚体时,或Bax蛋白自身也聚合成同源二聚体时,就会起到促进细胞凋亡的作用。Kim等[15]研究结果显示,当Bcl-2作为靶基因被下调后,可以诱导多发性骨髓瘤细胞的凋亡[16]。Fas为细胞死亡因子,能诱导细胞发生凋亡,当其与FasL结合时,能激活细胞内的相关凋亡信号通路[17-18]。但关于花姜酮抗胃癌作用机制的研究尚浅,有待深入研究。
本研究结果显示,与对照组比较,不同质量浓度的花姜酮能显著抑制7901细胞的活性,随着浓度和时间的增加,细胞增殖抑制率明显升高,具有明显的浓度依赖性;不同质量浓度花姜酮组中细胞形态发生明显变化,细胞逐渐皱缩,贴壁不牢,随浓度增加变化越明显,具有明显的浓度依赖性;不同质量浓度花姜酮组中细胞核染色质凝聚,逐渐出现凋亡,且随着浓度增加,细胞凋亡数目增多,高浓度组的细胞核呈致密浓染,凋亡率比低浓度组、对照组高,呈现出明显的浓度依赖性;随着花姜酮质量浓度的增加,Fas mRNA、FasL mRNA的表达逐渐升高,表明花姜酮可以上调凋亡基因Fas、FasL的表达,进而诱导细胞凋亡。Shimada等[19]研究结果显示,Fas在非小细胞肺癌和正常组织中的阳性表达率分别为46.7%(28/60)、100.0%(20/20),两者的差异有统计学意义(P>0.05);肿瘤细胞通过下调Fas的表达,使其不能正常与其配体FasL结合,逃避由Fas/FasL介导的细胞凋亡过程,达到无限增殖的目的。上述研究成果与本研究相似,进一步证实花姜酮可以通过上调Fas mRNA、FasL mRNA的表达启动凋亡通路,诱导7901细胞凋亡。WB检测结果显示,随着花姜酮质量浓度的增加,Bax的表达升高,Bcl-2的表达降低,表明花姜酮可以上调Bax、下调Bcl-2的表达,进而诱导细胞凋亡。Xi等[20]研究结果显示,部分抗肿瘤药可以通过下调Bcl-2的表达诱导肿瘤细胞凋亡,如鼠尾草酚可使白血病细胞的Bax表达上调、Bcl-2的表达下降34%~53%。Nefif等[21]研究结果显示,消化道上皮肿瘤异常的Bcl-2表达下调、Bax表达上调可能是消化道肿瘤形成的早期变化。上述研究成果与本研究相似,进一步证实花姜酮诱导7901细胞的凋亡可能是通过上调Bax的表达、下调Bcl-2的表达而实现的。该结果为花姜酮治疗胃癌的作用机制提供了理论基础,但所需的治疗药物浓度及在人体中的治疗效果,有待动物实验及临床试验进一步证明。
综上所述,本研究证实花姜酮可以抑制人胃癌7901细胞株的增殖,并能够诱导7901细胞发生凋亡,其诱导细胞凋亡可能是通过上调Fas mRNA、FasL mRNA的表达,上调Bax的表达,下调Bcl-2的表达来实现的。
[1]Brenner H,Rothenbacher D,Arndt V.Epidemiology of stomach cancer[J].Methods Mol Biol,2009,472:467-477.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[3]Ryu MH,Kang YK.ML17032 trial:capecitabine/cisplatin versus 5-fluorouracil/cisplatin as fi rst-line therapy in advanced gastric cancer[J].Expert Rev Anticancer Ther,2009,9(12):1745-1751.
[4]De Vita F,Vecchione L,Galizia G,et al.Perspectives in adjuvant therapy of gastric cancer[J].Oncology,2009,77(Suppl 1):38-42.
[6]Mello BS,Lucena Ade F,Echer IC,et al.Patients with gastric cancer submitted to gastrectomy:an integrative review[J].Rev Gaucha Enferm,2010,31(4):803-811.
[7]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treat-ment of HER2-positive advanced gastric or gastro-oesophageal junct-ion cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[8]Olaku O,White JD.Herbal therapy use by cancer patients:a litera-ture review on case reports[J].Eur J Cancer,2011,47(4):508-514.
[9]Murakami A,Tanaka T,Lee JY,et al.Zerumbone,a sesquiterpene in subtropical ginger,suppresses skin tumor initiation and promotion stages in ICR mice[J].Int J Caneer,2004,110(4):481-490.
[10] Abdul AB,Abdelwahab SI,Bin Jalinas J,et al.Combination of zerumbone and cisplatin to treat cervical intraepithelial neoplasia in female BALB/c mice[J].Int J Gyn Cancer,2009,19(6):1004-1010.
[11] Kim M,Miyamoto S,Yasui Y,et al.Zerumbone,a tropical ginger sesquiterpene,inhibits colon and lung carcinogenesis in mice[J].Int J Cancer,2009,124(2):264-271.
[12] Xian M,Ito K,Nakazato T,et al.Zerumbone,a bioactive sesqu-iterpene,induces G2/M cell cycle arrest and apoptosis in leukemia cells via a Fas- and mitochondria-mediated pathway[J].Cancer Sci,2007,98(1):118-126.
[13] Sakinah SA,Handayani ST,Hawariah LP.Zerumbone induced apoptosis in liver cancer cells via modulation of Bax/Bcl-2 ratio[J].Cancer Cell Int,2007,7:4.
[14] Cory S,Huang DC,Adams JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[15] Kim SH,Ahn KS,Jeong SJ,et al.Janus activated kinase 2/signal transducer and activator of transcription 3 pathway mediates icar-iside Ⅱ-induced apoptosis in U266 multiple myeloma cells[J].Eur J Pharmacol,2011,654(1):10-16.
[16] Thoennissen NH,Iwanski GB,Doan NB,et al.Cucurbitacin B induces apoptosis by inhibition of the JAK/STAT pathway and potentiates antiproliferative effects of gemcitabine on pancreatic cancer cells[J].Cancer Res,2009,69(14):5876-5884.
[17] Myong NH.Tissue microarray analysis of Fas and FasL expressions in human non-small cell lung carcinomas with reference to the p53 and bcl-2 overexpressions[J].J Korean Med Sci,2005,20(5):770-776.
[18] Chang JS,Hsu YL,Kuo PL,et al.Up regulation of Fas/Fas ligand-mediated apoptosis by gossypol in an immortalized human alveolar lung cancer cell line[J].Clin Exp Pharmacol Physiol,2004,31(10):716-722.
[19] Shimada H,Takeda A,Arima M.Serum p53 antibody is a useful tumormarker in superficial esophageal aquamous cell carcinoma[J].Cancer,2000,89(8):1677-1683.
[20] Xi S,Dyer KF,Kimak M,et al.Decreased STAT1 expression by promoter methylation in squamous cell carcinogenesis[J].J Natl Caneer Inst,2006,98(3):181-189.
[21] Neri M,Betta P,Marroni P,et al.Serum anti-p53 autoantibodies in pleural malignant mesothelioma,lung cancer and non-neoplastic lung diseases[J].Lung Cancer,2003,39(2):165-172.
StudyonEffectsofZerumboneonProliferationandApoptosisofGastricCancer7901CellsΔ
OU Renbing, JI Min, MA Debo, YANG Fang, HUANG Kun, RAN Hongbing
(Dept.of Pharmacy, Jingzhou the Third People’s Hospital, Hubei Jingzhou 434001, China)
OBJECTIVE: To study the effects of zerumbone on proliferation and apoptosis of gastric cancer 7901 cells and changes of B-cell lymphoma-2(Bcl-2), Bcl-2 associated X protein(Bax) and Bcl-2 expression. METHODS: Gastric cancer 7901 cells were cultured and divided into control group(without administration) and administration group(with different concentrations of zerumbone). Methyl thiazolyl tetrazolium(MTT) experiment was used to observe effects of different concentrations of zerumbone and time on the inhibition of cell proliferation. The morphological changes of gastric cancer 7901 cells were observed by inverted microscope in different concentrations of zerumbone, the apoptosis was detected by DAPI staining, the expression levels of Fas and FasL mRNA were detected by RT-PCR method, and the expression of Bax and Bcl-2 protein was detected by Western blot. RESULTS: Compared with the control group, different concentrations of zerumbone could significantly inhibit the activity of cell 7901, the proliferation inhibition rate increased with the increase of concentration and time, and it was concentration dependent. The cell morphology in different concentration changed obviously under the inverted microscope, the cells gradually shrank, and the adherence was not strong. The changes were more obvious with the increase of concentrations, and it was concentration dependent. Nuclear chromatin in different concentrations condensed with apoptosis. The number of apoptotic cells increased with the increase of concentrations, and it was concentration dependent. The expression of Fas and FasL mRNA in different concentrations increased significantly, and the expression of Fas and FasL mRNA became higher with the increase of concentrations, and it was concentration dependent. The protein expression of Bax in different concentrations increased significantly with the increase of zerumbone concentrations, the protein expression of Bcl-2 decreased significantly with the increase of concentration, and they were concentration dependent. CONCLUSIONS: Zerumbone can inhibit the proliferation of human gastric cancer 7901 cells and induce the apoptosis. The apoptosis may be mediated by up-regulation the expression of Fas and FasL mRNA, up-regulation the expression of Bax protein and down-regulation of the expression of Bcl-2 protein.
Zerumbone; Human gastric cancer 7901 cells; Proliferation and apoptosis; Bax; Bcl-2
R96
A
1672-2124(2017)09-1176-04
DOI 10.14009/j.issn.1672-2124.2017.09.009
湖北省自然科学基金项目(No.2015FFB02017)
*主管药师。研究方向:药学。E-mail:417955104@qq.com
#通信作者:副主任药师。研究方向:药物的临床和基础研究。E-mail:sghytkorean@163.com
2017-04-30)
