TiO2纳米管电极上电化学还原CO2生成CH3OH
2017-11-01裘建平童怡雯赵德明何志桥陈建孟
裘建平 童怡雯 赵德明 何志桥 陈建孟 宋 爽,*
(1浙江工业大学环境学院,杭州 310032;2金华职业技术学院,浙江 金华 321007;3浙江工业大学化学工程学院,杭州 310032)
TiO2纳米管电极上电化学还原CO2生成CH3OH
裘建平1,2童怡雯1赵德明3何志桥1陈建孟1宋 爽1,*
(1浙江工业大学环境学院,杭州 310032;2金华职业技术学院,浙江 金华 321007;3浙江工业大学化学工程学院,杭州 310032)
采用原位阳极氧化-煅烧法制备TiO2纳米管(TiO2NTs)电极,运用X射线衍射(XRD)、电场发射扫描电子显微镜(FESEM)、X射线光电子能谱(XPS)、双电位阶跃测试等对制备电极进行表征,考察了其在0.1 mol·L−1KHCO3水溶液中电化学还原CO2的催化活性。结果表明TiO2NTs电极上电化学还原CO2的主产物为CH3OH,CH3OH由HCOOH和HCHO进一步还原而来。电极制备的最佳煅烧温度为450 °C(TiO2NTs-450),电解电位−0.56 V (vs RHE (可逆氢电极))时反应120 min后,生成CH3OH的法拉第效率和分电流密度分别为85.8%和0.2 mA·cm−2。与550和650 °C煅烧的电极相比,TiO2NTs-450电极具有更高的催化活性,归因于电极表面更多的三价钛活性位,有利于CO2吸附,从而对·CO2−起到稳定的作用,速率控制步骤转变为·CO2−的质子化反应。
TiO2纳米管电极;电化学还原;CO2;甲醇;还原机理
1 引 言
化石燃料燃烧会产生大量 CO2气体导致温室效应,并引发不可再生能源的枯竭1。CO2可被视作丰富且廉价的碳源用于生产燃料和有机化学品,将其转化为能源燃料可产生显著的环境效益和经济效益。
将CO2还原为有机组分的非生物转化有辐射2、热3、光4以及电化学5等方法。其中,电化学还原 CO2具有操作条件相对简便、反应过程易于控制、转化率较高、可以利用洁净可再生能源以及系统紧凑灵活、模块化、易于放大生产等优点,更具备实用性和潜在的工业应用价值。目前电化学法还原 CO2的电极主要为多晶单金属电极,按催化转化产物可分为两大类:选择生成CO电极(如Au、Ag、Zn),选择生成甲酸电极(如 Sn、In、Pb)。
甲醇(CH3OH)因运输、储存方便,能量利用率高而被广泛应用6,7。“甲醇经济”模式可再循环大气中过多的二氧化碳,并且CH3OH可作为可再生燃料或用于合成几乎所有目前源自化石产品的原料。在水溶液中将CO2电化学还原为CH3OH主产物的电极主要有GaAs电极8、金属电极(Mo、Pd)9,10和金属氧化物电极(CuO)11。其中Canfield和Frese等9首次在 pH 为 4.2的 0.2 mol·L−1Na2SO4电解液中于 p-GaAs、n-GaAs电极上将 CO2电化学还原为CH3OH,但其生成CH3OH获得高法拉第效率所需电极电位为−1.2 − −1.4 V (vs SCE(饱和甘汞电极)),远低于该条件下CO2还原生成CH3OH的标准电极电位−0.536 V (vs SCE)。Mo电极能使生成CH3OH的法拉第效率达到 100%以上,主要源于Mo 电极的自腐蚀。而向 0.5 mol·L−1NaClO4电解液中加入0.01 mol·L−1吡啶可使Pd电极上生成甲醇的法拉第效率提高至 30%10。CuO电极在 0.5 mol·L−1KHCO3电解液中生成 CH3OH 法拉第效率达到38%11。
最近,Zhang等12对比了 Pt/RuO2/TiO2纳米管电极和 Pt/RuO2/TiO2纳米颗粒电极在 0.5 mol·L−1NaHCO3电解液中电化学还原 CO2的活性,发现TiO2纳米管基电极表现出较高的CH3OH生成法拉第效率(60.5%),然而,TiO2纳米管电极的晶相组成对电化学还原 CO2的影响及其电化学还原CO2为CH3OH机理目前未见报道。本文采用阳极氧化法原位制备具有高催化活性的TiO2纳米管电极,考察煅烧温度对电极物理化学性质及电极催化还原CO2活性的影响,并探讨了CO2电化学还原为CH3OH机理。
2 实验部分
2.1 TiO2NTs电极制备
将 20 mm × 20 mm × 0.5 mm 的 Ti片(纯度99.99%)依次置于丙酮(AR,上海凌峰)和无水乙醇(AR,上海凌峰)中超声清洗10 min,然后在体积比为1 : 3的HF(AR,40%(w,质量分数),阿拉丁)和HNO3(AR,68%(w),阿拉丁)混合溶液中刻蚀5 min,蒸馏水洗净并用 N2吹干,最后作为阳极置于乙酸(AR,上海凌峰)和 HF混合电解液中(乙酸与0.5% HF体积比为1 : 7),阴极为25 mm × 25 mm × 0.5 mm的Pt片。控制电压20 V下电解40 min,在预设温度下煅烧2 h得到TiO2NTs电极。在450、550、650 °C下煅烧得到的电极,分别记为TiO2NT-450、TiO2NTs- 550和TiO2NTs-650。
2.2 催化剂表征
催化剂的晶相结构分析采用 X射线衍射仪(XRD,XʹPert PRO,PANalytical,荷兰)。分析条件:Cu靶Kα射线,衍射光束波长为λ = 0.15418 nm,室温,工作电流和电压分别为40 mA和45 kV,衍射角2θ的扫描范围为10°−80°,扫描速率为 2 (°)·min−1,扫描步长 0.01°。
催化剂的微观表面形貌采用场发射扫描电子显微镜(FESEM,S-4800,Hitachi,日本)表征。催化剂的元素成分、表面电子态等采用X射线光电子能谱(XPS,PHI-5000C ESCA,Perkin-Elmer,美国)表征。
电极粗糙因子的测定方法:在 0.5 mol·L−1NaClO4溶液中,控制温度为20 °C,电极电位先设定为0.1 V (vs SCE),10 s后再阶跃至0.095 V (vs SCE)保持10 s,其计算如公式(1)所示13。
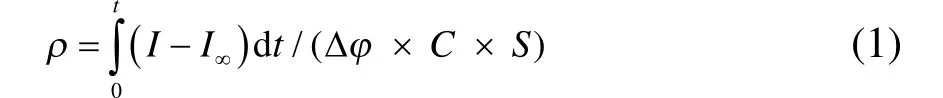
式中,ρ为粗糙因子(cm2·cm−2),I为反应电流(A),I∞为阶跃后的稳定电流(A),S为电极几何面积(cm2),C 为理想双电层间电容(20 µF·cm−2),t = 10 s,Δφ = 5 mV。
2.3 电化学还原CO2实验
电化学还原CO2在自制的密闭H型反应池中进行。柱形阴极室直径50 mm,高150 mm,有效容积295 mL,阴极室密封并设有取样口及研究电极和参比电极接口;柱形阳极室的直径 6 mm,高 150 mm,有效容积424 mL。阴阳极室之间用Nafion-117阳离子交换膜分隔。实验中阴极液为100 mL CO2饱和的0.1 mol·L−1KHCO3水溶液,阳极液为180 mL 0.5 mol·L−1NaOH水溶液,反应温度由低温恒温槽(THD-2015;宁波天恒仪器厂,中国)控制为25 °C。CO2还原反应由电化学工作站(CHI-660D,CH Instrument,美国)的时间-电流曲线功能控制进行恒电位电解,反应时间为120 min,在不同时间取样测定产物的浓度。实验中的电极电位通过公式(2)转化为可逆氢电极电位。
E(vs RHE) = E(vs SCE) + 0.2412 V +0.0591 V × pH (2)
气相产物 H2和 CO利用气相色谱仪(7890B,Agilent,美国)分析检测,配置HP-MOLESIEVE色谱柱(30 m × 320 µm × 12 µm),热导检测器(TCD)检测。
气相和液相中的 CH3OH均采用气相色谱仪(6890N,Agilent,美国)检测分析,配置了 30 m × 250µm × 25 µm的HP-INNOWAX毛细管柱,检测器为FID。液相产物HCHO通过乙酰丙酮分光光度法进行测定14。
液相 HCOO−采用离子色谱仪(ICS 2000;Dionex,美国)测得,双活塞泵(in series),IonPac AS19分析柱(4 mm × 250 mm;Dionex)分离,IonPac AS19保护柱(4 mm × 250 mm;Dionex),电导检测器(DS6;Dionex),洗脱液使用阴离子电解抑制器(4 mm ASRS;Dionex)。
反应电极的催化选择性、活性分别用产物的法拉第效率(FE)和分电流密度(PCD)来表征,FE可由公式(3)计算:
FE = znF/Q (3)其中,z为CO2还原为产物过程中的电子转移个数,n为反应产物的摩尔数(mol),F为法拉第常数(96485 C·mol−1),Q 为反应过程中输入的总电量(C)。
PCD可由公式(4)计算:
PCD = jtotal× FE (4)
其中,jtotal为反应的总电流密度。
3 结果与讨论
3.1 催化剂的物理化学表征
3.1.1 XRD
不同温度煅烧的TiO2NTs电极的XRD测定结果如图1所示,由图1(a)可知,所有样品在2θ衍射角为 35.1°、38.4°、40.1°、53.0°和 70.7°出现衍射峰,分别对应于 Ti的(100)、(002)、(101)、(102)和(103)晶面(JCPDS卡片号05-0682),这主要源于Ti基底,由图 1(aʹ),在 2θ 为 25.3°处均出现了锐钛矿 TiO2(101)晶面衍射峰(JCPDS卡片号21-1272),而当煅烧温度升至550 和650 °C时,在 27.4°出现了金红石相 TiO2(110)晶面特征衍射峰(JCPDS卡片号 65-0190),且衍射峰随煅烧温度升高而增强,说明了450 °C煅烧获得的电极为纯锐钛矿相,550和650 °C时得到的电极则为锐钛矿和金红石的混相。根据Spur-Myers公式15计算可得,TiO2NTs-550和TiO2NTs-650电极片中金红石相的比例分别为0.64和0.92。
3.1.2 XPS
采用XPS分析不同温度煅烧的TiO2NTs电极表面元素组成及元素化学价态。TiO2NTs-450、TiO2NTs-550、TiO2NTs-650电极的全谱图和高分辨窄谱图如图 2所示,所有元素的结合能位置均根据C 1s峰(结合能284.6 eV)进行荷电校正。图2(a)为所制备TiO2NTs电极的全谱图,谱图中出现了O、Ti、C的特征峰,表明所制备催化剂中有O、Ti、C三种元素存在。
TiO2NTs催化剂表面Ti 2p的高分辨XPS窄谱图见图2(b),一般而言,在Ti 2p窄谱图中,结合能位置在457.4、458.5、463.3和464.4 eV的四个特征峰,分别对应于Ti3+2p3/2、Ti4+2p3/2、Ti3+2p1/2和 Ti4+2p1/2。用 Shirley法扣除本底,并用Voigt函数(Lorentzian-Gaussian卷积法)对Ti 2p图进行分峰拟合16,具体结果如表 1所示,由表可知TiO2NTs电极上三价钛(Ti(III))含量随着煅烧温度的升高而逐渐减少,TiO2NTs-450、TiO2NTs-550和TiO2NTs-650的Ti(III)原子百分含量分别为33.7%、16.6%和10.9%。
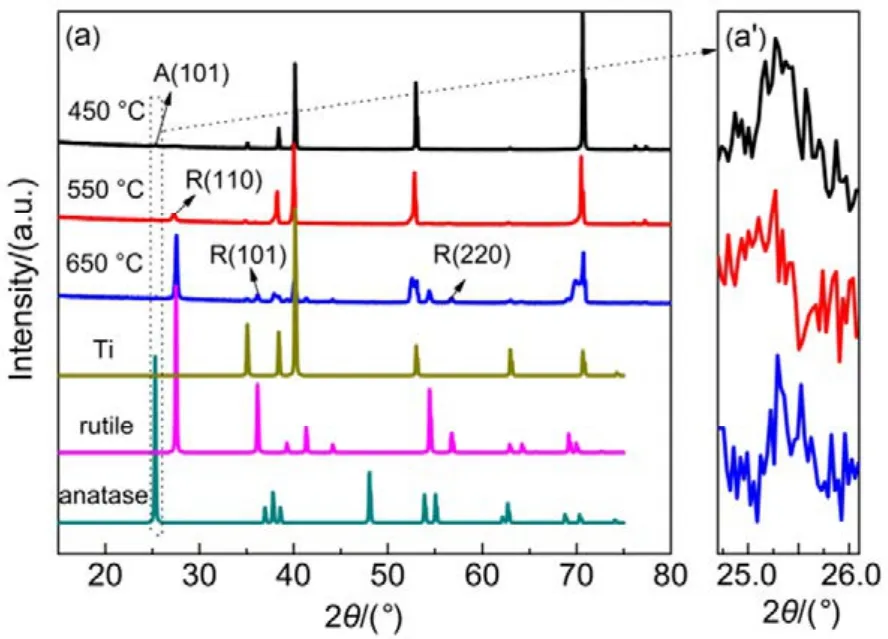
图1 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650的XRD图谱Fig.1 XRD patterns of TiO2NTs-450,TiO2NTs-550 and TiO2NTs-650.
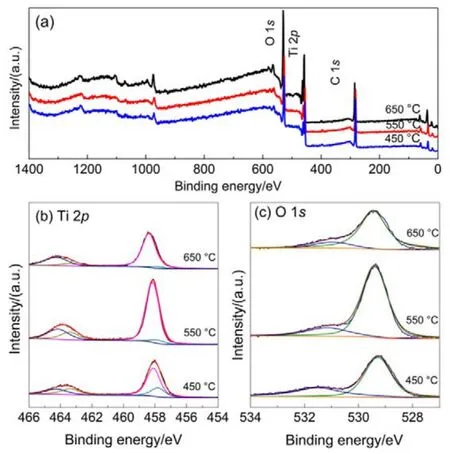
图 2 TiO2NTs-450、TiO2NTs-550、TiO2NTs-650的XPS全谱图(a)以及Ti 2p (b),O 1s (c)高分辨窄谱图Fig.2 Wide-scan XPS spectra of (a) TiO2NTs-450,TiO2NTs-550 and TiO2NTs-650, as well as high-resolution scanning XPS spectra of(b) Ti 2p and (c) O 1s.
图2(c)为各TiO2催化剂样品的O 1s窄谱图。如图所示,O 1s峰去卷积分为3个特征峰:O 1s结合能在529.5 eV处的主要特征峰归属于晶格氧(Ti-O-Ti),而结合能在531.8 eV位置出现的特征峰为氧空位(O*),化学吸附的水分子在结合能532.8 eV位置处。由表 1可以看到,TiO2NTs- 450、TiO2NTs-550、TiO2NTs-650的表面氧空位占总含氧量的比例分别为33%、16.5%和13.6%,结果与Ti(III)变化一致。
3.1.3 FESEM
为研究煅烧温度对TiO2NTs电极表观形貌的影响,对其进行了FESEM测试。由图3可知,所制备的TiO2纳米管阵列有序紧凑,分布均匀,管径范围为69−82 nm,管壁厚度为24−27 nm。此外,通过对比纳米管的形貌还可以看出,当煅烧温度为450 °C时,TiO2NTs表面上TiO2纳米管分布更为均匀,孔径相对较大。当煅烧温度高于550 °C时,部分纳米管管口开始坍塌,并出现少量团聚现象。这是因为高温煅烧时,TiO2发生锐钛矿相向金红石相转变(从XRD图中可证实),而这种晶相转变导致TiO2晶格体积膨胀,且向外界释放了大量的热量,同时,锐钛矿相向金红石相的转变引起 TiO2晶粒生长过快引发纳米管坍塌现象,从而造成粒径增大,电化学表面积减少17。
3.1.4 粗糙因子
为考察煅烧温度对电极粗糙程度的影响,通过双电位阶跃法对 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极的粗糙因子进行测定,根据式(1)可计算得到 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极的粗糙因子分别为 875.3、723.7 和 540.3 cm2·cm−2,说明煅烧温度升高会导致电化学表面积下降。
3.2 电催化还原CO2的活性和选择性
为探明 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上电催化还原CO2活性,考察了反应时间为 120 min 时,电解电位(−0.16 − −1.16 V)对各产物FE和PCD的影响。从图4中可以看出,受电极电位和检测方法检出限两方面的影响,对于不同的电极,CO在电解电位负于−0.36 V时才能检测到,HCHO则在电解电位负于−0.56 V时检出,对应于 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极,HCOOH则在电解电位分别负于−0.36、−0.46和−0.56 V时才能检测到。CH4及其他二碳还原产物在研究的电极电位范围内均未检出。
在图 4(a)、(b)和(d)中,三个电极上 FECO、FEHCOOH和 FECH3OH随电解电位变化呈现相同趋势,均随电解电位负移先增加后下降,当电位为−0.56 V时达到最大值,此时TiO2NTs-450电极上FECO、FEHCOOH和 FECH3OH分别为 7.2%、4.5%和85.8%,TiO2NTs-550电极上 FECO、FEHCOOH和FECH3OH则为5.2%、2.5%和78.6%,TiO2NTs- 650电极上 FECO、FEHCOOH和 FECH3OH分别是2.7%、2.0%和72.2%,而FEH2则呈现相反的趋势。对于TiO2NTs-450、TiO2NTs-550和TiO2NTs- 650电极,FEHCHO从−0.56 V的2.1%、1.05%和0.92%下降至−1.16 V的0.17%、0.10%和0.09% (图4(c))。CO2的还原产物中FECH3OH最高,在电解电位为−0.56 V时,对应于 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极的FECH3OH分别为85.8%、78.6%和 72.2%。需要指出的是,实验中有总FE大于100%的情况出现,这可能是由于实验误差导致的。此外由图4和表1可知,所有产物中CH3OH为主产物,对于TiO2NTs- 450而言,在电解电位为−0.56 V时,FECH3OH是FECO的11.9倍、FEHCOOH的19倍和FEHCHO的40.8倍。
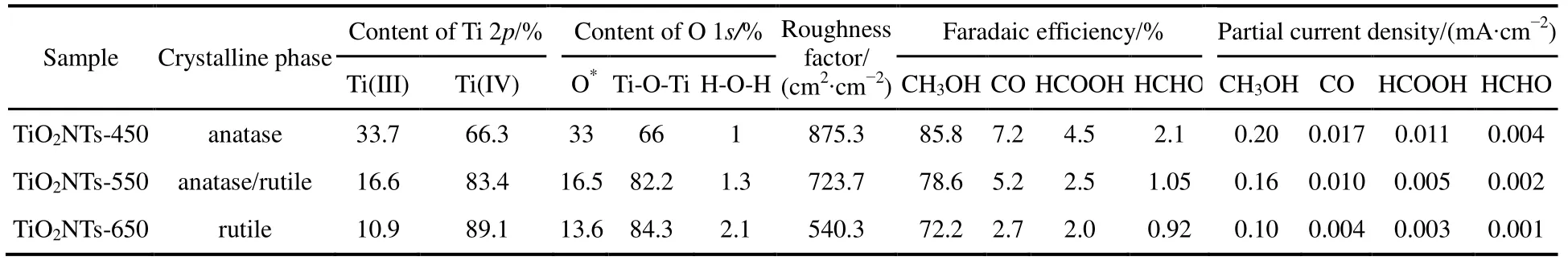
表1 TiO2NTs电极的物理特性及其在电解电位为−0.56 V时的电催化活性Table 1 Summary of physicochemical parameter of various TiO2NTs electrodes at a potential of −0.56 V.

图 3 TiO2NTs-450(a)、TiO2NTs-550(b)和TiO2NTs-650(c)电极的FESEM图Fig.3 FESEM images of TiO2NTs-450 (a),TiO2NTs-550 (b) and TiO2NTs-650 (c) electrodes.
以电极的 FECH3OH/FEH2比值来表征电化学还原 CO2为 CH3OH的选择性。TiO2NTs-450、TiO2NTs-550和 TiO2NTs-650电极在电解电位为−0.56 V时,其FECH3OH/FEH2分别为34.3、5.7和3.1,则三个电极上产生 CH3OH的选择性分别为97.2%、85.1%和 75.6%,这说明 TiO2NTs-450电极具有更高的产 CH3OH选择性。此外,较之TiO2NTs-550和 TiO2NTs-650电极,TiO2NTs-450电极还具有更宽的抑制生成氢的电化学窗口(−0.76 − −0.46 V)。
图 5为 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上总电流密度及各产物分电流密度随电位变化曲线,本实验总电流密度随过电位的增加而增加,当电解电位为−1.16 V时,对应于TiO2NTs-450、TiO2NTs-550和TiO2NTs- 650的总电流密度分别为4.03、2.85和2.13 mA·cm−2。
CO2还原产物的分电流密度随电极电位变负逐渐增加,当电极电位达到−0.76 V时趋于稳定,此电位下PCDCH3OH在TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上分别为0.81、0.23和0.16 mA·cm−2,PCDCO分别为 0.039、0.014 和 0.008 mA·cm−2,PCDHCOOH分别为 0.027、0.011和 0.006 mA·cm−2,PCDHCHO分别为 0.006、0.002 和 0.002 mA·cm−2,同时 PCDH2从−0.76 V 时的 0.30、0.24和 0.25 mA·cm−2分别增加至 3.04、2.38和 1.89 mA·cm−2,说明在更负电极电位下析氢副反应增强。
表2为本研究与文献的PCDCH3OH对比,尽管本文电极生成CH3OH的FE更高,但PCDCH3OH仍然相对较低,这是因为CO2直接还原为CH3OH是复杂的 6电子过程。由于实际工业应用要求电流密度达到 100 mA·cm−2以上18,所以进一步的工作需在电极几何面积不变的前提下,极大地提高其电化学活性表面积。
此外,计算产生速率在化工生产中具有重要意义,不同催化剂在不同电势下CH3OH的产生速率见图6。由图可知,三个电极上CH3OH的产生速率均随过电位的增大而增大,在相同的电极电位下,电极制备过程中煅烧温度的升高会减慢CH3OH的生成。在研究的电位范围内,最大CH3OH的产生速率出现在−1.16 V,对于TiO2NTs-450、TiO2NTs-550和 TiO2NTs-650电极而言分别为 5.76、2.70 和 1.49 μmol·cm−2·h−1;而在电极电位为−0.56 V(此时 FE最大)时,CH3OH在TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上的产生速率分别为 1.25、1.00和 0.62 μmol·cm−2·h−1。较之文献报道的 CH3OH 产生速率(表 2),TiO2NTs-450电极优于 n-GaAs、p-GaAs和p-InP电极,但劣于CuO电极。鉴于CuO电极存在Cu浸出毒性风险,TiO2NTs较之CuO电极还是有一定优越性的。
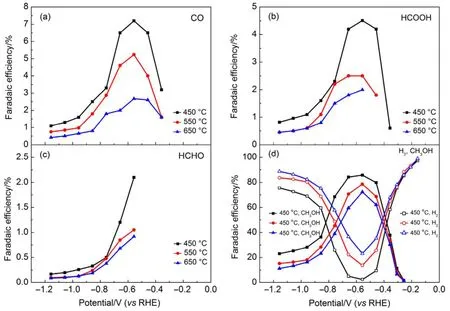
图4 TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上各产物法拉第效率随电位变化Fig.4 Faradaic efficiency of each CO2 reduction products for TiO2NTs-450, TiO2NTs-550 and TiO2NTs-650 electrodes as a function of cathode potential.(a) CO; (b) HCOOH; (c) HCHO; (d) H2 and CH3OH.
3.3 电化学还原CO2机理
基于TiO2还原CO2的机理主要有两条途径,如式(5)和(6)所示19:
CO2→ ·CO2−→ CO → C → ·CH → ·CH3→
CH3OH/CH4(途径一) (5)CO2→ ·CO2−→ HCOOH → HCHO → CH3OH
(途径二) (6)
为进一步探明TiO2纳米管电极上电化学还原CO2的机理,以CO和HCOOH替代CO2进行120 min电化学反应,CO饱和的0.1 mol·L−1KHCO3溶液用HClO4调节初始pH为6.8,以确保与CO2饱和的0.1 mol·L−1KHCO3溶液的初始pH一致,而在 0.1 mol·L−1KHCO3溶 液中 加入 75 μL HCOOH控制其初始pH为6.8。实验结果表明,在通 CO的反应体系中(无 CO2)除 H2外未检测到其他含碳物质,而单独添加 HCOOH的反应体系中,产生 CH3OH的法拉第效率和产量分别为75.5%和8.9 μmol,产HCHO的法拉第效率和产量分别为5.9%和1.04 μmol,由此说明本实验体系中CO是终产物,不会被进一步还原。CH3OH是以HCOOH为中间产物,经途径二产生的,根据文献20−22,电化学还原CO2产生CH3OH的具体反应方程如式(7)至(11)。
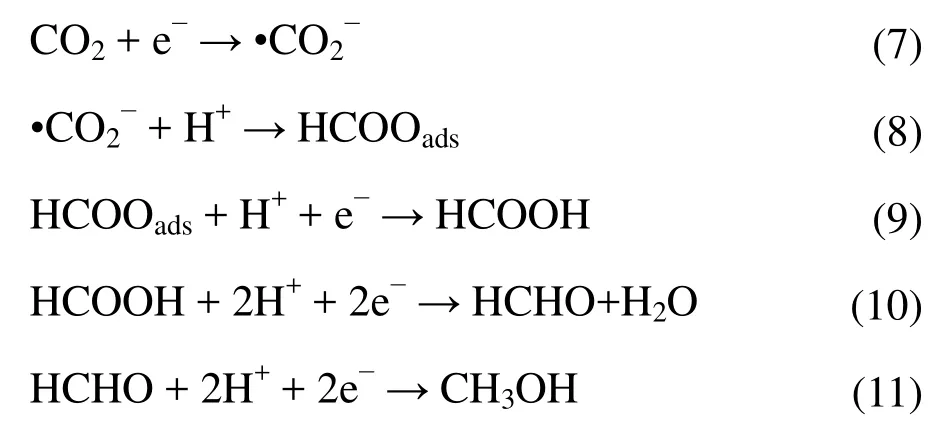
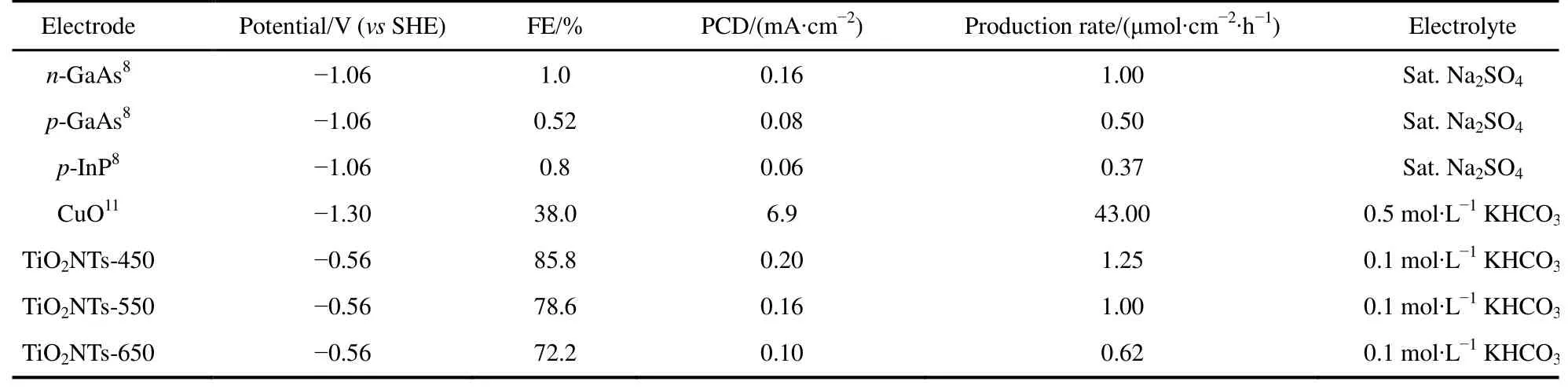
表2 不同半导体电极产甲醇性能比较Table 2 Electrochemical reduction of CO2 to methanol on different semiconductor electrodes.
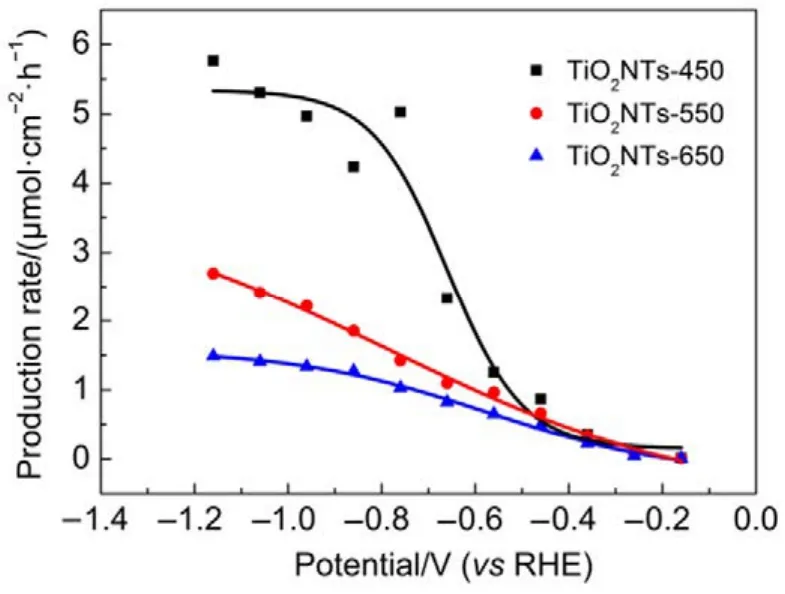
图6 CH3OH产生速率随电解位变化Fig.6 Production rate CH3OH with cathode potential.
CO2电化学还原为HCOOH、HCHO和HCHO和CH3OH过程中需要分别传递2、4和6个电子,在本实验中,HCOOH和 HCHO浓度未累积,说明电化学还原HCOOH为HCHO(式(10))和HCHO还原为CH3OH(式(11))不是速率控制步骤。许多研究认为CO2得1电子还原生成·CO2−(式(7))为速率控制步骤23,因其标准电极电位为−1.9 V。然而根据Fletcher24以第一性原理为基础推导的理论可知,·CO2−得质子反应(式(8))为速率控制步骤。Fletcher推导得到的塔菲尔斜率公式如式(12)。
b = 2.303RT/(afF) (12)
af= np+ nqβf(13)
式中,b为塔菲尔斜率(mV·dec−1),R为理想气体常数(8.314 J·mol−1·K−1),T 为反应温度(K),af为传递系数,np为速率控制步骤前电子转移个数,nq为速率控制步骤电子转移个数(1,或0 (化学控制步骤)),βf为对称因子(一般取0.5)。
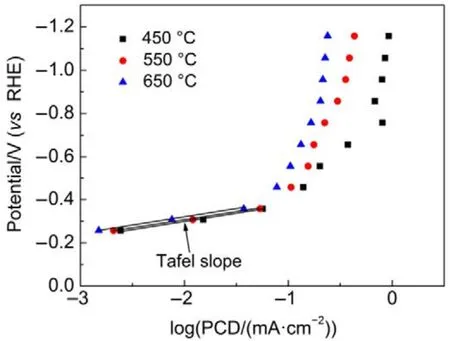
图7 TiO2NTs-450、TiO2NTs-550和 TiO2NTs-650电极上产CH3OH的塔菲尔曲线Fig.7 Potential versus methanol production partialcurrent density on TiO2NTs-450, TiO2NTs-550 and TiO2NTs-650 electrodes.
基于公式(12)24,当第一电子转移为控制步骤时,其塔菲尔斜率应为120 mV·dec−1,与本实验值70 mV·dec−1(图 7)不一致;而当第二步化学反应为速率控制步骤时,塔菲尔斜率为 60 mV·dec−1与本实验值接近,这说明·CO2−得质子反应为 TiO2NTs电极上电化学还原CO2的速率控制步骤。这可能是因为Ti(III)参与了CO2的电化学还原过程,从而加速了CO2得电子反应(式(7))。为证明此推断,考察了三个电极比活性与本征 Ti(III)含量之间的关系,以扣除电化学表面积的影响,具体结果如图8所示。
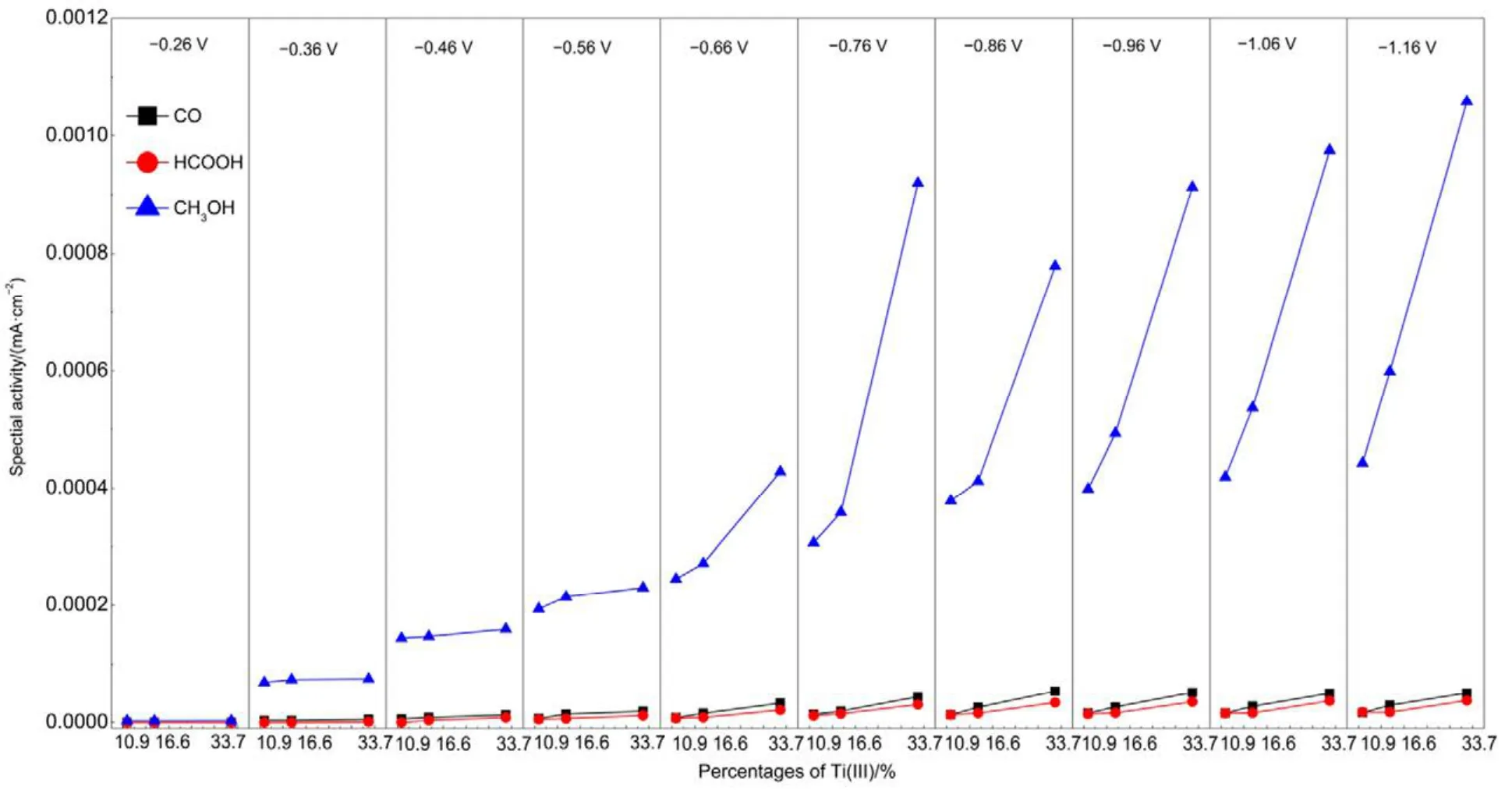
图8 CO2还原产物的比活性与Ti(III)含量的关系Fig.8 Specific activity of products formed from CO2electroreduction versus percentages of Ti(III).
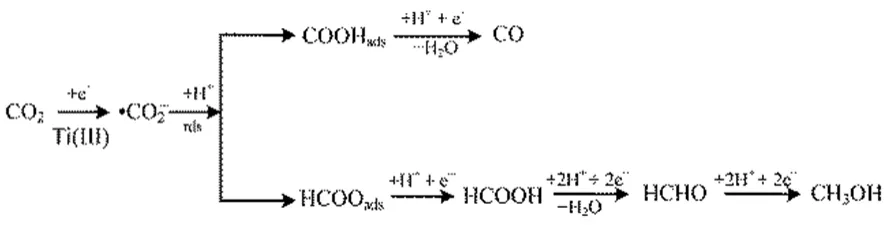
图9 TiO2NTs电极上CO2电化学还原途径Fig.9 Proposed reaction pathway for CO2 electroreduction on the TiO2NTs electrode.
由图8可知,TiO2NTs电极上CO2各还原产物的比活性与 Ti(III)的含量成正相关,说明电极表面的Ti(III)有利于CO2电还原,Weitz等25认为Ti(III)位为弱路易斯酸位,在其邻位存在相应的强路易斯碱位[O],CO2中的C原子与[O]位结合,从而形成Ti2O-CO2;或者CO2中的C原子直接与Ti3+结合,同时CO2中的O原子占据相邻的氧空位,从而形成TiO2-COOH。Xiong等26通过CO2-TPD实验也证明这一结论。因此推断出TiO2NTs电极上CO2电化学还原为CH3OH的途径如图9所示,由于Ti(III)的存在,促进了·CO2−的生成,导致控速步骤转变为·CO2−得质子反应。
4 结 论
(1) 通过阳极氧化-高温煅烧法制备了TiO2NTs电极,采用XRD、XPS、FESEM和双电位阶跃等技术对电极表面结构、形貌及粗糙程度进行表征,结果表明所制备的TiO2NTs电极由管径约为69−82 nm,管壁厚度为24−27 nm的纳米管组成,随着煅烧温度的升高,Ti(III)含量降低,且氧空位数量减少。
(2) 电催化实验结果表明,CO2电化学还原的主要含碳产物为CH3OH、CO、HCOOH和HCHO,其中CH3OH为主产物。在电解电位为−0.56 V时,电化学还原120 min后TiO2NTs-450、TiO2NTs-550和TiO2NTs-650电极上CH3OH的法拉第效率分别为85.8%、78.6%和72.2%,对应的分电流密度为0.2、0.16和0.10 mA·cm−2。
(3) TiO2NTs电极上电化学还原CO2为CH3OH机理研究表明,CH3OH是以HCOOH和HCHO为中间产物生成的。电极表面的Ti(III)含量与电极催化活性成正相关,·CO2−得质子反应为速率控制步骤。
(1) Qiao, J. L.; Liu, Y. Y.; Hong, F.; Zhang, J. J. Chem. Soc. Rev. 2014,43, 631. doi: 10.1039/c3cs60323g
(2) Ritter, S. K. Chem. Eng. News. 2007, 85(18), 11.
(3) Mistry, H.; Reske, R.; Zeng, Z.; Zhao, Z. J.; Greeley, J.; Strasser, P.;Cuenya, B. R. J. Am. Chem. Soc. 2014, 136, 16473.doi: 10.1021/ja508879j
(4) He, Z. Q.; Tang, J. T.; Shen, J.; Chen, J. M.; Song, S. Appl. Surf. Sci.2016, 364, 416. doi: 10.1016/j.apsusc.2015.12.163
(5) Liu, Z. F. Acta Phys. -Chim. Sin. 2016, 32, 793. [刘忠范. 物理化学学报, 2016, 32, 793.] doi: 10.3866/PKU.WHXB201602181
(6) Lee, C. H.; Kanan, M. W. ACS Catal. 2014, 5, 465.doi: 10.1021/cs5017672
(7) Olah, G. A.; Goeppert, A.; Prakash, G. K. S. J. Org. Chem. 2008, 74,487. doi: 10.1021/jo801260f
(8) Canfield, D.; Frese, K. W., Jr. J. Electrochem. Soc. 1983, 130, 1772.doi: 10.1149/1.2120090
(9) Summers, D. P.; Leach, S.; Frese, K. W., Jr. J. Electroanal. Chem.1986, 205, 219. doi: 10.1016/0022-0728(86)90233-0
(10) Seshadri, G.; Lin, C.; Bocarsly, A. B. J. Electroanal. Chem. 1994,372, 145. doi: 10.1016/0022-0728(94)03300-5
(11) Le, M.; Ren, M.; Zhang, Z.; Sprunger, P. T.; Kurtz, R. L.; Flake, J.C. J. Electrochem. Soc. 2011, 158, E45. doi: 10.1149/1.3561636
(12) Qu, J. P.; Zhang, X. G.; Wang, Y. G.; Xie, C. X. Electrochim. Acta 2005, 50, 3576. doi: 10.1016/j.electacta.2004.11.061
(13) Zhao, F. M.; Yan, F.; Qian, Y.; Xu, Y. H.; Ma, C. A. J. Electroanal.Chem. 2013, 698, 31. doi: 10.1016/j.jelechem.2013.03.014
(14) Water Quality-Determination of Formaldehyde-Acetylacetone Spectrophotometric Method. GB/T 1397-1991. [水质甲醛的测定—乙酰丙酮分光光度法. GB/T 13197-1991.]
(15) Liu, L. J.; Li, Y. Aerosol. Air Qual. Res. 2014, 14, 453.doi: 10.4209/aaqr.2013.06.0186
(16) Zhang, H.; Chen, J. H.; Chen, H. B.; Lin, C. J. J. Mol. Catal. 2006,20, 249. [张 慧, 陈建华, 陈鸿博, 林昌健. 分子催化, 2006, 20,249.] doi: 10.16084/j.cnki.issn1001-3555.2006.03.013
(17) Wang, W.; Ni, Y. R.; Lu, C. H.; Xu, Z. Z. RSC Adv. 2012, 2, 8286.doi: 10.1039/c2ra21049e
(18) Goeppert, A.; Czaun, M.; Jones, J. P.; Prakash, G. K. S.; Olah, G. A.Chem. Soc. Rev.2014, 43, 7995. doi: 10.1039/c4cs00122b
(19) Chen, X. W. Study on Preparation of Modified TiO2Nanotube Photoelectrode and Its Photoelectrocatalytic Degradation of Diclofenac. Ph. D. Dissertation, Harbin Institute of Technology,Harbin, 2014. [程修文. 改性TiO2纳米管光电极制备及光电催化降解双氯芬酸研究[D]. 哈尔滨: 哈尔滨工业大学, 2014.]
(20) Russell, P. G.; Kovac, N.; Srinivasan, S.; Steinberg, M. J.Electrochem. Soc. 1977, 124, 1329. doi: 10.1149/1.2133624
(21) Jitaru, M.; Lowy, D. A.; Toma, M.; Toma, B. C.; Oniciu, L. J. Appl.Electrochem. 1997, 27, 875. doi: 10.1023/a:1018441316386
(22) Innocent, B.; Pasquier, D.; Ropital, F.; Hahn, F.; Léger, J. M.;Kokoh, K. B. Appl. Catal. B2010, 94, 219. doi:10.1016/j.apcatb.2009.10.027
(23) Hori, Y.; Murata, A.; Takahashi, R. J. Chem. Soc., Faraday Trans.1989, 85, 2309. doi: 10.1039/F19898502309
(24) Fletcher, S. J. Solid State Electrochem. 2009, 13, 537.doi: 10.1007/s10008-008-0670-8
(25) Bhattacharyya, K.; Danon, A. K.; Vijayan, B. K.; Gray, K. A.; Stair,P. C.; Weitz, E. J. Phys. Chem. C 2013, 117, 12661.doi: 10.1021/jp402979m
(26) Xiong, L. B.; Li, J. L.; Yang, B.; Yu, Y. J. Nanomater. 2012, 2012,1. doi: 10.1155/2012/831524
Electrochemical Reduction of CO2to Methanol at TiO2Nanotube Electrodes
QIU Jian-Ping1,2TONG Yi-Wen1ZHAO De-Ming3HE Zhi-Qiao1CHEN Jian-Meng1SONG Shuang1,*
(1College of Environment, Zhejiang University of Technology, Hangzhou 310032, P. R. China;2Jinhua Polytechnic, Jinhua 321007, Zhejiang Province, P. R. China;3College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310032, P. R. China)
A series of highly ordered TiO2nanotube (TiO2NTs) electrodes are prepared via potentiostatic anodization of Ti foil followed by calcining in air. X-ray diffraction (XRD), field-emission scanning electron microscopy (FESEM), X-ray photoelectron spectroscopy (XPS), and potential steps determination are used to characterize the electrodes. The electrochemical reduction of CO2on these three TiO2NTs electrodes is investigated by cyclic voltammetry and potentiostatic electrolysis in 0.1 mol·L−1KHCO3aqueous solution. Methanol is found to be the major product in electrochemical CO2reduction, while formic acid, formaldehyde, methane, and CO are formed as minor products. Compared with the electrodes sintered at 550 and 650 °C, the optimal TiO2NTs electrode is found to be the one calcined at 450 °C (TiO2NTs-450). After 120 min of reaction, the Faradaic efficiency and partial current density of methanol is 85.8% and 0.2 mA·cm−2at −0.56 V vs reversible hydrogen electrode (RHE), respectively. The trivalent titanium in TiO2serves as an efficient site for adsorption of CO2and stabilization of the adsorbed ·CO2−radical. Consequently, the reduction of CO2on TiO2NTs electrodes involves a fast firstelectron and proton transfer followed by a slow second proton transfer as the rate-limiting step.
TiO2nanotube electrode; Electrochemical reduction; CO2; Methanol;Reaction mechanism
December 21, 2016; Revised: March 24, 2017; Published online: April 7, 2017.
O646
10.3866/PKU.WHXB201704078 www.whxb.pku.edu.cn
*Corresponding author. Email: ss@zjut.edu.cn; Tel: +86-571-88320726.
The project was supported by the National Natural Science Foundation of China (21477117) and Natural Science Foundation of Zhejiang Province, China(LR14E080001, LQ15E080007, LY15B070005).
国家自然科学基金(21477117)和浙江省自然科学基金(LR14E080001, LQ15E080007, LY15B070005)资助项目
© Editorial office of Acta Physico-Chimica Sinica
