金黄色葡萄球菌的耐药性分析
2017-10-24王前勇武汉市农业学校湖北武汉430043
董 尧 王前勇 (武汉市农业学校 湖北 武汉 430043)
试验研究
金黄色葡萄球菌的耐药性分析
董 尧 王前勇 (武汉市农业学校 湖北 武汉 430043)
为调查金黄色葡萄球菌的耐药性现状,用世界卫生组织(WTO)推进的Kirby-Bauer法,完成11株金黄色葡萄球菌对林可霉素、头孢氨苄、丁胺卡那霉素、青霉素G、恩诺沙星、庆大霉素、万古霉素、复方新诺明、氨苄青霉素、氟哌酸、红霉素、阿莫西林12种抗菌药的药敏试验,试验按美国临床实验室标准化委员会(NCCLS)1999年版标准进行判定。结果表明:金黄色葡萄球菌对万古霉素100%敏感,对头孢氨苄和丁胺卡那霉素的敏感程度仅次于万古霉素。但是对β-内酰胺类抗生素几乎全部耐药。对林可霉素、恩诺沙星、庆大霉素、复方新诺明、氟哌酸、红霉素的耐药率分别为63.6%、36.4%、9.1%、45.5%、63.6%、81.8%。
金黄色葡萄球菌 耐药性 抗生素
由于抗菌药的广泛使用,导致耐药菌株的不断增加,尤其是广谱抗菌药的滥用,造成了耐药突变株的大量出现。从而使经验用药失败率增高,重症感染因抗菌药物剂量不足,而延误治疗,或盲目加大剂量造成中毒。细菌的耐药性不断增加,使临床用药愈显棘手。
在兽医领域,临床上许多动物疾病,在没有得到确诊的情况下,就大剂量使用广谱抗菌药,因而造成细菌耐药性的普遍存在[1]。而在规模化养殖场生产中,抗菌药长期作为预防药物使用,这样便为细菌耐药性的增强,提供了便利的“温床”。如此,一旦规模化养殖场中爆发流行性疾病,便会在抗菌药的选用以及抗菌药剂量的选择上,很难做出判断。这样便需要对细菌的耐药性做好监测和分析,以便了解抗菌药对其的临床治疗效果[2]。而金黄色葡萄球菌无论是在临床还是规模化养殖生产中,都让人觉得棘手的病原菌。由于其耐药机制复杂,耐药谱广,耐药突变株多等诸多性质,使对其耐药性监测显得更为重要[3]。因而可以利用药敏试验对金黄色葡萄球菌进行耐药性监测,以此为临床用药提供科学依据。
1 材料和方法
1.1 材料
1.1.1 试验菌株 11株金黄色葡萄球菌菌株分别从不同地区的临床标本中分离,纯培养后得到。其中猪源6株,气源2株,鸡源1株,羊源1株。
1.1.2 质控菌株 金黄色葡萄球菌ATCC25923,由中国药品检察所提供。
1.1.3 抗菌药纸片 林可霉素Lincomycin(30µg/片),头孢氨苄Cefalexin(30µg/片),丁胺卡那霉素Amikacin(30µg/片),青霉素G Penicillin(10U/片),恩诺沙星Enfloxacin(5µg/片),庆大霉素Gentamycin(10µg/片),万古霉素Vancomycin(30µg/片),复方新诺明SMZ/TMP(23.75/1.25g/片),氨苄青霉素Ampicillin(10µg/片),氟哌酸Norfloxacin(10µg/片),红霉素Erythromycin(15µg/片),阿莫西林Amoxicillin(10µg/片)12种抗菌药纸片,由杭州天和微生物试剂有限公司提供,生产批号均为:20030417。零下20℃保存,有效期2年。
1.1.4 试剂 氯化钡、1%硫酸、蛋白胨、牛肉浸膏等;MH肉汤,普通营养琼脂由实验室自制,MH琼脂由杭州天和微生物试剂有限公司提供。
1.1.5 培养皿 直径90mm的一次性塑料培养皿,环氧。
1.1.6 单糖发酵管和麦氏比浊管 6种单糖发酵管:蕈糖、甘露醇、松二糖、纤维二糖、木糖、麦芽糖、蔗糖,现购自杭州天和微生物试剂有限公司。0.5号麦氏比浊管由本实验室自制。
1.2 方法
1.2.1 细菌鉴定 取纯培养菌落进行革兰氏染色镜检,根据其染色及形态特征,做血浆凝固酶,甘露醇发酵试验等生化鉴定。
1.2.2 质量控制试验[4]质量控制试验是在药敏试验相同条件下,同样采取Kirby-Bauer法进行质控菌株的药敏试验。
1.2.3 药敏试验 采用Kirby-Bauer[4,5]。(1)增菌液的制备:可溶性淀粉1.5g,酸水解酪蛋白17.5g,牛肉膏6g,蒸馏水1000ml。将上述成分混合,校正pH値至7.2~7.4,121℃15min高压灭菌后,4℃冰箱保存,使用1个月。(2)0.5号麦氏比浊管制备:在10ml的小试管中,将1%氯化钡0.5ml和1%硫酸9.5ml充分混合后,即成相当于10 ℃ C FU/ml 的菌浓度。在使用时应充分摇匀。(3)MH琼脂平板的制备:临用时,取36gMH琼脂粉,加1000ml蒸馏水混合,校正pH值至7.2~7.4,121℃15min高压灭菌后,冷却至45℃左右,倾注培养皿,培养基厚度为4mm,凝固备用。(4)药敏试验:在已分纯的待测菌平板上挑取4~5个直径约1mm左右的菌落接种到3~5mlMH肉汤中,35℃培养6~8h。用无菌生理盐水校正菌液浊度汁0.5麦氏比浊管标准,菌液校正后应在15min内接种完成。无菌棉拭子蘸取菌液,在MH平板表面均匀涂布接种3次,每次旋转平板60度,最后沿平板内缘涂抹一周。涂布菌液的平板于室温中干燥3~5min后,用无菌镊子去药敏纸片,贴于平板表面,并轻压纸片,使其贴平。每张纸片的间距不应少于24mm,纸片的中心距平板的边缘不小于15mm,90mm的平板贴6张为宜。将贴好的纸片的平板置于35℃孵育18~24h后,用游标卡尺量取抑菌圈直径。将所测得抑菌圈直径,与NCCLS1999年公布的相应抗生素敏感性判定标准比较,判定结果为敏感(s)、耐药(R)或中度敏感(I)。
2 结果
2.1 细菌鉴定结果
取纯培养菌落进行革兰氏染色,镜检,镜下均呈现蓝紫色的(呈革兰氏阳性着色的)葡萄串状球菌[9]。生化鉴定结果:在血浆凝固酶试验中,玻片法与试管法均变浑浊,呈阳性,见表1.

表1 细菌生化鉴定结果
2.2 质量控制试验结果
药敏试验应NCCLS的要求在一周内完成,在一周内做3次质量控制试验,3次的质控菌株药敏试验结果见表2,与质控标准比较,结果均在控制范围。
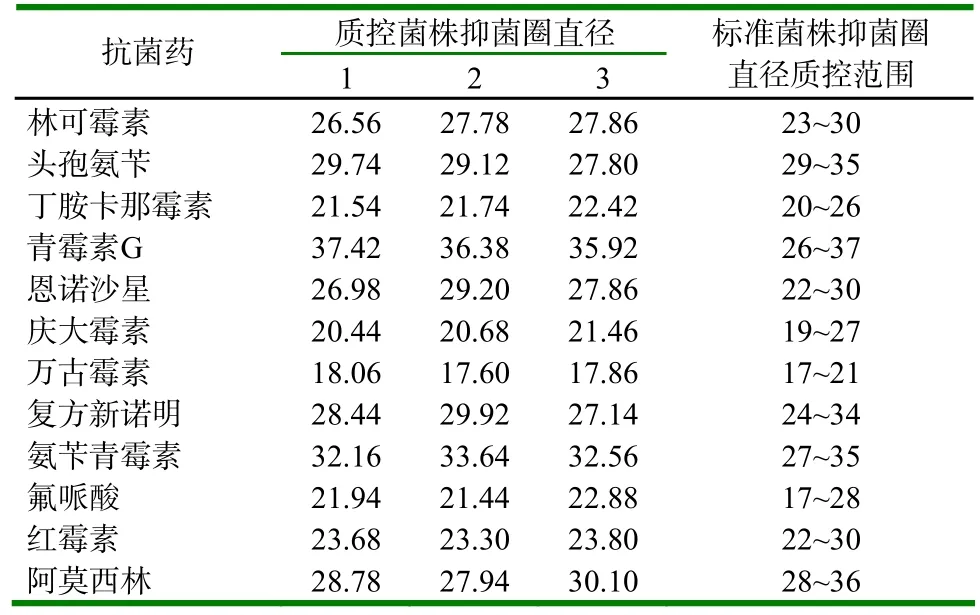
表2 质量控制试验结果及标准菌株质控范围 (mm)
2.3 试验菌株药敏试验结果
所测得的12种抗菌药对11株金黄色葡萄球菌的抑菌圈大小见表3。
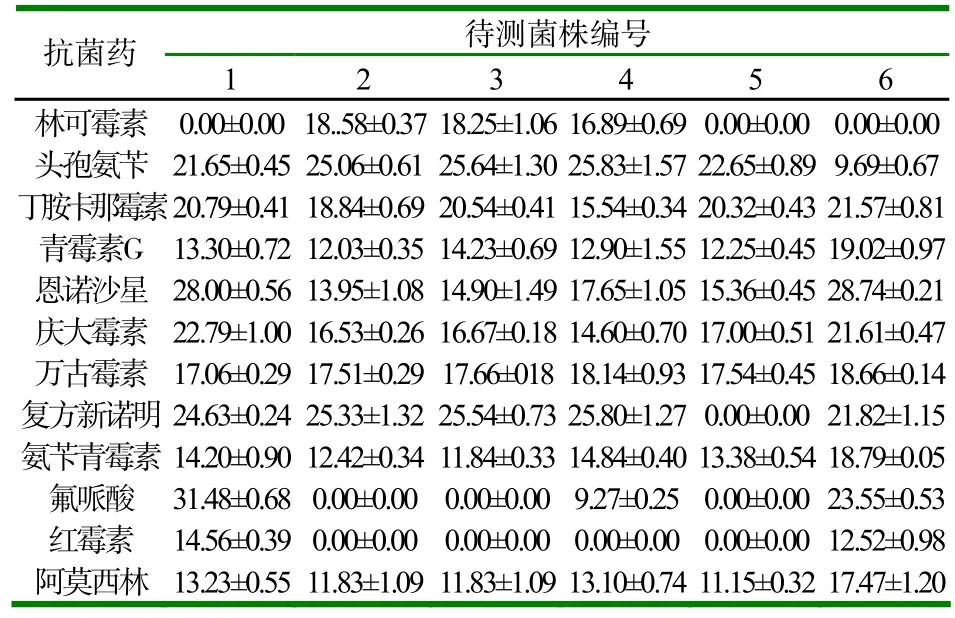
表3 药敏试验结果(x±SD,n=6) (mm)

续表 药敏试验结果(x±SD,n=6) (mm)
12种抗生素对金黄色葡萄球菌的体外抗菌活性表明,仅万古霉素敏感率为100%,对β-内酰胺类抗生素几乎全部耐药。对林可霉素、恩诺沙星、庆大霉素、复方新诺明、氟哌酸红霉素等的耐药率分别为63.6%、36.4%、9.1%、45.5%、63.6%、81.8%。其中对头孢氨苄、丁胺卡那霉素的敏感性程度也较高(见表4)。

表4 金黄色葡萄球菌的耐药率
3 讨论
3.1 方法的选择与评价
Kirby-Baeur 法为世界卫生组织推荐的体外抗菌药物敏感性试验的标准方法,它的优点是操作方法简单,试剂量较低,不需要特殊设备,易于人为判断,可自由选择抗菌药物[10]。但是试验必须标准化,即必须在NCCLS所规定的一系列标准下,进行严格的试验操作,以减少人为的失误因素,以及避免抗菌药扩散早期的浓度梯度不稳地性所产生的缺点。同时必须在统计学上与产生判定结果的抑菌圈直径相关,才能对结果作出临床意义的评价[11]。在抑菌圈直径测量方面应当注意:在金黄色葡萄球菌对万古霉素的抑菌圈内允许有少量细菌的存在,在量取结果时,可忽略不计,以外圈为准[12]。
3.2 金黄色葡萄球菌的耐药机制
3.2.1 产生β-内酰胺酶 大部分金黄色葡萄球菌菌株能产生青霉素(一种β-内酰胺酶),β-内酰胺酶早在β-内酰胺类抗生素应用于临床前便已经发现,并不是细菌生长所必需的,因为其唯一功能是水解β-内酰胺[13]。
3.2.2 PBP改变介导的细菌耐药 PBP改变包括获得新的对抗生素低亲和力的PBP和本身发生修饰导致对抗生素低亲和力的PBP,从而导致耐药[13]。
3.2.3 DNA螺旋酶的改变 金黄色葡萄球菌在对喹诺酮类药物耐药时,易发生DNA螺旋酶的改变[14]。
3.2.4 主动外排系统 在金黄色葡萄球菌的细菌外膜上还有特殊的药物泵出外排系统,使细菌内的药物浓度不足以发挥抗菌而导致耐药[15]。
3.2.5 其它机制 金黄色葡萄球菌 可通过增加对抗菌药物拮抗物的产量而耐药[15]。
3.3 耐药性研究的意义
(1)本组药敏试验结果显示,金黄色葡萄球菌对常用抗生素药物敏感性均呈下降趋势,它对青霉素G、氨苄青霉素和阿莫西林的耐药性的耐药性率最高,几乎都为100%。此类药物均为β-内酰胺类抗生素,说明金黄色葡萄球菌的耐药即使仍是以产生β-内酰胺酶为主,因此临床用药时,一般不采用此类药物[16]。而万古霉素对金黄色葡萄球菌活性最佳,无1株耐药。虽然如此,但体外实验证实,高水平的万古霉素耐药性可从肠球菌转移到金黄色葡萄球菌,且Noble已经在实验室构建了耐万古霉素金黄色葡萄球菌,其预示着金黄色葡萄球菌耐万古霉素的可能性[17]。因此临床应用时不应该把万古霉素作为预防和常规治疗金黄色葡萄球菌感染的首选要[18]。(2)在兽医领域,由于目前许多现代化养殖场普遍使用抗菌药物预防各类疾病,且使用抗菌药物作为饲料添加剂,同时有不少养殖场发生疾病时,常不做药敏试验就主观投药,从而破坏了敏感菌株与耐药菌株之间的细菌区系的菌态平衡,使敏感菌株受到抑制,耐药菌株得以优先繁殖。从本组药敏试验结果来看,金黄色葡萄球菌对某些药物的耐药性,虽然要比近年来人医所检测到的耐药性要弱,但是因为对于细菌的耐药性的重视程度,兽医远不及人医。那么如果常此以往,对付细菌耐药性的工作,兽医将比人医更显棘手。目前在细菌耐药性监测方面,人医领域已经较具规模,且正在不断完善;在兽医领域,监测工作做得却很不够,所以应该尽早在该领域做好耐药菌的监测与检测,从而指导兽医临床用药。
4 结论
本试验严格按照NCCLS规定的一系列标准,进行实验操作,所得数据真实、可靠。12种常用抗生素对金黄色葡萄球菌的体外抗菌活性表明,仅万古霉素敏感率为100%,对β-内酰胺类抗生素几乎全部耐药。对头孢氨苄、丁胺卡那霉素的敏感率均为90.9%,而对林可霉素、恩诺沙星、庆大霉素、复方新诺明、氟哌酸、红霉素等的耐药率分别为63.6%、36.4%、9.1%、45.5%、63.6%、81.8%,所以,临床选用药物时应尽量选择头孢氨苄、丁胺卡那霉素、庆大霉素等敏感药物,但万古霉素虽然极其敏感,却不宜作为首选药和临床一线药。
[1] 李乾学, 阎继业, 邓旭明等. 吉林省动物源性金黄色葡萄球菌和链球菌的耐药性监测[J]. 吉林畜牧兽医, 2002, 6: 7-8.
[2] 甘孟侯, 鸡葡萄球菌研究资料汇编[D]. 北京: 中国农业大学兽医学院. 1992.
[3] 裴建武, 甘孟侯. 鸡源金黄色葡萄球菌耐药性转移的研究[J]. 中国兽医杂志. 1996, 22(4): 7-9.
[4] 周庭银, 赵虎主编, 临床微生物学诊断与图解[M]. 上海: 上海科学技术出版社, 2001.
[5] NCCLS, Performantance standards for antimicrobial susceptibility testing[J]. Ninth informational Supplement, M100-A9. 1999.
[6] 桂炳东, 孙敬, 徐建民主编. 细菌药物敏感性试验测定手册[M].南昌: 江西科学技术出版社, 2001.
[7] 张卓然主编. 医学微生物实验学第2版[M]. 北京: 科学出版社,1998
[8] 于玺华主编. 现代空气微生物学[M]. 北京: 人民军医出版社,2002.
[9] C. A. Hart,P. Shears. Diagnosis in color Medical Mircobiology International of Harcourt Publishers Limited ,Spain,2001.
[10] 王辉, 陈民钧, 许英春等. 简要介绍美国NCCLS药敏试验纸片扩散法规(续)[J]. 中华医药检验杂志, 1995, 18(2): 118.
[11] National Committee for Clinical Laboratory Standards . Perforance standards for antimicrobials suspceptibility testing . 10th inform suppl.M2-A7 and M7-A5. NCCLS ,Wayne,Wayne,pa,2000;48-52.
[12] 王清涛, 杜小玲. 金黄色葡萄球菌耐药性分析[J]. 中华医药检验杂志, 1996, 19(4): 186.
[13] 何述祥. 金黄色葡萄球菌耐药性的变迁和耐药机理[J]. Inner Mongolia Mongolia MedJ. 2001, 33(4): 342-345.
[14] 倪语星, 洪秀华. 细菌耐药性检测与抗感染治疗[M]. 北京: 人民军医出版社, 2002.
[15] 雷连成. 细菌的耐药性[J]. 中国兽医杂志. 2002, 36(11): 41-44, 49.[16] 李光辉, 张婴元. 耐甲氧西林葡萄球菌研究现况[J]. 国外医学(内科学分册). 1994, 21(6): 390.
[17] 苏建荣, 马继平, 许淑珍等. 耐甲氧西林选择培养基的研究[J],中华医学检验杂志. 1996, 19(2): 73.
[18] 陈民钧, 任冰, 谢秀丽等. 万古霉素等十种抗生素对耐苯唑西林的葡萄球菌的体外活性比较[J]. 中华传染病杂志, 1997, 15(2): 125.
S852.61+1
A
1007-1733(2017)10-0001-04
2017–04–07)
