含胸苷激酶自杀基因的重组腺病毒预防肝细胞癌术后复发的疗效分析
2017-10-23杜松涛张劲光
孟 健, 杜松涛, 张劲光
(首都医科大学附属北京佑安医院, 北京 100069)
论著/肝脏肿瘤
含胸苷激酶自杀基因的重组腺病毒预防肝细胞癌术后复发的疗效分析
孟 健, 杜松涛, 张劲光
(首都医科大学附属北京佑安医院, 北京 100069)
目的观察外科手术联合基因治疗对预防肝细胞癌(HCC)术后复发的疗效。方法选取2006年7月-2013年2月首都医科大学附属北京佑安医院收治的102例单发HCC患者(肿瘤分期TNM1~2期,肿瘤直径<10 cm), 对其中60例患者在手术前后联合含胸苷激酶自杀基因的重组腺病毒(ADV-TK)基因治疗(基因组),42例患者采用单纯手术切除(手术组),对患者术后复发情况进行定期随访。2组患者的临床资料比较采用t检验(计数资料)和χ2检验(计量资料);采用log-rank检验分析2组患者的累积复发率,采用单因素和多因素Cox回归分析对患者复发率有显著影响的因素。结果基因组1、3、5年的肿瘤复发率为13.8%、33.7%和47.7%, 手术组为18.5%、53.2%和69.2%,2组累积复发率比较,差异有统计学意义(χ2=2.643,P=0.041)。除术后基因组发热患者显著多于手术组外,2组并发症发生率以及住院时间无明显差别。多因素分析显示,基因治疗是肿瘤累积复发率的独立影响因素(比值比=2.752,95%可信区间:1.164~4.251,P=0.038)。结论在手术切除的基础上联合基因治疗,可以有效减少术后肿瘤复发,值得临床推广。
癌, 肝细胞; 基因疗法; 复发
随着肝胆外科技术的发展,大部分肝细胞癌(HCC)患者都能获得手术切除的机会,但术后肿瘤复发率居高不下,成为困扰肝胆外科医生的重要难题之一。基因治疗是近几年来在国际发展起来的一种有别于传统治疗的非常规方法,通过不同的基因载体将病毒整合于肿瘤细胞中,引发某种基因改变使肿瘤细胞自行凋亡或者提高对特定药物的敏感性,为一些难治性肿瘤提供了一种新的思路,这种方法在妇科及胃肠肿瘤的治疗中已经得到了广泛应用并观察到了较好的效果[1],但其在肝癌的临床应用中尚缺少相关的临床数据和资料。为了观察基因治疗对预防肝癌术后复发的影响及长期疗效,解决术后肝癌复发的难题,为提高目前国内肝癌外科治疗水平提供新的思路,本院在2000年开始对裸鼠体内肝癌和体外肝癌细胞进行了基因治疗,结果发现其能有效的抑制肿瘤细胞生长,未观察到明显毒副作用[2]。在此基础上,进一步采用含胸苷激酶自杀基因的重组腺病毒(ADV-TK)基因对HCC患者进行了试验性治疗,观察了术后复发率,现报告如下。
1 资料与方法
1.1 研究对象 选取2006年7月-2013年2月在本院肝胆外科治疗的HCC患者。纳入标准:(1)年龄40~60岁(肝癌多人群,有代表性);(2)术前经临床影像学诊断单发肿瘤直径<10 cm,无明确淋巴结及远处转移,TNM分期1~2期(无肝内大血管侵犯);(3)手术完整切除肿瘤,术后病理诊断为HCC,病理切缘距肿瘤>2 cm。排除标准:(1)术前已有介入或者其他肿瘤治疗史;(2)服用免疫抑制剂或者其他影响免疫功能药物的患者;(3)术中或术后出现严重并发症在1个月内死亡;(4)严重肝硬化,肝功能Child-Pugh分级B~C级;(5)严重脾功能亢进,PLT<5.0×109/L;(6)有其他脏器的功能不全以及对更昔洛韦过敏等不适合进行基因治疗的患者。本研究获得本院伦理委员会批准,所有参加试验的患者均签属了知情同意书。
1.2 研究方法和分组标准 共有102例患者参加了试验,在治疗前将基因治疗的方法、费用及可能产生的副作用向患者及家属讲明,然后根据自愿的原则由患者自主选择分组和治疗的方法。在术前符合研究要求的患者中,有60例患者采用了基因+手术治疗(基因组),其他42例患者采用单纯的手术切除(手术组)。
1.3 基因治疗方法 基因组患者分别进行至少3次或者多次基因注射。注射用基因为ADV-TK(浓度5×1012/ml),共分3次(或者多次)进行注射。第1次于术前在B超引导下通过穿刺针经皮注射,3~4 ml/次,以生理盐水100 ml稀释后使用,注射于肿瘤中心及四周;第2次在术中注射于肝断面、隔肌、肾包膜、后腹膜及胃网膜血管,2~3 ml/次,以生理盐水100 ml稀释后使用;第3次在术后2周通过介入方法,经导管于肝动脉内注射基因2~3 ml(根据情况可多次注射,每次间隔1~2个月)。每次基因治疗后常规静脉滴注更昔洛韦,0.25 g/次,2次/d,持续2周。术后根据患者情况,可通过介入进行多次局部或者全身治疗。
1.4 观察指标 术后每月对患者随访1次,随访内容包括AFP、肝功能、B超,如有可疑,即行CT或者MRI检查以明确诊断,必要时对患者行PET-CT或者肝穿刺检查,随访终点为肿瘤复发或者死亡。复发定义为术后CT或MRI检查见肝内肝外再次出现HCC或者AFP明显升高。观察指标包括术前肿瘤大小、肝功能、AFP、异常凝血酶原[维生素K缺乏或拮抗剂Ⅱ诱导的蛋白质 (protein induced by vitamine K absence or antagonist-Ⅱ,PIVKA-Ⅱ)]、术后病理结果(分化程度)、术后1个月内并发症及住院天数,主要观察指标为肿瘤累积复发率以及对其有显著影响的因素。
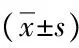
2 结果
2.1 一般资料 在参加试验的102例患者中,最终有92例患者完成了试验(基因组54例,手术组38例),10例患者未完成基因治疗疗程或者术后无法进行定期随访确定肿瘤复发时间。术前2组患者的肿瘤大小、肝功能、PLT以及肿瘤标志物、PIVKA-Ⅱ比较,差异均无统计学意义(P值均>0.05)(表1)。基因组54例患者中,有28例进行了局部切除,17例进行了1个肝段的切除,9例进行了2个肝段及以上的切除;术后病理结果6例为高分化癌,其余48例患者为中-低分化癌。手术组38例患者中,19例进行了局部切除,11例进行了1个肝段切除,8例进行了2个肝段及以上的切除;术后病理结果7例为高分化癌,其余31例为中-低分化癌。2组术后并发症比较,除发热基因组高于手术组外,余下差异均无统计学意义。2组住院时间无明显差异。术后病理切缘及患者术后1个月复查CT结果均未发现有肿瘤残余或者复发。基因治疗后,约88%的患者通过大体标本及病理证实肿瘤坏死明显,并形成完整包膜(图1a~c),而手术组仅有34%的患者有自然形成的包膜,二者相差明显(χ2=3.12,P<0.05)。

表1 2组患者的临床资料比较



图1基因组术前MRI及术后病理标本a:术前在治疗后可见肿瘤与肝组织间有低信号带;b:肿瘤包膜完整,中心有大量坏死细胞;c:包膜由纤维及部分凝固性坏死细胞组成(箭头所示), T示肿瘤, H示正常肝细胞
2.2 临床预后 基因组平均随访时间为(3.9±1.2)年,手术组为(3.7±1.1)年。基因组中肿瘤复发26例,手术组肿瘤复发25例。基因组1、3、5年肿瘤复发率分别为13.8%、33.7%和47.7%;手术组为18.5%、53.2%和69.2%,2组累积复发率比较,差异有统计学意义(χ2=2.643,P=0.041)(图2)。多数肿瘤复发部位在原肿瘤附近,或者肝内其他部位出现新的增强结节。另有2例患者出现肺转移,2例患者为肝门及后腹膜淋巴结转移。

图2 2组患者累积复发率比较

变量单因素分析(P值)多因素分析βP值比值比95%可信区间男/女0.5730.2630.310年龄(岁)(>60vs≤60)0.4830.2010.651基础肝病(乙型肝炎vs丙型肝炎)0.7590.1750.397基因治疗(是vs否)0.0311.1740.0382.7521.164~4.251肝硬化(是vs否)0.1730.4210.205TBil(μmol/L)(>34.2vs≤34.2)0.3920.3180.301PLT(109/L)(>100vs≤100)0.8690.1920.562PTA(%)(>80vs≤80)0.5640.1730.591AFP(ng/ml)(>7vs≤7)0.0290.4180.152PIVKA-Ⅱ(mAU/ml)(>40vs≤40)0.0210.3210.126肿瘤大小(cm)(>2vs≤2)0.1750.2850.375
2.3 与肿瘤累积复发率相关的影响因素分析 单因素分析结果显示,AFP、PIVKA-Ⅱ和基因治疗与肿瘤累积复发率相关;多因素分析结果显示,基因治疗是肿瘤累积复发率的独立影响因素(表2)。
3 讨论
对于可切除的HCC患者,肿瘤复发仍是影响预后的重要因素。研究[3]发现HCC在肝内扩散以及局部的微转移是术后复发的主要原因之一,此外手术过程对肝组织的挤压和推动也加速了肿瘤的转移。所以多数医院在术后采用药物、介入及放疗等方法,防止肿瘤复发。但肝癌一般恶性程度相对较高,对药物敏感性较差,故效果均不明显。因此目前迫切需要一种新的辅助方法防止肿瘤在术后扩散。
根据最新国际研究成果以及本院的前期临床试验,在对肝癌和晚期口腔肿瘤治疗的体外试验中,基因治疗具有良好的疗效[4]。试验中采用的是整合了自杀基因的重组腺病毒,其中病毒作为载体将胸苷激酶基因传入肿瘤细胞,磷酸化并纳入到新生的DNA链中,其编码产生鸟苷化合物(胸苷激酶),可以将无毒性药物前体更昔洛韦转化为细胞毒性药物,从而使肿瘤细胞产生调亡。病毒对代谢和分裂活跃的细胞感染率较高[5],而对正常细胞作用较少,因而可以有效的消灭残留的肿瘤细胞。通过病理检查还发现在基因治疗后,肿瘤组织局部会出现明显的炎症反应,伴有T、B淋巴细胞、巨细胞浸润,纤维组织增生,肿瘤体积缩小并形成完整的包膜,这样减少了肿瘤复发和扩散的机率[6]。所以这是一种新的治疗思路,比传统方式适用性和可重复性高,同时无其他毒副作用,对于肝功能较差的患者同样适用。因此笔者在上述研究的基础上将其用于HCC的临床治疗,发现基因治疗同传统治疗方法相比,患者的无瘤生存率明显提高,说明基因治疗可以延缓和减少肿瘤的复发。通过单因素分析发现与肿瘤累积复发率有关的因子包括AFP、PIVKA-Ⅱ和基因治疗,在多因素分析中独立影响因素仅为基因治疗。这是因为前2个指标主要反映了肿瘤的恶性程度,AFP及PIVKA-Ⅱ高的患者肿瘤恶性程度高,易复发,这一点已经在临床得到证实,而后一项主要反映了治疗因素,所以在单因素分析中也与肿瘤复发相关;在多因素治疗中排除了前二者,是因为基因治疗可以有效的解决恶性程度较高的肿瘤高复发的问题,是与肿瘤复发相关性最强的因素。基因治疗之所以较传统方法疗效更好,除了能够直接抑制肿瘤转移和生长外,还可以通过旁观者效应,使附近肿瘤以及部分正常细胞死亡,与正常肝组织间形成一道纤维屏障,阻止肿瘤细胞向临近播散和内外血管交汇[7],这在本研究术前影像及术后病理中也得到了证实。所以在术前采用基因治疗,就可以有效防止在手术过程中挤压肿瘤所发生的肝内扩散,反复多次治疗可以为再次切除或者射频治疗创造条件。而且这种方法基本无毒副作用,对肝功能不产生损伤,可以通过反复多次使用,达到更好的效果,这一点更是目前其他疗法不具备的。
通过多年的临床试验发现,临床疗效与基因治疗的肿瘤转染率密切相关,这就需要注意以下几个问题。首先是肿瘤体积对治疗的完全性影响较大,这是因为尽管ADV-TK可以通过旁观者效应使临近的肿瘤细胞死亡,但由于腺病毒渗透能力过低,一般来说只有表层及临近的细胞受到转染,而坏死的细胞对内部肿瘤细胞的进一步感染有一定防护作用,这样仅从外围注射难以到达肿瘤内部[8],因此需要多点的内部注射,而对于10 cm以及更大的肿瘤,多点注射转染率也会受到明显影响,甚至大部分肿瘤细胞都无法转染,则难以达到治疗目的,这也是此次试验主要针对10 cm以上肝癌患者的主要原因。此外转染的途径和次数对于转染率也有一定的影响,如果采用传统的全身注射的方式,腺病毒浓度较低,且易被免疫系统破坏,所以为了提高转染率,采用了多次和局部给药的方式,所有患者给药3次或者以上。同时笔者认为作为一种仍处于试验阶段的方法[9],还有下列问题需要进一步研究,主要包括探讨新的载体及其转染方式,使基因转染量增加,以及针对个体的基因化精准应用,制订标准化的基因治疗方案和疗效评估标准。
基因治疗具有安全、创伤小等优点,在肝癌患者的手术治疗过程中,肝切除联合基因治疗可以在清除肿瘤的同时,防止术后复发和转移,提高患者的生存期,是一种值得推广的新的治疗方法。
[1] AJITH TA. Strategies used in the clinical trials of gene therapy for cancer[J]. J Exp Ther Oncol, 2015, 11(1): 33-39.
[2] LI LX, LI N, HE Q, et al. ADV-TK gene inhibits recurrence and metastasis of hepatocellular carcinoma after curative resection in a nude mouse model[J]. Chin J Gen Surg, 2008, 23(6): 454-456.(in Chinese)
李立新, 李宁, 贺强, 等. 局部应用ADV-TK基因防止裸鼠肝癌切除后转移复发的实验研究[J]. 中华普通外科杂志, 2008, 23(6): 454-456.
[3] HUSAIN SR, HAN J, AU P, et al. Gene therapy for cancer: regulatory considerations for approval[J]. Cancer Gene Ther, 2015, 22(12): 554-563.
[4] WANG D, GAO G. State-of-the-art human gene therapy: part II. Gene therapy strategies and clinical applications[J]. Discov Med, 2014,18(98): 151-161.
[5] JIA LT, CHEN SY, YANG AG. Cancer gene therapy targeting cellular apoptosis machinery[J]. Cancer Treat Rev, 2012, 38(7): 868-876.
[6] PAHLE J, WALTHER W. Vectors and strategies for nonviral cancer gene therapy[J]. Expert Opin Biol Ther, 2016, 16(4): 443-461.
[7] SURESH PS, VENKATESH T, TSUTSUMI R. Gene therapy in endocrine tumors: a comprehensive overview[J]. Endocr J, 2014, 61(7): 655-665.
[8] LU CM, XUE YJ, FENG SD, et al. Effect of adenovirus-mediated transfer of HSV-tk/GCV drived by human midkine promoter on human hepato cellular carcinoma in vitro[J].Shandong Med J, 2009, 49(20): 29-32. (in Chinese)
陆春明, 薛彦俊, 封书德, 等. 人Midkine启动子驱动的HSV—TK自杀基因体外抗肝癌作用[J].山东医药, 2009, 49(20): 29-32.
[9] ZHU PL, YIN C, FENG JL. Progress in comprehensive treatment of primary liver cancer[J]. J Clin Hepatol, 2015, 32(6): 4-6. (in Chinese)
祝普利, 尹超, 冯建龙. 原发性肝癌综合治疗进展[J]. 临床肝胆病杂志, 2015, 32(6): 4-6.
Clinicaleffectofrecombinantadenoviruscontainingthymidinekinasesuicidegeneinpreventingpostoperativerecurrenceofhepatocellularcarcinoma
MENGJian,DUSongtao,ZHANGJinguang.
(BeijingYouAnHospital,CapitalMedicalUniversity,Beijing100069,China)
ObjectiveTo investigate the clinical effect of surgical operation combined with gene therapy in preventing postoperative recurrence of hepatocellular carcinoma (HCC).MethodsA total of 102 patients with single HCC (TNM stage 1-2, tumor diameter <10 cm) who were admitted to Beijing YouAn Hospital, Capital Medical University, from July 2006 to February 2013 were enrolled, and among these patients, 60 underwent the gene therapy with recombinant adenovirus containing thymidine kinase suicide gene (ADV-TK) before and after surgery (gene group) and 42 underwent surgical resection alone (surgery group). The patients were followed up regularly after surgery to observe postoperative recurrence. Thet-test was used for comparison of continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. The log-rank test was used for the analysis of cumulative recurrence rate, and univariate and multivariate Cox regression analyses were used to identify influencing factors for recurrence rate.ResultsThe 1-, 3-, and 5-year recurrence rates of tumor were 13.8%, 33.7%, and 47.7% in the gene group and 18.5%, 53.2%, and 69.2% in the surgery group, and there was a significant difference between the two groups (χ2=2.643,P=0.041). The gene group had a significantly higher proportion of patients with pyrexia after surgery than the surgery group, and there were no significant differences in the incidence rates of other complications and length of hospital stay between the two groups. The multivariate analysis showed that gene therapy was an independent influencing factor for cumulative rumulative recurrence rate (odds ratio=2.752,95 confidence interval:1.164-4.251,P=0.038).ConclusionGene therapy combined with surgical resection can effectively reduce postoperative recurrence of tumor, and therefore, it holds promise for clinical application.
carcinoma, hepatocellular; gene therapy; recurrence
R735.7
A
1001-5256(2017)10-1944-05
10.3969/j.issn.1001-5256.2017.10.019
2017-04-25;
2017-06-13。
孟健(1972-),男,副主任医师,主要从事肝癌治疗和肝移植免疫方面的研究。
张劲光, 电子信箱:3522428451@qq.com。
引证本文:MENG J, DU ST, ZHANG JG. Clinical effect of recombinant adenovirus containing thymidine kinase suicide gene in preventing postoperative recurrence of hepatocellular carcinoma[J]. J Clin Hepatol, 2017, 33(10): 1944-1948. (in Chinese)
孟健, 杜松涛, 张劲光. 含胸苷激酶自杀基因的重组腺病毒预防肝细胞癌术后复发的疗效分析[J]. 临床肝胆病杂志, 2017, 33(10): 1944-1948.
(本文编辑:朱 晶)
