Glasgow-Blatchford评分对肝硬化食管胃底静脉曲张破裂出血患者早期预后的预测价值
2017-10-23吕洪敏王凤梅
崔 舒, 王 芳, 吕洪敏, 王凤梅
(天津医科大学三中心临床学院, 天津市第三中心医院 肝病科, 天津市人工细胞重点实验室, 天津市肝胆疾病研究所, 天津 300170)
论著/肝纤维化及肝硬化
Glasgow-Blatchford评分对肝硬化食管胃底静脉曲张破裂出血患者早期预后的预测价值
崔 舒, 王 芳, 吕洪敏, 王凤梅
(天津医科大学三中心临床学院, 天津市第三中心医院 肝病科, 天津市人工细胞重点实验室, 天津市肝胆疾病研究所, 天津 300170)
目的比较Glasgow-Blatchford评分(GBS评分)、Child-Pugh 评分(CTP评分)和终末期肝病模型(MELD)评分对预测肝硬化伴食管胃底静脉曲张破裂出血1周和6周预后的价值。方法回顾性收集自2014年1月1日-2014年12月31日在天津市第三中心医院住院的202例肝硬化伴食管胃底静脉曲张出血患者的病历资料。以入院后6周的最后结局死亡为研究终点,分为1周内死亡组(n=10)、6周内(包含1周)死亡组(n=23)、存活组(n=179)。分别计算其入院时的GBS评分、MELD评分和CTP评分及分级,比较各评分系统在1周内或6周内死亡组和生存组的差异。符合正态分布的计量资料组间比较采用两独立样本t检验,不符合正态分布的采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验或Fisher检验。各评分系统之间受试者工作特征曲线下面积(AUC)的比较采用Z检验。结果1周内死亡组与生存组相比,肝癌伴血管侵犯或转移(χ2=4.559,P=0.033)、肝性脑病(χ2=25.568,P<0.01)、黑便(χ2=0.842,P=0.04)、心力衰竭发生率(P=0.003)、脉搏(Z=-2.943,P=0.003),以及CTP分级(χ2=12.22,P=0.002)、CTP评分(Z=-2.505,P=0.012)、MELD评分(t=-2.395,P=0.018)、GBS评分(Z=-2.545,P=0.011)差异均有统计学意义;6周内死亡组与生存组相比,肝癌(χ2=9.374,P=0.002)、肝癌伴血管侵犯或转移(χ2=14.766,P<0.01)、肝性脑病发生率(χ2=16.327,P<0.01),Alb(Z=-2.770,P=0.006)、胆红素(Z=-3.191,P=0.001)、Hb(Z=-2.484,P=0.013)、血尿素氮(Z=-2.407,P=0.016)、INR(Z=-2.304,P=0.021)、收缩压(t=2.69,P=0.008)、脉搏(Z=-3.507,P<0.01)水平,以及CTP分级(χ2=25.851,P<0.01)、CTP评分(Z=-3.591,P<0.01)、MELD评分(t=-4.121,P<0.01)、GBS评分(Z=-3.54,P<0.01)差异均有统计学意义。预测1周死亡风险,GBS评分[AUC=0.738, 95%可信区间(95%CI): 0.67~0.80]优于MELD评分(AUC=0.731,95%CI: 0.66~0.79)及CTP评分[AUC=0.728, 95%CI: 0.66~0.79)]。预测6周死亡风险,MELD评分(AUC=0.761,95%CI: 0.70~0.89)优于CTP评分(AUC=0.748, 95%CI: 0.69~0.81)及GBS评分(AUC=0.726,95%CI:0.66~0.79)。3种评分系统之间预测1周病死率AUC的比较,GBS评分与CTP评分之间差异有统计学意义(Z=0.079,P=0.037),余各评分系统之间以及3种评分系统预测6周病死率比较,差异均无统计学意义(P值均>0.05)。结论对于肝硬化伴食管胃底静脉曲张破裂出血患者1周死亡风险的预测方面,GBS评分优于MELD评分及CTP评分,6周死亡风险的预测方面,MELD及CTP评分优于GBS评分。
Glasgow-Blatchford评分; 肝硬化; 食管和胃静脉曲张; 预后
急性食管胃底静脉曲张破裂出血作为肝硬化最严重的并发症之一,有着较高的病死率,占所有上消化道出血病例的6%~23%[1]。终末期肝病模型(MELD)在肝硬化静脉曲张出血及预后中具有一定的预测价值[2]。Child-Pugh分级(CTP分级)长期以来也一直用于评价慢性肝病的预后[3]。但目前针对肝硬化伴食管胃底静脉曲张出血患者的早期死亡风险的预测仍缺乏有效的评分系统。Glasgow-Blatchford评分(GBS评分)目前已被广泛应用于急性上消化道出血患者早期死亡风险的评估[4-5],然而,有关静脉曲张性上消化道出血病死率的研究多被排除在外。因此本研究针对GBS评分、MELD评分和CTP分级在预测急性食管胃底静脉曲张破裂出血患者的短期(1周)和院内(6周)病死率的有效性方面进行进一步探讨。
1 资料与方法
1.1 一般资料 纳入2014年1月1日-2014年12月31日在天津市第三中心医院住院治疗的肝硬化门静脉高压症食管胃底静脉曲张破裂出血患者202例。患者于入院12~48 h内经急诊内镜检查确诊,主要临床表现为呕血和(或)黑便。排除标准:(1)在入院前或入院后内镜下诊断为其他原因引起的上消化道出血(如消化性溃疡、反流性食管炎、胃窦血管扩张)的患者;(2)入院时无活动性出血的患者(经外院治疗或自行服药后出血已停止);(3)检查项目不全,无法进行评分的患者;(4)中断治疗要求出院,无法进行随访的患者。202例患者中男155例,女47例,年龄23~88岁,平均56岁。本研究经院伦理委员会批准,所有入选者均知情同意。
1.2 研究指标 患者入院后详细记录其年龄、性别、既往史、合并疾病(如心脏病、 糖尿病、 高血压及恶性肿瘤等)、生命体征、精神状态、呕吐物及大便性状,以及实验室、影像学检查等;并记录患者住院期间的药物使用情况、内镜下表现及干预措施等。将GBS评分、CTP分级、MELD评分所需参数提取出来。CTP分级由以下参数组成:腹水、肝性脑病、血清Alb、TBil、PT[3]。MELD评分由以下公式计算:9.57 ×ln(血清肌酐)+3.78×ln(血清胆红素) +11.2 ×ln(INR)+ 6.43 ×(肝硬化病因:酒精性、胆汁淤积性为0,其余为1)[6]。GBS评分由以下参数组成:血尿素氮(BUN)、Hb、血压、脉搏、黑便、晕厥、肝脏疾病、心力衰竭[4]。在患者入院时分别计算GBS评分、MELD评分和CTP评分的数值。以患者入院时间为临床研究起点,以入院后6周的最后结局死亡为研究终点,短期病死率定义为在入院后1周内死亡,院内病死率定义为入院后6周内死亡。
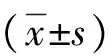
2 结果
2.1 死亡原因分析 根据入院后6周的最终结局将202例患者分为生存组(179例),1周内死亡组(10例,5.0%),6周内(包括1周)死亡组(23例,11.4%)。患者因出血直接或间接致死首要死亡原因:(1)食管胃底静脉曲张破裂出血直接导致死亡9例;(2)出血诱发肝昏迷4例、感染5例、全身衰竭2例、肝衰竭3例。
2.2 基线资料比较 202例患者中肝硬化病因为病毒性的(HBV或HCV)102例(50.49%),酒精性的55例(27.23%),病毒性+酒精性的6例(2.97%),其他原因的39例(19.31%)。共有39例(19.31%)患者诊断为肝癌。1周内死亡组与生存组相比,肝癌伴血管侵犯或转移(χ2=4.559,P=0.033)、肝性脑病发生率(χ2=25.568,P<0.01)、黑便(χ2=0.842,P=0.040)、心力衰竭发生率(P= 0.003)、脉搏(Z=-2.943,P=0.003),以及CTP分级(χ2=12.22,P=0.002)、CTP评分(Z=-2.505,P=0.012)、MELD评分(t=-2.395,P=0.018)、GBS评分(Z=-2.545,P=0.011)差异均有统计学意义;6周内死亡组与生存组相比,肝癌(χ2=9.374,P=0.002)、肝癌伴血管侵犯或转移(χ2=14.766,P<0.01)、肝性脑病发生率(χ2=16.327,P<0.01),Alb(Z=-2.770,P=0.006)、胆红素(Z=-3.191,P=0.001)、Hb(Z=-2.484,P=0.013)、BUN(Z=-2.407,P=0.016)、INR(Z=-2.304,P=0.021)、收缩压(t=2.69,P=0.008)、脉搏(Z=-3.507,P<0.01),以及CTP分级(χ2=25.851,P<0.01)、CTP评分(Z=-3.591,P<0.01)、MELD评分(t=-4.121,P<0.01)、GBS评分(Z=-3.54,P<0.01)差异均有统计学意义(表1)。
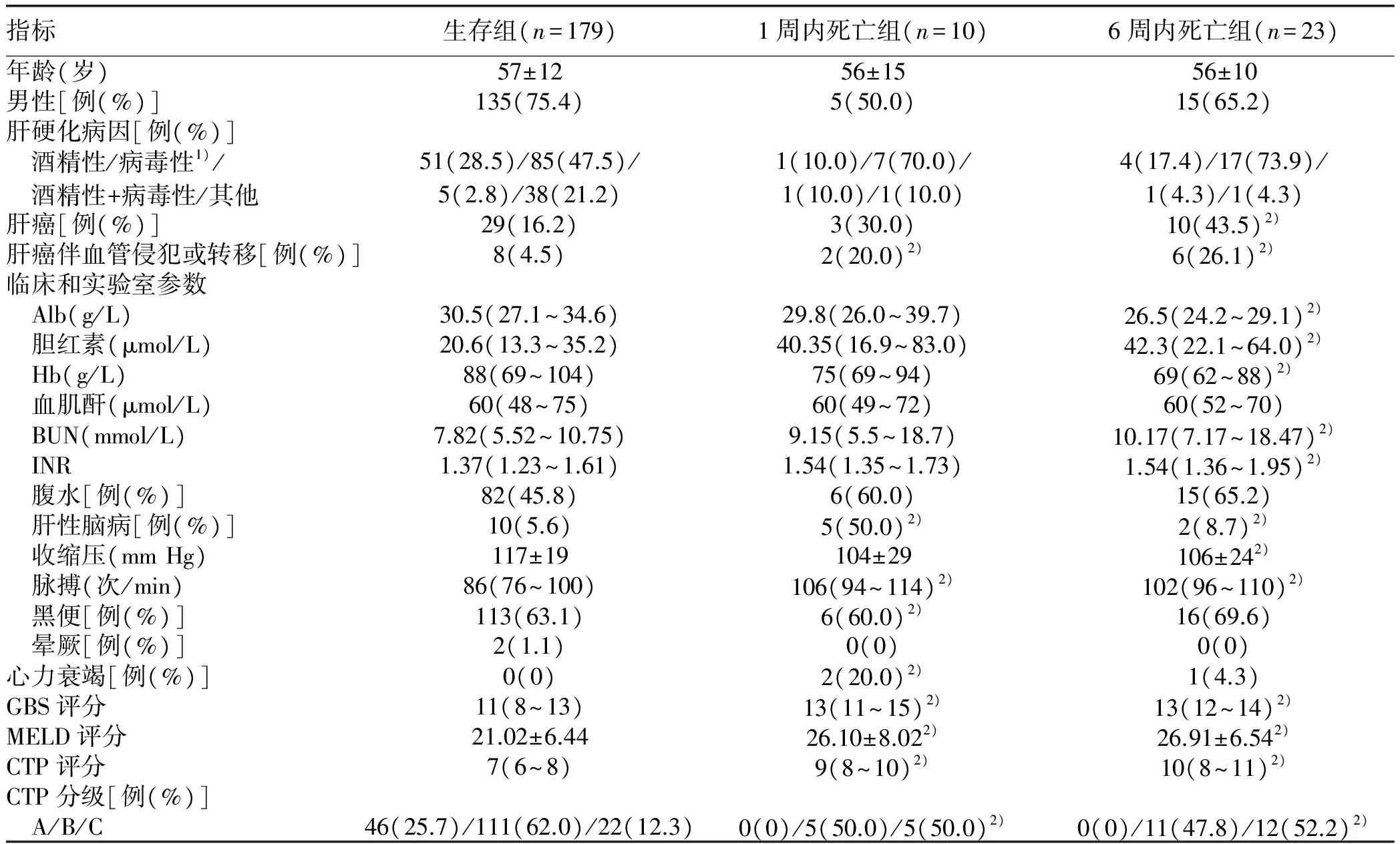
表1 3组患者的临床特征及生化数据比较
注:1) HBV或HCV;2)与生存组比较,P<0.05
2.3 3种评分系统的诊断价值对比 1周内病死率的预后危险分层模型显示,GBS评分、MELD评分、CTP评分的AUC分别为0.738、0.731、0.728,3者对于1周病死率均有很好的预测价值(AUC>0.7)(表2,图1);配对比较显示,GBS评分与CTP评分相比预测1周病死率辨别能力有显著差异(P<0.05)(表3)。6周内病死率的预后危险分层模型显示,MELD评分、CTP评分、GBS评分的AUC分别为0.761、0.748、0.726,3者对于6周病死率均有很好的预测价值(AUC>0.7)(表2,图2),配对比较显示,3种评分辨别能力均无显著差异(P值均>0.05)(表4)。
3 讨论
近年来由于对患者管理方法的改进,包括抗生素的应用,内镜下干预及经颈静脉肝内门体分流术等技术的进展,肝硬化伴食管胃底静脉曲张破裂出血患者的院内病死率较前有所降低[7-9],然而食管静脉曲张破裂出血仍有高达20%的6周内病死率[10]。因此,及时有效的判断此类患者的生存与预后情况至关重要。
GBS评分最初的目的是鉴别不需临床干预或仅需门诊内镜检查的低危患者[5],后来不断有研究评估了其对急性上消化道出血患者的不良预后(如死亡、再出血)及临床干预需求(如输血、内镜治疗等)方面的预测价值。近年来被广泛应用于急性非静脉曲张性上消化道出血患者的风险与预后评价中[4-5]。为进一步探索其对静脉曲张性上消化道出血这类患者的预后评估价值,Iino等[11]及Hsu等[12]做了相关研究,结果显示,GBS评分对该类患者的院内病死率预测能力方面不如MELD评分及CTP评分。与本次研究结果相似,本研究结果显示,MELD评分及CTP评分在预测6周病死率的AUC优于GBS评分,但GBS评分与CTP评分及MELD评分的诊断效能差异不明显(P>0.05),考虑可能与研究的样本量大小有关。
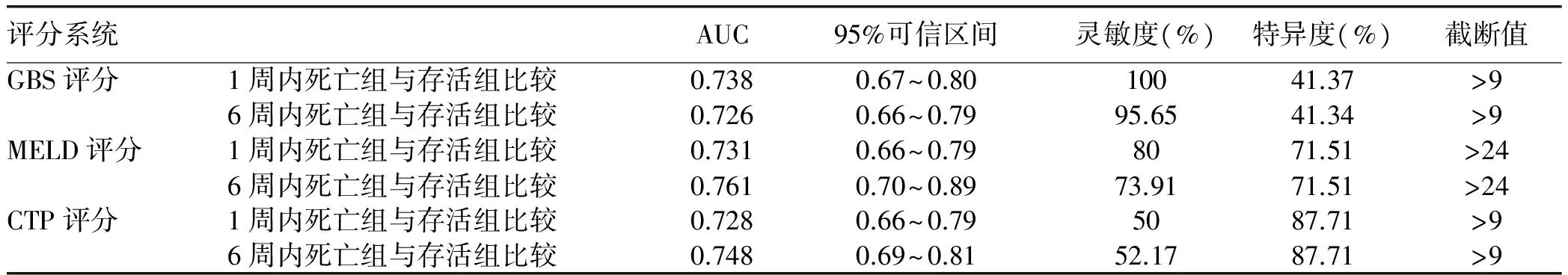
表2 3种评分系统关于1周内死亡组、6周内死亡组与存活组ROC曲线的比较

图1 3种评分系统预测肝硬化食管胃底静脉曲张出血1周内病死率的ROC曲线
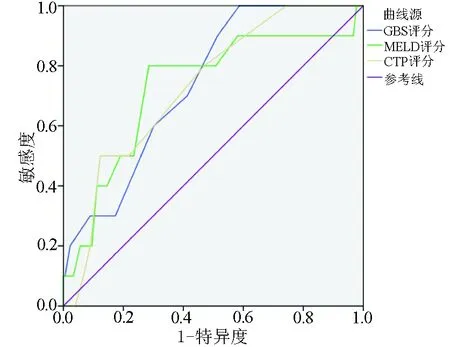
图2 3种评分预测肝硬化食管胃底静脉曲张出血6周内病死率的ROC曲线
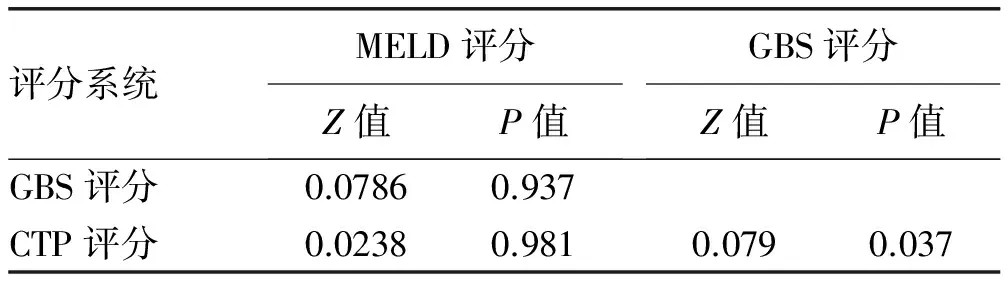
评分系统MELD评分Z值P值GBS评分Z值P值GBS评分0.07860.937CTP评分0.02380.9810.0790.037
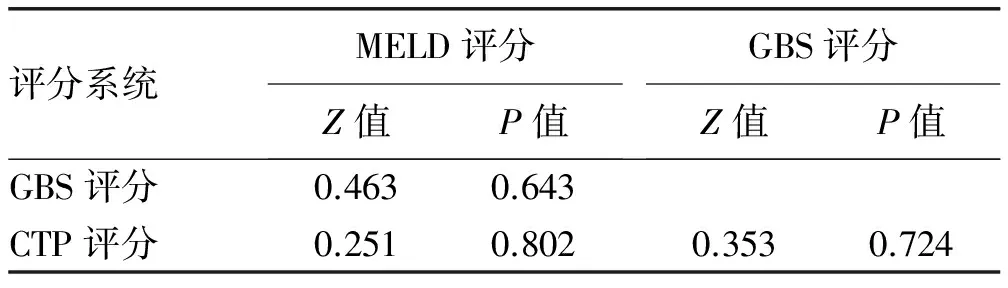
表4 3种评分系统之间预测6周病死率AUC的比较
CTP分级长期以来被用于评估慢性肝病患者的预后[4],MELD评分也被用于评价终末期肝病患者病情的严重程度[6,13],并且有研究[14]表明MELD评分对终末期肝病患者3个月病死率有较好的预测作用。虽然CTP评分及MELD评分包含的影响预后的指标较少,对有食管胃底静脉曲张出血肝硬化患者的短期预后评价的有效性还缺乏充足的证据,但是,就本次研究结合国外研究结果显示,这两种评分系统在对肝硬化食管胃底静脉曲张出血患者院内病死率的预测方面优于GBS评分系统。
考虑到GBS评分在评估上消化道出血患者出血严重程度的优势,Iino等[11]的研究进一步缩短了不同评分系统对肝硬化食管胃底静脉曲张患者预后评价的时间,评估了GBS评分、MELD评分及CTP评分3种评分系统对急性食管静脉曲张出血患者的1周病死率的预测价值,结果显示了GBS评分的优越性。本研究扩展了研究人群,覆盖了胃底静脉曲张出血患者,研究结果显示,GBS评分在预测1周内病死率的AUC优于CTP评分及MELD评分,GBS评分的诊断效能优于CTP评分(P=0.037),但与MELD评分的效能差异不明显,同样考虑可能受到研究样本量的影响。此外,本研究显示在最佳截断点>9分的情况下,GBS评分预测1周病死率的灵敏度可达到100%,但是尚需进一步大样本研究确定最佳阈值。目前还缺乏公认的针对急性肝硬化食管胃底静脉曲张出血患者的早期危险评分系统,本研究结果显示,出血直接导致的失血性休克及出血诱发的肝性脑病、感染等并发症是患者死亡的主要原因。未来有能结合出血及肝病严重程度,以及联合并发症的评分系统,可能有利于进一步提高该类患者早期死亡风险预测的准确性。
总的来说,在对肝硬化伴食管胃底静脉曲张破裂出血患者的1周内病死率预测方面,GBS评分预测能力优于CTP评分及MELD评分,而在6周内病死率预测方面,MELD评分及CTP评分优于GBS评分。
[1] MOHAMMAD AN, MORSY KH, ALI MA. Variceal bleeding in cirrhotic patients: what is the best prognostic score?[J]. Turk J Gastroenterol, 2016, 27(5): 464-469.
[2] van LEERDAM ME. Epidemiology of acute upper gastrointestinal bleeding[J]. Best Pract Res Clin Gastroenterol, 2008, 22(2): 209-224.
[3] FORMAN LM, LUCEY MR. Predicting the prognosis of chronic liver disease: an evolution from CTP to MELD[J]. Hepatology, 2001, 33(2): 473-475.
[4] BLATCHFORD O, MURRAY WR, BLATCHFORD M. A risk score to predict need for treatment for uppergastrointestinal haemorrhage[J]. Lancet, 2000, 356(9238): 1318-1321.
[5] STANLEY AJ, ASHLEY D, DALTON HR, et al. Outpatient management of patients with low-risk upper-gastrointestinal haemorrhage: multicentre validation and prospective evaluation[J]. Lancet, 2009, 373(9657): 42-47.
[6] KAMATH PS, WIESNER RH, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470.
[7] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Endoscopy, Chinese Medical Association. Guidelines for the diagnosis and treatment of esophageal and gastric variceal bleeding in cirrhotic portal hypertension[J]. J Clin Hepatol, 2016, 32(2): 203-219. (in Chinese)
中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会内镜学分会. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2016, 32(2): 203-219.
[8] XIAO JQ, ZHUGE YZ. Advances in transjugular in Trahepatic portosystemic shunt and its application in treatment of cirrhotic portal hypertension[J]. J Clin Hepatol, 2016, 32(2): 234-237. (in Chinese)
肖江强, 诸葛宇征. 经颈静脉肝内门体分流术研究进展及其在肝硬化门静脉高压治疗中的应用[J]. 临床肝胆病杂志, 2016, 32(2): 234-237.
[9] WILLIAMS MJ, HAYES P. Improving the management of gastrointestinal bleeding in patients with cirrhosis[J]. Expert Rev Gastroenterol Hepatol, 2016, 10(4): 505-515.
[10] ZHOU GW, YANG LY. Expert consensus on the diagnosis and treatment of esophagogastric variceal bleeding in cirrhotic portal hypertension (2015)[J]. Chin J Pract Surg, 2015, 35(10): 1086-1090. (in Chinese)
周光文, 杨连粤. 肝硬化门静脉高压症食管, 胃底静脉曲张破裂出血诊治专家共识(2015)[J]. 中国实用外科杂志, 2015, 35(10): 1086-1090.
[11] IINO C, SHIMOYAMA T, IGARASHI T, et al. Usefulness of the Glasgow-Blatchford score to predict 1-week mortality in patients with esophageal variceal bleeding[J]. Eur J Gastroenterol Hepatol, 2017, 29(5): 547-551.
[12] HSU SC, CHEN CY, WENG YM, et al. Comparison of 3 scoring systems to predict mortality from unstable upper gastrointestinal bleeding in cirrhotic patients[J]. Am J Emerg Med, 2014, 32(5): 417-420.
[13] MALINCHOC M, KAMATH PS, GORDON FD, et al. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts[J]. Hepatology, 2000, 31(4): 864-871.
[14] KIM SY, YIM HJ, LEE J, et al. Comparison of CTP, MELD, and MELD-Na scores for predicting short term mortality in patients with liver cirrhosis[J]. Korean J Gastroenterol, 2007, 50(2): 92-100.
ValueofGlasgow-Blatchfordscoreinpredictingearlyprognosisofcirrhoticpatientswithesophagogastricvaricealbleeding
CUIShu,WANGFang,LYUHongmin,etal.
(TheThirdCentralClinicalCollegeofTianjinMedicalUniversity,DepartmentofHepatology,TianjinThirdCentralHospital,TianjinKeyLaboratoryofArtificialCells,TianjinInstituteofHepatobiliaryDisease,Tianjin300170,China)
ObjectiveTo investigate the value of Glasgow-Blatchford score (GBS), Child-Turcotte-Pugh (CTP) score, and Model for End-Stage Liver Disease (MELD) score in predicting the 1- and 6-week prognosis of cirrhotic patients with esophagogastric variceal bleeding via a comparative analysis.MethodsA retrospective analysis was performed for the clinical data of 202 cirrhotic patients with esophagogastric variceal bleeding who were hospitalized in Tianjin Third Central Hospital from January 1 to December 31, 2014. According to the endpoint of death at 6 weeks after admission, the patients were divided into 1-week death group (10 patients), 6-week death group (23 patients), and survival group (179 patients). The Glasgow-Blatchford score, MELD score, CTP score, and CTP score and classification were calculated on admission, and these scores were compared between the three groups. The two-independent-samplesttest was used for comparison of normally distributed continuous data between groups, and the non-parametric Mann-WhitneyUtest was used for comparison of non-normally distributed continuous data between groups. The chi-square test or the Fisher′s exact test was used for comparison of categorical data between groups. TheZtest was used for comparison of the area under the receiver operating characteristic curve (AUC) of these three scoring systems.ResultsThere were significant differences between the 1-week death group and the survival group in the incidence rates of liver cancer with vascular invasion or metastasis (χ2=4.559,P=0.033), hepatic encephalopathy (χ2=25.568,P<0.01), melena (χ2=0.842,P=0.04), and heart failure (P=0.003), pulse rate (Z=-2.943,P=0.003), CTP classification (χ2=12.22,P=0.002), CTP score (Z=-2.505,P=0.012), MELD score (t=-2.395,P=0.018), and GBS score (Z=-2.545,P=0.011). There were significant differences between the 6-week death group and the survival group in the incidence rates of liver cancer (χ2=9.374,P=0.002), liver cancer with vascular invasion or metastasis (χ2=14.766,P<0.01), and hepatic encephalopathy (χ2=16.327,P<0.01), albumin (Z=-2.770,P=0.006), bilirubin (Z=-3.191,P=0.001), hemoglobin (Z=-2.484,P=0.013), blood urea nitrogen (Z=-2.407,P=0.016), international normalized ratio (Z=-2.304,P=0.021), systolic pressure (t=2.69,P=0.008), pulse rate (Z=-3.507,P<0.01), CTP classification (χ2=25.851,P<0.01), CTP score (Z=-3.591,P<0.01), MELD score (t=-4.121,P<0.01), and GBS score (Z=-3.54,P<0.01). GBS score (AUC=0.738, 95% confidence interval [CI]: 0.67-0.80) was superior to MELD score (AUC=0.731, 95%CI: 0.66-0.79) and CTP score (AUC=0.728, 95% CI: 0.66-0.79) in predicting the risk of death at 1 week. MELD score (AUC=0.761, 95%CI: 0.70-0.89) was superior to CTP score (AUC=0.748, 95%CI: 0.69-0.81) and MELD score (AUC=0.726, 95%CI: 0.66-0.79) in predicting the risk of death at 6 weeks. There was a significant difference in the AUC for predicting the death rate at 1 week between GBS score and CTP score (Z=0.079,P=0.037), while there was no significant difference in the AUC for predicting the death rate at 6 weeks between the three scoring systems (P>0.05).ConclusionGBS score is superior to MELD score and CTP score in predicting the risk of death at 1 week in cirrhotic patients with esophagogastric variceal bleeding, and MELD and CTP scores are superior to GBS score in predicting the risk of death at 6 weeks.
Glasgow-Blatchford score; liver cirrhosis; esophageal and gastric varices; prognosis
R575.2
A
1001-5256(2017)10-1939-05
10.3969/j.issn.1001-5256.2017.10.018
2017-04-24;
2017-05-25。
天津市卫计委科技基金项目(2014KY03);天津市卫计委科技基金攻关项目(16KG151);天津市卫计委科技基金项目(2010KZ123)
崔舒(1993-),女,主要从事肝脏相关疾病的研究。
吕洪敏,电子信箱:lvhongmin58@163.com。
引证本文:CUI S, WANG F, LYU HM, et al. Value of Glasgow-Blatchford score in predicting early prognosis of cirrhotic patients with esophagogastric variceal bleeding[J]. J Clin Hepatol, 2017, 33(10): 1939-1943. (in Chinese)
崔舒, 王芳, 吕洪敏, 等. Glasgow-Blatchford评分对肝硬化食管胃底静脉曲张破裂出血患者早期预后的预测价值[J]. 临床肝胆病杂志, 2017, 33(10): 1939-1943.
(本文编辑:林 姣)
