放牧改变了藏北高原高寒草甸土壤微生物群落
2017-10-21付刚沈振西
付刚,沈振西
(中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,拉萨高原生态系统研究站,北京 100101)
放牧改变了藏北高原高寒草甸土壤微生物群落
付刚,沈振西*
(中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,拉萨高原生态系统研究站,北京 100101)
本研究基于2008年7月布设的3个围栏与自由放牧样地(一个高寒草原化草甸,冬季牧场;一个高寒草原化草甸,夏季牧场;一个典型高寒草甸,夏季牧场),开展了藏北高原高寒草甸土壤微生物群落组成对放牧的响应研究。土壤微生物群落组成采用磷脂脂肪酸方法(phospholipid fatty-acid,PLFA)测定。结果表明,冬季放牧显著降低了高寒草原化草甸的土壤真菌、革兰氏阴性细菌、放线菌和原生动物。夏季放牧显著降低了典型高寒草甸的土壤总PLFA、真菌、细菌、革兰氏阳性细菌、革兰氏阴性细菌、放线菌、丛枝菌根真菌和原生动物。基于冗余度分析,3个放牧与围栏条件下的土壤微生物群落组成都存在显著差异。土壤无机氮和水溶性有机氮显著影响着高寒草原化草甸冬季牧场的土壤微生物群落组成,而硝态氮和水溶性有机碳显著影响着高寒草原化草甸夏季牧场和典型高寒草甸夏季牧场的土壤微生物群落组成。因此,放牧对高寒草甸土壤微生物群落的影响与放牧季节和草地类型有关。
围栏;磷脂脂肪酸;冗余度分析;放牧季节
土壤微生物是土壤生态系统的重要组成部分,是生物地球化学循环的主要驱动者,它们在调节有机质分解和营养物质循环等生态系统功能方面发挥着重要作用[1-3]。草地不仅是陆地生态系统中最重要的生态系统类型之一,而且是放牧等人类活动影响较为严重的区域之一[4]。作为生态系统功能与生态健康的敏感指标[5-6],土壤微生物群落组成能够较早地指示草原生态环境变化以及生态系统过程和功能的变化[7]。放牧是草地最重要的土地利用方式之一[8-10]。开展土壤微生物群落组成对放牧的响应及其机制的研究,在草原生态系统保护、恢复及重建中都具有重要理论和实践意义[11-15]。
虽然很多研究已经对比分析了围栏与放牧条件下的土壤微生物群落,但是目前仍没有一致的结论[11-15]。如张莉等[16]在海北矮嵩草(Kobresiahumilis)草甸的研究表明,放牧增加了土壤真菌与细菌的比值;王蓓等[17]在四川红原县高寒草甸的研究表明,模拟放牧(刈割+牦牛粪便)降低了土壤真菌与细菌的比值,增加了土壤总磷脂脂肪酸(phospholipid fatty-acid,PLFA);Zhang等[18]在美国高草草原的研究发现,刈割没有改变土壤真菌与细菌的比值;而邹雨坤等[19]在呼伦贝尔羊草(Leymuschinensis)典型草原的研究则表明,放牧对土壤总PLFA无显著影响。
虽然高寒草甸是青藏高原重要的草地类型之一,但是有关放牧如何影响土壤微生物群落的研究还不多见[6,16-17,20]。这些前人的研究只是探讨了冬季放牧或夏季放牧对土壤微生物群落的影响,而没有对比分析不同季节放牧对土壤微生物群落的影响差异。前人的研究已经表明不同季节放牧对青藏高原高寒草地植被(如生物量等)的影响不同[21],而植被的变化会引起土壤微生物群落组成的变化[22-23]。这些前人的研究只是在一种类型的高寒草地上开展,而缺少有关对比不同类型的高寒草地土壤微生物群落对放牧的响应差异。不同类型高寒草地间的土壤微生物群落组成、土壤理化性质指标(如土壤湿度、有机碳和全氮等)和植被群落结构都可能存在显著差异[24-25],而不同类型的高寒草地的土壤理化性质和植被特征对人类放牧活动干扰的响应都可能不同[26-27]。因此,本研究在念青唐古拉山的南坡通过布设3个围栏与自由放牧配对样地,对比分析不同季节放牧(冬季放牧和夏季放牧)对高寒草地土壤微生物群落的影响差异;对比分析高寒草原化草甸和典型高寒草甸土壤微生物群落对夏季放牧的响应差异。
1 材料与方法
1.1研究地概况和实验设计
研究区域(30°30′-30°32′ N,91°03′-91°04′ E)位于西藏自治区当雄县草原站。年均温为1.87 ℃,年降水量为474.9 mm。本研究选择了两个草原化草甸(一个冬季牧场,一个夏季牧场)和一个典型高寒草甸(夏季牧场)。在3个高寒草甸区域,2008年7月分别布设了1个约20 m×20 m的围栏样地。两个高寒草原化草甸的建群种有小嵩草(Kobresiapygmaean)、丝颖针茅(Stipacapillacea)和窄叶苔草(Carexmontis-everestii)等,而典型高寒草甸的建群种是小嵩草。草原化草甸冬季牧场区域0~30 cm的土壤有机碳和全氮分别为19.83 g/kg和2.12 g/kg;草原化草甸夏季牧场区域0~30 cm的土壤有机碳和全氮分别为24.04 g/kg和2.18 g/kg;典型高寒草甸0~30 cm的土壤有机碳和全氮分别为43.74 g/kg和3.32 g/kg[28]。
1.2土壤采样及分析
2013年8月,在3个配对的围栏样地内外,利用直径3.7 cm的土钻采集了0~10 cm的土壤样品,4个重复样方(1 m×1 m),两个重复样方间的距离约为3 m。在每个重复样方内,随机选择3个点取土后混合作为一个重复样方的土样。取得的土壤样品立即放入装有冰的泡沫箱子,带回实验室后在-20 ℃下冷冻保存。部分土壤样品风干用于土壤有机碳(soil organic carbon,SOC)和全氮(total nitrogen,TN)的测定。部分土壤用于硝态氮(nitrogen nitrogen,NO3--N)、铵态氮(ammonium nitrogen,NH4+-N)、水溶性有机碳(dissolved organic carbon,DOC)、水溶性有机氮(dissolved organic nitrogen,DON)和微生物群落组成的测定。土壤有机碳采用重铬酸钾法测定。土壤全氮采用碳氮分析仪(Elementar Variomax CN)测定。土壤无机氮采用流动分析仪(LACHAT Quickchem Automated Ion Analyzer)测定。水溶性有机碳和有机氮的测定参照[29]。土壤微生物群落组成采用磷脂脂肪酸方法(phospholipid fatty-acid,PLFA)测定[30]。土壤微生物脂肪酸分离和提取步骤如下: 用6 mL 氯仿、3 mL磷酸缓冲液和12 mL甲醇混合液溶解相当于8 g 干重的土壤鲜土后避光震荡2 h;将震荡后的土壤浸提液在自动离心机上以3000 r/min 速度离心10 min;将离心后的上清液转移到装有12 mL 磷酸缓冲液和12 mL三氯甲烷的分液漏斗中;再次用6 mL 氯仿、3 mL磷酸缓冲液和12 mL甲醇混合液溶解已经浸提、震荡和离心过一次的土壤,手工摇动并震荡30 min;再次离心、转移上清液到分液漏斗中,最后将分液漏斗中的上清液摇动2 min,静置过夜,避光保存;第2 天,将分液漏斗中的中下层土壤溶液转移至50 mL的大试管中;30~32 ℃水浴50 mL大试管中的土壤溶液,并用氮吹仪吹干;用2 份500 mL 三氯甲烷将大试管内浓缩后的磷脂转移到萃取小柱(硅胶柱),依次采用5 mL三氯甲烷,10 mL丙酮,5 mL甲醇洗脱液淋洗,并收集甲醇相,吹干;用1 mL 0.2 mol/L 氢氧化钾和1 mL 1∶1 甲醇甲苯溶液溶解吹干的样品,摇匀,37 ℃水浴加热15 min,用正己烷萃取,收集正己烷相并吹干,最后用气相色谱质谱仪测定。
脂肪酸a11:0,i13:0,a13:0,14:0,i14:0,a14:0,15:0,i15:0,a15:0,i16:0,a16:0,10Me16:0,16:1ω7c, 17:0,10Me17:0,i17:0,a17:0,cy17:0ω7c,17:1ω8c,10Me18:0,i18:0,18:1ω5c,18:1ω7c,a19:0,cy19:0ω7c, 10Me20:0和i22:0是土壤细菌标记物。脂肪酸16:1ω5c,18:1ω9c,18:2ω6c和18:3ω6c是土壤真菌标记物。 脂肪酸20:0是土壤原生动物标记物。脂肪酸16:1ω5c是土壤丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)标记物[31]。脂肪酸10Me16:0,10Me17:0,10Me18:0和10Me20:0是土壤放线菌标记物。脂肪酸a11:0,i13:0,a13:0,i14:0,a14:0,i15:0,a15:0,i16:0,a16:0,i17:0,a17:0,i18:0,a19:0和 i22:0是土壤革兰氏阳性细菌(gram-positive bacteria,G+)。脂肪酸16:1ω7c,cy17:0ω7c,17:1ω8c,18:1ω5c,18:1ω7c和cy19:0ω7c是土壤革兰氏阴性细菌(gram-negative bacteria,G-)。本研究中还包括了脂肪酸16:0,18:0,22:0和24:0。
1.3统计分析
本研究计算了两个能够反映土壤微生物群落组成变化的比值,即土壤真菌与细菌的比值(F/B)和革兰氏阳性细菌与革兰氏阴性细菌的比值(G+/G-);还计算了两个能够反映胁迫的比值,即(cy17:0ω7c+cy19:0ω7c)/(16:1ω7c+18:1ω7c)和(i17:0+i15:0)/(a17:0+a15:0)[32]。在每一个围栏与放牧配对样地,利用CANOCO for windows 4.5(Microcomputer Power, Ithaca, USA)软件进行了冗余度分析(redundancy analysis,RDA)。T-检验被用来对比分析围栏与自由放牧对第一主轴和第二主轴的RDA得分,PLFA总量,真菌含量,细菌含量,原生动物含量,丛枝菌根真菌含量,放线菌含量,革兰氏阳性细菌含量,革兰氏阴性细菌含量,F/B,G+/G-,(cy17:0ω7c+cy19:0ω7c)/(16:1ω7c+18:1ω7c)和(i17:0+i15:0)/(a17:0+a15:0)。所有的统计显著性检验P<0.05。
2 结果与分析
冬季放牧显著降低了高寒草原化草甸的水溶性有机氮,而对土壤有机碳、全氮、碳氮比、水溶性有机碳、硝态氮和铵态氮都无显著影响(图1)。夏季放牧显著降低了高寒草原化草甸的硝态氮,而对土壤有机碳、全氮、碳氮比、水溶性有机碳、水溶性有机氮和铵态氮都无显著影响(图1)。夏季放牧对典型高寒草甸的土壤有机碳、全氮、碳氮比、水溶性有机碳、水溶性有机氮、硝态氮和铵态氮都无显著影响。
冬季放牧显著降低了高寒草原化草甸的土壤真菌含量、革兰氏阴性细菌含量、放线菌含量和原生动物含量,趋于(P<0.10)减少了土壤PLFA总量和细菌含量,而对革兰氏阳性细菌含量和丛枝菌根真菌含量无显著影响(图2)。夏季放牧趋于(P<0.10)减少了高寒草原化草甸的放线菌含量,而对高寒草原化草甸的土壤PLFA总量、真菌含量、细菌含量、革兰氏阳性细菌含量、革兰氏阴性细菌含量、丛枝菌根真菌含量和原生动物含量都无显著影响(图2)。相反,夏季放牧显著降低了典型高寒草甸的土壤PLFA总量、真菌含量、细菌含量、革兰氏阳性细菌含量、革兰氏阴性细菌含量、放线菌含量、丛枝菌根真菌含量和原生动物含量(图2)。
夏季放牧显著增加了高寒草原化草甸和典型高寒草甸的土壤(cy17:0ω7c+cy19:0ω7c)/(16:1ω7c+18:1ω7c),而冬季放牧则对高寒草原化草甸的土壤(cy17:0ω7c+cy19:0ω7c)/(16:1ω7c+18:1ω7c)无显著影响(图3)。冬季放牧对高寒草原化草甸的土壤F/B、G+/G-和(i17:0+i15:0)/(a17:0+a15:0)都无显著影响,夏季放牧对高寒草原化草甸和高寒典型草甸的土壤F/B、G+/G-和(i17:0+i15:0)/(a17:0+a15:0)也都无显著影响(图3)。

图1 藏北高原围栏与放牧条件下的高寒草原化草甸冬季牧场(ASMWP)、高寒草原化草甸夏季牧场(ASMSP)和典型高寒草甸 夏季牧场(AMSP)的(a)土壤有机碳、(b)全氮、 (c)碳氮比、(d)水溶性有机碳、(e)水溶性有机氮、 (f)无机氮、(g)硝态氮和(h)铵态氮的对比Fig.1 Comparison of (a) soil organic carbon, (b) total nitrogen, (c) ratio of soil organic carbon to total nitrogen, (d) dissolved organic carbon, (e) dissolved organic nitrogen, (f) inorganic nitrogen, (g) nitrate nitrogen and (h) ammonium nitrogen between ungrazed and grazed soils for an alpine steppe meadow for winter pasture (ASMWP), an alpine steppe meadow for summer pasture (ASMSP) and an alpine meadow for summer pasture (AMSP) in the Northern Tibet 不同字母代表显著差异(P<0.05)。下同。The different letters mean significant difference at P<0.05 level. The same below.
冗余度分析表明,围栏样方和放牧样方在排序图上可以明显的分开(图4)。具体而言,在高寒草原化草甸,冬季放牧的样方分布在RDA图的下部,而围栏的样方分布在RDA图的上部(图4a);在高寒草原化草甸,夏季放牧的样方分布在RDA图的右侧,而围栏的样方分布在RDA图的左侧(图4b);在典型高寒草甸,夏季放牧的样方分布在RDA图的左侧,而围栏的样方分布在RDA图的右侧(图4c)。第一主轴分别解释了65.8%、45.5%和79.3%的高寒草原化草甸冬季牧场、高寒草原化草甸夏季牧场和典型高寒草甸夏季牧场的土壤PLFA(图4)。第二主轴分别解释了25.7%、25.9%和19.0%的高寒草原化草甸冬季牧场、高寒草原化草甸夏季牧场和典型高寒草甸夏季牧场的土壤PLFA(图4)。无机氮与水溶性有机氮分别显著解释了62%和16%的高寒草原化草甸冬季牧场的土壤PLFA;硝态氮和水溶性有机碳分别解释了36%和23%的高寒草原化草甸夏季牧场的土壤PLFA;硝态氮和水溶性有机碳分别解释了54%和14%的典型高寒草甸夏季牧场的土壤PLFA。围栏与冬季放牧处理间的高寒草原化草甸的第二主轴得分有显著差异;围栏与夏季放牧处理间的高寒草原化草甸和典型高寒草甸的第一主轴得分有显著差异;与围栏处理相比,夏季放牧趋于(P<0.10)增加了高寒草原化草甸的第二主轴得分(图5)。
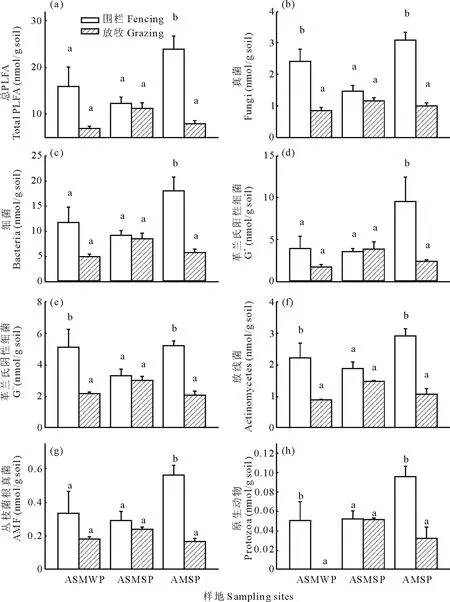
图2 藏北高原围栏与放牧条件下的高寒草原化草甸冬季牧场(ASMWP)、高寒草原化草甸夏季牧场(ASMSP)和典型高寒草甸 夏季牧场(AMSP)的(a)土壤总磷脂脂肪酸、(b)真菌、 (c)细菌、(d)革兰氏阳性细菌、(e)革兰氏阴性 细菌、(f)放线菌、(g)丛枝菌根真菌和(h)原生动物的对比Fig.2 Comparison of soil (a) total PLFA, (b) fungi, (c) bacteria, (d) gram-positive bacteria, (e) gram-negative bacteria, (f) actinomycetes, (g) arbuscular mycorrhizal fungi and (h) protozoa between ungrazed and grazed soils for an alpine steppe meadow for winter pasture (ASMWP), an alpine steppe meadow for summer pasture (ASMSP) and an alpine meadow for summer pasture (AMSP) in the Northern Tibet
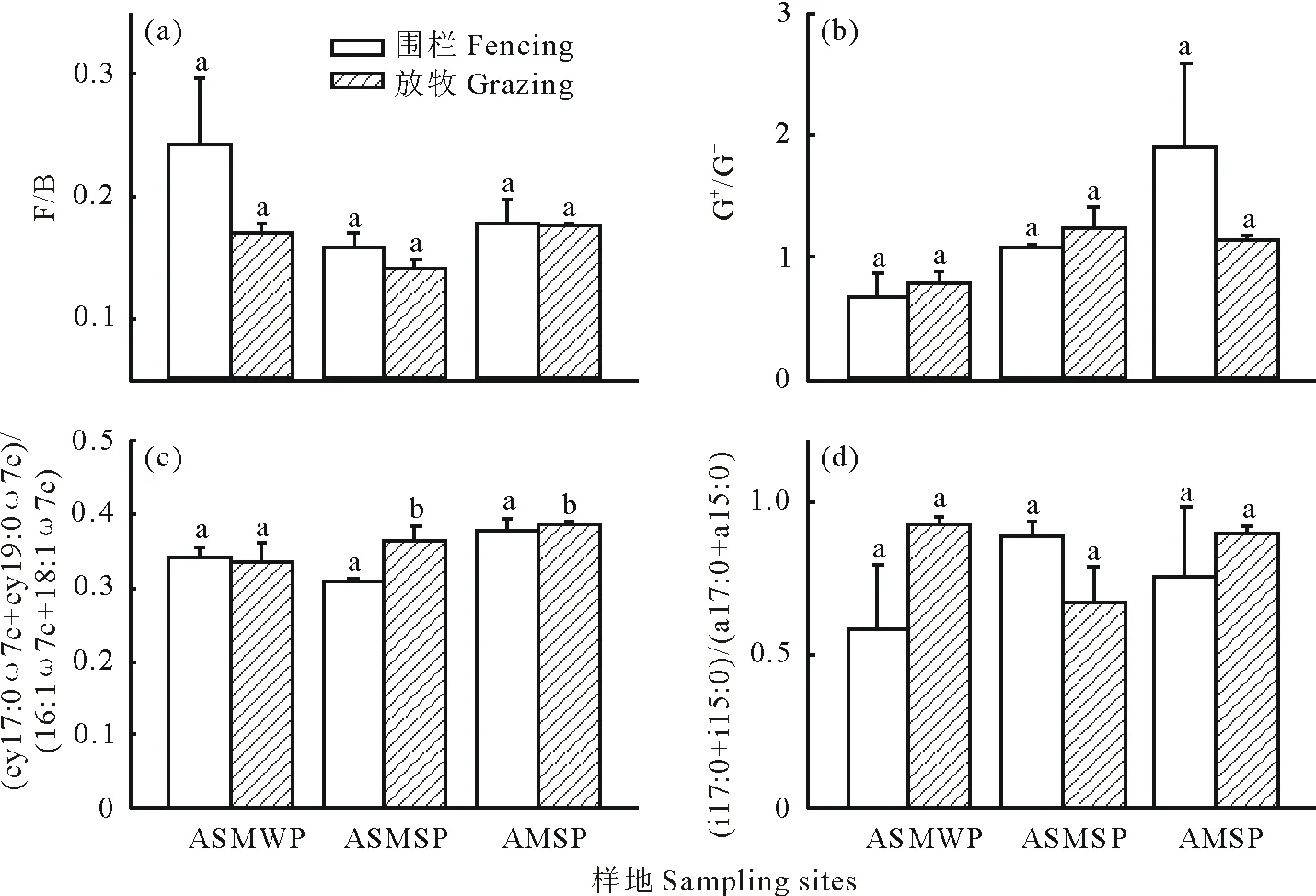
图3 藏北高原围栏与放牧条件下的高寒草原化草甸冬季牧场(ASMWP)、高寒草原化草甸夏季牧场(ASMSP)和典型高寒草甸 夏季牧场(AMSP)的(a)真菌与细菌的比、(b)革兰氏阳性细菌与革兰氏阴性细菌的比、 (c)(cy17:0ω7c+cy19:0ω7c)/ (16:1ω7c+18:1ω7c)和(d)(i17:0+i15:0)/(a17:0+a15:0)的对比Fig.3 Comparison of soil (a) ratio of fungi to bacteria, (b) ratio of gram-positive bacteria to gram-negative bacteria, (c) (cy17:0ω7c+cy19:0ω7c)/(16:1ω7c+18:1ω7c) and (d) (i17:0+i15:0)/(a17:0+a15:0) ungrazed and grazed soils for an alpine steppe meadow for winter pasture (ASMWP), an alpine steppe meadow for summer pasture (ASMSP) and an alpine meadow for summer pasture (AMSP) in the Northern Tibet
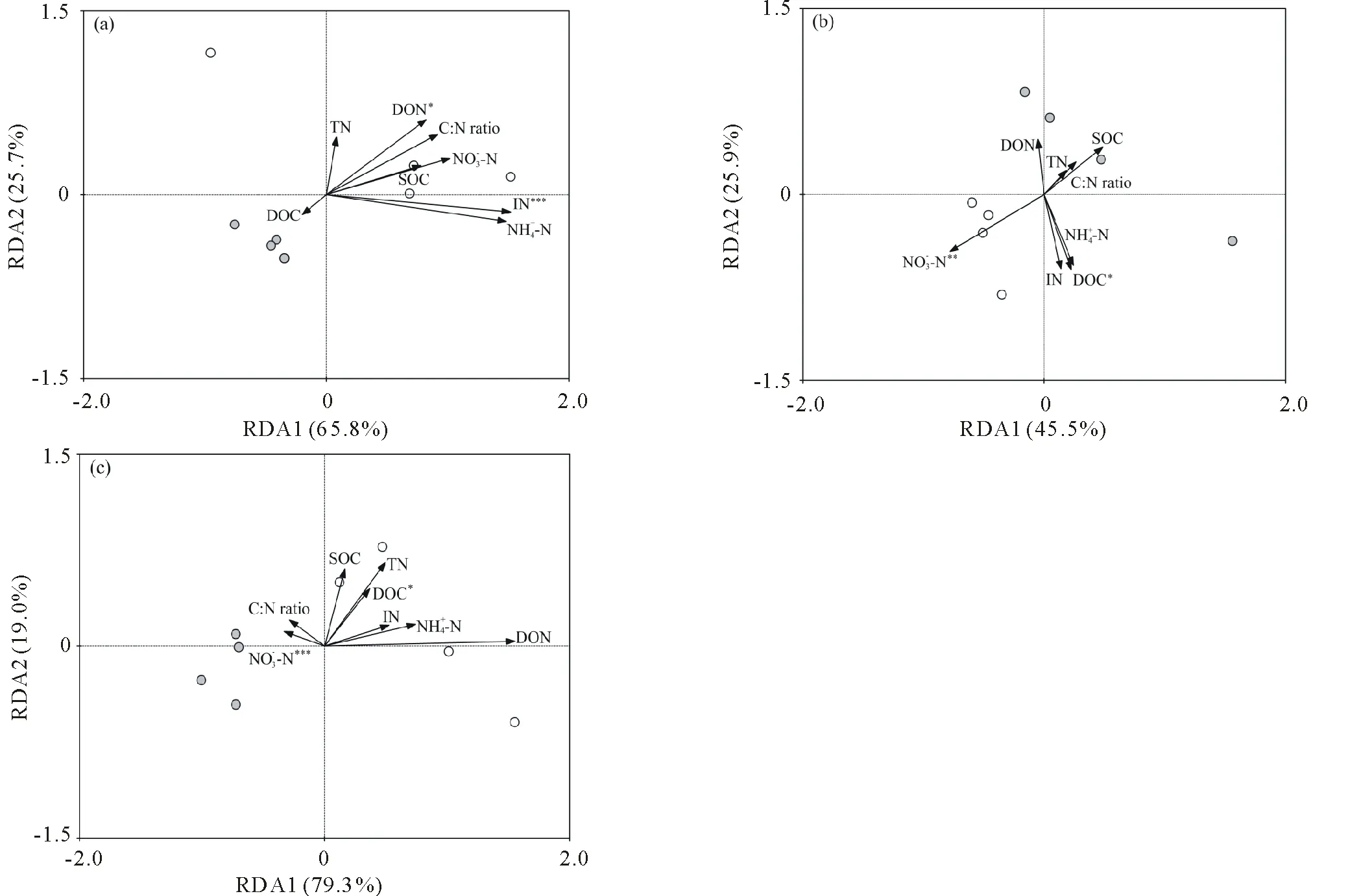
图4 藏北高原(a)高寒草原化草甸冬季牧场、(b)高寒草原化草甸夏季牧场和(c)典型高寒草甸夏季牧场的冗余度分析Fig.4 Redundancy analysis (RDA) of the phospholipid fatty acid (PLFA) profile as explained by soil organic carbon (SOC), total nitrogen (TN), ratio of SOC to TN (C∶N ratio), dissolved organic carbon (DOC) and nitrogen (DON), inorganic nitrogen (IN), nitrogen nitrogen (NO3--N) and ammonium nitrogen (NH4+-N) in (a) an alpine steppe meadow for winter pasture, (b) alpine steppe meadow for summer pasture and (c) alpine meadow for summer pasture in the Northern Tibet The solid and hollow circle symbols indicate the grazed and ungrazed soils.

图5 藏北高原(a)高寒草原化草甸冬季牧场、(b)高寒草原化草甸夏季牧场和(c)典型高寒草甸 夏季牧场的冗余度分析第一主轴(RDA1)和第二主轴(RDA2)得分Fig.5 Redundancy analysis (RDA) scores in (a) an alpine steppe meadow for winter pasture, (b) alpine steppe meadow for summer pasture and (c) alpine meadow for summer pasture in the Northern Tibet
3 讨论与结论
土壤无机氮与土壤PLFA组成显著相关,这与前人的研究一致。如赵帅等[33]在内蒙古针茅(Stipa)草原的研究发现,土壤总PLFA、真菌、细菌和革兰氏阴性细菌含量随着土壤硝态氮含量的增加显著增加。土壤细菌主导着土壤微生物群落组成,这与前人在青藏高原高寒草地的研究结果一致[16-17]。
放牧降低了土壤微生物量,这与前人的很多研究结果一致。谭红妍等[34]在呼伦贝尔草原的研究表明,放牧降低了土壤总PLFA、细菌、革兰氏阴性细菌、腐生真菌和丛枝菌根真菌含量。赵帅等[33]在内蒙古3种类型的(克氏针茅Stipakrylovii、贝加尔针茅Stipabaicalensis和大针茅Stipagrandis)针茅草原的研究发现,放牧显著降低了土壤总PLFA、细菌和革兰氏阳性细菌含量。王蓓等[17]在四川红原县高寒草甸的研究表明,模拟放牧(刈割+牦牛粪便)减少了土壤真菌含量。邹雨坤等[19]在呼伦贝尔羊草典型草原的研究发现,放牧降低了土壤放线菌含量。Francini等[35]在斯堪的纳维亚半岛北部的极地草原的研究表明,放牧降低了土壤总PLFA和细菌含量。Ford等[36]在英国沙丘草原的研究发现,放牧降低了土壤革兰氏阳性细菌的相对丰度。
放牧虽然没有影响土壤真菌与细菌比值以及土壤革兰氏阳性细菌与阴性细菌的比值,但是显著改变了高寒草原化草甸和典型高寒草甸的土壤微生物群落,这与前人的研究结果一致。Jirout等[37]在捷克共和国草原的研究表明,虽然放牧没有显著改变土壤真菌与细菌的比值,但是显著改变了土壤真菌的群落组成。Ford等[36]在英国沙丘草原和盐沼的研究发现,与围栏处理相比,放牧虽然显著改变了土壤微生物群落组成,但是对土壤真菌与细菌的比值无显著影响。因此,即使土壤真菌与细菌的比值不发生变化,土壤微生物群落组成也很可能发生变化。即在今后的研究中,不能仅仅通过土壤真菌与细菌比值的变化反映土壤微生物群落组成的变化。
放牧对土壤微生物量的影响与高寒草地类型有关,这与前人的研究一致。赵帅等[33]在内蒙古针茅草原的研究表明,虽然放牧增加了克氏针茅草原的土壤真菌与细菌的比值,但是降低了贝加尔针茅和大针茅草原的土壤真菌与细菌的比值;放牧显著降低了贝加尔针茅和大针茅草原的土壤真菌含量,而对克氏针茅草原的土壤真菌含量无显著影响;放牧显著增加了克氏针茅草原的革兰氏阴性细菌含量,而对贝加尔针茅和大针茅草原的革兰氏阴性细菌含量无显著影响。
在高寒草原化草甸,冬季放牧与围栏处理间在第二主轴上有显著差异;与无机氮相比,水溶性有机氮与第二主轴的相关性更强,放牧对水溶性有机氮的负效应越大,因此冬季放牧可能主要是通过干扰土壤水溶性有机氮进而导致了高寒草原化草甸的土壤微生物群落组成的变化。在高寒草原化草甸,夏季放牧与围栏处理间在第一主轴上有显著差异,在第二主轴上也存在一定差异;硝态氮与第一主轴的相关性较强,而水溶性有机碳与第二主轴的相关性更强;夏季放牧显著影响了硝态氮而对水溶性有机碳无显著影响,因此夏季放牧可能主要是通过干扰土壤硝态氮进而导致了高寒草原化草甸的土壤微生物群落组成的变化。在典型高寒草甸,夏季放牧与围栏处理间在第一主轴上有显著差异;水溶性有机碳与第一主轴为正相关,而硝态氮与第一主轴为负相关;围栏处理的土壤PLFA与第一主轴为正相关,而夏季放牧处理的土壤PLFA与第一主轴为负相关;夏季放牧趋于减少了土壤硝态氮和水溶性有机碳,因此夏季放牧可能主要是通过干扰土壤水溶性有机碳进而导致了典型高寒草甸的土壤微生物群落组成的变化。
综上,放牧减少了土壤微生物量,改变了土壤微生物群落组成。与夏季放牧相比,冬季放牧对土壤微生物群落的影响更大。与高寒草原化草甸相比,夏季放牧对典型高寒草甸的土壤微生物群落影响更大。
References:
[1] Chu H Y. Microbial communities in high latitudes and high altitudes ecosystems. Microbiology China, 2013, 40(1): 123-136.
褚海燕. 高寒生态系统微生物群落研究进展. 微生物学通报, 2013, 40(1): 123-136.
[2] Wang Q L, Cao G M, Wang C T. Quantitative characters of soil microbes and microbial biomass under different vegetations in alpine meadow. Chinese Journal of Ecology, 2007, 26(7): 1002-1008.
王启兰, 曹广民, 王长庭. 高寒草甸不同植被土壤微生物数量及微生物生物量的特征. 生态学杂志, 2007, 26(7): 1002-1008.
[3] Peng Y L, Cai X B, Xue H Y. Study on the variation characteristics of soil microbial biomass in the degraded alpine steppes. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16(4): 112-115
彭岳林, 蔡晓布, 薛会英. 退化高寒草原土壤微生物变化特性研究. 西北农业学报, 2007, 16(4): 112-115.
[4] Fu G, Shen Z X, Zhang X Z,etal. Respondence of grassland soil respiration to global change. Progress in Geography, 2010, 29(11): 1391-1399.
付刚, 沈振西, 张宪洲, 等. 草地土壤呼吸对全球变化的响应. 地理科学进展, 2010, 29(11): 1391-1399.
[5] Schindlbacher A, Rodler A, Kuffner M,etal. Experimental warming effects on the microbial community of a temperate mountain forest soil. Soil Biology & Biochemistry, 2011, 43(7): 1417-1425.
[6] Niu L, Liu Y H, Li Y,etal. Microbial community structure of the alpine meadow under different grazing styles in Naqu prefecture of Tibet. Chinese Journal of Applied Ecology, 2015, 26(8): 2298-2306.
牛磊, 刘颖慧, 李悦, 等. 西藏那曲地区高寒草甸不同放牧方式下土壤微生物群落结构特征. 应用生态学报, 2015, 26(8): 2298-2306.
[7] Royer-Tardif S, Bradley R L, Parsons W F J. Evidence that plant diversity and site productivity confer stability to forest floor microbial biomass. Soil Biology & Biochemistry, 2010, 42(5): 813-821.
[8] Li W, Cao W X, Shi S L,etal. Changes in organic carbon and nitrogen storage in alpine meadows under different grazing management regimes. Acta Prataculturae Sinica, 2016, 25(11): 25-33.
李文, 曹文侠, 师尚礼, 等. 放牧管理模式对高寒草甸生态系统有机碳、氮储量特征的影响. 草业学报, 2016, 25(11): 25-33.
[9] Fu G, Shen Z, Zhang X,etal. Response of microbial biomass to grazing in an alpine meadow along an elevation gradient on the Tibetan Plateau. European Journal of Soil Biology, 2012, 52: 27-29.
[10] Si G C, Yuan Y L, Wang J,etal. Effects of fencing on microbial communities and soil enzyme activities in Damxung alpine grassland. Pratacultural Science, 2015, 32(1): 1-10.
斯贵才, 袁艳丽, 王建, 等. 围封对当雄县高寒草原土壤微生物和酶活性的影响. 草业科学, 2015, 32(1): 1-10.
[11] Hiltbrunner D, Schulze S, Hagedorn F,etal. Cattle trampling alters soil properties and changes soil microbial communities in a Swiss sub-alpine pasture. Geoderma, 2012, 170: 369-377.
[12] Oates L G, Balser T C, Jackson R D. Subhumid pasture soil microbial communities affected by presence of grazing, but not grazing management. Applied Soil Ecology, 2012, 59: 20-28.
[13] Sun X, Wang S P, Lin Q Y,etal. Molecular ecological network analyses revealing the effects of livestock grazing on soil microbial. Microbiology China, 2015, 42(9): 1818-1831.
[14] Bardgett R D, Jones A C, Jones D L,etal. Soil microbial community patterns related to the history and intensity of grazing in sub-montane ecosystems. Soil Biology & Biochemistry, 2001, 33(12-13): 1653-1664.
[15] Patra A K, Abbadie L, Clays-Josserand A,etal. Effects of grazing on microbial functional groups involved in soil N dynamics. Ecological Monographs, 2005, 75(1): 65-80.
[16] Zhang L, Dang J, Liu W,etal. Effects of continuous enclosure and fertilization on soil microbial community structure in alpine meadow. Chinese Journal of Applied Ecology, 2012, 23(11): 3072-3078.
张莉, 党军, 刘伟, 等. 高寒草甸连续围封与施肥对土壤微生物群落结构的影响. 应用生态学报, 2012, 23(11): 3072-3078.
[17] Wang B, Sun G, Luo P,etal. Microbial communities of alpine meadow soil in the Eastern Qinghai-Tibetan Plateau subjected to experimental warming and grazing. Chinese Journal of Applied and Environmental Biology, 2011, 17(2): 151-157.
王蓓, 孙庚, 罗鹏, 等. 模拟升温和放牧对高寒草甸土壤微生物群落的影响. 应用与环境生物学报, 2011, 17(2): 151-157.
[18] Zhang W, Parker K M, Luo Y,etal. Soil microbial responses to experimental warming and clipping in a tallgrass prairie. Global Change Biology, 2005, 11(2): 266-277.
[19] Zou Y K, Zhang J N, Yang D L,etal. Phospholipid fatty acid analysis of microbial community structure under different land use patterns in soil ecosystems ofLeymuschinensissteppes. Acta Prataculturae Sinica, 2011, 20(4): 27-33.
邹雨坤, 张静妮, 杨殿林, 等. 不同利用方式下羊草草原土壤生态系统微生物群落结构的PLFA分析. 草业学报, 2011, 20(4): 27-33.
[20] Yang Y F, Wu L W, Lin Q Y,etal. Responses of the functional structure of soil microbial community to livestock grazing in the Tibetan alpine grassland. Global Change Biology, 2013, 19(2): 637-648.
[21] Cui S J, Bu R B Y, Zhu X X,etal. Effects of seasonal moderate grazing on plant community of alpine meadow. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(2): 349-357.
崔树娟, 布仁巴音, 朱小雪, 等. 不同季节适度放牧对高寒草甸植物群落特征的影响. 西北植物学报, 2014, 34(2): 349-357.
[22] Lange M, Habekost M, Eisenhauer N,etal. Biotic and abiotic properties mediating plant diversity effects on soil microbial communities in an experimental grassland. PLoS ONE, 2014, 9(5): e96182. doi: 96110.91371/journal.pone.0096182.
[23] Huang X M, Liu S R, Wang H,etal. Changes of soil microbial biomass carbon and community composition through mixing nitrogen-fixing species withEucalyptusurophyllain subtropical China. Soil Biology & Biochemistry, 2014, 73: 42-48.
[24] Zhang B, Chen S, He X,etal. Responses of soil microbial communities to experimental warming in alpine grasslands on the Qinghai-Tibet Plateau. PLoS ONE, 2014, 9(8): e103859. doi:103810.101371/journal.pone.0103859.
[25] Li N, Wang G X, Yang Y,etal. Plant production, and carbon and nitrogen source pools, are strongly intensified by experimental warming in alpine ecosystems in the Qinghai-Tibet Plateau. Soil Biology & Biochemistry, 2011, 43(5): 942-953.
[26] Rui Y C, Wang S P, Xu Z H,etal. Warming and grazing affect soil labile carbon and nitrogen pools differently in an alpine meadow of the Qinghai-Tibet Plateau in China. Journal of Soils and Sediments, 2011, 11(6): 903-914.
[27] Sun J, Wang X D, Cheng G W,etal. Effects of grazing regimes on plant traits and soil nutrients in an alpine steppe, Northern Tibetan Plateau. PLoS ONE, 2014, 9(9): 1-9.
[28] Fu G, Zhang Y J, Zhang X Z,etal. Response of ecosystem respiration to experimental warming and clipping in Tibetan alpine meadow at three elevations. Biogeosciences Discussion, 2013, 10(8): 13015-13047.
[29] Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil. Soil Biology & Biochemistry, 2006, 38(5): 991-999.
[30] Baath E, Anderson T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques. Soil Biology & Biochemistry, 2003, 35(7): 955-963.
[31] Olsson P A, Baath E, Jacobsen I,etal. The use of phospholipid and neutral lipid fatty acids to estimate biomass of arbuscular mycorrhizal fungi in soil. Mycological Research, 1995, 99(9): 623-629.
[32] Kieft T L, Ringelberg D B, White D C. Changes in ester-linked phospholipid fatty acid profiles of subsurface bacteria during starvation and desiccation in a porous medium. Applied and Environmental Microbiology, 1994, 60(9): 3292-3299.
[33] Zhao S, Zhang J N, Lai X,etal. Analysis of microbial biomass C, N and soil microbial community structure ofStipaSteppes using PLFA at grazing and fenced in Inner Mongolia, China. Journal of Agro-Environment Science, 2011, 30(6): 1126-1134.
赵帅, 张静妮, 赖欣, 等. 放牧与围栏内蒙古针茅草原土壤微生物生物量碳氮变化及微生物群落结构PLFA分析. 农业环境科学学报, 2011, 30(6): 1126-1134.
[34] Tan H Y, Yan R R, Yan Y C,etal. Phospholipid fatty acid analysis of soil microbial communities under different grazing intensities in meadow steppe. Acta Prataculturae Sinica, 2015, 24(3): 115-121.
谭红妍, 闫瑞瑞, 闫玉春, 等. 不同放牧强度下温性草甸草原土壤微生物群落结构PLFAs分析. 草业学报, 2015, 24(3): 115-121.
[35] Francini G, Liiri M, Mannisto M,etal. Response to reindeer grazing removal depends on soil characteristics in low Arctic meadows. Applied Soil Ecology, 2014, 76: 14-25.
[36] Ford H, Rousk J, Garbutt A,etal. Grazing effects on microbial community composition, growth and nutrient cycling in salt marsh and sand dune grasslands. Biology and Fertility of Soils, 2013, 49(1): 89-98.
[37] Jirout J, Simek M, Elhottova D. Inputs of nitrogen and organic matter govern the composition of fungal communities in soil disturbed by overwintering cattle. Soil Biology & Biochemistry, 2011, 43(3): 647-656.
GrazingalterssoilmicrobialcommunityinalpinegrasslandsofNorthernTibet
FU Gang, SHEN Zhen-Xi*
LhasaPlateauEcosystemResearchStation,KeyLaboratoryofEcosystemNetworkObservationandModeling,InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China
A grazing experiment was conducted in two alpine steppe meadows (winter pasture and summer pasture) and one alpine meadow (summer pasture) in Northern Tibet in July 2008. The phospholipid fatty-acid (PLFA) method was used to characterise the soil microbial community. Fungi, gram-negative bacteria, actinomycetes and protozoa in ungrazed soils were significantly higher than grazed soils in winter pasture on the alpine steppe meadow. Total PLFA, fungi, bacteria, gram-positive bacteria, gram-negative bacteria, actinomycetes, arbuscular mycorrhizal fungi and protozoa in the ungrazed soils were also significantly higher than those of grazed soils in the summer alpine meadow. There were significant differences in soil microbial community structure between ungrazed and grazed soils for all three alpine grasslands based on redundancy analysis. Soil inorganic nitrogen and dissolved organic nitrogen significantly affected the variation in the soil PLFA profile in the alpine steppe meadow for the winter pasture, whereas nitrate nitrogen and dissolved organic carbon significantly affected the variation of soil PLFA profile for the summer pastures. Our findings suggested that clarifying the effect of grazing on alpine soil microbial communities needs to consider grazing season and grassland types in Northern Tibet.
fencing; phospholipid fatty-acid; redundancy analysis; grazing season
10.11686/cyxb2017011http//cyxb.lzu.edu.cn
付刚, 沈振西. 放牧改变了藏北高原高寒草甸土壤微生物群落. 草业学报, 2017, 26(10): 170-178.
FU Gang, SHEN Zhen-Xi. Grazing alters soil microbial community in alpine grasslands of Northern Tibet. Acta Prataculturae Sinica, 2017, 26(10): 170-178.
2017-01-09;改回日期:2017-05-04
国家自然基金项目(31600432,41171084)和国家重点研发计划(2016YFC0502005,2016YFC0502006)资助。
付刚(1984-),男,河北保定人,副研究员,博士。E-mail: fugang@igsnrr.ac.cn
*通信作者Corresponding author. E-mail: shenzx@igsnrr.ac.cn
