利用MR1523/苏御糯F2:3群体定位水稻抗灰飞虱QTL
2017-10-17温培正孙志广肖世卓胡金龙乐江程遐年刘裕强万建民南京农业大学作物遗传与种质创新国家重点实验室江苏南京0095中国农业科学院作物科学研究所北京0008
仲 杰 温培正 孙志广 肖世卓 胡金龙 张 乐江 玲 程遐年 刘裕强,* 万建民,南京农业大学作物遗传与种质创新国家重点实验室, 江苏南京 0095;中国农业科学院作物科学研究所, 北京 0008
利用MR1523/苏御糯F2:3群体定位水稻抗灰飞虱QTL
仲 杰1温培正1孙志广1肖世卓1胡金龙1张 乐1江 玲1程遐年1刘裕强1,*万建民1,21南京农业大学作物遗传与种质创新国家重点实验室, 江苏南京 210095;2中国农业科学院作物科学研究所, 北京 100081
灰飞虱是我国水稻生产的主要害虫之一, 不仅直接取食危害水稻, 还是水稻主要病毒病的传播介体, 严重制约水稻生产。籼稻品种MR1523对灰飞虱表现较强的排趋性。为发掘抗灰飞虱新基因, 本研究利用MR1523与感虫粳稻品种苏御糯构建了一个包含200个家系的F2:3分离群体, 进行灰飞虱抗性鉴定。并利用120对均匀分布在水稻12条染色体的多态性SSR标记, 构建了全基因组连锁图谱, 进行抗灰飞虱QTL定位。结果分别在水稻第2、第5和第 6染色体上检测到 Qsbph2、Qsbph5a、Qsbph5b和 Qsbph6 4个抗灰飞虱 QTLs, 分别位于分子标记RM526–RM3763、RM17804–RM13、RM574–RM169和 RM190–RM510之间, LOD 值分别为 2.14、3.13、3.23和 2.35,贡献率分别为12.0%、14.7%、17.4%和14.1%, 各QTL的抗性等位基因效应均来自抗虫亲本MR1523。该结果为后续抗灰飞虱基因的精细定位及通过分子标记辅助选择培育抗灰飞虱水稻新品种奠定了基础。
水稻; 灰飞虱; 抗性; 数量性状基因座
Abstract:The small brown planthopper (SBPH), Laodelphax striatellus Fallén (Homoptera: Delphacide), is one of the most destructive insect pests in rice (Oryza sativa L.) production. SBPH not only causes direct damage by sucking plant sap but also transmits the main viral diseases, which seriously threatens the safety of rice production. An indica cultivar MR1523 displayed strong antixenosis against SBPH. In order to identify SBPH resistance genes, an F2:3population derived from a cross between MR1523 and susceptible japonica cultivar Suyunuo was constructed, and then evaluated for SBPH resistance. Moreover, 120 polymorphic SSR markers between the parents uniformly distributed on 12 chromosomes of rice were used to construct the molecular linkage map, and then conducted the QTL assay for SBPH resistance. A total of four QTLs on chromosome 2, 5, and 6,Qsbph2, Qsbph5a, Qsbph5b, and Qsbph6 were detected in the interval of RM526–RM3763, RM17804–RM13, RM574–RM169,and RM190–RM510, with LOD score of 2.14, 3.13, 3.23, and 2.35, and explained the phenotypic variance of 12.0%, 14.7%, 17.4%,and 14.1%, respectively. All of the QTLs came from the resistance parent MR1523. The results in this study lay a foundation for furtherly fine mapping SBPH resistance and developing new cultivars by molecular marker assisted selection in the future.
Keywords:Rice (Oryza sativa L.); Small brown planthopper (SBPH); Resistance; Quantitative trait locus (QTL)
稻飞虱属同翅目(Homoptera), 飞虱科(Delphacide), 是危害水稻生产最严重的害虫之一[1], 主要包括褐飞虱、灰飞虱和白背飞虱 3种类型, 这 3种害虫均以吸食水稻韧皮部汁液为生, 严重影响水稻的产量及品质[2-3]。其中灰飞虱(Laodelphax striatellus Fallén)广泛分布于我国长江中下游及华北等地区[4]。灰飞虱危害时主要以成虫、若虫成群聚集在水稻茎、叶、穗部, 刺吸汁液, 引起植株黄叶、早枯萎缩, 甚至霉烂枯死, 或导致稻穗发黑霉变, 严重影响水稻灌浆结实, 造成空秕率上升, 千粒重下降, 稻米品质降低[5]。灰飞虱不仅直接取食危害水稻, 还是水稻主要病毒病水稻条纹叶枯病(Rice stripe virus disease)和水稻黑条矮缩病(Rice black-streaked dwarf virus disease)的传播介体, 这两类病毒病在我国南方粳稻种植区流行发生, 严重制约我国水稻生产。此外, 灰飞虱寄主广泛, 除水稻外, 还可取食小麦、大麦和玉米等绝大部分禾本科植物, 也是玉米粗缩病和小麦丛矮病的传播介体[6-7]。
目前对灰飞虱及其传播病毒, 主要是依靠化学防治, 但由于灰飞虱具有较强的迁飞特性和爆发性,且其传毒迅速, 导致防治效果并不理想。同时, 化学农药的过度使用, 不仅污染环境、破坏生态平衡, 还会带来农药残留, 造成灰飞虱抗药性的产生。因此,培育抗性品种被认为是防治灰飞虱最为经济有效的措施[8-10]。然而相对其他农艺性状, 受抗性鉴定等因素的限制, 水稻抗灰飞虱研究较为滞后。此外, 依赖表型选择的传统育种方式, 培育抗虫品种, 工作量大, 具有较大的盲目性, 周期较长, 难以满足生产需求。通过分子标记辅助选择(Marker Assisted Selection, MAS)技术, 可显著提高抗虫育种的效率,缩短育种年限。抗灰飞虱基因的发掘及其紧密连锁标记的鉴定, 是利用MAS培育抗性品种的前提与基础。为此, 前人已相继从各类水稻资源中鉴定了一批抗灰飞虱水稻资源。迄今, 已利用上述资源相继在水稻9条染色体上定位抗灰飞虱QTL约30个[11-15]。但目前尚未见抗灰飞虱基因精细定位和克隆的报道。
为进一步发掘与定位抗灰飞虱基因, 本研究利用筛选到的抗灰飞虱水稻品种MR1523与感虫品种苏御糯构建遗传群体, 进行灰飞虱基因的遗传分析及 QTLs检测。以期为抗灰飞虱基因的精细定位和育种利用提供有用的基因资源和分子标记。
1 材料与方法
1.1 水稻材料
以高抗灰飞虱水稻品种 MR1523为母本, 高感品种苏御糯(SYN)为父本, 构建了一个包含200个单株的F2群体, F2单株自交获得相应的F2:3家系, 用于灰飞虱抗性鉴定。
1.2 灰飞虱虫源
灰飞虱最初采集于南京水稻田, 饲养于苏御糯植株上, 并在南京农业大学温室内大量饲养和繁殖作为供试虫源。
1.3 灰飞虱抗性鉴定
灰飞虱抗性采用改进的标准苗期集团筛选法(standard seed box screening test, SSST)鉴定。主要参照 SSST方法, 并针对灰飞虱食量相对较小的特性,在反复试验的基础上, 进行了改进即在水稻幼苗1.5~2.0叶期接虫, 接虫量增加至每株15头; 以苏御糯为感虫对照品种, MR1523为抗虫对照; 接虫后,当感虫对照幼苗死亡率达 100%时, 参照 IRRI制定的抗性评价标准[16], 对各个材料进行评级, 通过加权平均计算各材料的平均抗虫级别, 分别为0, 免疫;0.1~1.9, 高抗; 2.0~3.9, 抗虫; 4.0~5.9, 中抗; 6.0~7.9,感虫; 8.0~9.0, 高感。为确保各材料生长一致, 所有供试品种均浸种催芽。将每个材料分别播种于一个直径8.0 cm、高9.0 cm, 盛满营养土的圆形塑料钵中(钵底部有一小孔, 便于渗透吸水), 每 60钵置于65 cm×44 cm×14 cm的塑料箱内, 随机排列, 箱内保持2 cm左右水层, 外加亲本和感虫对照各2钵。每钵播种35粒发芽种子, 接虫前3 d间苗, 淘汰病弱苗, 每钵保留30棵苗用于接虫, 每个材料两钵。自然光照, 室温25~27℃。
1.4 排趋性试验
将催芽后的水稻种子播于 5 L的玻璃烧杯内,每个品种25株, 随机排列, 重复3次。待幼苗长至1.5~2.0叶期, 剔除弱苗, 每个品种留苗20株, 按每株 5头接入 2~3龄的灰飞虱若虫, 自然光照, 室温25~27°C。24 h 后开始调查每个单株上的虫数, 每天1次, 调查后保持烧杯内状态不变, 连续调查5 d。5 d后计算每个品种上的平均虫数, 作为排趋性测验值。
1.5 抗生性试验
将催芽后的水稻种子播于直径为 6 cm, 高 15 cm的无色透明塑料杯中, 每个品种5株, 重复3次,待秧苗长至 1.5~2.0叶期, 接入每杯 25头 1~2龄灰飞虱若虫, 纱布封口, 1 d后统计每个杯子剩余的虫数, 计算灰飞虱若虫的残存率, 作为抗生性测验值。
1.6 DNA样品制备
采用CTAB法制备DNA样品。取新鲜水稻叶片200~300 mg, 研磨成细粉; 加入 600 μL的 10×CTAB,置 65°C 水浴 30 min; 加入 700 μL 氯仿, 12 000×g,离心5 min; 转移上清液至另一离心管中, 加入240 μL异丙醇, 13 000×g, 离心 5 min; 弃上清液, 加入400 μL 的 70%乙醇, 12 000×g离心 5 min; 弃 70%乙醇, 风干; 加 100~200 μL TE, 溶解后 4℃保存。
1.7 SSR标记分析
10 μL 反应体系包括 10 mmol L–1Tris-HCl, pH 8.3, 50 mmol L–1KCl, 1.5 mmol L–1MgCl2, 50 μmol L–1dNTPs, 0.2 μmol L–1引物, 0.5 U Taq polymerase和20 ng DNA模板。在PCR仪中进行扩增反应, 94°C 4 min; 94°C 1 min, 55°C 1 min, 72°C 1.5 min, 35 个循环; 72°C 7 min。扩增产物经8%的非变性PAGE胶分离后, 银染显色。利用装有荧光灯的灯箱观察DNA条带, 将扩增产物在双亲间表现明显多态的引物用于F2群体的分析。
1.8 连锁图谱的构建及QTL分析
根据分子标记分析的结果, 将具有 MR1523带型的个体赋值为1, 具有苏御糯带型的赋值为 2, 具有双亲带型(杂合带)的个体赋值为3, 数据缺失的记为0。利用MapMaker 3.0软件和120对均匀分布在水稻12条染色体的多态性SSR和InDel标记, 构建全基因组连锁图谱, 检测抗灰飞虱 QTL, 以 LOD≥2.0为阈值判断QTL是否存在。
2 结果与分析
2.1 亲本MR1523和苏御糯的灰飞虱抗性表现
如图1所示, 在接虫后约15 d, 粳稻品种苏御糯的死苗率达100%, 籼稻品种MR1523的死苗率仅约为18%。表明MR1523和苏御糯对灰飞虱的抗性存在较大差异, MR1523高抗灰飞虱, 而苏御糯高感灰飞虱。
为进一步探明 MR1523抗灰飞虱机制, 对 2个亲本分别进行了排趋性和抗生性检测。排趋性实验表明, 接种灰飞虱后抗虫品种 MR1523植株上的虫数明显少于感虫品种苏御糯, 且在接虫第 4天之后,两品种上灰飞虱的数目达到差异显著水平(图 2-A),表明MR1523对灰飞虱具有较强的排趋性。而在抗生性实验中, 接虫后 1~5 d, 2个品种灰飞虱的存活率均没有显著差异(图2-B), 表明抗生性并不是引起两品种抗感差异的主要因素。
2.2 MR1523/苏御糯 F2群体的构建及灰飞虱抗性鉴定
为解析 MR1523抗灰飞虱的遗传基础, 利用MR1523与苏御糯构建 F2分离群体, 并自交获得相应的 F2:3家系, 进行灰飞虱抗性鉴定。从中筛选出92份表型鉴定重复性较好的家系(重复间误差<10%),用于抗灰飞虱基因的定位。92个F2:3家系的灰飞虱抗性级别从0~9级呈连续性分布, 最小为0级, 最大为 9级(图 3)。根据分级标准将对应 F2的表型分为0~1级: 纯合抗虫(RR); 2~6级: 杂合型(Rr)和7~9级:纯合感虫(rr), 92个F2:3家系表型分离比为35∶36∶21, 适合性测验表明 RR∶Rr∶rr的分离比不符合1∶2∶1 (表1), 表明MR1523对灰飞虱的抗性可能受多个基因控制。

图1 MR1523和苏御糯(SYN)灰飞虱抗性对比分析Fig. 1 Comparative analysis of the resistance to SBPH between MR1523 and Suyunuo (SYN)

图2 苏御糯(SYN)和MR1523灰飞虱的排趋性(A)和抗生性(B)对比分析Fig. 2 Comparative analysis of antixenosis (A) and antibiosis (B) against SBPH between Suyunuo (SYN) and MR1523

表1 MR1523/苏御糯F2群体对灰飞虱的抗性分离Table 1 Segregation of SBPH resistance in F2population derived from the cross MR1523/SYN
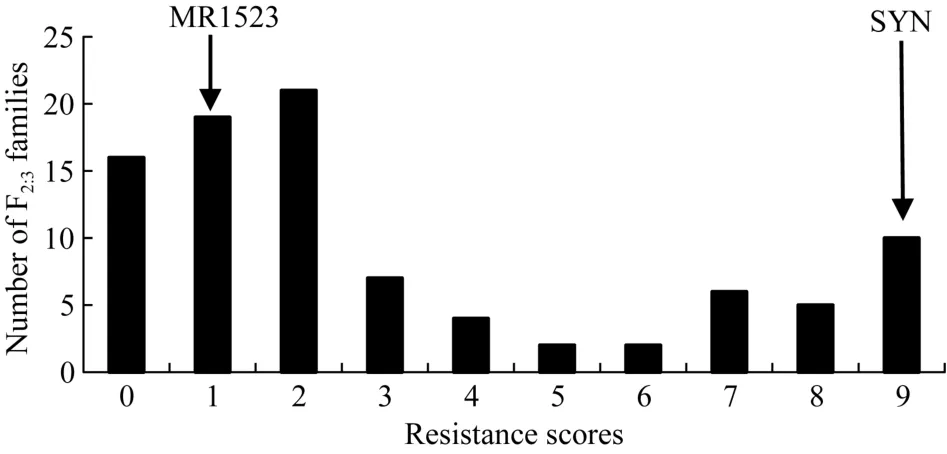
图3 MR1523/苏御糯F2:3家系灰飞虱(SBPH)抗性等级次数分布图Fig. 3 Frequency distribution of SBPH resistance scores of F2:3families derived from a cross between MR1523/Suyunuo (SYN)
2.3 MR1523/苏御糯F2分子连锁图谱的构建
利用覆盖全基因组的500余对SSR和InDel标记进行 MR1523和苏御糯的多态性筛选, 共筛选出两亲本间有多态性的分子标记 140对, 选用多态性较好, 且均匀分布于12条染色体上的120对分子标记, 构建分子连锁图谱。分子图谱覆盖整个水稻基因组的1074.3 cM, 每两个标记之间的平均遗传距离约为8.95 cM, 达到了QTL检测的基本要求。
2.4 MR1523/苏御糯F2群体抗灰飞虱QTL分析
利用IciMapping进行复合区间作图分析[17], 在第2、第5和第6染色体上共检测到4个抗灰飞虱QTL, Qsbph2、Qsbph5a、Qsbph5b和 Qsbph6, 分别位 于 标 记 RM526–RM3763、 RM17804–RM13、RM574–RM169 和 RM190–RM510 之间(图 4), LOD值分别为 2.14、3.13、3.23和 2.35, 贡献率分别为12.0%、14.7%、17.4%和14.1% (表2)。各QTL的加性效应推测结果显示, 增强抗性等位基因均来自MR1523。
3 讨论
灰飞虱寄主范围广, 群体密度大, 爆发性强,近年来在我国各地危害日益严重, 给我国农业生产造成严重损失。目前我国主栽水稻品种, 尤其是粳稻品种, 大多易感灰飞虱及其传播的病毒病, 在一定程度上加重了其危害。因此, 培育抗灰飞虱水稻品种, 对于防治灰飞虱及其传播病毒病均具有十分重要的意义。
根据已有的报道, 籼稻品种 MR1523不仅高抗灰飞虱, 同时还兼抗褐飞虱、白背飞虱和稻瘿蚊等多种吸汁类害虫, 表现广谱的抗虫性, 具有较大的应用前景[18-20]。遗传分析表明, 其白背飞虱抗性受1对隐性基因 wbph4控制, 但其携带的抗灰飞虱和褐飞虱基因的染色体位置尚未明确。Himabindu等[21]发现MR1523对稻瘿蚊的不同生物型均表现较强的抗性, 并利用以TN1为背景的近等基因系将其定位在第12染色体RM28574和RM28706之间约1.7 Mb的区间内, 分别相距 4.4 cM 和 3.8 cM, 命名为GM11。本研究首次解析了MR1523抗灰飞虱的遗传基础, 分别在 3条染色体上检测到 4个抗灰飞虱QTL。然而并未在第12染色体GM11位点检测到抗灰飞虱QTL, 表明MR1523对不同吸汁类害虫的抗性可能分别由不同的抗性基因控制。
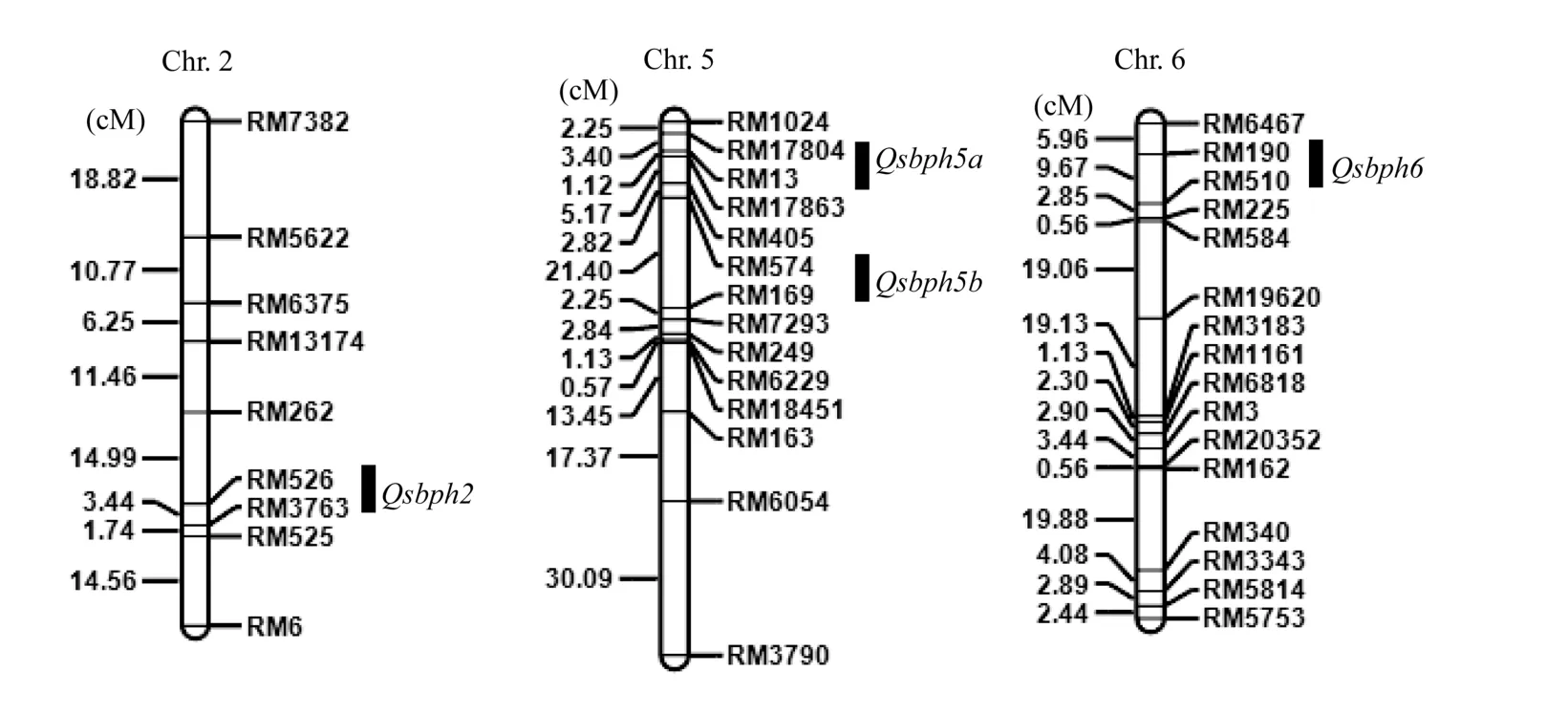
图4 在MR1523/苏御糯F2群体中检测到抗灰飞虱QTL在染色体上的分布Fig. 4 Chromosomal locations of QTLs for SBPH resistance detected in MR1523/Suyunuo F2population
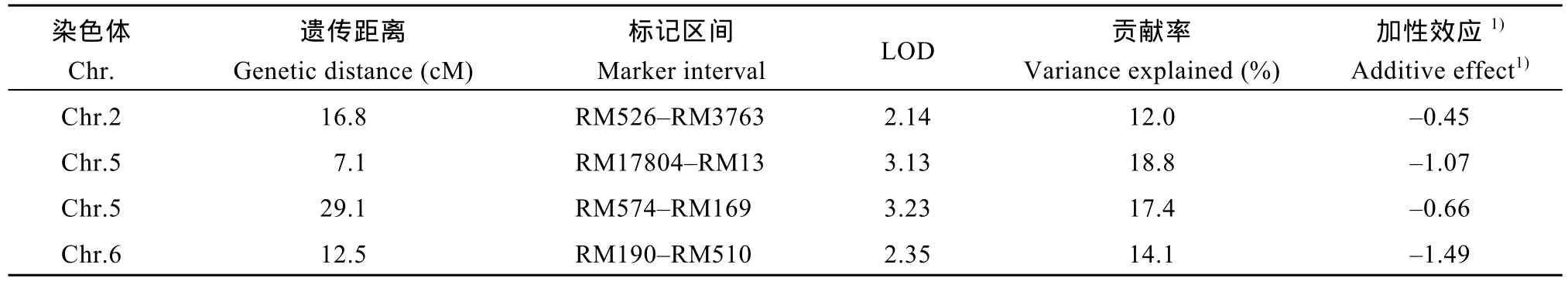
表2 在MR1523/苏御糯F2群体中检测到的抗灰飞虱QTLTable 2 QTLs for SBPH resistance detected in MR1523/Suyunuo F2population
抗灰飞虱基因的发掘是培育抗性品种及利用品种抗性防治灰飞虱的前提和基础。此前, 研究者已相继定位了多个水稻抗灰飞虱QTL[22]。利用水稻品种Mudgo鉴定到3个抗灰飞虱QTL, 即Qsbph2b、Qsbph3d和Qsbph12, 分别定位于第2、第3和第12染色体上[11]。利用籼稻品种Kasalath检测到3个趋避性QTLs和2个抗生性QTL, 分别定位在第2、第3、第8和第11染色体上, 其中位于第11条染色体S2260和G257之间的Qsbph11为一个抗灰飞虱的主效 QTL[12]。利用 RathuHeenati/02428 F2和 BC1F2, 在水稻第2、第4、第5和第12染色体上检测到4个抗灰飞虱QTL, 即qSBPH2b2、qSBPH4a、qSBPH5c和qSBPH12a1, 其中qSBPH12a1的LOD值为18.99,贡献率为37.84%, 为一主效QTL[23]。2013年, Wang等[24]在籼稻品种N22中发现了5个抗灰飞虱的QTL,即 qSBPH2、qSBPH3、qSBPH5、qSBPH7 和 qSBPH11,其中利用排趋性、抗生性和耐害性 3种不同的表型鉴定方法, 均检测到 qSBPH7。Zhang等[25]在利用Oryza officinalis, 在第3、第7和第12染色体上鉴定了3个抗灰飞虱QTL。本研究利用MR1523/苏御糯的F2群体, 在水稻3条染色体上检测到4个抗灰飞虱QTL, 即Qsbph2、Qsbph5a、Qsbph5b和Qsbph6。通过与之前定位的抗性位点比较分析, 发现 Qsbph2与N22中检测到的qSBPH2和来自Rathu Heenati的qSBPH2a位置相邻; Qsbph5a与来自N22的qSBPH5位于相同染色体区间, 表明这2个QTLs可能与前人报道的位点等位。而另外 2个 QTL, Qsbph5b和Qsbph6, 此前未见报道, 可能为新的抗灰飞虱位点。
4 结论
检测到 4个灰飞虱抗性位点并鉴定其连锁分子标记, 为利用分子标记辅助选择培育抗灰飞虱水稻品种、防治灰飞虱及其传播病毒病提供了有用的基因资源, 并为进一步精细定位和克隆抗灰飞虱基因、解析水稻抗灰飞虱的分子机制奠定了基础。
[1]Brar D S, Virk P S, Jena K K, Khush G S. Breeding for resistance to planthoppers in rice. In: Heong K L, Hardy B, eds. Planthoppers: new threats to the sustainability of intensive rice productionsystems in Asia. International Rice Research Institute, Los Baños,Philippines, 2009. pp 401–428
[2]邰德良, 李瑛, 梅爱中, 丁志宽, 王春兰, 仲凤翔. 2004年稻田灰飞虱重发原因分析与控制对策. 中国植保导刊, 2005, 25(3):29–31 Tai D L, Li Y, Mei A Z, Ding Z K, Wang C L, Zhong F X. Analysis and control measures of rice brown planthopper occurrence in 2004. China Plant Prot, 2005, 25(3): 29–31 (in Chinese)
[3]顾伯良, 薛萍霞, 施文贤, 周丽花. 水稻灰飞虱转移穗部为害及其对产量损失的观察. 中国植保导刊, 2005, 25(5): 7–8 Gu B L, Xue P X, Shi W X, Zhou L H. Observation on rice spikes infected by Laodelphax striatellus and rice yield loss. China Plant Prot, 2005, 25(5): 7–8 (in Chinese with English abstract)
[4]兰莹, 周彤, 范永坚, 周益军. 水稻对灰飞虱传播的两种病毒病抗性的研究进展. 江苏农业学报, 2012, 28: 1480–1486 Lan Y, Zhou T, Fan Y J, Zhou Y J. Advances in rice resistance to two virus diseases carried by small brown planthopper. Jiangsu J Agric Sci, 2012, 28: 1480–1486 (in Chinese with English abstract)
[5]Duan C X, Wan J M, Zhai H Q, Cheng Q, Wang J K, Su N, Lei C L. Quantitative trait loci mapping of resistance to Laodelphax striatellus (Homoptera: Delphacidae) in rice using recombinant in bredlines. J Econ Entomol, 2007, 100: 1450–1455
[6]王宝祥, 江玲, 陈亮明, 卢百关, 王琦, 黎光泉, 樊继伟, 程遐年, 翟虎渠, 徐大勇, 万建民. 水稻黑条矮缩病抗性资源的筛选和抗性QTL的定位. 作物学报, 2010, 36: 1258–1264 Wang B X, Jiang L, Chen L M, Lu B G, Wang Q, Tuyen L Q, Fan J W, Cheng X N, Zhai H Q, Xu D Y, Wan J M. Screening of rice resources against rice black-streaked dwarf virus and mapping of resistant QTL. Acta Agron Sini, 2010, 36: 1258–1264 (in Chinese with English abstract)
[7]段灿星, 张世贤, 陈青, 程治军, 翟虎渠, 万建民. 水稻种质资源抗灰飞虱评价及抗性机制分析. 中国水稻科学, 2007, 21:425–430 Duan C X, Zhang S X, Cheng Q, Chen Z J, Zhai H Q, Wan J M.Evaluation of rice germplasm for resistance to the small brown planthopper and analysis on resistance mechanism. Chin J Rice Sci, 2007, 21: 425–430 (in Chinese with English abstract)
[8]Sone S, Hattori Y, Tsuboi S, Otsu Y. Difference in susceptibility to imidacloprid of the populations of the small brown planthopper,Laodelphax striatellus Fallén. J Pestic Sci, 1995, 20: 541–543
[9]Endo S, Tsurumachi M. Insecticide resistance and insensitive acetylcholinesterase in small brown planthopper, Laodelphax striatellus. J Pestic Sci, 2000, 25: 395–397
[10]Endo S, Takahashi A, Tsurumachi M. Insecticide susceptibility of the small brown planthopper, Laodelphax striatellus Fallén (Homoptera: Delphacidae), collected from East Asia. Appl Entomol Zool, 2002, 37(1): 79–84
[11]段灿星, 程治军, 雷才林, 翟虎渠, 万建民. 利用 Mudgo/武育粳3号F2群体分析水稻抗灰飞虱 QTL. 作物学报, 2009, 35:388–394 Duan C X, Cheng Z J, Lei C L, Zhai H Q, Wan J M. Analysis of QTLs for resistance to small brown planthopper in rice using an F2population from across between Mudgo and Wuyujing 3. Acta Agron Sin, 2009, 35: 388–394 (in Chinese with English abstract)
[12]Duan C X, Su N, Cheng Z J, Lei C L, Wang J L, Zhai H Q, Wan J M. QTL analysis for the resistance to small brown planthopper(Laodelphax striatellus Fallén) in rice using back cross inbred lines. Plant Breed, 2010, 129: 63–67
[13]朱文银, 朱其松, 张洪瑞, 陈峰, 陈博聪, 杨连群. 不同类型水稻品种对灰飞虱抗性的初步鉴定. 江苏农业科学, 2012,40(7): 110–111 Zhu W X, Zhu Q S, Zhang H R, Chen F, Chen B C, Yang L Q.Preliminary identification of resistance to brown planthopper in different rice varieties. J Agric Sci Jiangsu, 2012, 40(7): 110–111(in Chinese)
[14]孙黛珍, 江玲, 张迎信, 程遐年, 王春明, 翟虎渠, 万建民. 8个水稻品种的条纹叶枯病抗性特征. 中国水稻科学, 2006, 20:219–222 Sun D Z, Jiang L, Zhang Y X, Cheng X N, Wang C M, Zhai H Q,Wan J M. Resistance to rice stripe in eight rice varieties. Chin J Rice Sci, 2006, 20: 219–222 (in Chinese with English abstract)
[15]刘芳, 宋英, 包善微, 卢海燕, 祝树德, 梁国华. 水稻品种对灰飞虱的抗性及其机制. 植物保护学报, 2007, 34: 449–454 Liu F, Song Y, Bao S W, Lu H Y, Zhu S D, Liang G H. Resistance to small brown planthopper and its mechanism in rice varieties.Acta Phytophgl Sin, 2007, 34: 449–454 (in Chinese with English abstract)
[16]IRRI. Standard evaluation systems for rice. Manila, Philippines:IRRI, 1988
[17]Meng L, Li H H, Zhang L Y, Wang J K. QTL IciMapping: Integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations. Crop J, 2015,3: 269–283
[18]Sarao P S, Bentur J S. Antixenosis and tolerance of rice genotypes against brown planthopper. Rice Sci, 2016, 23: 96–103
[19]程正新, 黄所生, 黄凤宽, 吴碧球, 韦素美. 水稻品种资源抗白背飞虱核心种质的研究. 中国农学通报, 2014, 34(4):288–292 Cheng Z X, Huang S S, Huang F K, Wu B Q, Wei S M. Studies on core collection of rice germplasms for resistance to whitebacked planthopper. Chin Agric Sci Bull, 2014, 34(4): 288–292(in Chinese with English abstract)
[20]邓伟, 胡兰香, 陈红萍, 陈明亮, 肖叶青. 水稻抗白背飞虱研究进展. 江西农业学报, 2012, 24(1): 91–97 Deng W, Hu L X, Chen H P, Chen M L, Xiao Y Q. Research progress in resistance of rice to Sogatella furcifera. Acta Agric Jiangxi, 2012, 24: 91–97 (in Chinese with English abstract)
[21]Himabindu K, Suneetha K, Sama V S A K, Bentur J S. A new rice gall midge resistance gene in the breeding line CR57-MR1523,mapping with flanking markers and development of NILs.Euphytica, 2010, 174: 179–187
[22]Yang L, Zhang W L. Genetic and biochemical mechanisms of rice resistance to planthopper. Plant Cell Rep, 2016, 35: 1559–1572
[23]Tuyen L Q, Liu Y Q, Jiang L, Wang B X, Wang Q, Hanh T T T,Wan J M. Identification of quantitative trait loci associated with small brown planthopper (Laodelphax striatellus Fallén) resistance in rice (Oryza sativa L.). Hereditas, 2012, 149: 16–23
[24]Wang Q, Liu Y Q, Hu J L, Zhang Y X, Xie K, Wang B X, Tuyen L Q, Song Z Q, Wu H, Liu Y L, Jiang L, Liu S J, Cheng X N,Wang C M, Zhai H Q, Wan J M. Detection of quantitative trait loci (QTLs) for resistances to small brown planthopper and rice stripe virus in rice using recombinant inbred lines. Int J Mol Sci,2013, 14: 8406–8421
[25]Zhang W L, Dong Y, Yang L, Ma B J, Ma R R, Huang F D, Wang C C, Hu H T, Li C S, Yan C Q, Chen J P. Small brown planthopper resistance loci in wild rice (Oryza officinalis). Mol Genet Genom, 2014, 289: 373–382
Identification of QTLs Conferring Small Brown Planthopper Resistance in Rice (Oryza sativa L.) Using MR1523/Suyunuo F2:3Population
ZHONG Jie1, WEN Pei-Zheng1, SUN Zhi-Guang1, XIAO Shi-Zhuo1, HU Jin-Long1, ZHANG Le1, JIANG Ling1, CHENG Xia-Nian1, LIU Yu-Qiang1,*, and WAN Jian-Min1,2
1State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
10.3724/SP.J.1006.2017.01596
本研究由国家重点研发计划项目(2017YFD0100400-01), 国家自然科学基金项目(31522039, 31471470)和江苏省自然科学基金项目(BK20150026)资助。
This study was supported by the National Key R&D Program of China (2017YFD0100400-01), the National Natural Science Foundation of China (31522039, 31471470), and the Natural Science Foundation of Jiangsu Province of China (BK20150026)
*通讯作者(Corresponding author): 刘裕强, E-mail: yql@njau.edu.cn
联系方式: 仲杰, E-mail: 2014101003@njau.edu.cn
): 2017-04-18; Accepted(接受日期): 2017-07-23; Published online(网络出版日期): 2017-08-11.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170811.0900.002.html
