基于金包裹磁性纳米粒子与适配体修饰CdTe 纳米探针的凝血酶检测方法
2017-10-15文艳清张友玉李海涛
文艳清, 龙 倩, 张友玉, 李海涛,
(1.湖南安全技术职业学院,湖南长沙 410151; 2.湖南师范大学化学化工学院,湖南长沙 410181)
适配体本质上是采用指数富集的配体系统进化技术(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)从寡核苷酸文库中筛选出来的随机DNA(或RNA)序列,具有高亲和力,能选择性结合大量目标分子,如蛋白质(凝血酶,黄曲霉毒素,血小板生长因子)[1 - 3]、小分子(ATP,可卡因)[4 - 6]和金属离子(K+,Hg2+,Pb2+)[7 - 8],还能用于微生物的检测[9]。在生化分析中,适配体易于分离和修饰,稳定性良好,容易储存,应用广泛,亲和力高而且体外选择简便,可以作为一种有前景的检测工具。
凝血酶(因子Iia)是凝血过程中的一种重要的蛋白酶,可以加速和巩固凝血过程,同时能抑制血栓并使血小板活化,对很多心血管疾病有重要的作用,并能调控很多炎症和伤口愈合过程。因此,建立快速、高灵敏度检测凝血酶的方法和传感器在医学上具有重要的意义。凝血酶适配体是最先从体外筛选出来的,并被广泛的研究,且证明它能形成一种G -四重体空间结构,并能在特定位点结合凝血酶[10]。目前,采用不同的方法利用其适配体定量检测凝血酶,已有大量报道[11 - 12],基于光谱的检测方法也有不少研究[3,13 - 14]。这些方法虽然现象明显,也有很好的特异性,灵敏度却不是很高。然而,电化学方法简单,灵敏,响应快,处理方便,在蛋白质检测方面有明显的优势[15 - 16]。
近年来,纳米粒子由于其独特的性质越来越受到人们的重视。磁性纳米粒子以其优越的物理特性[17 - 18],在生物医学领域具有广泛的应用前景。而半导体纳米粒子,又可称为量子点(QDs),如CdS、CdTe和CdSe等,由于其独特的发光及电化学特性,在生化分析中常被用做荧光或电化学探针[16,19]。本文以磁性纳米粒子作为分离材料,适配体修饰的CdTe纳米粒子作为探针,构建了一个基于适配体的电化学检测凝血酶的新方法。该方法中,金包覆的磁性纳米粒子不仅用于分离,同时还是DNA的固定材料。巯基修饰的适配体互补链通过Au-S键被固定在金包覆的磁性微球表面,而经半胱氨酸修饰的CdTe纳米粒子,其表面的自由氨基与适配体链5′端磷酸基团连成亚磷酰胺键[10],形成CdTe -Aptamer复合物,通过杂交反应,得到Fe3O4/Au/DNA/Aptamer复合物。若分析物中存在凝血酶,其适配体与之形成G -四重体结构,使双链DAN解链。固液分离后,应用差分脉冲伏安法(DPV)检测上清液中的Cd,最终实现凝血酶的检测,如图1所示。这种适配体传感器对检测凝血酶特异性好,灵敏度高,操作简单,在其他已被筛选出适配体的分析物的检测中也有很好的应用前景。
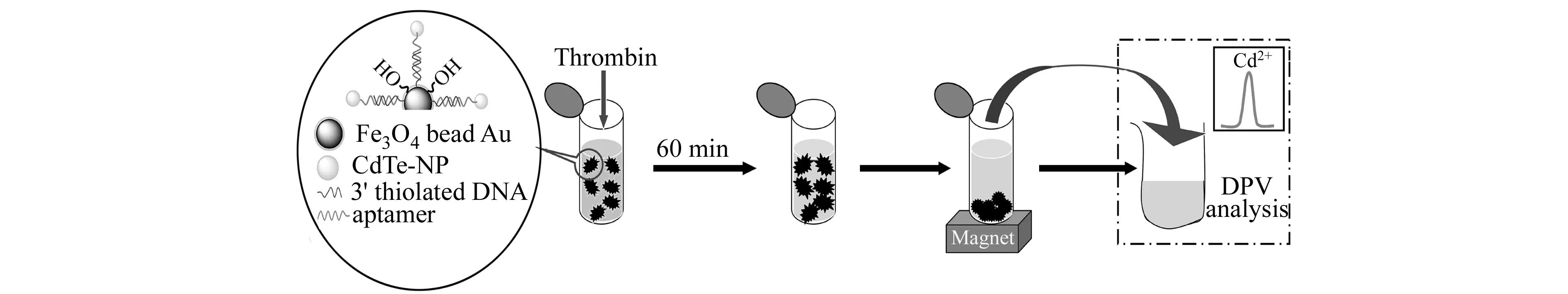
图1 适配体传感器形成及凝血酶检测过程示意图Fig.1 An illustration for aptasensor formation and thrombin detection process
1 实验部分
1.1 仪器与试剂
Nexus 670型傅里叶变换红外光谱仪(Nicolet Instrument Co.,Madison,WI);Picoscan 2100型原子力显微镜(Molecular Imaging Co.,USA);I660A型电化学工作站(上海辰华仪器公司);采用三电极体系,工作电极为玻碳电极(直径3 mm),参比电极为饱和甘汞电极,对电极为石墨电极。
碲粉(99.0%),CdCl2(99.0%),L-半胱氨酸(98.5%),NaBH4(98.0%),三羟甲基氨基甲烷(Tris),NaCl,MgCl2等均购自上海化学试剂厂。凝血酶,牛血清白蛋白,人血清白蛋白,纤维原蛋白,萘酚均购自Sigma公司。所有试剂都直接使用,并用Milli-Q超纯水配置。
合成的DNA片段购于上海生工生物工程技术与服务有限公司,其序列如下:适配体链:3′-GGT TGG TGT GGT TGG TTT TTT TTT TTT TTT TTT TT-SH-5′;互补链:5′-TTT TTT TTT CCA ACC ACA CCA ACC-3′。DNA原液(100 μmol/L)用Tris-HCl缓冲液配制并置于-20 ℃保存备用。
1.2 CdTe 纳米粒子的制备
功能化CdTe纳米粒子的合成在文献中[20]已有了详细的描述。NaBH4和蹄粉以2∶1的摩尔比在冰浴和强磁力搅拌及氮气保护下避光反应,离心后得到NaHTe上清液,将该上清液与Cd2+以L-半胱氨酸作为稳定剂,在碱性条件下反应30 min左右,得到CdTe前驱体溶液,再于100 ℃下回流1 h后得到CdTe纳米粒子。
1.3 Fe3O4/Au纳米粒子的制备
Fe3O4/Au纳米粒子采用共沉淀法[21]合成,用1.5 mol/L NaOH 作为沉淀剂合成Fe3O4纳米粒子。FeCl3·6H2O和FeCl2·4H2O溶解在HCl中,在氮气的保护下剧烈搅拌,逐滴加入沉淀剂,产生大量黑色沉淀,通过磁性分离多次清洗至中性,分散至一定量超纯水中,缓慢加入HAuCl4水溶液(加入的时间至少为10 min),混合均匀,使Au3+充分吸附于种子颗粒表面;最后,加入还原剂盐酸羟胺,混合均匀,反应进行1 h左右,形成核/壳结构的Fe3O4/Au磁性复合微粒。磁性分离,除去上清液,用超纯水洗涤至中性,最后分散至超纯水中备用。
1.4 凝血酶适配体传感器的制备
取适量Fe3O4/Au磁性复合纳米粒子储备液至20 mmol/L Tris-HCl(100 mmol/L NaCl,5 mmol/L KCl,1 mmol/L MgCl2,2 mmol/L EDTA,pH=7.4)缓冲液中,超声分散30 min,加入5 μL适配体的互补链在室温下搅拌2 h,再清洗三遍,分离出未连接到磁性纳米粒子上的DNA。磁性分离后,沉淀分散到500 μL 1%巯基乙醇中浸泡15 min以封闭多余的金表面,清洗后分散到500 μL杂交缓冲液中(2×SSC,0.05%Tween-20),与5 μL巯基修饰的适配体链在60 ℃下搅拌2 h,磁性分离后得到Aptamer-DNA-Au/Fe3O4复合物,分散到400 μL Tris-HCl缓冲液中,并加入100 μL CdTe纳米粒子,反应24 h后,磁性分离,清洗沉淀5次,以除去多余的和非特异性结合的物质,得到CdTe -Aptamer-DNA-Au/Fe3O4复合物,即凝血酶适配体传感器。最后,将此沉淀分散到500 μL Tris-HCl缓冲液中,并与一定浓度的凝血酶在室温下反应1 h,通过磁性分离弃去沉淀,所得到的上清液将用于DPV法检测。
1.5 电化学检测
往10 μL上清液中加入25 μL 1 mol/L HNO3,然后将混合溶液加入到5 mL 0.1 mol/L的乙酸缓冲溶液(pH=4.5)中,再加入10 μL 1 mg/mL Bi(NO3)3溶液。将玻碳电极用0.05 μm Al2O3抛光粉抛光,乙醇中超声10 min,清洗后氮气吹干。在玻碳电极表面滴加5 μL Nafion溶液(1%,用无水乙醇配制),自然风干。设定初始电位-1.0 V,终止电位-0.5 V,富集电位-1.0 V,清洗电位0.3 V,振幅50 mV,脉冲宽度50 ms,设置适当的富集时间、清洗时间、灵敏度等参数,并记录溶出伏安曲线,记录Cd(-0.84 V)的溶出峰高。所有实验均在室温下进行。
2 结果与讨论
2.1 L-半胱氨酸修饰的CdTe纳米粒子的表征
分别用红外(IR)光谱和原子力显微镜(AFM)对合成的CdTe纳米粒子进行了表征,其结果见图2。图2(a)和2(b)分别为L-半胱氨酸和L-半胱氨酸修饰的CdTe纳米粒子IR谱图。图2(b)中2 549 cm-1(υS-H)归属为-SH基团的特征吸收峰,2 968 cm-1归属为-CH2基团的特征吸收,1 589 cm-1处归属为-NH2基团的特征吸收峰。比较两张谱图,CdTe纳米粒子经L-半胱氨酸修饰后,红外光图谱中出现了-NH2基团和-CH2基团的吸收峰,同时官能团-SH吸收峰消失,说明L-半胱氨酸已成功修饰到CdTe纳米粒子表面。AFM结果显示了CdTe纳米粒子呈球形,分布比较均匀,平均粒径约25 nm(图2(c))。
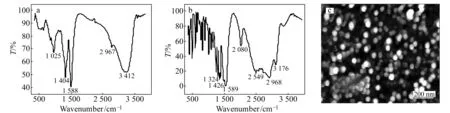
图2 L-半胱氨酸修饰的CdTe纳米粒子(a)和L-半胱氨酸(b)的红外光(IR)谱图; CdTe纳米粒子的原子力显微镜(CAFM)图(c)Fig.2 IR spectra of L-cysteinemodified CdTe nanoparticles(a) and L-cysteine(b);AFM imag of CdTe nanoparticles(c)
2.2 Fe3O4/Au纳米粒子的表征
分别用X-射线衍射(XRD)和AFM对合成的Fe3O4/Au纳米粒子进行了表征。图3(a)为XRD谱图,从图中可以看出,谱图中2θ为38.24o、44.29o、64.78o、77.64o处出现了Au的特征衍射峰,表明合成的磁性复合物是由Au和Fe3O4构成的。AFM结果显示了Fe3O4/Au纳米粒子尺寸大小比较均匀,平均粒径约50 nm(图3(b))。
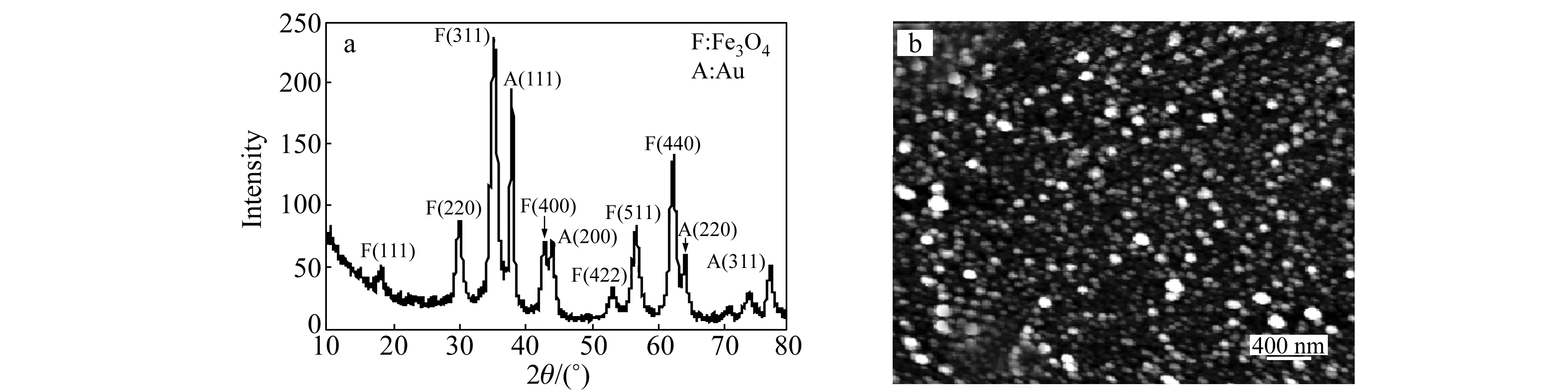
图3 Fe3O4/Au纳米粒子的X-射线衍射(XRD)谱图(a)及原子力显微镜(AFM)图(b)Fig.3 XRD pattern(a) and AFM imag(b) of Fe3O4/Au core/shell nanoparticles
2.3 凝血酶的检测原理
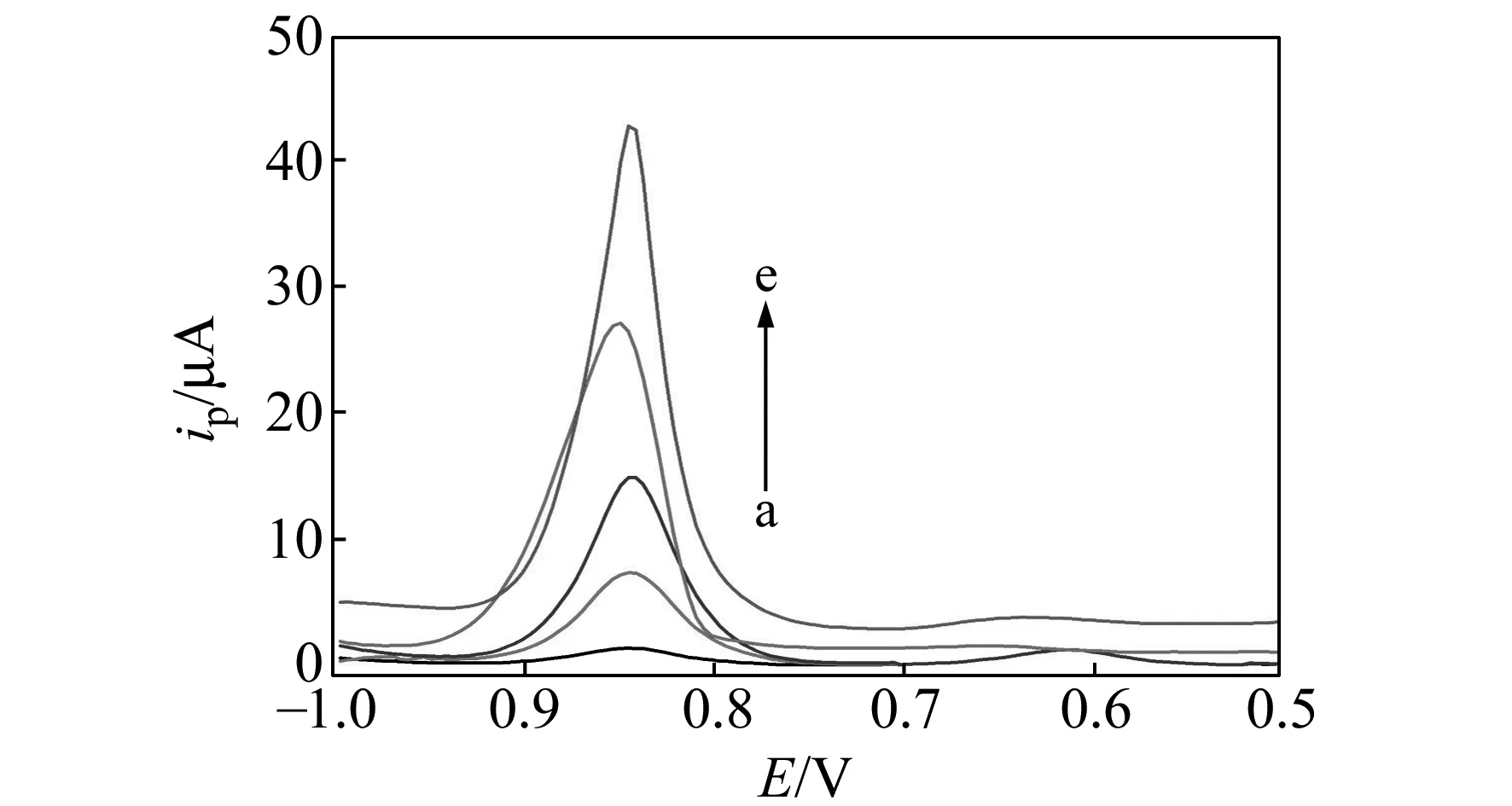
图4 不同凝血酶浓度下体系的DPV曲线Fig.4 DPV curres of the system with different concentration of thrombin a-e:0,1.5×10-12,2.5×10-12,7.0×10-12,13.0×10-12(mol/L).
图1描述了适配体传感器检测凝血酶的过程。通过Au-S键的共价结合和DNA的杂交反应,适配体互补链、适配体依次固定到了磁性纳米粒子表面,再将CdTe纳米粒子连接到适配体上,磁性分离后,得到的CdTe -Aptamer-DNA-Au/Fe3O4复合物(凝血酶适配体传感器)。重新分散到Tris-HCl 缓冲液中,并往该悬浮液中加入不同浓度的凝血酶,反应后再磁性分离,应用差分脉冲溶出法对上清液进行检测。结果如图4所示,不加凝血酶时,上清液中几乎检测不到Cd的电化学信号(a),当加入一定浓度的凝血酶时,由于凝血酶与适配体发生特异性结合,形成G -四重体稳定结构,导致DNA双链解旋,CdTe -Aptamer-thrombin复合物从磁性纳米粒子上分离,分散到缓冲液中,上清液中即可检测到Cd的电化学信号,且随着凝血酶浓度的增加,信号不断增强(b~e),从而达到检测凝血酶的目的。
2.4 实验条件的优化
为了得到更高的检测灵敏度,优化了各种实验条件。首先考察了缓冲液pH 值对适配体-凝血酶结合反应的影响,考察范围从pH为4.5至8.5。图5(A)显示了pH 值对检测结果的影响,从图中可以看出,当pH值为7.4时,其电化学响应最大,而高于或低于此值则响应较小,但影响并不大。因此,选择pH=7.4作为检测最佳的pH。我们还考察了温度对适配体与凝血酶结合的影响。如图5(B)所示,当温度为15 ℃时上清液中Cd的峰电流最大,并且随着温度的升高,其峰电流不断减小。结果表明,四重体结构在温度较低时稳定性更高,孵化温度对适配体与凝血酶的结合有很重要的影响。但由于15 ℃与25 ℃时的峰电流响应区别不大,最终选择25 ℃作为孵化温度。在本实验中,反应时间包括适配体与凝血酶的结合时间以及磁性分离时间。如图5(C)所示,很明显,Cd的峰电流信号随着反应时间的增加也不断增大,且在5 min到45 min范围内变化较大,而当时间长于45 min后,变化却很小,因此,选择60 min作为本实验的反应时间。
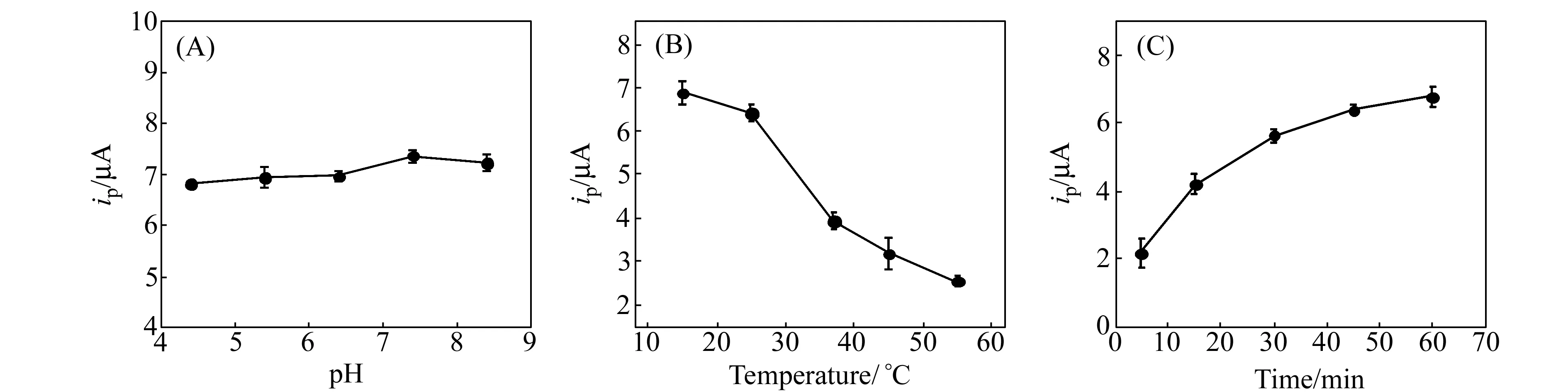
图5 溶液pH值(A)、反应温度(B)和反应时间(C)对检测结果的影响 Fig.5 Effects of pH(A),incubation temperature(B) and incubation time(C) on the stripping peak current The aptasensor has been prepared with 2.0×10-12 mol/L of thrombin.
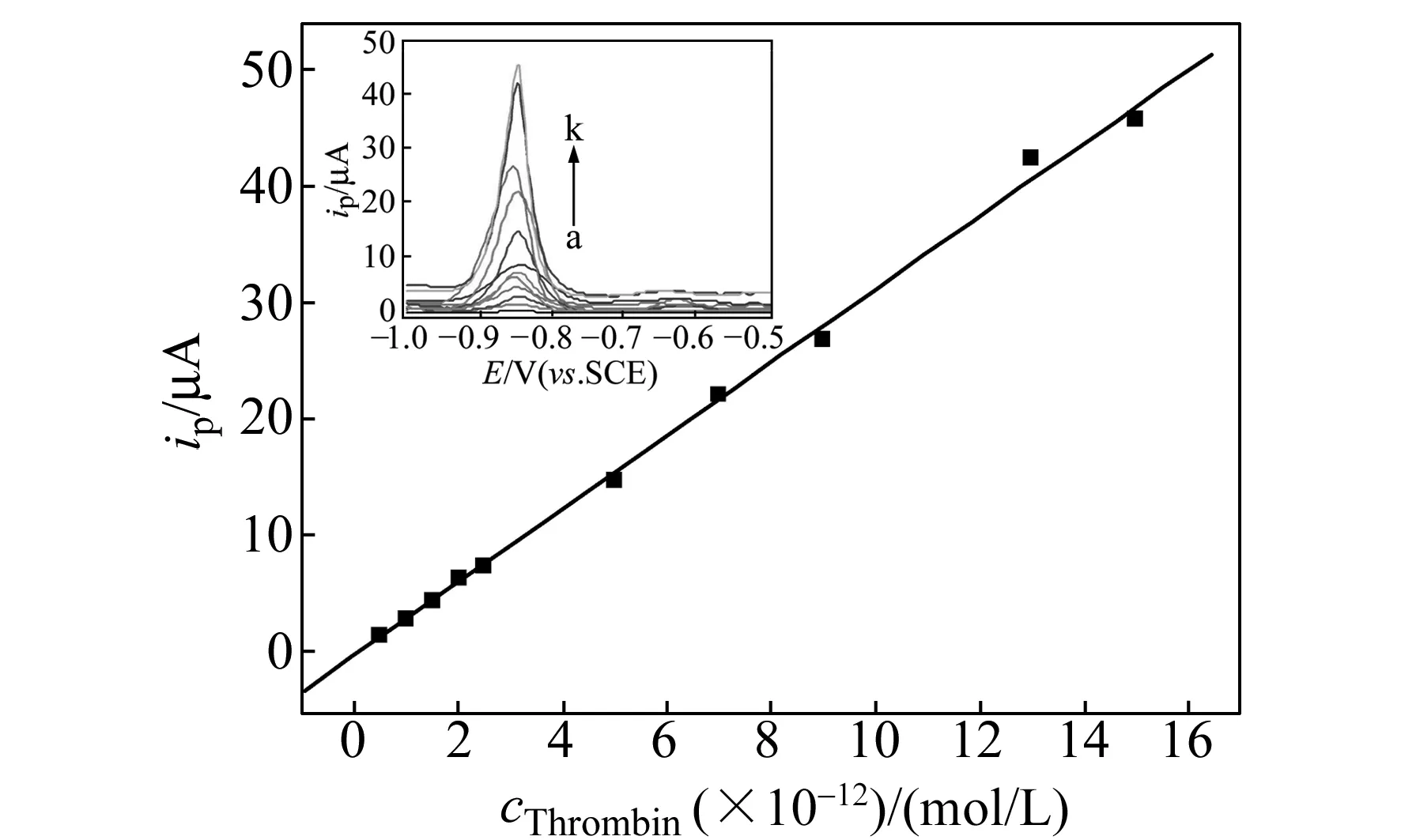
图6 ip-cThrombin校准曲线;插图为不同凝血酶浓度下体系的DPV曲线Fig.6 Calibration curve between ip and cThrombin;Insert: DPV curves of the system with different concentration of thrombin a-k:0,0.5×10-12,1.0×10-12,1.5×10-12,2.0×10-12,2.5×10-12,5.0×10-12,7.0×10-12,9.0×10-12,13.0×10-12,15.0×10-12(mol/L).
2.5 凝血酶的检测
根据凝血酶与适配体的特异性结合,在最佳条件下检测凝血酶。图6显示了峰电流与不同浓度的凝血酶的关系图,如图所示,随着凝血酶浓度的增大,Cd的峰电流信号也不断增强(图6,插图曲线a~k),其峰电流与凝血酶浓度有很好的线性关系,其线性范围为5.0×10-13~1.5×10-11mol/L,相关系数R2=0.9878,线性关系良好,检测限(S/N=3)达0.13 pmol/L,大大低于很多其他方法得到的检测限(1 pmol/L~11 nmol/L)[10,15]。
2.6 特异性实验
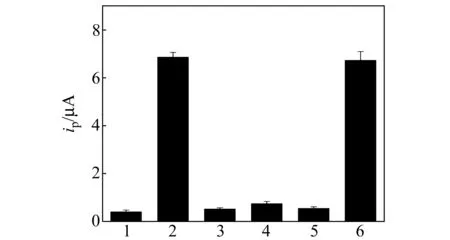
图7 特异性实验Fig.7 Specificity of the aptasensor(1) without thrombin,(2) 2.0×10-12 mol/L thrombin,(3) 3.5×10-6 mol/L BSA,(4) 3.5×10-6 mol/L HSA,(5) 3.5×10-6 mol/L Fibrinogen,(6) 2.0×10-12 mol/L thrombin 3.5×10-6 mol/L BSA.
为了证实所研究的电化学生物传感器对凝血酶蛋白具有特异性识别能力,分别考察了BSA、HAS、纤维原蛋白与适配体作用后的电化学响应。BSA、HSA及纤维原蛋白的浓度均为3.5×10-6mol/L,而凝血酶的浓度为2.0×10-12mol/L。结果如图7所示,只有凝血酶显示出明显的响应(柱2),而其他蛋白质的响应(柱3、柱4和柱5)与空白(柱1)相近,几乎可以忽略。结果表明,该适配体传感器对目标分子凝血酶有很好的特异性。此外,还考察了BSA共存下凝血酶与适配体作用后的电化学响应,发现BSA(3.5×10-6mol/L)共存下凝血酶与其适配体反应后的峰电流与没有BSA存在下的峰电流相比,没有明显的变化(比较图7柱2和柱4),同样说明适配体与BSA没有特异性结合,而且BSA的存在对于适配体与凝血酶的结合没有影响。
2.7 实际样品分析
为了验证本方法的实用性,对两个全血样品进行加标实验,全血样品来源于医院,并用Tris-HCl缓冲液稀释10 000倍。检测结果如表1所示。数据表明凝血酶的回收率在95.5%~105.0%之间。表明本方法能很好的应用于血样中凝血酶的检测。
3 结论
本文报道了一种超灵敏的基于适配体的凝血酶检测方法,该方法利用CdTe纳米粒子作为电化学探针,形成一种Fe3O4/Au-DNA-适配体-CdTe复合物,通过凝血酶与其适配体的特异性结合来检测凝血酶,检测限达到0.13 pmol/L,并且其他蛋白质(BSA、HSA及纤维原蛋白)并不影响凝血酶的检测,对全血中凝血酶的含量分析有很好的应用。这种适配体传感器有很多优点,一方面,采用CdTe纳米粒子作为电化学探针,能达到很低的检测限,并只需很少量的样品;另一方面,利用Fe3O4/Au磁性纳米粒子进行DNA的固定及分离,样品不需要进一步的富集及提纯,既经济又省时。总的来说,这种适配体传感器为凝血酶等的检测提供了一个灵敏、简便的方法,同时本方法经济省时,特异性高,为食品安全和疾病诊断中目标物的检测提供了有力的工具。
