基于丝网印刷电极的甲胎蛋白电化学免疫传感器
2017-10-15施晓文杜予民
毕 可, 施晓文, 杜予民
(武汉大学资源与环境科学学院,湖北武汉 430079)
甲胎蛋白(AFP)是一种由591个氨基酸残基组成的糖蛋白,也是一种临床中广泛使用的癌症标志物,其在血清中的含量对原发性肝癌及畸胎瘤的诊断治疗和愈后判断具有指导意义[1 - 2]。目前,临床用于AFP检测的传统方法,如酶联免疫吸附法(ELISA)[3]、荧光免疫法(FIA)[4]、放射免疫法(RIA)[5],存在灵敏度不高、步骤繁琐、辐射及废物污染严重等缺点。近年来应用的化学发光法(CLIA)[6]、电化学发光法(ECLIA)[7]等在以上问题有了一定的突破,但是仍存在需使用特殊设备,药品昂贵的问题。而电化学检测则具有设备简单,分析快速及易于小型化的特点,因此发展经济便捷且稳定可靠的电化学传感器对于癌症标志物的检测具有重要价值。
针对AFP的电化学传感器已有报道,但大多是基于玻碳电极[8 - 9]、金电极[10]等圆盘电极的电化学传感器,虽然能够重复使用,但是处理步骤复杂,不便于大规模使用。而近年来丝网印刷电极(SPE)的发展则有效规避了以上问题,SPE具有体积小、成本低廉的特点,使用一次后即可抛弃,避免多次使用产生的样品污染,并且样品体积需求小,结合便携式的电化学检测设备可发展个人医疗所需的电化学传感器。本文在SPE上电沉积金纳米粒子(AuNPs)改善了SPE的重现性,在保持其低成本优势的同时增强SPE的可靠性,通过静电组装捕获包被抗体[11],使用AuNPs/酶标检测抗体免疫探针作为检测探针,构建了一种基于双抗夹心结构的电化学免疫传感器,利用AuNPs的双重信号放大原理[12],实现了原发性肝癌以及畸胎瘤中标志物AFP的高灵敏检测。该传感器在低抗原浓度时即可获得较强响应信号,传感灵敏度优于相关文献报道[9,13-15]。
1 实验部分
1.1 仪器与试剂
Sigma场发射扫描电镜(SEM)(德国,Zeiss公司);CHI660e电化学工作站(上海辰华仪器有限公司);3-30K高速离心机(德国,Sigma公司)。
AFP标准品、AFP鼠单抗、HRP酶标记AFP鼠多抗(北京万域美澜科技有限公司),HAuCl4(国药集团),对苯二酚(HQ,国药集团),牛血清白蛋白(BSA,博士德生物工程有限公司),3,3′,5,5′-四甲基联苯胺(TMB,BIOSHARP),其他试剂均为国产分析纯试剂。丝网印刷电极(SPE)购于上海钼镁电子科技有限公司,实验用水均为电阻率达到18.25 MΩ·cm的超纯水。
1.2 实验方法
1.2.1电沉积AuNPs修饰丝网印刷电极基底首先使用无水乙醇清洗SPE,随后将其浸入0.5 mol/L H2SO4中,在-0.6~1.0 V间用循环伏安法(CV)活化电极20圈。再将其浸入含有0.01 mol/L K2SO4和0.001 mol/L HAuCl4溶液中,通过CV法沉积纳米金,电位窗口为-0.5~1.1 V,扫描圈数为38,扫速为0.1 V/s。超纯水清洗电极后氮气吹干备用。将电极浸入5 mmol/L的K3[Fe(CN)6]溶液中,通过微分脉冲伏安法(DPV)测试其重现性。
1.2.2AuNPs/酶标抗体免疫探针的制备参考文献方法并根据柠檬酸钠还原法制备AuNPs[11,16]。用0.2 mol/L K2CO3溶液调节pH到9.0以超过抗体等电点,加入适量HRP酶标记AFP鼠多抗,4 ℃ 孵育12 h后用含10%BSA的TBS缓冲液调节BSA浓度至1%以稳定并封闭纳米粒子;再4 ℃孵育12 h后2 000 r/min离心10 min,弃去沉淀,上清液12 000 r/min离心20 min,再弃去上清液,沉淀用含1%BSA的TBS缓冲液重悬,随后离心重悬两次得到纯化的免疫探针[17]。使用TMB显色液评价免疫探针的组装结果[18],确保沉淀的重悬液可以催化显色液显色,检验合格后将其保存在4 ℃冰箱内备用。
1.2.3双抗夹心电化学传感体系的构建取AuNPs修饰的SPE,在工作电极表面滴涂8.75 μL AFP鼠单抗溶液,4 ℃吸附组装12 h,用pH为7.4的磷酸盐缓冲溶液(PBS)冲洗未吸附抗体并氮气吹干。随后将50 μL封闭液滴涂在整个三电极区域上,4 ℃封闭12 h。
将待测的AFP抗原用含0.1%BSA的PBS配制成一系列不同浓度的样品,分别取8.75 μL滴涂于工作电极表面,37 ℃孵育1 h,用PBST洗涤缓冲液(0.05%Tween-20,pH=7.4,0.015 mol/L PBS)洗涤数次,氮气吹干。再将免疫探针稀释后滴涂于工作电极表面,37 ℃反应40 min,随后用PBST洗涤缓冲液洗涤数次,氮气吹干。
1.2.4AFP抗原的电化学检测通过DPV法在含有1 mmol/L对苯二酚(HQ),5 mmol/L H2O2[19](测试时加入),pH=5.4的柠檬酸-NaH2PO4缓冲液中测试组装的传感器。参数设置为电势增量4 mV,振幅50 mV,脉冲宽度50 ms,采样宽度40 ms,脉冲周期100 ms,静置时间20 s,可以根据具体情况微调电位窗口。
2 结果与讨论
2.1 基于双抗夹心法的传感体系检测原理
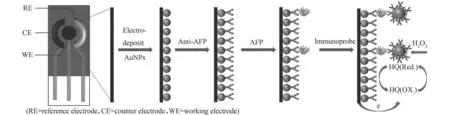
图1 免疫传感器的组装示意图Fig.1 Schematic illustration of the fabrication process of AFP immunosensor
基于双抗夹心法的电化学传感体系的组装过程及检测原理如图1所示。SPE表面的AuNPs通过静电作用吸附AFP鼠单抗(Anti-AFP),并用BSA封闭剩余非特异性结合位点。AFP鼠单抗结合AFP抗原后进一步与免疫探针结合,形成免疫复合物,同时引入了相当数量的HRP酶,起到放大电信号的作用[20]。因此,该传感体系可以在HQ的存在下催化H2O2的还原,并利用还原电流与AFP浓度之间的关系实现其定量检测。
2.2 修饰AuNPs提高电极基底重现性
在5 mmol/L的K3[Fe(CN)6]溶液中进行DPV测试,发现未经AuNPs修饰的SPE的重现性较差,电极间相对标准偏差(RSD)达到4.63%,峰峰电位差高达277 mV,不能满足实验要求。改变电沉积条件可以调节AuNPs形貌,粒径较小时吸附的抗体量过低,导致响应电流偏低,而粒径较大时纳米粒子形状不再规则,且电极表面易形成缺陷,影响电极的重现性。实验优化电沉积条件,采用CV法在0.001 mol/L HAuCl4的溶液中沉积纳米金,在-0.5~1.1 V区间内以扫速0.1 V/s扫描38圈。对经过电沉积处理后的电极进行15圈CV测试的结果如图2a所示,电极的峰电位差降低到80 mV内,峰电流提高近一倍,且曲线基本重合,说明经过AuNPs修饰,工作电极表面的导电性和平整度得到提升。在不同片电极间进行DPV测试,结果如图2b所示,电极间相对标准偏差降低至1.27%,对同一片电极重复测试的相对标准偏差仅有0.40%,重现性得到明显提升。
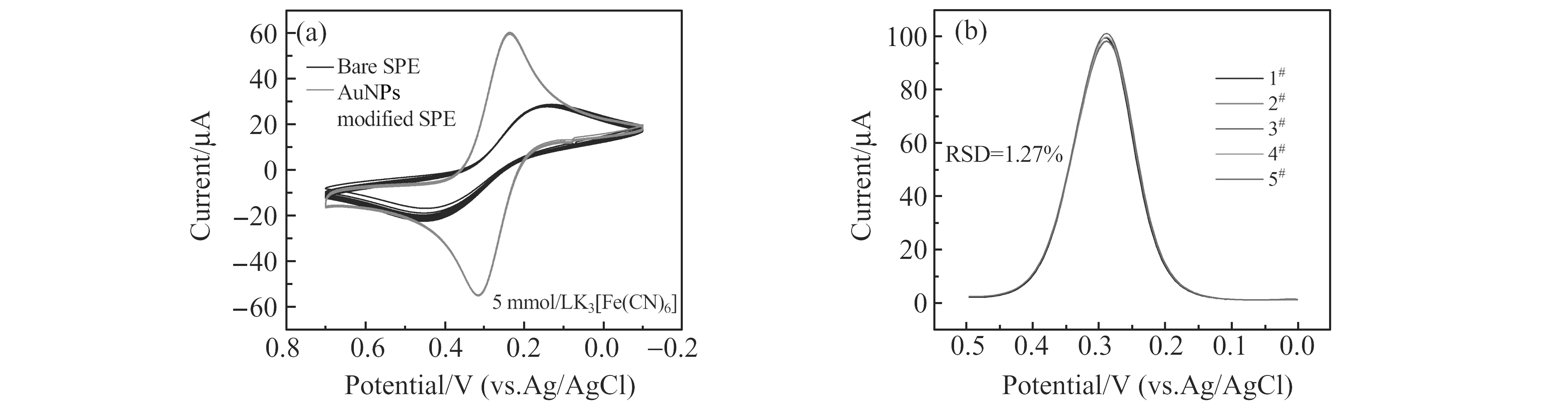
图2 不同电极间的测试差异:电极修饰AuNPs前后对比(a);修饰AuNPs后DPV的重现性(b) Fig.2 The differences between different electrodes:differences between bare SPE and AuNPs modified SPE(a);the recovery of AuNPs modified SPE(b)
2.3 传感器的形貌表征
采用扫描电镜(SEM)技术对组装过程进行了形貌表征。图3为不同组装步骤下电极的SEM照片。从图3a可以看到未经修饰的电极表面为聚合物黏结碳粉形成的片层状结构,这造成了电极界面性质的不稳定,但此结构也具有较高的比表面积,可以修饰更多的AuNPs,增强其反应性。经过电沉积后,电极表面成功引入AuNPs,增强了电极表面的平整度(图3b),此粒径下的电极对比图3b和图3c可以发现,包被过AFP抗体并用BSA封闭后,AuNPs的体积明显增大,形状更不规则,其边缘相对模糊,这说明引入了导电性较差的蛋白。从图3d可见,孵育AFP并与免疫探针形成免疫复合物后,电极表面结合了相当数量的免疫探针。免疫探针相对于电沉积的金纳米粒子粒径更大,即使结合蛋白质后也大体保持了其本身的形状[21]。

图3 不同组装过程的扫描电镜(SEM)图Fig.3 SEM images of (a)bare SPE,(b)AuNPs,(c) AuNPs/Anti-AFP and (d)AuNPs/Anti-AFP/AFP/Immunoprobe
2.4 封闭条件
由于在电极表面引入了AuNPs,电极对蛋白质的吸附能力极大增强,这也导致表面的非特异性吸附增加,因此需要特别优化封闭条件。实验尝试使用不同浓度的BSA及聚乙二醇(PEG20000)对电极进行封闭。在K3[Fe(CN)6]溶液中进行DPV测试,结果表明,BSA的封闭效果优于PEG20000,而2%BSA的封闭效果与5%BSA效果差距不大,见图4。考虑到成本因素,实验确定含有2%BSA 的PBST缓冲液作为封闭液。
2.5 底物溶液的组成
实验采用HQ作为酶催化底物,HQ在碱性条件及某些金属离子存在下容易发生氧化而在检测时出现较大的背景电流。如图5所示,采用结合了免疫探针的传感器在不同pH缓冲液中进行测试,最终确定pH=5.4的0.1 mol/L柠檬酸-NaH2PO4缓冲液作为底物缓冲液[22 - 23]。 将含有1 mmol/L HQ的缓冲溶液放置一段时间后用于传感器测试,背景电流没有明显增高,表明底物溶液相对稳定(图6)。
如图7所示,配制不同HQ浓度的底物溶液,并使用结合了免疫探针的传感器检测,实验结果显示其响应电流随着HQ的浓度有先增加后缓慢降低的趋势,HQ的优化浓度为1 mmol/L。
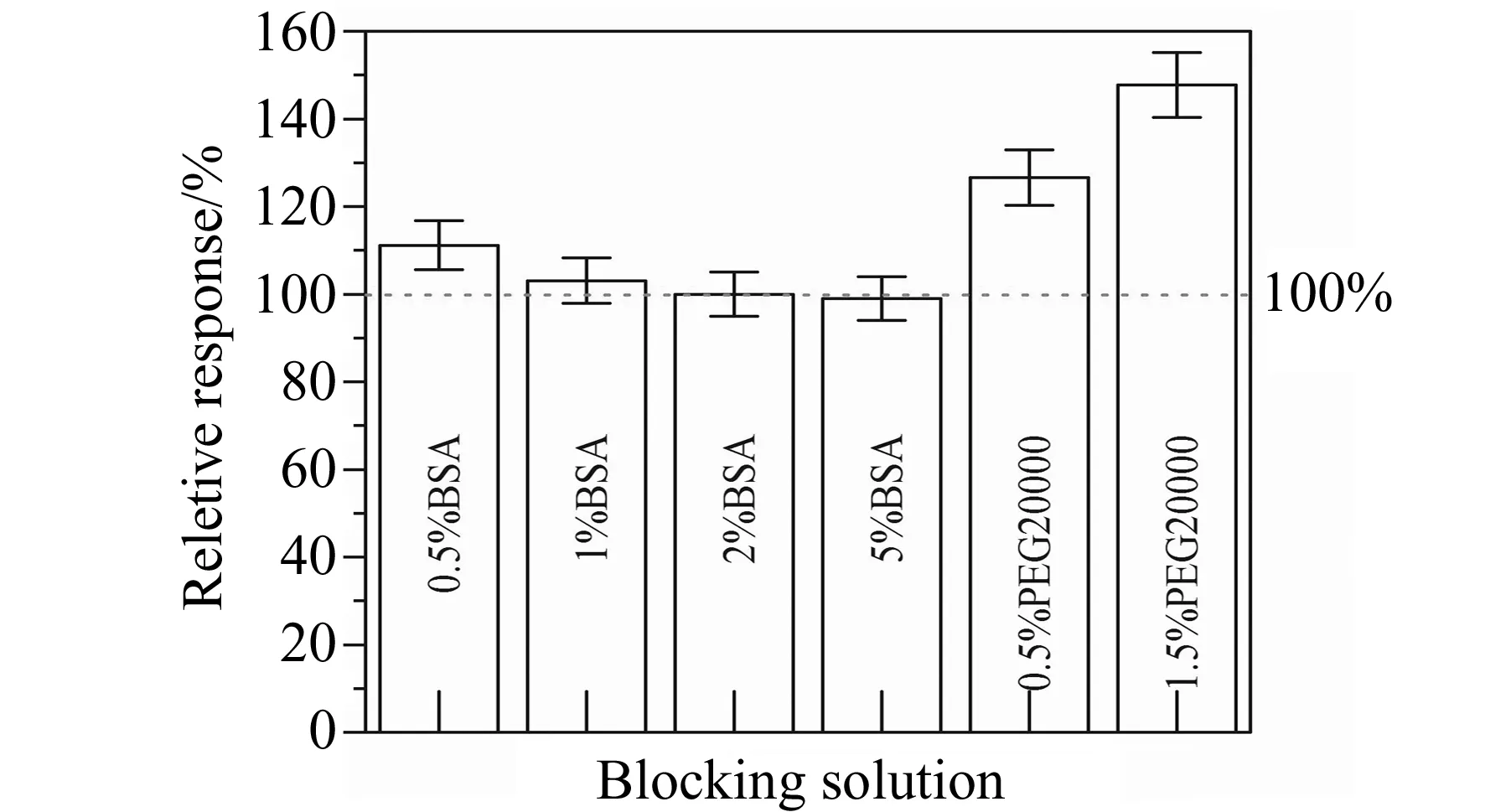
图4 不同封闭条件封闭后电极响应电流对比Fig.4 Current response under different blocking conditions
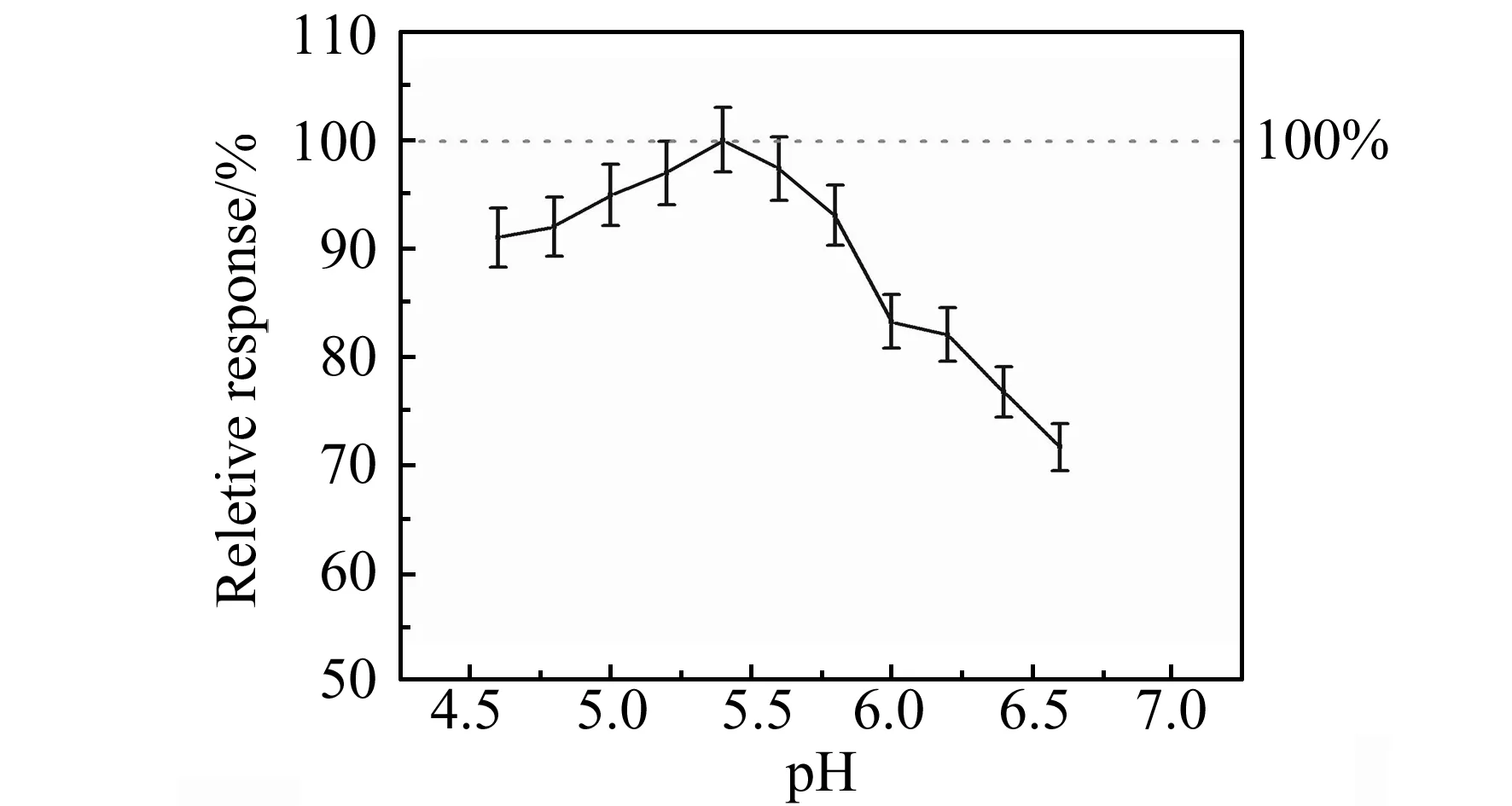
图5 缓冲液pH对响应电流的影响Fig.5 Effect of pH on the current response
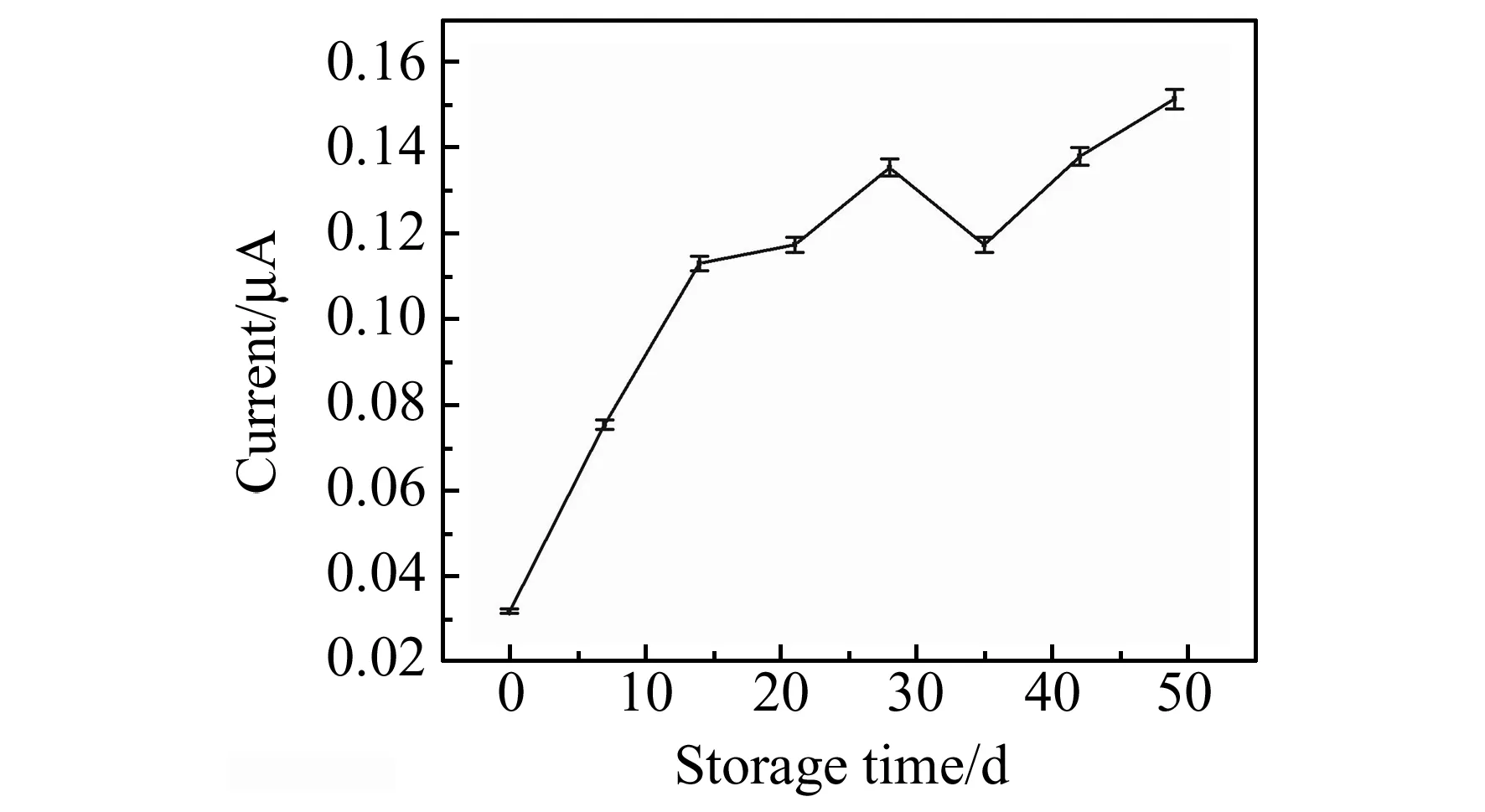
图6 底物溶液的稳定性Fig.6 The stability of substrate with time
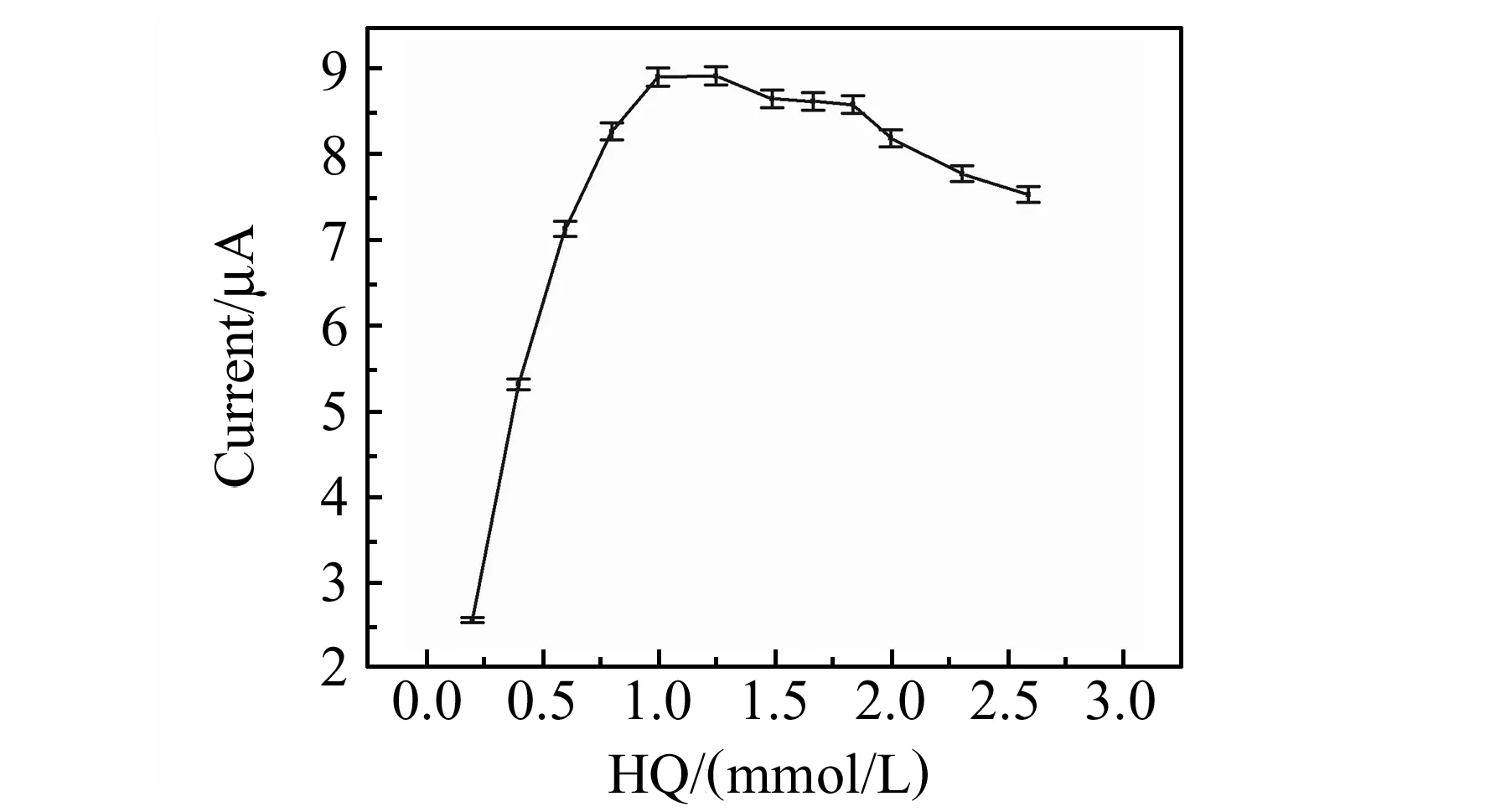
图7 HQ浓度对响应电流的影响Fig.7 Effect of HQ concentration on the current response
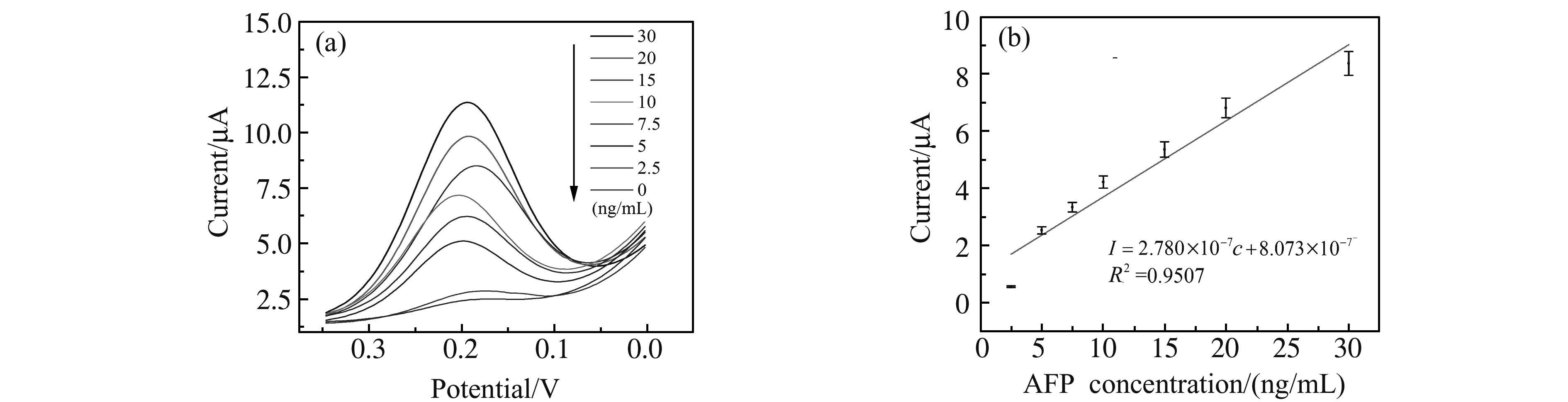
图8 孵育不同浓度AFP的传感器响应电流(a)和峰电流拟合曲线(b)Fig.8 DPV current under different AFP concentration(a) and fitting curve(b)
2.6 传感器的响应特性
取两组同样孵育过20 ng/mL AFP的SPE,分别测试直接结合酶标抗体和使用免疫探针进行放大的传感器信号,发现前者对应的峰电流仅为后者的6.9%,免疫探针的放大效果较为明显。
在最优化实验条件下,将8片孵育过不同浓度AFP抗原并结合免疫探针的传感器浸入底物溶液中进行DPV检测。检测结果表明响应电流随着AFP浓度的提高先增加,后趋于不变,这是由于与免疫探针反应形成的复合物体积较大,基本覆盖了电极的表面,无法引入更多的酶提升催化电流。如图8所示,当AFP浓度范围在2.5~30 ng/mL时,响应电流(I)与传感器工作电极孵育的AFP浓度(c)成线性关系,线性方程为:I=2.780×10-7c+8.073×10-7,检出限为0.16 ng/mL。通常临床检验时需要稀释血清样品,因此本传感器所具有的窄范围高灵敏度响应的优势突出,如表1所示本传感器灵敏度优于同类报道[9,14 - 15]。传感器与ELISA法对照结果如表2所示,制备的传感器与ELISA结果吻合度较为理想。

表1 不同AFP传感器性能的对比
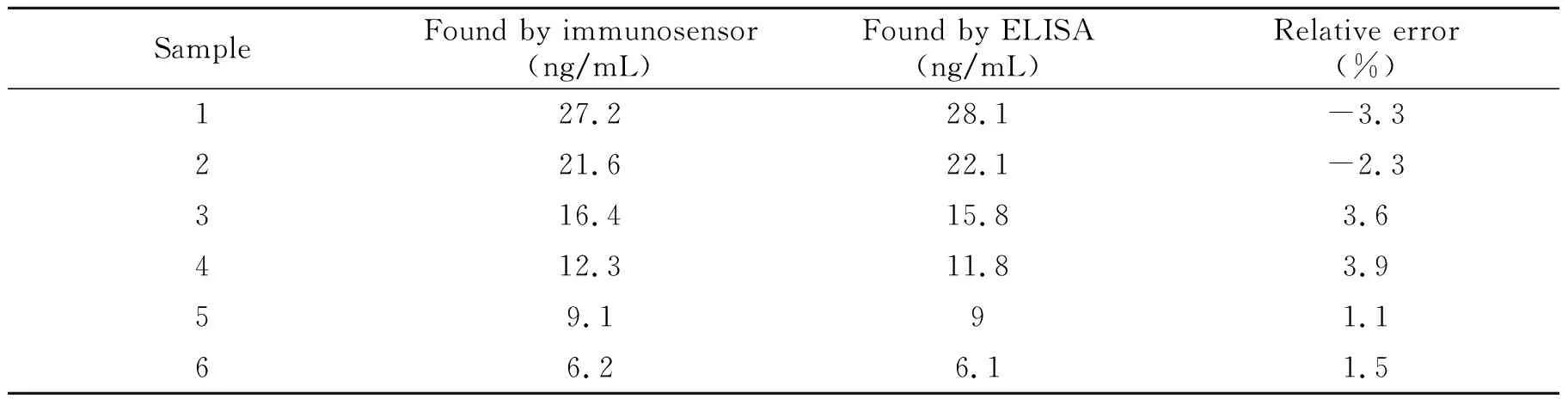
表2 传感器与ELISA结果对比
2.7 传感器的特异性
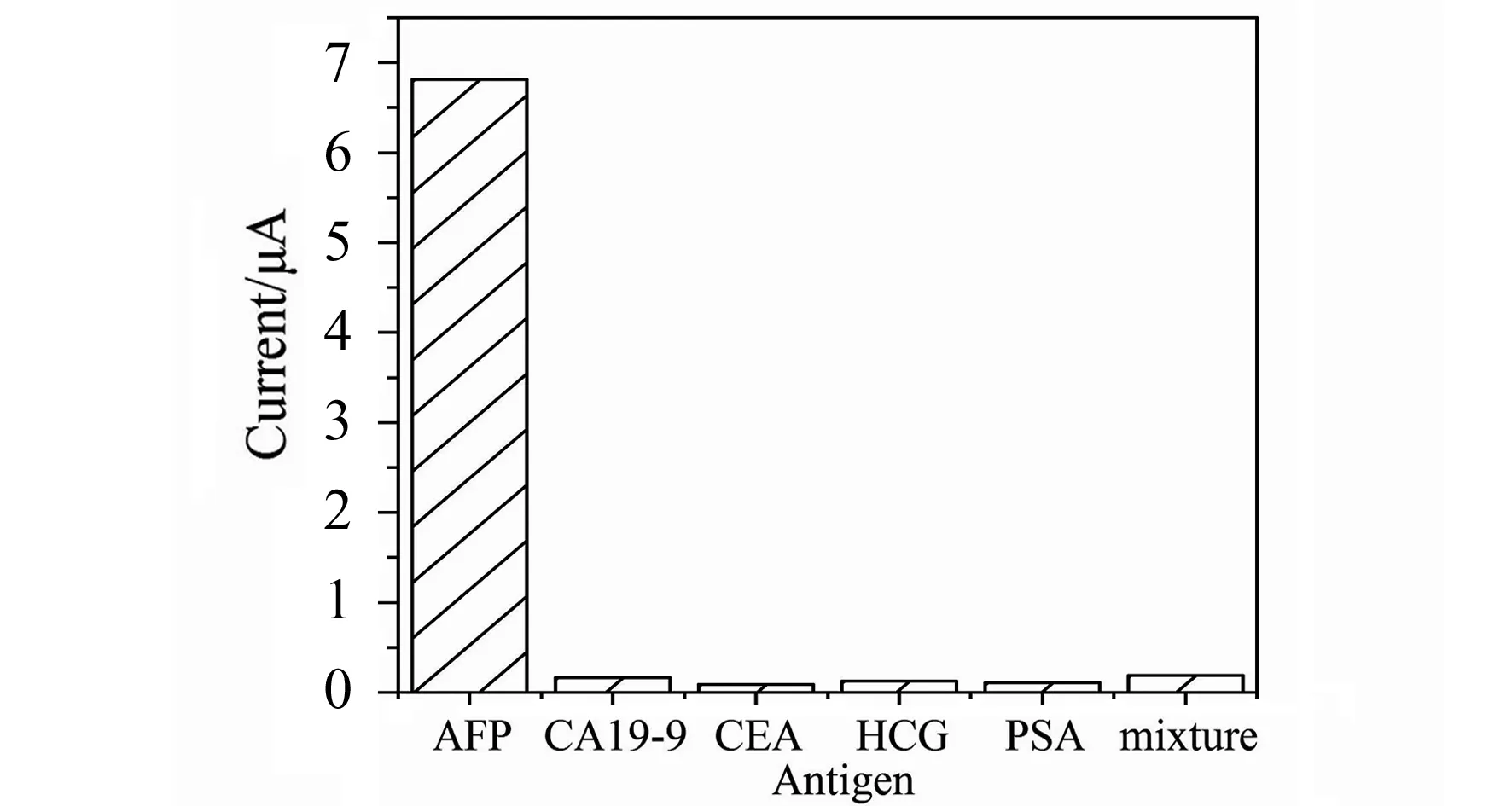
图9 传感器的特异性分析Fig.9 Specificity of the immunosensor
对传感器的特异性问题进一步测试,避免复杂的检测体系中存在假阳性反应造成干扰。实验选取其他四种癌症标志物,即糖类抗原19-9(CA19-9)、癌胚抗原(CEA)、人绒毛促性腺激素(HCG)、前列腺特异抗原(PSA)(浓度均为20 ng/mL),测试传感器的抗干扰能力。实验结果如图9所示,AFP的响应电流可达6.81 μA,而分别及混合测试其他几种标志物的响应电流均在0.2 μA以下,说明该传感体系具有良好的选择性,抗干扰能力较强。
2.8 传感器的重现性及使用寿命
制备6片传感器,将其浸入30 ng/mL的AFP溶液中按照上述步骤孵育并结合免疫探针,浸入底物溶液进行DPV测试,6片传感器响应电流的相对标准偏差为3.53%,重现性相对良好。制备6片传感器并放置在盛有PBS(pH=7.4)的湿盒中并于4 ℃保存,经过28 d后孵育30 ng/mL的AFP抗原并结合免疫探针,响应电流仅降低3.5%,表明传感器的使用寿命良好。
3 结论
在丝网印刷电极基底上电沉积金纳米粒子,改善了电极的表面平整度,增强了其电极反应的重现性,以金纳米粒子捕获样品中的AFP抗原并与金纳米粒子和酶标抗体组装而成的免疫探针进行免疫反应,在对苯二酚的存在下,免疫探针可以催化底物H2O2放大响应电流,增强灵敏度,建立定量测定AFP抗原的传感器,该传感体系有望应用于构建其他免疫原的传感器。
