Tolprocarb衍生物的合成和对稻瘟病的活性
2017-10-14侯文君编译
侯文君 编译
Tolprocarb衍生物的合成和对稻瘟病的活性
侯文君 编译
(上海市农药研究所,上海 200032)
子囊菌亚门稻瘟病菌()是对水稻造成毁灭性的,分布广泛的病原菌之一。稻瘟病菌在侵染过程中产生单细胞侵染结构附着胞,附着胞产生纤细的“入侵丝”,刺穿寄主的细胞壁。附着胞的细胞壁含有由1,8-二羟萘(1,8-DHN)合成的黑色素致密层。黑色素的积累是稻瘟病菌附着胞穿透寄主植物的重要一步。研究也表明缺乏黑色素的稻瘟病菌突变体不能侵染被损伤的寄主植物。不同真菌的黑色素生物合成途径已被报道。真菌中黑素色生物合成途径起始于在聚酮合酶作用下1,3,6,8-四羟萘的生成。随后,相继发生还原和脱水得到中间体1,8-DHN,最后发生聚合反应生成黑色素。
黑色素生物合成抑制剂早已被用于防治稻瘟病。根据所抑制的酶(还原酶和脱水酶)将此类抑制剂分为2类。环丙酰菌胺、咯喹酮或氰菌胺等还原酶抑制剂作用于黑色素生物合成中的2个羟萘还原酶。
Tolprocarb(2,2,2-三氟乙基[(1)-2-甲基-1-[[(4-甲基苯甲酰)氨基]甲基]丙基]氨基甲酸酯)由日本三井化学公司开发,对稻瘟病高效。其作用靶标点为聚酮合酶,与传统杀菌剂不同。因此其被杀菌剂抗性行动委员会分为新的作用机制类别。本文评估了一系列tolprocarb衍生物对稻瘟病菌聚酮合酶抑制活性(PKS-A)、黑色素生物合成抑制活性(MBI-A)和对稻瘟病的防效(RBC-E),来确定其作用靶点,研究其构-效关系(SARs)和活性-活性关系(activity-activity relationship)。本文以tolprocarb为参考,将其衍生物分为3类进行构效关系研究(图1)。
1 材料和方法
1.1 化合物、培养基和稻瘟病菌品系
本文中所有tolprocarb衍生物都是三井化学公司根据文献中的常规方法合成(图2)。一般,其衍生物都是从各自的氨基酸或氨基醇合成,如-叔丁氧羰基(-Boc)保护的氨基酸酯a或氨基醇b。Tolprocarb衍生物g可用不同的试剂或反应合成,如氯甲酸酯衍生物、对硝基苯酚、-(4-硝基苯基)硫代碳酸盐、异氰酸酯、异硫氰酸酯、氨基甲酰氯、氯酸、酸酐,或混合酸酐,或二环己基碳二亚胺或羰二咪唑等耦合剂与酸直接耦合。用Mettler FP62熔点仪(加热速率3 ℃/min)测定熔点(ms),未校正。以四甲基硅烷为内标,用JEOL JNM-400 FT-NMR或JEOL JNM-ECA-500测定质子核磁共振谱(400或500 MHz)。丙二酰辅酶A和麦片琼脂从Sigma购买。马铃薯葡萄糖琼脂(PDA)和马铃薯葡萄糖肉汤(PDB)分别从Kyokuto Seiyaku和Difco实验室购买。所用的稻瘟病菌为三井化学公司所培养。
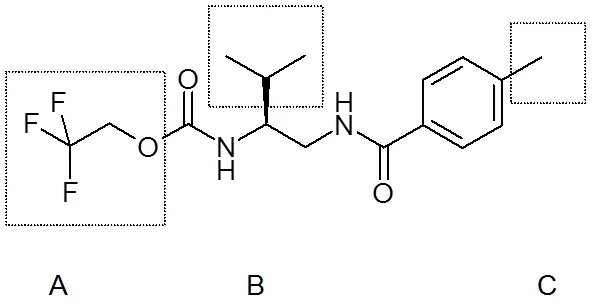
图1 tolprocarb的结构和SAR设计
1.2 对聚酮合酶活性的无细胞生测(Cell-free assay of PKS)
用已有的方法从异源表达稻瘟病菌聚酮合酶的米曲霉()中提取含有聚酮合酶的无细胞提取物(cell-free extract),对聚酮合酶的活性进行无细胞测定。含有50 mM磷酸钾(pH 7.2)、500 μM丙二酰辅酶A、450 μg/mL蛋白和1个tolprocarb衍生物的反应混合液(总体积200 μL)在25 ℃反应2 h。然后加入到6 M HCl,使1,3,6,8-四羟萘氧化为淡黄霉素,终止反应。用0.2 μm膜过滤,用高效液相色谱分析淡黄霉素。用四参数逻辑曲线拟合法(Prism Graph Pad 6.00)确定聚酮合酶被抑制的IC50。
1.3 用马铃薯葡萄糖琼脂平板法测定黑色素生物合成被抑制活性
在含有或没有tolprocarb衍生物的马铃薯葡萄糖琼脂平板上接种稻瘟病菌菌碟(直径6 mm)。在25 ℃培养7 d后,测定了500、100、5、1和0.04 mg/L tolprocarb衍生物对马铃薯葡萄糖琼脂平板上菌丝黑化的最小抑制浓度(MICs)。肉眼观察菌丝颜色的变化来确定黑色素生物合成的MICs,因为可观察到菌丝中合成的黑色素为深灰色,而黑色素生物合成被抑制后产生的菌丝无色,如被tolprocarb抑制。发现所有化合物对真菌生长没有抑制作用。
注:alkyl为乙基或甲基;Boc为叔丁基羰基;DEAD为偶氮二甲酸二乙酯;X为N(脲)、O(氨基甲酸酯)、C(酰胺)或S(硫代氨基甲酸酯);A为氯甲酸酯、对硝基苯酚、-(4-硝基苯基)硫代碳酸盐、异氰酸酯、异硫氰酸酯、氨基甲酰氯、氯酸、酸酐,或混合酸酐
图2 tolprocarb衍生物合成的总反应途径
1.4 盆栽试验评估对稻瘟病的防效
在室温,把水稻种子在水中浸泡2 d,然后在装满土壤的直径6 cm的塑料盆中种植约30颗种子,培养10~14 d。在燕麦琼脂平板上培养稻瘟病菌至产生分生孢子。把50 mg tolprocarb衍生物溶解于10 mL的丙酮中,然后用水稀释为所需浓度。对2叶期水稻苗分别喷250、50、12.5、3.13、0.781和0.195 mg/L的药液,喷药量为50 mL/3个盆栽。自然干燥后,在受药植物上喷稻瘟病菌孢子悬浮液(1×105个孢子/mL),在25 ℃,12 h光照/12 h黑暗、高湿的培养室中培养7 d。计算10个接种病原菌苗(1个单元)的受损情况,病指:0为无症状,1为1~5个侵染斑,2为6~10个,3为11~20个,4为>20个。按以下方程计算病害的严重程度和防治效果。
病害严重性(DS)=[∑(病指×每个病指的单元数)/(4×单元总数)]×100
防效=[(未处理植物的DS-处理植物的DS)/未处理植物的DS]×100
表1中的指数为tolprocarb衍生物防治稻瘟病的活性水平。
1.5 代谢生测
在21 ℃,在含有1个测试化合物的马铃薯葡萄糖肉汤中旋转震荡(110 rpm)培养稻瘟病菌,以孢子悬浮液为接种体(1×104孢子/mL)。用液相色谱-串联质谱法分析母体化合物和其代谢产物。用0.45 μm膜过滤,把稀释的培养液注射入液相色谱柱,液相色谱柱通过Valco阀与质谱相连,前2.4 min的洗涤液(注射后)以废物从此阀排出。以正离子多反应监测方式测定母体和代谢化合物的量。
1.6 计算机分析
用偏最小二乘法的遗传算法(ver.5.07)进行统计分析,选择最可能的变量。按以下方法定义经验参数值对遗传算法的影响:群数量500,选择率0.3,交叉频率0.05,突变频率0.01。
2 结 果
2.1 对聚酮合酶抑制活性和对黑色素生物合成抑制活性间的关系
Tolprocar衍生物的活性和ms列于表2-4。除了无活性化合物(图3)外,表2-4中所有化合物以对数形式表达时对聚酮合酶的抑制活性(pIC50)和对黑色素生物合成抑制活性(pMIC)间的线性关系(2=0.90)显而易见。此外,除了化合物34外,聚酮合酶生测中无活性化合物在抑制黑色素生物合成的生测中活性非常弱或无。根此,笔者证实聚酮合酶是tolprocarb在黑色素生物合成途径中的靶标点。计算所得Alog也列于表2-4。Alog与对聚酮合酶抑制活性呈正相关性,特别是对于A(2=0.77)和C部分(2=0.67)。这些相关性表明化合物的A或C部分含有较多疏水基时对聚酮合酶具有较高的抑制活性。
2.2 对稻瘟病防效与对聚酮合酶抑制活性或对黑色素生物合成抑制活性间的相关关系
进行GAPLS计算来确定对聚酮合酶抑制活性或对黑色素生物合成抑制活性与对稻瘟病防效间关系的参数。用MOE计算了可能的二维形状描述符。虽然GAPLS计算涉及许多二维描述符如极性分子表面面积和摩尔折射率,但选ms作为连接对稻瘟病防效(指数)和对聚酮合酶抑制活性(pIC50)或对黑色素生物合成抑制活性(pMIC)间关系的参数。对稻瘟病防效指数用m和pIC50或pMIC来表示。
指数=2.52 pIC50-0.041 8m+6.42
=29,2=0.651,=1.65,2.26=24.2 (1)
指数=1.45 pMIC-0.045 3m+11.5
=29,2=0.659,=1.63,2.26=25.1 (2)
其中,pIC50=log[1/IC50(mg/L)],pMIC=log[1/MIC(mg/L)],m为摄氏熔点,式(1)和(2)中,为化合物的数量,为相关系数,为标准差,为菲舍尔统计。
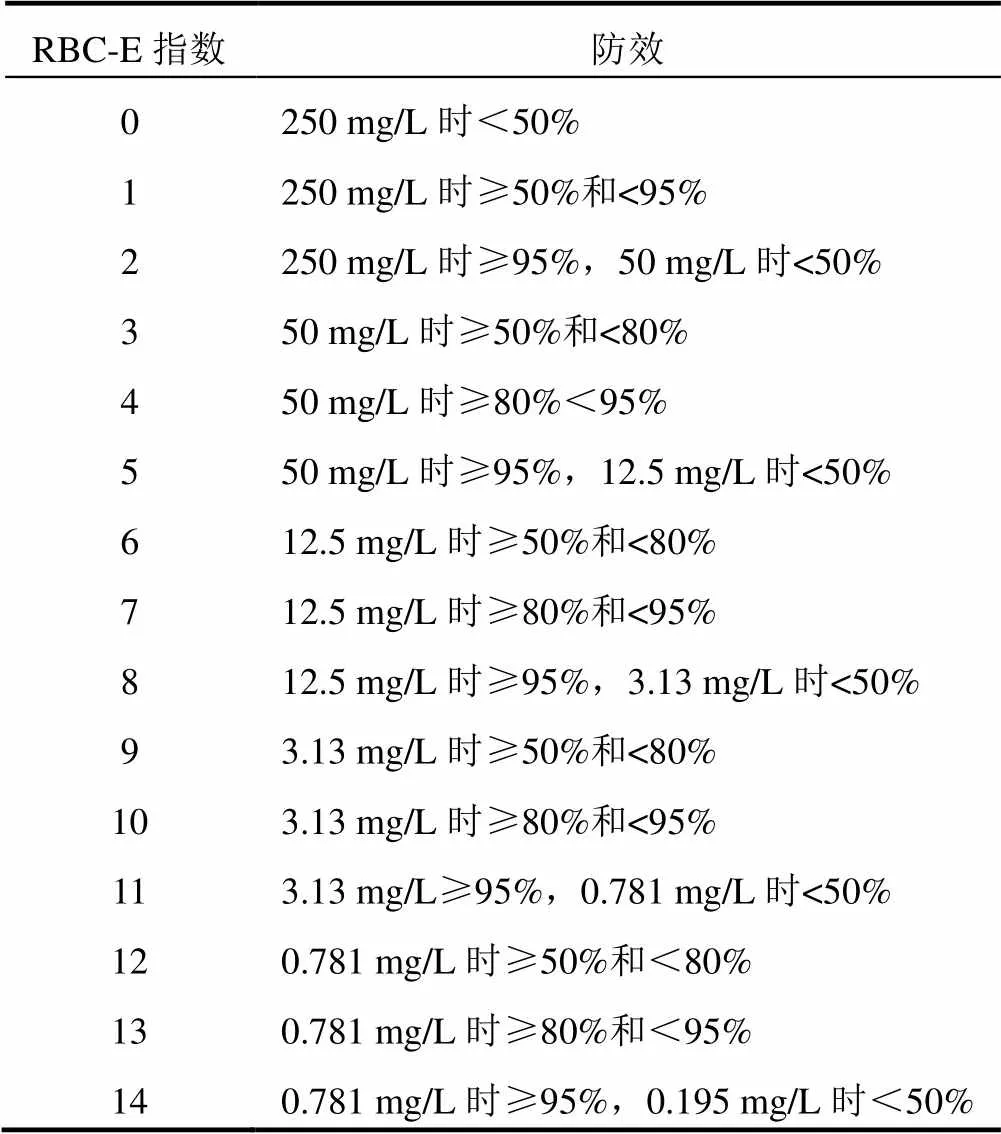
表1 盆栽试验指数
2.3 在稻瘟病菌菌丝群落中的代谢作用
黑色素生物合成抑制生测涉及稻瘟病菌对tolprocarb衍生物的代谢作用,然而,聚酮合酶无细胞生测不涉及。因此,通过对聚酮合酶抑制活性与黑色素生物合成抑制活性的对比来揭示稻瘟病菌的代谢作用。C部分为甲基酯基团的化合物(34)对聚酮合酶的抑制活性和对黑色素生物合成抑制活性间不存在线性关系。一般,甲基酯代谢为羧酸。评估了有或无稻瘟病菌的马铃薯葡萄糖肉汤中化合物34和其预期的无活性代谢物(36)以及tolprocarb(1)的稳定性,以此来研究此菌的代谢作用。表5列出了这几个化合物随时间的增加被稻瘟病菌代谢的情况。从表可知,化合物34的甲基酯被完全代谢为羧酸,即化合物34被代谢为36,但只是在稻瘟病菌的处理中。相比较,在稻瘟病菌的处理中,在140 h内化合物1和36稳定。
表2 tolprocarb衍生物(A部分)的活性和物理参数
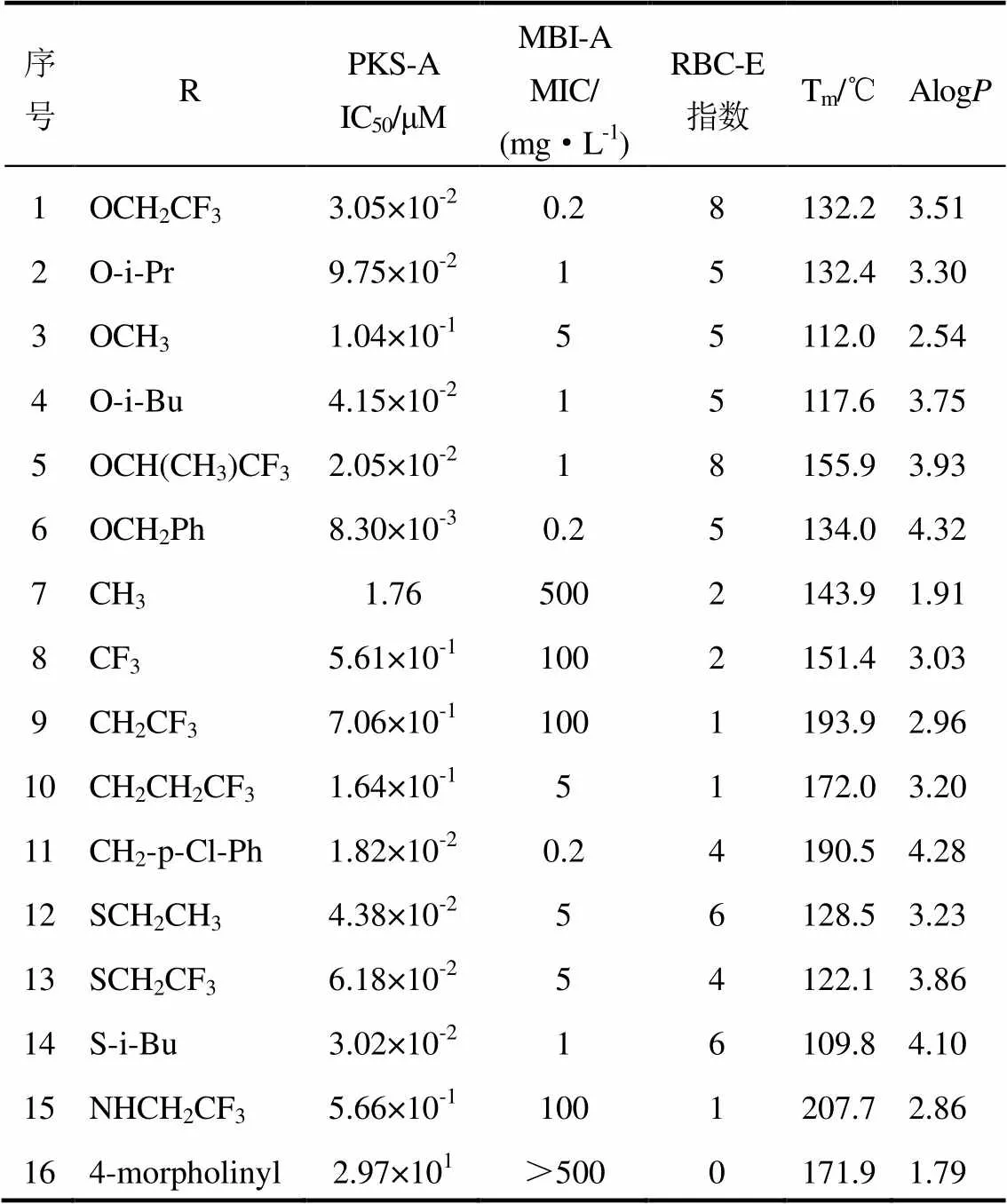
序号RPKS-A IC50/μMMBI-A MIC/(mg·L-1)RBC-E指数Tm/℃AlogP 1OCH2CF33.05×10-20.28132.23.51 2O-i-Pr9.75×10-215132.43.30 3OCH31.04×10-155112.02.54 4O-i-Bu4.15×10-215117.63.75 5OCH(CH3)CF32.05×10-218155.93.93 6OCH2Ph8.30×10-30.25134.04.32 7CH31.765002143.91.91 8CF35.61×10-11002151.43.03 9CH2CF37.06×10-11001193.92.96 10CH2CH2CF31.64×10-151172.03.20 11CH2-p-Cl-Ph1.82×10-20.24190.54.28 12SCH2CH34.38×10-256128.53.23 13SCH2CF36.18×10-254122.13.86 14S-i-Bu3.02×10-216109.84.10 15NHCH2CF35.66×10-11001207.72.86 164-morpholinyl2.97×101>5000171.91.79
2.4 化合物结构和对聚酮合酶抑制活性的关系
2.4.1 A部分
对A部分进行修饰后化合物的活性列于表2和3。如表2和图3(b)所示疏水基团如苯甲基(化合物6和11)的化合物对聚酮合酶具有高的抑制活性。A部分为三氟乙基的化合物(化合物1,26和28)对聚酮合酶的抑制活性要高于异丙基化合物(2,27和29)。通过比较2组化合物(7和3,9和1)发现氨基甲酸酯键化合物比酰胺键的对聚酮合酶的抑制活性高。引入脲键后化合物对聚酮合酶的抑制活性降低,如化合物15和1。比较化合物14和4,以及13和1,发现硫代氨基甲酸酯键和氨基甲酸酯键化合物对聚酮合酶的抑制活性相同。
2.4.2 B部分
对B部分进行修饰后化合物的活性列于表3。R1和R2为氢原子(17)或二甲基(18),化合物对聚酮合酶的抑制活性降低。对映体的活性大不同,-异构体(1)是对聚酮合酶抑制活性最高的化合物之一,而-异构体(19)没有活性。R1为体积大的取代基如环己烷(24)和叔丁基(22)时,化合物对聚酮合酶的抑制活性高,这表明R1取代基周围的空间位阻相当大,然而,B部分为大的取代基时化合物的活性不会增加。亲水甲基酯(25)化合物对聚酮合酶的抑制活性也高。R1为-分支的取代基比直链(21)或-分支取代基(23)化合物的活性高。
表3 tolprocarb衍生物(B部分)的活性和物理参数


化合物AR1R2PKS-A IC50/μMMBI-A MIC/(mg/L-1)RBC-E指数Tm/℃AlogP 1CH2CF3i-PrH3.05×10-20.28132.23.51 2i-Pri-PrH9.75×10-215132.43.30 17CH2CF3HH2.01×10-152169.32.23 18i-PrCH3CH31.395002110.02.50 19CH2CF3Hi-Pr>1005002129.03.51 20i-PrHi-Pr>100>5001159.73.30 21CH2CF3n-PrH6.93×10-213170.83.51 22CH2CF3t-BuH2.82×10-20.212101.04.02 23CH2CF3t-BuH4.68×10-11001147.53.84 24CH2CF3c-HexH4.32×10-213155.04.20 25CH2CF3COOCH3H2.87×10-213139.32.12 26CH2CF3CH2SCH3H3.03×10-152153.02.58 27i-PrCH2SCH3H1.655002162.22.36 28CH2CF3CH2SOCH3H1.04×101>5000153.71.44 29i-PrCH2SOCH3H>100>5000192.71.22
pMIC Alog
注:(a)pIC50[=log(1/IC50(mg/L))]和pMIC[=log(1/MIC(mg/L))],tolprocarb衍生物列于表2-4,测定的线性拟合系数2=0.90;(b) pIC50[=log(1/IC50(mg/L))],用Accelrys Draw (4.1 SP1)计算Alog。
图3 对聚酮合酶的抑制活性与对黑色素生物合成抑制活性(a)和与Alog(b)间的关系
2.4.3 C部分
对C部分进行修饰后化合物的活性列于表4。疏水取代基(甲基,1;乙基,31;氯代,32;三氟甲基,33)比亲水取代基(甲磺酰基,35;羧基,36) 化合物对聚酮合酶的抑制活性高。相比,亲水甲基酯化合物(34)是对聚酮合酶抑制活性最高的化合物之一,这表明C部分非疏水相互作用也增加化合物对聚酮合酶的抑制活性。供电子基团(甲基,1)比吸电子基团(三氟甲基,33)化合物对聚酮合酶的抑制活性高。
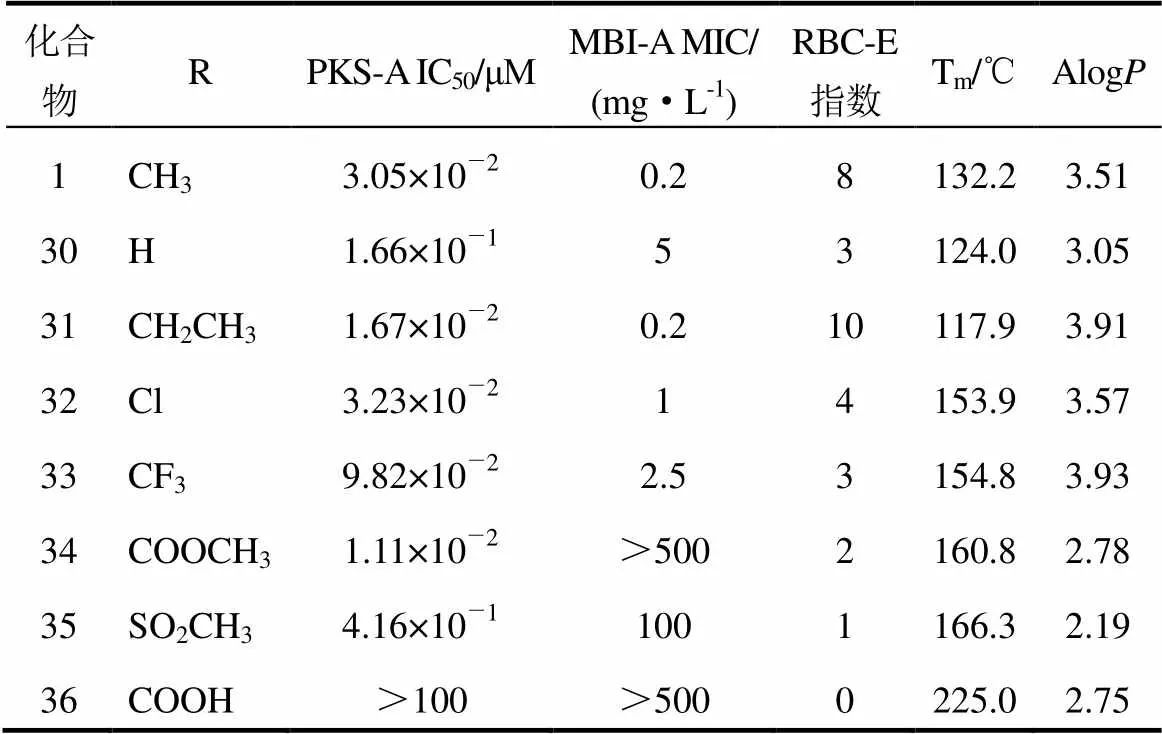
表4 tolprocarb衍生物(C部分)的活性和物理参数
3 讨 论
稻瘟病菌会侵染水稻发生稻瘟病,此病是水稻的重要病害之一。在此病菌侵染的过程中,黑色素的积累对稻瘟病菌穿透侵入寄主植物很重要。黑色素生物合成抑制剂是广泛用于防治稻瘟病的杀菌剂。然而,抑制脱水酶的传统黑色素生物合成抑制剂抗性的发展已成为稻瘟病防治的一大问题。三井公司开发的tolprocarb育苗箱应用和水稻田应用对稻瘟病有高的防效。笔者已进行的研究表明tolprocarb抑制聚酮合酶的活性,其IC50为0.03 μM。本文评估了一系列tolprocarb衍生物对聚酮合酶、黑色素生物合成的抑制活性和对稻瘟病的防效。研究发现化合物对聚酮合酶的抑制活性和对黑色素生物合成的抑制活性间存在线性关系,2=0.90。此进一步证实tolprocarb和其衍生物抑制聚酮合酶的活性,进而直接抑制稻瘟病菌的黑色素的生物合成。
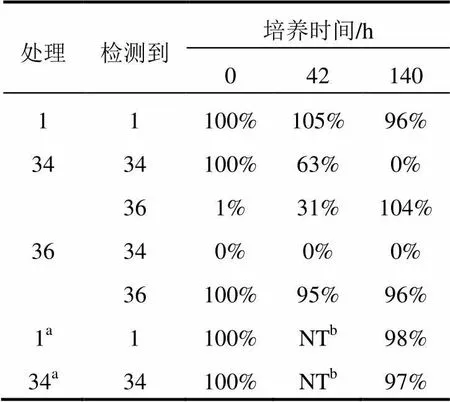
表5 稻瘟病菌对化合物1、34和36的生物转化(摩尔比率)
注:a不加稻瘟病菌菌丝;b没有测定。
对稻瘟病的防效与对聚酮合酶抑制活性存在正相关性(2=0.51),进一步证实聚酮合酶是tolprocarb的靶标点。对稻瘟病的防效指标可用m与对聚酮合酶的抑制活性,或m与对黑色素生物合成抑制活性表示。m与溶解度有关,有较多的应用。包括tolprocarb在内的黑色素生物合成抑制剂不直接影响稻瘟病菌的发育,而抑制病原菌穿透寄主植物的能力。因此,稻瘟病菌能够穿透叶子中不存在黑色素生物合成抑制剂的寄主植物,叶子上有均匀的黑色素生物合成抑制剂层可能对于保护寄主免受稻瘟病菌的侵染很重要。推测具有高m的易于结晶的化合物可能不易在植物叶子表面形成均匀的黑色素生物合成抑制剂层,因此在盆栽试验中药效低。有必要进行进一步试验来验证以上推测,例如通过添加扩展剂或其他助剂阻止黑色素生物合成抑制剂结晶。
C部分具有甲基酯基团的tolprocarb衍生物,即化合物34对聚酮合酶的抑制活性与对黑色素生物合成的抑制活性之间不存在线性关系,也就是化合物34对聚酮合酶有高的抑制活性,而对黑色素生物合成没有抑制活性,化合物34的甲基酯在稻瘟病菌菌丝中被彻底代谢为羧酸。代谢物36对聚酮合酶和黑色素生物合成都没有抑制活性。因此,化合物34对黑色素生物合成没有抑制活性应该是由于稻瘟病菌解毒甲基酯为羧酸所致。而B部分为甲基酯基团的化合物(25)对聚酮合酶和黑色素生物合成都具有高的抑制活性,这表明B部分的甲基酯代谢速率慢或其预期的代谢产物羧酸(B部分)也对聚酮合酶和黑色素生物合成有高的抑制活性高。此外,对聚酮合酶的抑制活性和对黑色素生物合成的抑制活性具有密切相关性,这表明本研究中的大多数tolprocarb衍生物在稻瘟病菌菌丝中没有被显著代谢。对聚酮合酶的抑制活性和对黑色素生物合成抑制活性的比较表明真菌代谢是设计新颖杀菌剂的一个重要因素。
化合物被活体运输的性能一般以log表示。如果用全细胞进行对黑色素生物合成抑制的生测试验,会受到活体运输的影响,而对聚酮合酶的活性进行无细胞测定可能不受此影响。因此,本研究中发现的疏水性(Alog)与对聚酮合酶的抑制活性间的线性关系可能在存在活体运输影响的试验中并不如此。此外,对聚酮合酶的抑制活性与对黑色素生物合成抑制活性间强的相关性表明对黑色素生物合成抑制活性不受活体运输的影响。
总的来说,对聚酮合酶的抑制活性与对黑色素生物合成抑制活性间具有的强的相关性证实tolprocarb在稻瘟病菌体内的靶标点为聚酮合酶。比较靶标点和离体和活体活性,能发现化合物的代谢和物理参数对其活性的影响,这对于设计新颖杀菌剂具有一定的价值。此外,构效关系和活性-活性关系会为新颖聚酮合酶抑制剂的开发结构要求提供灵感和信息。
10.16201/j.cnki.cn31-1827/tq.2017.04.05
TQ450
A
1009-6485(2017)04-0027-05
侯文君,女,工程师,硕士。Tel: 021-64387891-201。
2017-07-31。
