硅对不同盐生境下高羊茅生物量及渗透调节物质含量的影响
2017-10-13周钰佩刘慧霞林丽果林选栋
周钰佩,刘慧霞,于 成,林丽果,林选栋
1 草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 兰州 730020 2 西北民族大学生命科学与工程学院, 兰州 730030
硅对不同盐生境下高羊茅生物量及渗透调节物质含量的影响
周钰佩1,刘慧霞2,*,于 成1,林丽果2,林选栋2
1 草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 兰州 730020 2 西北民族大学生命科学与工程学院, 兰州 730030
高羊茅(Festucaarundinacea)因长期多频灌溉往往生长在土壤盐渍化或潜在盐渍化的生境中。采用盆栽试验研究了不同盐生境下添加硅对两个高羊茅品种(抗性强的XD和抗性弱的K31)生物量和渗透调节物质的影响。结果表明:不同盐生境均降低了两个不同抗性高羊茅品种K31和XD的地上生物量和地下生物量。添加硅显著增加了盐浓度小于或等于150 mmol/L时XD的地上和地下生物量,以及盐浓度小于或等于100 mmol/L时K31地下生物量,但对K31地上生物量没有显著影响。添加硅显著增加了盐浓度小于或等于150 mmol/L时XD的地下地上生物量比,以及盐浓度100 mmol/L时K31地上地下生物量比。盐生境降低了XD和K31可溶性糖、可溶性蛋白、脯氨酸和丙二醛含量。添加硅没有显著影响XD的渗透调节物质含量,但显著降低了盐浓度大于或等于200 mmol/L时K31的可溶性糖含量,以及盐浓度250 mmol/L时K31的脯氨酸含量。添加硅均显著降低盐浓度大于或等于150 mmol/L时K31和XD的丙二醛含量,但XD的降低幅度大于K31。结果表明,添加硅对盐生境下高羊茅生长有一定的促进作用,但这种促进作用与品种自身抗性密切相关。
盐渍土壤;盐浓度;高羊茅;品种;添加硅;生物量;渗透调节物质含量
Abstract: Tall fescue (Festucaarundinacea) typically grows in saline soil or potential saline soil because tall fescue turf often needs to be irrigated. A pot experiment was conducted to investigate the effects of silicon (Si) supplements on the biomass and osmolyte content of two tall fescue varieties (XD and K31) at different soil saline levels. The variety XD is strongly resistant to salinity and K31 is weakly resistant. Above- and underground biomass of both varieties tended to decrease as soil salinity increased. Added Si significantly increased the above- and belowground biomass of XD when soil salinity was 150 mmol/L or below and the belowground biomass of K31 when the salinity was 100 mmol/L or below; it did not affect the aboveground biomass of K31. Silicon supplementation significantly increased the root-to-shoot ratio of XD when the salinity was 150 mmol/L or below and that of K31 at a salinity of 100 mmol/L. Salinity reduced the soluble sugar, soluble protein, proline, and malondialdehyde contents of both varieties. Silicon supplementation did not affect the osmolyte contents of XD. It significantly decreased the soluble sugar content of K31 when it was 200 mmol/L or above and proline content of K31 when the salinity was 100 mmol/L. Silicon supplementation significantly decreased the MDA content of both varieties when the salinity was 150 mmol/L or above, but the magnitude of decrease was greater in XD than in K31. These results indicate that silicon supplementation aids in growth of tall fescue in saline soil, and that this benefit is closely related to the biology of the variety.
KeyWords: saline soil; salinity; tall fescue; variety; silicon; biomass; osmolyte contents
多年生冷季型禾草高羊茅(Festucaarundinacea)是西北乃至西部地区城镇草坪绿地建植的主要草种之一[1]。高羊茅草坪绿地需要灌溉维持其功能的正常发挥[2],但长期多频次的灌溉往往会促进土壤深层可溶性盐向浅层富集,容易引起土壤次生盐渍化[3],因此高羊茅往往生长在土壤盐渍化或潜在盐渍化的生境中,而盐渍生境反过来往往会严重影响高羊茅草坪绿地的建植和使用寿命[4],所以提高高羊茅耐盐性是延长草坪绿地持久性利用的重要途径[5]。添加外源硅不仅能够促进植物的生长,而且能够提高植物的耐盐性[6-7]。已有研究表明,外源硅能够提高大麦(HordeumvulgareL.)[8]、水稻(OryzasativaL.)[9]、黑麦草(LoliumperenneL.)[10]、番茄(Solanumlycopersicum)[11]等植物的耐盐性,但硅提高植物耐盐性的有益作用与植物种类密切相关,譬如1 mmol/L的硅就能显著提高120 mmol/L盐浓度下大麦的膜流动性[8],而只有3 mmol/L硅才能对50 mmol/L盐浓度下水稻株高具有最大的增幅效应[9]。硅增强植物耐盐性的作用不仅与植物种类有关,而且与同一种植物的不同品种密切相关,例如同样盐生境下添加硅后,耐盐性小麦(Triticumaestivumcv.)品种Izmir- 85茎和根的Na含量要远远小于敏感型小麦(Triticumdurumcv.)品种Gediz- 75[12],早熟禾(PoapratensisL.)品种‘Perfection’的鲜重增加量要大于品种‘Midnight’[13],耐盐性弱的美洲狼尾草(P.amcrieanum)体内丙二醛含量的降幅要远远大于耐盐性强的杂交狼尾草(P.amcrieanum×P.purpurenm)[14]。目前已经证实外源性硅能够增加盐生境下高羊茅品种红象的株高和生物量[5],但我国西北乃至西部地区城镇草坪绿地建植中使用的高羊茅品种较多[15-16],硅对不同高羊茅品种耐盐性的影响是否存在差异,目前尚无科学证据。本研究通过分析外源性硅对不同抗性高羊茅品种生物量和渗透调节物质的影响,揭示硅提高不同高羊茅品种耐盐性的异同,以期为高羊茅草坪绿地的管理提供科学依据。
1 材料与方法
1.1 试验设计
试验采用盆栽试验,3个处理因素分别为盐浓度、添加硅否和品种。盐浓度采用NaCl配制,分别为0、50、100、150、200、250、300、350、400 mmol/L,在每个盐浓度梯度下,再设置添加硅(+Si)和不添加硅(-Si)两种处理。盐生境下硅浓度为2 mmol/L时高羊茅的种子发芽率和保苗率最高[17],因此本试验中硅处理的硅离子浓度设置为2 mmol/L,硅源采用硅酸钠形式添加[5-13]。计算盐分浓度时,将硅酸钠带入的盐离子浓度考虑在内,因此盐分浓度还包括硅酸钠内的钠离子。参试的两个高羊茅品种分别为抗性强的XD和抗性较弱的K31,试样种子来源于北京百绿集团。试验总计36个处理,每个处理重复6次。试验在兰州大学榆中校区智能日光温室内进行。为减轻其他养分元素的干扰,试验采用珍珠石和蛭石(体积比为1∶1) 的混合基质,将混匀基质等量放入塑料盆(高15cm,盆口直径14cm),播种时间为2015年5月20日,每个盆内播种饱满的高羊茅种子300粒,然后将塑料盆随机摆放。在Hoagland营养液中添加相应浓度的硅酸钠和氯化钠,将其充分混合后配置成处理溶液,种植用处理溶液按照试验设计浇灌每个塑料盆,直至盆底托盘有处理溶液渗出为止,当盆底不再渗出处理溶液时,称重,记录每个塑料盆的重量。此后每隔一天分别称重,然后根据减轻重量添加处理溶液。待高羊茅品种完全出苗后(高羊茅发芽时间21 d),根据高羊茅出苗率决定哪种处理继续进行。当某种处理的高羊茅出苗率低于60%时,认为这种处理将来无法有效建植草坪绿地[18],故放弃继续观测;若高羊茅出苗率大于或等于60%,则认为该处理有可能在未来有效建植草坪绿地,继续观测。对于遴选的能够继续观测的处理,采用人工定株措施,即每个盆中选择长势均匀的50株幼苗,其他多余幼苗以间苗的形式人工除去,以便排除密度对高羊茅生长的影响。根据试验过程中高羊茅的最终出苗率,当盐浓度大于300 mmol/L时,无论添加硅还是不添加硅,两个品种的出苗率均低于60%(表1),因此后续观测试验中将盐浓度大于300 mmol/L的处理舍弃。而对盐浓度小于或等于250 mmol/L的处理持续观测40d,然后取样。
表1硅对不同盐浓度处理下高羊茅累计发芽率的影响(%)
Table1Theeffectofsiliconsuppliesonthecumulativegerminationrateoftwotallfescuevarietiesunderdifferentsaltconcentrationconditions
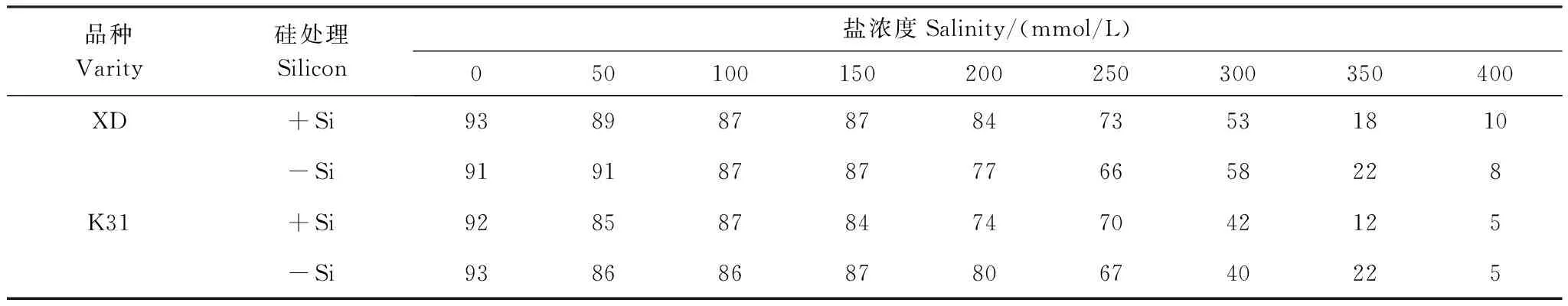
品种Varity硅处理Silicon盐浓度Salinity/(mmol/L)050100150200250300350400XD+Si938987878473531810-Si91918787776658228K31+Si92858784747042125-Si93868687806740225
XD:向导Persuaion;K31品种的编号全称
1.2 取样与指标测定
1.2.1 取样方法
每个处理中,3盆测定生物量,3盆测定生理指标。对于测定生物量的重复,将每个盆中的高羊茅植株完整地从盆中取出(包括地上和地下),利用自来水冲洗干净,利用镊子手工再次除去附着于植物上的蛭石和珍珠岩,然后用滤纸吸干植株表面的水分,全部用剪刀分为茎叶和根系,分别保存。对于测定渗透调节物质和酶活性的重复,利用剪刀仅收获茎叶,每个盆中的样品置于液氮中保存,然后带回实验室后快速转移到-80℃冰柜中保存,以备实验分析。
1.2.2 指标测定
生物量测定采用常规烘干法测定。参照郝再彬[19]的方法,采用考马斯亮蓝法测定可溶性蛋白,采用硫代巴比妥酸法测定丙二醛。参照李合生[20]的方法,用蒽酮法测定可溶性糖,用酸性茚三酮显色法测定脯氨酸。
1.3 数据分析
数据采用SPSS 17.0 软件进行三因素方差分析,采用LSD法检验不同数据组间的差异显著性,Duncan法进行多重差异性比较,结果用均值±标准差(Mean±SD)表示,数据制图采用Excel 2007软件。
2 结果
2.1 盐浓度、添加硅和高羊茅品种对各项测定指标的方差分析
三因素ANOVA分析结果表明:高羊茅品种对可溶性蛋白、脯氨酸、丙二醛、地上和地下生物量及比值具有显著影响(P<0.05),而对可溶性糖没有明显影响(表2);盐浓度对可溶性糖、可溶性蛋白、脯氨酸、丙二醛、地上和地下生物量及比值均具有显著影响(P<0.05);硅处理对可溶性糖、脯氨酸、丙二醛、地上和地下生物量及比值具有显著作用(P<0.05),而对可溶性蛋白没有显著影响。高羊茅品种、盐浓度和硅处理三者的交互作用对可溶性蛋白和地下生物量具有显著的交互作用(P<0.05)。
2.2 不同盐浓度下硅对两个高羊茅生物量的影响
2.2.1 盐浓度对两个高羊茅生物量的影响
无论是添加硅还是不添加硅,两个高羊茅品种K31和XD的地上生物量和地下生物量均随着盐浓度增加而呈下降趋势(表3)。不添加硅时,K31地上生物量在盐浓度小于或等于100 mmol/L时显著降低(P<0.05),XD地上生物量在盐浓度小于或等于200 mmol/L时显著降低(P<0.05);K31和XD地下生物量均在盐浓度小于或等于150 mmol/L显著降低(P<0.05)。添加硅时,K31地上生物量和地下生物量均在盐浓度为200 mmol/L时显著降到最低(P<0.05),XD地上生物量和地下生物量均随着盐浓度升高而显著降低(P<0.05)。
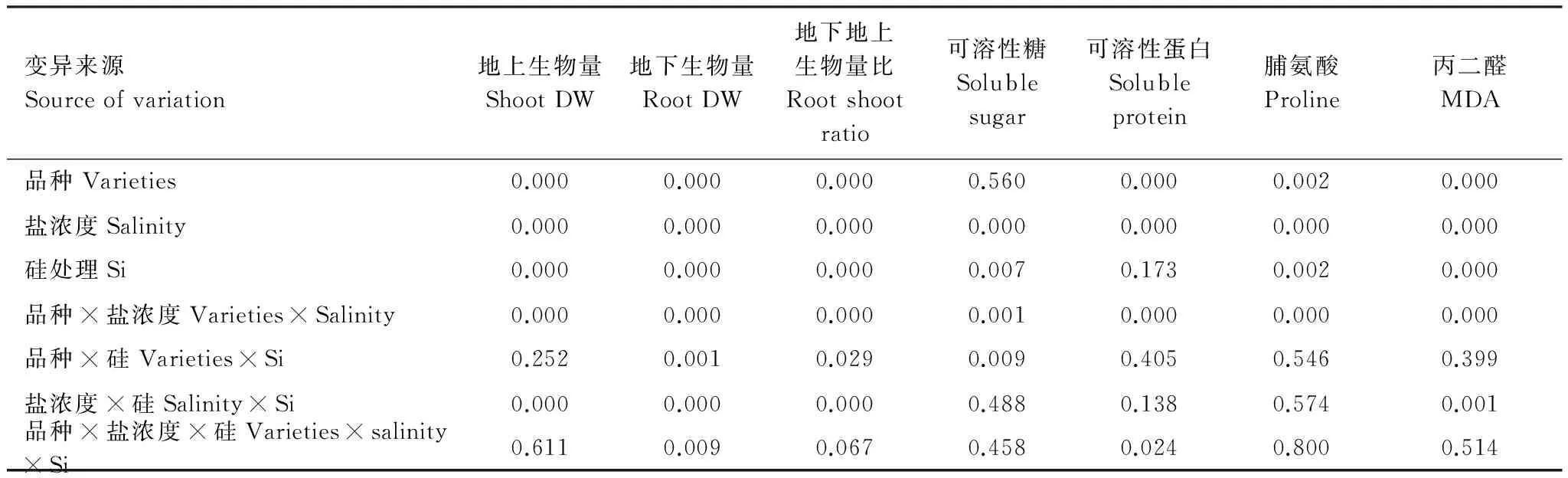
表2 高羊茅生物量和生理指标的三因素方差分析
DW表示干重Dry weight
表3不同盐浓度下硅对两个高羊茅品种地上地下生物量及其比值的影响
Table3Effectofsiliconsuppliesonshootandrootbiomassandtheirratiooftwotallfescuevarietiesunderdifferentsaltconcentrationconditions
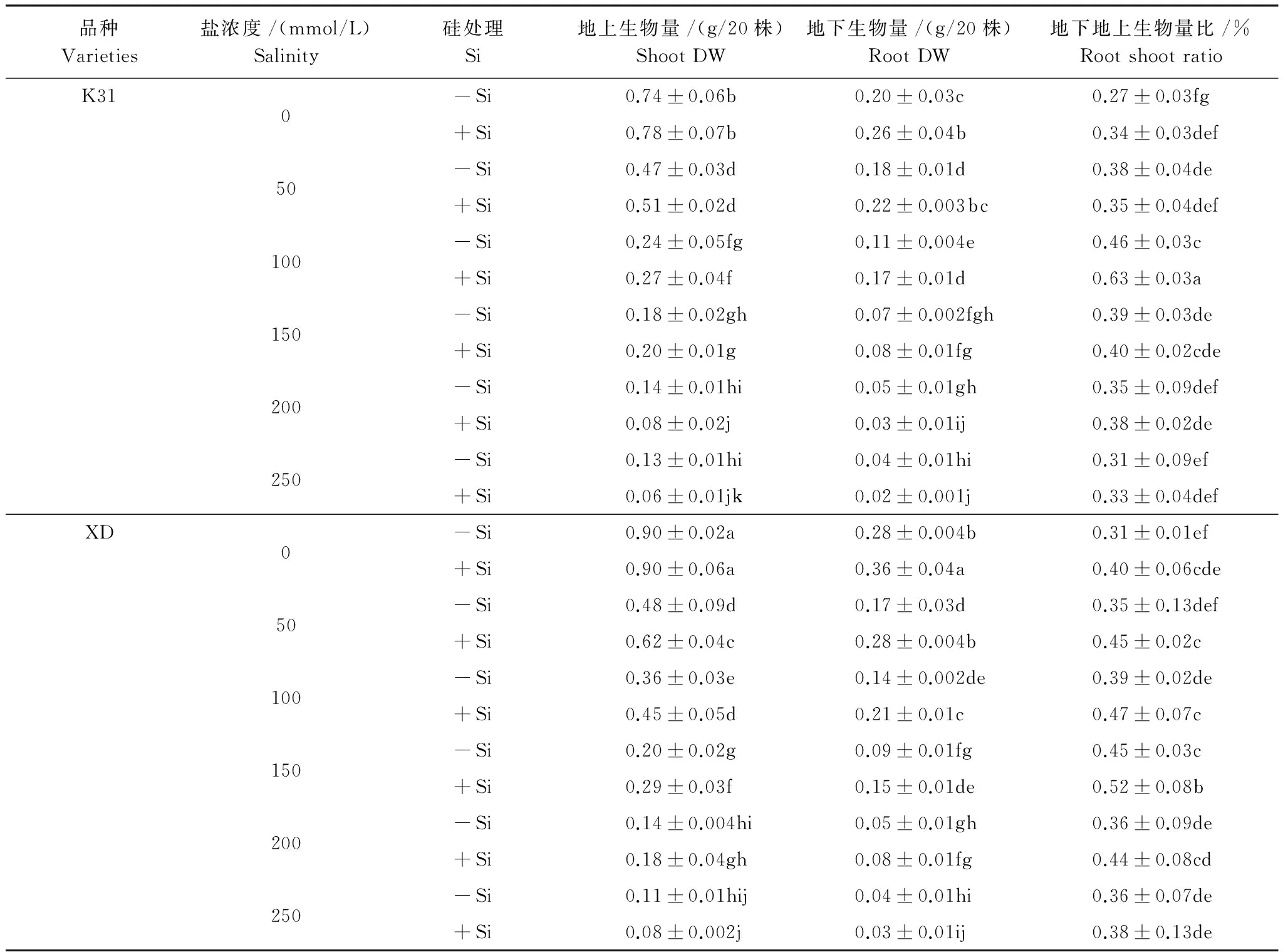
品种Varieties盐浓度/(mmol/L)Salinity硅处理Si地上生物量/(g/20株)ShootDW地下生物量/(g/20株)RootDW地下地上生物量比/%RootshootratioK310-Si0.74±0.06b0.20±0.03c0.27±0.03fg+Si0.78±0.07b0.26±0.04b0.34±0.03def50-Si0.47±0.03d0.18±0.01d0.38±0.04de+Si0.51±0.02d0.22±0.003bc0.35±0.04def100-Si0.24±0.05fg0.11±0.004e0.46±0.03c+Si0.27±0.04f0.17±0.01d0.63±0.03a150-Si0.18±0.02gh0.07±0.002fgh0.39±0.03de+Si0.20±0.01g0.08±0.01fg0.40±0.02cde200-Si0.14±0.01hi0.05±0.01gh0.35±0.09def+Si0.08±0.02j0.03±0.01ij0.38±0.02de250-Si0.13±0.01hi0.04±0.01hi0.31±0.09ef+Si0.06±0.01jk0.02±0.001j0.33±0.04defXD0-Si0.90±0.02a0.28±0.004b0.31±0.01ef+Si0.90±0.06a0.36±0.04a0.40±0.06cde50-Si0.48±0.09d0.17±0.03d0.35±0.13def+Si0.62±0.04c0.28±0.004b0.45±0.02c100-Si0.36±0.03e0.14±0.002de0.39±0.02de+Si0.45±0.05d0.21±0.01c0.47±0.07c150-Si0.20±0.02g0.09±0.01fg0.45±0.03c+Si0.29±0.03f0.15±0.01de0.52±0.08b200-Si0.14±0.004hi0.05±0.01gh0.36±0.09de+Si0.18±0.04gh0.08±0.01fg0.44±0.08cd250-Si0.11±0.01hij0.04±0.01hi0.36±0.07de+Si0.08±0.002j0.03±0.01ij0.38±0.13de
同列数据后不同字母表示不同处理间差异达5%显著水平
两个高羊茅品种K31和XD地下地上生物量比对盐浓度的响应一致,均随着盐浓度的增大而呈现出先上升后降低的趋势(表3)。不添加硅时, K31的地下地上生物量比在盐浓度小于或等于100 mmol/L时有显著变化(P<0.05),但盐浓度大于100 mmol/L时无显著变化,而XD的地下地上生物量比仅在盐浓度150 mmol/L时最大(P<0.05),在其他盐浓度下均没有显著变化。添加硅时, K31的地下地上生物量比在盐浓度100 mmol/L时显著最大(P<0.05),在其他盐浓度下均没有显著变化,而XD的地下地上生物量比在盐浓度150 mmol/L时达到最大(P<0.05)。
2.2.2 添加硅对两个高羊茅生物量的影响
硅对高羊茅地上生物量的影响与品种和盐浓度高低密切相关。当盐浓度较低时,硅对K31的地上生物量影响不显著,但对XD地上生物量显著影响,即盐浓度小于或等于150 mmol/L时添加硅显著增加了XD的地上生物量(P<0.05)。硅对两个高羊茅品种的地下生物量的影响趋同,均表现为盐浓度低于某一数值时硅显著增加了地下生物量(P<0.05),而当盐浓度大于某一数值时硅对地下生物量没有显著影响,但两个品种对应的盐浓度值存在分异,K31对应的盐浓度为100 mmol/L,而XD对应的盐浓度为150 mmol/L。
硅对K31和XD地下地上生物量比的影响与盐浓度高低密切相关。当盐浓度为100 mmol/L时,添加硅显著增加了K31地下地上生物量比(P<0.05),而在其他盐浓度下均无显著差异;当盐浓度大于150 mmol/L时,添加硅对XD的地下地上生物量比没有显著影响,而当盐浓度小于或等于150 mmol/L时,添加硅显著增加了XD的地下地上生物量比(P<0.05)。
2.3 不同盐浓度下硅对高羊茅叶片渗透调节物质的影响
2.3.1 盐浓度对两个高羊茅叶片渗透调节物质的影响
添加硅和不添加硅处理时,K31与XD的可溶性糖含量、可溶性蛋白含量、脯氨酸含量随盐浓度增加均表现为增加的变化态势(表4),但不同渗透调节物质显著增加所对应的盐浓度存在差异,而且可溶性糖、可溶性蛋白和脯氨酸含量显著增加所对应的盐浓度因品种而存在差异。

表4 不同盐浓度下硅处理对两个高羊茅品种叶片渗透调节物质含量的影响
不添加硅时,随盐浓度增加K31的可溶性糖和可溶性蛋白含量没有显著变化,脯氨酸含量在盐浓度为50、150、250 mmol/L时显著增加(P<0.05);XD可溶性糖含量在盐浓度为250 mmol/L时显著增加(P<0.05),可溶性蛋白含量在盐浓度为50 mmol/L和150 mmol/L时显著增加(P<0.05),脯氨酸含量在盐浓度大于或等于100 mmol/L时显著增加(P<0.05)。添加硅时,K31的可溶性糖含量随盐浓度增加没有显著变化,而XD的可溶性糖含量在盐浓度大于200 mmol/L时显著增加(P<0.05);K31可溶性蛋白含量在盐浓度为200 mmol/L时显著最大(P<0.05),XD的可溶性蛋白含量在盐浓度为150 mmol/L显著最大(P<0.05); K31脯氨酸含量在盐浓度为50 mmol/L和150 mmol/L时显著增加(P<0.05),而XD在盐浓度大于或等于100 mmol/L时脯氨酸含量显著增加(P<0.05)。
2.3.2 添加硅对两个高羊茅渗透调节物质的影响
硅对高羊茅叶片渗透调节物质含量的影响不仅与盐浓度高低有关,而且与品种有关。虽然硅对同一盐浓度下XD的可溶性糖和脯氨酸含量没有显著影响,但硅却显著影响了K31的可溶性糖和脯氨酸含量。当盐浓度大于或等于200 mmol/L时硅显著降低了K31的可溶性糖含量(P<0.05),当盐浓度为250 mmol/L时硅显著降低了K31的脯氨酸含量(P<0.05)。而在同一盐浓度下,硅对两个高羊茅品种的可溶性蛋白含量均没有显著影响。
2.4 不同盐浓度下硅对高羊茅叶片丙二醛含量的影响
2.4.1 盐浓度对两个高羊茅叶片丙二醛含量的影响
添加硅和不添加硅处理系列中,K31和XD的丙二醛含量随盐浓度增加均表现为上升趋势(图1)。不添加硅时,随着盐浓度升高K31丙二醛含量分别在盐浓度为150 mmol/L和200 mmol/L时显著增加(P<0.05),XD丙二醛含量分别在盐浓度为50 mmol/L和100 mmol/L时显著增加(P<0.05)。添加硅时,K31丙二醛含量在盐浓度为200 mmol/L时显著增加(P<0.05),而XD丙二醛含量在盐浓度为50 mmol/L时显著增加(P<0.05)。
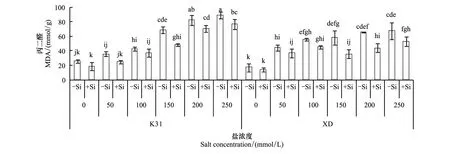
图1 不同盐浓度下硅处理对两个高羊茅品种叶片丙二醛含量的影响Fig.1 The effect of silicon supplies on the MDA content of two tall fescues varieties under different salt concentration conditions
2.4.2 添加硅对两个高羊茅叶片丙二醛含量的影响
当盐浓度相同时,K31和XD的丙二醛含量对硅的响应趋同,表现为当盐浓度大于或等于150 mmol/L时,硅显著降低了丙二醛含量(P<0.05)。当盐浓度为150、200、250 mmol/L时,硅降低K31丙二醛含量的幅度分别为20.73、11.49、12.44 mmol/g,而XD的降低幅度分别为22.60、21.43、14.70 mmol/g,说明同一盐浓度下,硅对XD丙二醛含量的降低幅度大于K31。
3 讨论
植物生物量是综合响应盐胁迫的直观体现[21]。本研究表明,高羊茅品种K31和XD的地上生物量在盐浓度大于或等于50 mmol/L时显著降低,说明盐浓度小于50 mmol/L时,高羊茅能够通过自身调节机制适应轻度盐生境,而盐浓度大于50 mmol/L,高羊茅品种已经不能通过自身的调节机制适应盐生环境,这与金丝小枣(Ziziphusjujuba)幼苗[22]对盐浓度变化的响应基本趋同。然而同一盐浓度下两个高羊茅品种地上生物量对添加硅的响应不一致,表现为同一盐浓度下硅对K31的地上生物量没有明显的影响,而硅显著增加了XD的地上生物量,其中XD对添加硅的响应趋同于金丝小枣幼苗、大麦、水稻、黑麦草、番茄,而K31没有趋同于上述植物对硅响应的结果,这说明同一植物,其不同品种地上生物量在盐生境下响应硅的结果存在分异。因此,将硅作为环境友好型元素添加时,不仅要考虑植物种类的响应,还要考虑同一物种不同品种的响应差异。虽然高羊茅两个品种K31和XD的地上生物量对添加硅的响应存在分异,但其地下生物量对盐浓度和添加硅的响应基本趋同,表现为K31和XD的地下生物量均随盐浓度增加表现为逐渐减小的趋势,且较低盐浓度下添加硅均显著增加了其地下生物量,这与紫花苜蓿(MedicagosativaL.)根系生物量响应盐胁迫和外源性硅的过程类同[23],说明盐生境下,植物地上生物量较地下生物量在盐生境下感应硅更加敏感。虽然高羊茅品种K31和XD的地下生物量对盐浓度和添加硅的响应趋势基本趋同,但其过程存在明显的差异,硅显著增加K31地下生物量的盐浓度为100 mmol/L,而硅显著增加XD地下生物量的盐浓度却是150 mmol/L,即硅对XD地下生物量的影响程度比K31更大。当盐浓度超过150 mmol/L时,硅添加显著降低了高羊茅K31的地下生物量,而对XD地下生物量没有影响,这说明盐胁迫下外源硅促进高羊茅地下生物量积累受盐浓度约束,而当盐浓度较高时,添加硅不仅不会增加地下生物量,反而可能降低地下生物量,对高羊茅植物根系的吸收能力产生不利的影响,这可能是高盐胁迫下添加硅降低了植物正常的物质代谢和能量代谢有关[24],从而降低了高羊茅的地下生物量。地下/地上生物量比往往用来检验盐生境下植物幼苗期根系生长状况[25],虽然高羊茅品种K31和XD的地下/地上生物量比对添加硅响应趋同,添加硅均在不同程度上增加了K31和XD的地下/地上生物量比,但是K31和XD对硅的响应过程中存在差异,在盐浓度分别为100 mmol/L和150 mmol/L时显著增加K31和XD的地下/地上生物量比,说明添加硅影响了盐生境下K31和XD地上和地下生物量的分配模式,有利于高羊茅将更多的物质积累在地下部分,从而有利于高羊茅根系部分从土壤中吸收更多的水分和养分来维持草坪绿地的健康和品质。
生物量是高羊茅响应盐生境的外在体现,而高羊茅生理生化过程则是其适应盐生境的内在机制,特别是渗透调节和细胞膜结构[26]。当植物遭受盐胁迫伤害,植物往往通过产生脯氨酸、可溶性糖和可溶性蛋白等渗透调节物质而维持细胞内外的渗透平衡[27],减轻盐胁迫对植物的伤害效应。已有研究表明,盐胁迫下添加硅可通过增加高粱(SorghumbicolorL. Moench)叶片内的可溶性糖含量而维持渗透调节,缓解盐害,促进植株生长[28]。本研究结果表明,虽然两个高羊茅品种植株叶片内的可溶性糖、可溶性蛋白、脯氨酸以及丙二醛含量均随盐浓度增加而逐渐升高,但添加硅均在不同程 度上降低了同一盐浓度下叶片内的可溶性糖、可溶性蛋白、脯氨酸以及丙二醛含量,此结果在紫花苜蓿[29]、小麦(TriticumaestivumL.)[12]、葡萄(VitisviniferaL.)[30]和玉米(ZeamaysL.)[31]等植物中也得到了证实,说明高羊茅添加硅在盐生境下改善高羊茅的渗透调节过程,保护了细胞膜的完整性,缓解了盐胁迫对高羊茅造成的危害,增强了其抗盐能力。虽然添加硅均改善了高羊茅的渗透调节过程,但不同高羊茅品种响应硅改善其渗透调节能力存在一定的差异,添加硅降低抗性弱品种(K31)的可溶性糖和脯氨酸含量的幅度要大于抗性强的品种(XD),说明在盐生境状态下添加硅对耐盐性弱的品种具有更显著的渗透调节效应。盐浓度胁迫下添加硅对XD叶片内丙二醛含量的降低幅度要大于K31,说明硅维持XD品种细胞膜结构完整性的效应要比K31好,从而更好地促进XD品种正常生长,这点也从添加硅显著提高了高羊茅品种XD地上生物量得到佐证,可以看出硅对高羊茅在盐生境下的影响不仅表现在渗透调节功效上,还表现在膜结构方面。这说明添加硅对高羊茅生长的影响不仅与盐浓度密切相关,而且与品种自身抗性密切相关。
[1] 白小明, 相斐, 鲁存海, 孙吉雄. 氮磷钾肥对高羊茅扩展性和根系特性的影响. 草地学报, 2009, 17(5):600-606.
[2] 杜建雄, 侯向阳, 刘金荣. 草地早熟禾对干旱及旱后复水的生理响应研究. 草业学报, 2010, 19(2):31-38.
[3] Flowers T J. Improving crop salt tolerance. Journal of Experimental Botany, 2004, 55(396):307-319.
[4] 杨海霞, 刘润进, 郭绍霞. AM真菌摩西球囊霉对盐胁迫条件下高羊茅生长特性的影响. 草业学报, 2014(4):195-203.
[5] 刘慧霞, 郭兴华, 郭正刚. 盐生境下硅对坪用高羊茅生物学特性的影响. 生态学报, 2011, 31(23):7039-7046.
[6] 朱佳, 梁永超, 丁燕芳, 李兆军. 硅对低温胁迫下冬小麦幼苗光合作用及相关生理特性的影响. 中国农业科学, 2006, 39(9):1780-1788.
[7] 郑世英, 郑芳, 徐建, 潘恩敬, 耿建芬, 李东臣. 外源硅对NaCl胁迫下小麦幼苗生长及光合特性的影响.麦类作物学报, 2015, 35(1):111-115.
[8] Liang Y C, Zhang W H, Chen Q, Liu Y L, Ding R X. Effect of exogenous silicon (Si) on H+-ATPase activity, phospholipids and fluidity of plasma membrane in leaves of salt-stressed barley(HordeumvulgareL.). Environmental and Experimental Botany, 2006, 57(3):212-219.
[9] Gong H J, Randall D P, Flowers T J. Silicon deposition in the root reduces sodium uptake in rice (OryzasativaL.) seedlings by reducing bypass flow. Plant Cell and Environment, 2006, 29(10):1970-1979.
[10] 刘建新, 胡浩斌, 王鑫. 硅对盐胁迫下黑麦草幼苗活性氧代谢和光合参数的影响. 中国草地学报, 2008, 30(5):25-31.
[11] 朱永兴, 李换丽, 胡彦宏, 张田田, 韩卫华, 宫海军. 硅酸盐提高番茄抗盐性的效应与生理机制. 农业环境科学学报, 2015, 34(2):213-220.
[12] Tuna A L, Kaya C, Higgs D, Murillo-Amador B, Aydemir S, Girgin A R. Silicon improves salinity tolerance in wheat plants. Environmental and Experimental Botany, 2008, 62(1):10-16.
[13] Bae E J, Lee K S, Huh M R, Lim C S. Silicon significantly alleviates the growth inhibitory effects of NaCl in salt-sensitive ‘Perfection’ and ‘Midnight’ Kentucky bluegrass (PoapratensisL.). Horticulture Environment and Biotechnology, 2012, 53(6):477-483.
[14] 刘大林, 张华, 曹喜春, 胡楷崎, 王奎, 刘兆明, 杨俊俏. 硅对盐胁迫下不同狼尾草属牧草生理代谢的影响. 草地学报, 2013, 21(6):1119-1123.
[15] 王忠文, 王晓琴. 干旱荒漠区观赏草坪草种的特性研究. 甘肃科技纵横, 2011, 40(4):54-55.
[16] 师尚礼, 李温. 西北地区羊茅属牧草和草坪草的综合评价. 甘肃农业大学学报, 2000, 35(2):127-131.
[17] 刘慧霞, 王康英, 郭兴华. 不同土壤水分条件下硅对坪用高羊茅种子出苗及生物学特性的影响. 草业学报, 2012, 21(1):199-205.
[18] 孙祎龙, 吕凤华. 东北寒冷地区冷地型草坪建植及养护管理. 草原与草坪, 2004(1):62-64.
[19] 郝再彬, 苍晶, 徐仲. 植物生理试验. 哈尔滨: 哈尔滨工业大学出版社, 2004.
[20] 李合生. 植物生理生化试验原理和技术. 北京: 高等教育出版社, 2006.
[21] Sairam R K, Rao K V, Srivastava G C. Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress, antioxidant activity and osmolyte concentration. Plant Science, 2002, 163(5):1037-1046.
[22] 刘永霞. 硅对金丝小枣盐胁迫的缓解效应及其机理[D]. 南京: 南京林业大学, 2007.
[23] 刘慧霞, 郭正刚, 周雪荣, 郭兴华, 邹文辉, 王爱国. 硅对紫花苜蓿根系生长的影响. 中国草地学报, 2009, 31(1):28-31..
[24] 王玉萍, 王映霞, 白向利, 王小青, 张峰. 硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响. 草业学报, 2015, 24(5):108-116.
[25] 解明. 外源硅对盐胁迫下玉米萌发及幼苗生长量的影响. 新疆农垦科技, 2015(7):50-52.
[26] 张润花, 郭世荣, 樊怀福, 李娟. 外源亚精胺对盐胁迫下黄瓜幼苗体内抗氧化酶活性的影响. 生态学杂志, 2006, 25(11):1333-1337.
[27] 刘建新, 王金成, 王瑞娟, 贾海燕. 外源过氧化氢提高燕麦耐盐性的生理机制. 草业学报, 2016, 25(2):216-222.
[28] Yin L, Wang S W, Li J Y, Tanaka K, Oka M. Application of silicon improves salt tolerance through ameliorating osmotic and ionic stresses in the seedling ofSorghumbicolor. Acta Physiologiae Plantarum, 2013, 35(11):3099-3107.
[29] 张永峰, 梁正伟, 隋丽, 崔彦如. 盐碱胁迫对苗期紫花苜蓿生理特性的影响. 草业学报, 2009, 18(40):230-235.
[30] Soylemezoglu G, Demir K, Inal A, Gunes A. Effect of silicon on antioxidant and stomatal response of two grapevine (VitisviniferaL.) rootstocks grown in boron toxic, saline and boron toxic-saline soil. Scientia Horticulturae, 2009, 123(2):240-246.
[31] 李佐同, 高聚林, 王玉凤, 杨克军. 硅对NaCl胁迫下玉米幼苗生理特性的影响. 玉米科学, 2011, 19(2): 73-76.
Effectsofsiliconsupplementsonbiomassandosmolytecontentsoftallfescue(Festucaarundinacea)underdifferentsoilsalinityconditions
ZHOU Yupei1, LIU Huixia2,*, YU Cheng1, LIN Liguo2, LIN Xuandong2
1StateKeyLaboratoryofGrasslandAgro-ecosystems;CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China2CollegeofLifeScienceandEngineering,NorthwestUniversityforNationalities,Lanzhou730030,China
国家自然科学基金资助项目(31360581);中央高校基本科研业务费资助项目(31920130050)
2016- 05- 10; < class="emphasis_bold">网络出版日期
日期:2017- 03- 26
*通讯作者Corresponding author.E-mail: liuhuixia2@aliyun.com
10.5846/stxb201605100909
周钰佩,刘慧霞,于成,林丽果,林选栋.硅对不同盐生境下高羊茅生物量及渗透调节物质含量的影响.生态学报,2017,37(16):5514- 5521.
Zhou Y P, Liu H X, Yu C, Lin L G, Lin X D.Effects of silicon supplements on biomass and osmolyte contents of tall fescue (Festucaarundinacea) under different soil salinity conditions.Acta Ecologica Sinica,2017,37(16):5514- 5521.
