猪伪狂犬病病毒LAMP可视化检测方法的建立
2017-10-12许宗丽黄溢泓李志源刘针伶周师师覃艳然盘美妮
许宗丽,黄溢泓,李志源,刘针伶,周师师,覃艳然,邱 洁,盘美妮
(柳州市动物疫病预防控制中心,广西柳州 545000)
猪伪狂犬病病毒LAMP可视化检测方法的建立
许宗丽,黄溢泓,李志源,刘针伶,周师师,覃艳然,邱 洁,盘美妮
(柳州市动物疫病预防控制中心,广西柳州 545000)
根据GenBank中猪伪狂犬病病毒(PRV)gB基因的保守序列,设计一套特异性引物,在对反应条件进行优化后,建立了PRV环介导等温扩增(LAMP)可视化检测方法。结果显示:该方法能在常规65 ℃水浴锅中30 min内实现对目的片段的特异性扩增,并且可通过肉眼观察颜色直接判定检测结果;该方法具有很高的特异性,与猪瘟病毒、猪圆环病毒2型等均无交叉反应;该方法的敏感性可达1 fg;将该方法应用于临床样品检测,结果与普通PCR方法一致。研究表明,本研究建立的LAMP方法简便、快速、灵敏、特异,适合基层PRV感染的快速检测。
猪伪狂病病毒;环介导等温扩增(LAMP);检测
Abstract:According to the sequences of PRV gB gene in GenBank,a set of primers was designed. After the optimization of the reaction conditions,a visualized LAMP for PRV was established. The results showed that the optimized detection assay could be conducted by incubating in the conventional water bath at 65℃ for 30min,and the result could be directly determined by visual observation. The assay was specific to PRV with a detection limit of 1 fg,and no crossreactivity with other pathogens of swine,including CSFV and PCV2. The results of detection of clinical samples by our LAMP approach were consistent with that of the ordinary PCR assay. These results suggested that the LAMP assay described in this study was a simple,rapid,specific method for detection of PRV in the field.
Key words:Pseudorabies virus;LAMP;detection
伪狂犬病(PR)是一种以急性脑脊髓炎、发热以及奇痒(猪除外)等为主要临床症状的急性传染病,由伪狂犬病病毒(PRV)引起,可危害多种家畜和野生动物[1-2]。猪是PRV的传染源和自然宿主,感染后表现为发热,仔猪还表现神经症状和高死亡率,大中猪表现呼吸症状,母猪出现流产、产死胎、不育等临床特征[3]。据邓仕伟等[4]统计,2006年该病在我国29个省、香港特别行政区及台湾发生。目前,PR的流行出现上升趋势,成为养猪业中危害严重的疫病之一。
环介导等温扩增技术(LAMP)是一种新型核酸扩增技术,由Notomi等[5]于2000年研发成功。它通过识别靶序列上的8个特异区域和Bst DNA聚合酶在恒温(60~65 ℃)下形成瀑布式的核酸高效扩增。该技术具有操作简便、反应快速、成本低廉和结果可视等优点,目前被广泛应用于病毒、细菌、寄生虫等病原体的检测[6-10]。为了提高检测的准确性及其效率、降低检测成本,本研究所采用LAMP技术对实验设备和实验条件要求不高,适合养殖场和基层兽医站快速准确检测的方法。
1 材料和方法
1.1 主要试剂
MgSO4、Bst DNA聚 合 酶( 大 片 段)、Betaine,购自New England Biolabs公司;TIANamp血液/细胞/组织 基因DNA提取试剂盒,购自天根公司;RNA提取试剂TRIzol LS Reagent,购自Invitrogen公司。
1.2 病毒株
猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、猪蓝耳病毒(PRRSV)和猪伪狂病毒(PRV-2015)等,由本实验室分离保存;猪O型口蹄疫病毒(FMDV-O)灭活疫苗,由本单位疫苗室保管。
1.3 引物设计和合成
下载GenBank中的PRV gB基因序列,利用Lasergene软件进行多序列比对,在保守区运用在线软件Primer Ex-plorer V4设计LAMP引物(表1)。引物由上海Invitrogen公司合成。

表1 LAMP引物序列
1.4 核酸的提取和模板的制备
对PCV-2和PRVDNA的提取,参照TIANamp血液/细胞/组织基因DNA提取试剂盒说书进行;对CSFV、PRRSV、FMDV-O疫苗株的RNA抽提,按照TRIzol LS Reagent使用说明书进行,并进行反转录制备cDNA,-70 ℃保存备用。
PRV模板标准品的制备:用试剂盒回收B3、F3引物,扩增PRV PCR产物,与pGM18-T载体链接,构建标准品重组质粒pGM-PRV;提取质粒,通过紫外分光光度计测定DNA浓度。
1.5 LAMP反应条件的优化
对反应体系在如下范围内进行优化:FIP/BIP引物终浓度 1.6 μmol/L、B3/F3 引物 0.2 μmol/L、LF/LB 0.8 μmol/L,Bst DNA 聚 合 酶(8 U/μL)1 μL、10×Bst buffer 2.5 μL、dNTPs(10 mmol/L)3.5 μL、Betaine(1 mol/L)1~7 μL、MgSO4(100 mmol/L)1.5 μL、Calcein(625 μmol/L)、MnCl2(12.5mmol/L)各 1 μL、模板 DNA 1 μL,加水至 25 μL。用水替代模板DNA,设阴性对照管。在水浴锅中65 ℃反应60 min,12 ℃ 4 min冷却,多次重复试验后确定Betaine最佳反应用量。根据Betaine的最佳用量,以上其他反应条件不变,MgSO41~7 μL,多次重复试验后确定最佳反应用量。根据Betaine、MgSO4的最佳用量,以上其他反应条件不变,将温度按59 ℃~67 ℃依次递增,多次重复试验后确定最佳退火温度。
1.6 特异性和灵敏度检验
利用优化好的LAMP反应体系,对CSFV、猪细小病毒(PPV)、PRRSV、PCV-2和FMDV-O的疫苗毒株进行检测,同时用水替代模板,设阴性对照管,检验LAMP方法的特异性;使用Beckman UV-800紫外分光光度计测定PRV的DNA浓度,并按10倍递增稀释;对各浓度DNA用LAMP方法进行检测,同时用水替代模板,设阴性对照管,并用PCR方法进行扩增;按照1.5%琼脂糖凝胶电泳观察结果确定该方法的灵敏度。
1.7 临床样品的检测
对2016年柳州市各养殖场送来的28份猪脑组织样品同时进行PCR和LAMP检测,来验证所建立方法的临床运用效果。PCR反应体系:2×Taq PCR mix 12.5 µL, 上 下 引 物 F3/B3各0.5 µL,模板 1 µL,补充水至 25 µL。反应程序为:94 ℃ 3 min ,94 ℃ 45 s,60 ℃ 45 s,72 ℃1 min,35个循环,72 ℃延伸10 min。扩增的目的片段为gB基因,长度为209 bp。
2 结果
2.1 LAMP反应条件的优化
通过对各反应条件的优化,最终确定LAMP反应体系为25 μL:FIP/BIP引物终浓度 1.6 μmol/L、B3/F3 引物 0.2 μmol/L、LF/LB 0.8 μmol/L,Bst DNA 聚合酶(8 U/ul)1 μL、10×Bst buffer 2.5 μL、dNTPs(10 mmol/L)3.5 μL、Betaine(1 mol/L)5 μL、MgSO4(100 mmol/L)1.5 μL、Calcein(625 μmol/L)、MnCl2(12.5 mmol/L)各 1 μL、模板 DNA 1 μL(14 ng/µL,加水至25 μL。用水替代模板DNA,设阴性对照管。充分混匀后,在水浴锅中65 ℃反应30 min,12 ℃4 min冷却。反应后肉眼可见阳性管溶液变绿,阴性对照管溶液为较浅的桔红色(图1-A);反应液琼脂糖凝胶电泳后的阳性管呈现出特征性梯形条带(图1-B)。

图1 LAMP方法的优化结果
2.2 特异性检验
用本研究建立的LAMP方法进行检测,发现只有PRV为阳性(肉眼观察可见翠绿色,琼脂糖凝胶电泳呈现特征性梯形条带),而CSFV、PPV、PRRSV、FMDV-O(疫苗株)和PCV-2均为阴性(图2)。
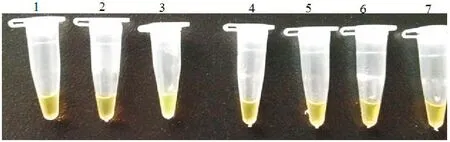
图2 LAMP方法检测特异性
2.3 灵敏度检验
该方法对PRV的最小检测限为1 fg(图3),灵敏度是常规PCR方法的100倍(图4)。
2.4 临床样品的检测
在2016年柳州市各养殖场送来的28份脑组织样品中,用所建立的方法检测出12份阳性。该结果与普通PCR结果一致,说明LAMP方法可以用于临床检测。
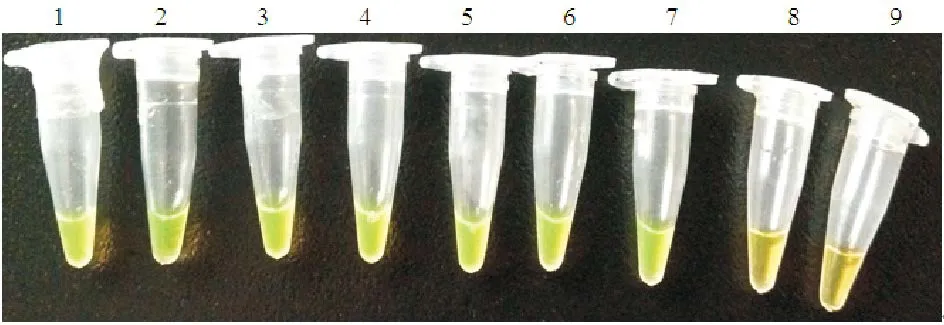
图3 LAMP方法检测的灵敏度
3 讨论
目前,PR在世界多个区域流行,给养猪业造成重大经济损失。我国是养猪业大国,也面临同样严峻的PR疫情。相关资料表明,我国有50%左右的规模化猪场存在PRV野毒感染,散养户的感染情况更为严重[11。如何防治和净化PR成为国内养猪业专家、技术人员及学者共同关注的话题。快速诊断技术在PR的防治中起至关重要的作用。
LAMP技术是新型的核酸扩增技术,不需要特殊的仪器设备,在水浴锅即可完成。在有荧光染料的条件下,反应结果可肉眼观察。本研究根据GenBank中PRV gB基因保守序列,优化反应条件,建立了PRV LAMP检测方法。本研究建立的PRV LAMP检测方法,具有较高的灵敏性,DNA的最小检测量为1 fg。杨睿等[12]、王树芬等[13]分别根据PRV gE和DBP基因保守序列建立了LAMP方法。他们建立的体系反应时间均为40 min。本研究根据gB基因建立的方法,只需要在65 ℃等温条件30 min内就可观察结果,表明建立的方法更快速。杨睿等[12]、张莉等[14]均选用SYBR Green I为染料,建立了PR可视化检测方法;王淑芬等[13]用一种新的荧光染料——罗丹明B衍生物作为指示剂。当其由紫色变成蓝色时为阳性,因而避免了反应后开盖加入染料造成的假阳性。本研究使用Calcein+MnCl直接加入反应液中,反应后阳性由桔红色变为翠绿色,更直观,因此开阔了不同反应指示剂在PR LAMP快速检测中的应用空间。应用所建立的方法对CSFV、PPV、PRRSV和PCV-2和FMDV-O(疫苗)等5种核酸进行检测,发现结果都为阴性。用该方法和PCR方法对28份临床样品进行检测,发现结果完全一致。这表明所建立的LAMP方法可用于临床样品的检测。此外,所建立的PRV LAMP检测方法,操作简单,仅需1台水浴锅,通过肉眼观察颜色变化,便可直接判定结果,适合基层的快速检测,在PR的诊断和净化方面具有广阔的应用前景。
[1]POMERANZ L E,REYNOLDS A E,HENGARTNER C J. Molecular biology of pseudorbies virus:impact on neurovirology and veterinary medicine[J]. Microbiology and Molecular Biology Reviews,2005,69(3):462-500.
[2] 殷震,刘景华. 动物病毒学[M]. 北京:北京科学出版社,1997.
[3] 王军,张秀凤,王瑞. 河南省猪伪狂犬病流行病学调查[J]. 江苏农业科学,2012,40(4):221-222.
[4] 邓仕伟,汪勇,薛春芳. 我国伪狂犬病流行现状及新特点[J]. 动物医学进展,2006,27(9):105-107.
[5] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res,2000,28(12):63.
[6] 罗忠永,王印,杨泽晓. 猪繁殖与呼吸综合征病毒LAMP检测方法的建立[J]. 动物医学进展,2016,37(1):1-5.
[7] MARUYAMA F,KENZAKA T,YAMAGUCHI N,et al. Detection of bacteria carrying the stx2 gene by in situ loop-mediated isothermal amplification[J]. Applied and environmental microbiology,2003,69(8):5023-5028.
[8] 范晴,谢芝勋,刘加波,等. 牛病毒性腹泻病毒RTLAMP检测方法的建立[J]. 生物技术通讯,2010,21(2):248-251.
[9] KUBOKI N,INOUE N,SAKURAI T,et al. Loopmediated isothermal amplification for detection of African trypanosomes[J]. Journal of clinical microbiology,2003,41(12):5517-5524.
[10] ENDO S,KOMORI T,RICCI G,et al. Detection of gp43of Paracoccidioides brasiliensis by the loop-mediated isothermal amplification(LAMP)method[J]. FEMS microbiology letters 2004,234:293-297.
[11] 汤丹,张文飞,张鑫雷. 浅谈猪伪狂犬病及其防控与净化[J]. 中国畜牧兽医文摘,2016,32(11):137-138.
[12] 杨睿,杨金龙,王孝友,等. 快速诊断伪狂犬病毒的LAMP方法的建立[J]. 中国兽医学报,2011,31(2):161-164.
[13] 王树芬,王德国,薛白,等. 可视化LAMP快速检测猪伪狂犬病毒[J]. 河南农业科学,2012,41(6):140-143.
[14] 张莉,鄢明华,王东,等. 猪伪狂犬病毒环介导等温扩增检测方法的建立[J]. 中国兽医科学,2011,41(7):723-727.
(责任编辑:朱迪国)
Establishment of a Visualized LAMP Method for Detection of Pseudorabies Virus
Xu Zongli,Huang Yihong,Li Zhiyuan,Liu Zhenling,Zhou Shishi,Qin Yanran,Qiu Jie,Pan Meini
(Liuzhou Animal Disease Prevention and Control Center,Liuzhou,Guangxi 545000)
S851.3
A
1005-944X(2017)10-0079-04
10.3969/j.issn.1005-944X.2017.10.022
广西柳州科技项目(2015E040501)
黄溢泓
