肝细胞癌组织中维甲酸相关孤核受体α的表达变化及其意义
2017-10-10谷锋杨继宏李琮张洪安康明段文都刘岩
谷锋,杨继宏,李琮,张洪安,康明,段文都,刘岩
(1河北大学附属医院,河北保定071000;2华北油田总医院)
肝细胞癌组织中维甲酸相关孤核受体α的表达变化及其意义
谷锋1,杨继宏2,李琮1,张洪安1,康明1,段文都1,刘岩1
(1河北大学附属医院,河北保定071000;2华北油田总医院)
目的观察肝细胞癌(HCC)组织中维甲酸相关孤核受体α(RORα)的表达变化,并探讨其临床意义。方法取92例HCC患者,术中获取HCC组织和癌旁正常肝组织各92例份。分别采用免疫组化法及Western blotting法检测HCC组织和癌旁正常肝组织中的RORα、VEGF,分析RORα表达与HCC临床病理参数的关系。结果HCC组织及正常肝组织中RORα阳性分别为31(33.7%)、62(67.3%)例,VEGF阳性分别为74(80.4%)、17(18.5%)例。HCC组织中RORα阳性表达率低于正常肝组织,VEGF阳性表达率高于正常肝组织(P均<0.05)。HCC组织及正常肝组织中RORα相对表达量分别为0.52±0.07、1.70±0.03,VEGF相对表达量分别为1.94±0.08、0.55±0.07。HCC组织中RORα相对表达量低于正常肝组织,VEGF相对表达量高于正常肝组织(P均<0.05)。HCC组织中RORα与VEGF表达无相关性(P>0.05)。RORα阳性表达与HCC患者的年龄、性别、肿瘤直径、临床分期、淋巴结转移情况等无关(P均>0.05)。HCC病理分级为Ⅰ~Ⅱ级者RORα阳性表达比例高于Ⅲ级者(P<0.05)。结论HCC组织中RORα表达下调,且与HCC的病理分级有关。RORα表达异常可能参与了HCC的发生发展。
肝肿瘤;肝细胞癌;维甲酸相关孤核受体α;血管内皮生长因子
原发性肝癌(PLC)是人类最常见的肿瘤之一,病死率高,其中有90%以上为原发性肝细胞性肝癌(HCC)。肝癌的发病较为隐匿,仅有接近30%的患者可在患病初期诊断并得到手术治疗机会,多数中晚期患者只能采用非手术治疗方式。研究肝癌细胞的分化、增殖、复发及转移的分子机制,对HCC的诊断、病程进展及预后评估有重要意义。维甲酸类孤儿核受体(ROR)是孤核因子家族的一个亚科,因其序列与维甲酸受体(RAR)和维甲酸X受体(RXR)相似,由此得名。RORα是第一个被发现的ROR家族成员。RORα在多种组织和细胞中均有表达,包括大脑、肌肉、肠、心脏、皮肤、肺、肝、脾、白细胞和乳腺上皮细胞等[1]。RORα的异常活化与多种疾病相关,例如骨质疏松症、自身免疫性疾病、哮喘等[2,3]。RORα在多种人类肿瘤中表达下调,发挥肿瘤抑制因子的作用。但对于RORα与HCC的关系目前研究较少,且无明确研究成果。本研究观察了HCC组织中RORα的表达变化,并探讨其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 住院手术治疗的HCC患者92例,其中男51例、女41例,年龄24~93岁。病理分级Ⅰ~Ⅱ级患者36例,Ⅲ级患者56例;淋巴结转移阳性患者40例。术中分别切取非坏死区HCC组织及距肿瘤边缘至少1 cm的癌旁组织,各92例份。
1.2 RORα、VEGF检测 ①免疫组化法:对组织切片进行免疫组化染色。步骤如下:60 ℃烘烤切片2 h,4 μm厚度石蜡切片脱蜡至水;双氧水阻断内源性过氧化物酶,在0.01 mol/L的枸橼酸缓冲液中90 ℃微波抗原修复8 min;5%二抗正常血清室温孵育封闭1 h;RORα(1∶100)或VEGF(1∶150)一抗稀释后室温孵育1 h;聚合物增强剂室温孵育20 min,酶标抗鼠聚合物室温孵育20 min,常规DAB显色。以磷酸缓冲液PBS代替一抗作为阴性对照,同时做空白对照。每张切片选取5个视野,以细胞核或细胞质染成棕黄或棕褐色且大于5%的细胞着色判断为蛋白表达阳性。②Western blotting法:取新鲜冰冻HCC组织和癌旁正常肝组织按照重量体积比1∶3加入组织裂解液(10 mmol/L的Tris-Cl,pH 8.0,150 mmol/L的NaCl,1 mmol/L的EDTA,1% NP-40,10%甘油及蛋白酶抑制剂)进行裂解,BCA法测定总蛋白浓度。配置10%分离胶和8%浓缩胶,取50 μg组织总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(32 mA,60 min);110 V条件下转膜120 min;5%脱脂奶粉封闭1 h后,加抗RORα(1∶1 000)及抗VEGF(1∶1 000)抗体室温孵育1 h;TBST漂洗,二抗(1∶5 000)室温孵育1 h;TBST漂洗,电化学发光法检测。扫描蛋白条带灰度值,用Image J软件软件进行分析。以目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白的相对表达量。
1.3 统计学方法 采用SPSS17.0软件进行统计学分析。计量资料采用t检验。计数资料采用χ2检验。RORα与VEGF的相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 HCC组织及正常肝组织中RORα、VEGF表达比较 免疫组化染色示RORα主要定位于肝细胞核,呈棕色颗粒状或灶性分布;正常肝组织大部分能被染色,HCC组织只有少部分被染色,且正常肝细胞均着色较深,呈深棕色;VEGF表达于细胞质中,正常肝组织中细胞染色为阴性或浅棕色,HCC组织均能被染色,且部分病例着色颜色较深,呈深棕色。详见图1。HCC组织及正常肝组织中RORα阳性分别为31(33.7%)、62(67.3%)例,VEGF阳性分别为74(80.4%)、17(18.5%)例。HCC组织中RORα阳性表达率低于正常肝组织,VEGF阳性表达率高于正常肝组织(P均<0.05)。HCC组织及正常肝组织中RORα相对表达量分别为0.52±0.07、1.70±0.03,VEGF相对表达量分别为1.94±0.08、0.55±0.07。HCC组织中RORα相对表达量低于正常肝组织,VEGF相对表达量高于正常肝组织(P均<0.05)。见图2。进一步分析结果显示HCC组织中RORα与VEGF表达无显著相关性(P>0.05)。
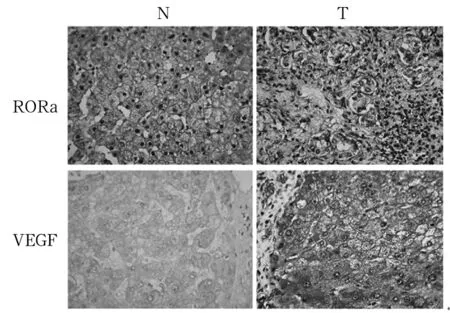
注:T为HCC组织;N为癌旁正常肝组织。
图1HCC组织和癌旁正常肝组织中RORα、VEGF表达情况(免疫组化法)
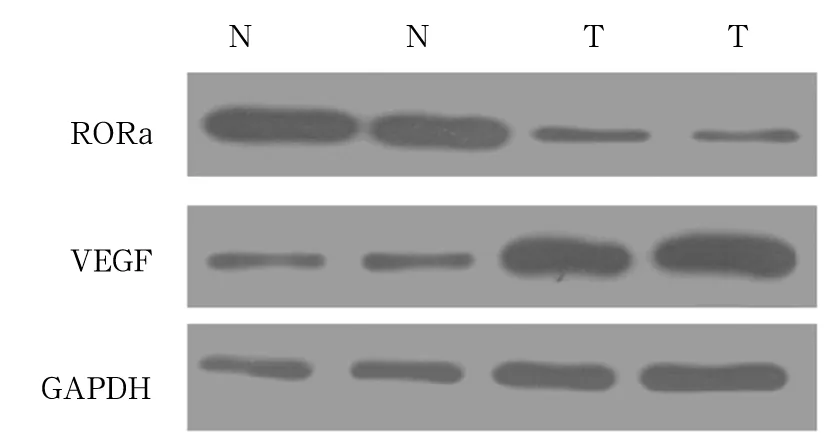
图2 HCC组织与正常肝组织中RORα、VEGF表达情况(Western blotting法)
2.2 RORα表达与HCC临床病理参数的关系 RORα阳性表达与HCC患者的年龄、性别、肿瘤直径、临床分期、淋巴结转移情况无关(P均>0.05)。HCC病理分级为Ⅰ~Ⅱ级者RORα阳性表达比例高于Ⅲ级者(P<0.05)。详见表1。
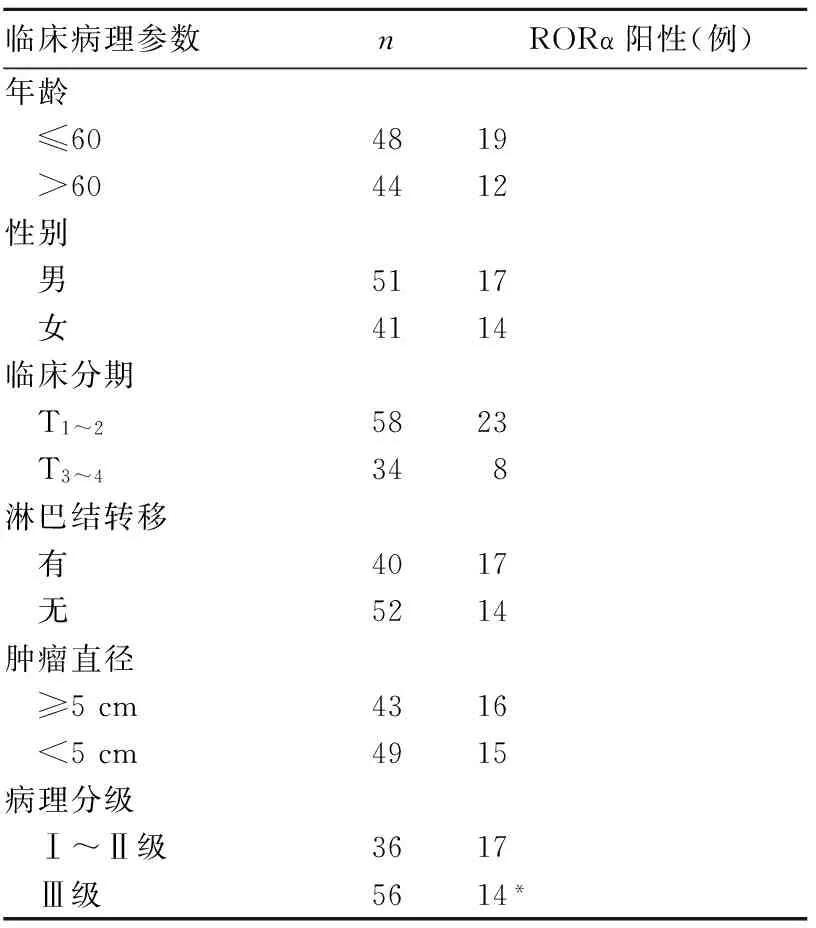
表1 RORα阳性表达与HCC临床病理参数的关系
注:与Ⅰ~Ⅱ级者相比,*P<0.05。
3 讨论
RORα是家族成员之一,参与多种重要生理功能的调节,在细胞分化、生物体发育、神经调控等方面发挥重要作用[4]。RORα从N端到C端包含多个结构域,可执行多种功能,其中的锌指模序1和锌指模序2可与特殊DNA序列ROR反应元件(RORE)进行特异性结合,从而调节靶基因转录[5]。经鉴定发现,生物体中多种肿瘤相关基因也含有RORE,如N-myc、Nm23。因此,ROR在肿瘤的发生发展中同样发挥重要作用[6,7]。
基因微阵列研究数据表明,多种肿瘤组织中RORα mRNA表达水平显著下调[8,9]。其中胃癌细胞中RORα基因存在甲基化沉默现象,提示甲基化可能导致RORα表达下调[10]。RORα在结肠癌、乳腺癌和前列腺癌组织中表达也下调。研究[11]显示,RORα过量表达可抑制Wnt/β-Catenin信号通路功能,后者在多种肿瘤中均存在异常激活,提示RORα可能通过调控Wnt/β-Catenin信号通路功能进而影响肿瘤的发生发展。目前有关RORα在肝癌发展中的作用研究较少[12]。最近报道显示,肝癌患者外周血中检测到RORα异常表达,RORα可能参与肝癌的肿瘤血管生成。因此,本研究不仅观察了HCC组织中RORα的表达变化,同时检测了与肿瘤血管生成密切相关的VEGF,期望探讨RORα在肿瘤血管生成中的作用。
本研究结果显示,RORα在HCC组织中的阳性表达率及表达水平较癌旁正常肝组织明显下降,且随着HCC病理分级增加,RORα表达下调越明显,提示RORα在HCC发生发展过程中发挥抑制肿瘤生长的作用。本研究结果还显示,VEGF在HCC组织中表达显著上调,但RORα和VEGF在HCC组织中的表达无相关性,提示RORα可能并不参与对VEGF的直接调控。最新研究结果显示,在NP细胞中抑制RORα表达可调节HIF1α-TAD的活性,但与HIF1α的靶基因VEGF、PFKFB3、Eno1的表达变化无直接关系[13]。还有研究者发现,RORα可促使p53蛋白稳定表达;利用最新合成的一种ROR激动剂作用于肿瘤细胞后,可使得p53稳定表达并诱导肿瘤细胞凋亡[14]。ROR激动剂有望应用于相关肿瘤的临床治疗[15]。
Wnt/β-Catenin信号通路是维持肝脏正常生理功能的关键通路,也与多种肝病的发病有关。最新研究显示,在肝癌中,Wnt/β-Catenin和Notch信号通路可提高肝癌干细胞的干细胞活性,并且Notch1作为Wnt/β-Catenin的下游蛋白对该通路有反馈调节作用。我们推测RORα可通过Wnt/β-Catenin通路调控肝癌进展。Cyclin D1、MMP7、c-MYC和E-cadherin等肿瘤相关蛋白均为Wnt/β-Catenin通路的下游靶蛋白,在肝癌细胞的增殖、侵袭和凋亡等过程中发挥重要作用。还有有学者发现,RORα可显著抑制胃癌MGC803细胞中E-cadherin表达和EMT过程。因此,在肝癌中,RORα是否参与Wnt/β-Catenin信号通路、EMT和肿瘤血管生成过程调节是进一步研究的焦点。
综上所述,HCC组织中RORα表达下调,且与肿瘤病例分级有关。对RORα深入研究有助于进一步阐述HCC的形成和演变机制,有望为HCC的临床诊断及治疗相关研究提供新的方向。同时,HCC组织中RORα与VEGF表达无相关性,提示RORα在HCC发生发展过程中并不参与肿瘤血管生成的直接调控,也为下一步研究提供了参考。
[1] Hamilton BA, Frankel WN, Kerrebrock A W, et al. Disruption of the nuclear hormone receptor RORalpha in staggerer mice[J]. Nature, 1996,377(6567):736-739.
[2] Wang NS, Mcheyzerwilliams LJ, Okitsu SL, et al. Divergent transcriptional programming of class-specific B cell memory by T-bet and ROR[alpha][J]. Nat Immunol, 2012,13(6):604-611.
[3] Wong SH, Walker JA, Jolin HE, et al. Transcription factor ROR[alpha] is critical for nuocyte development[J]. Nat Immunol, 2012,13(3):229-236.
[4] Shin D, Kim IS, Lee JM, et al. The hidden switches underlying RORα-mediated circuits that critically regulate uncontrolled cell proliferation[J]. J Mol Cell Blol, 2014,6(4):338-348.
[5] Aranda A, Pascual A. Nuclear hormone receptors and gene expression[J]. Physiol Rev, 2001,81(3):12-69.
[6] Paravicini G, Steinmayr M, André E, et al. The metastasis suppressor candidate nucleotide diphosphate kinase NM23 specifically interacts with members of the ROR/RZR nuclear orphan receptor subfamily[J]. Biochem Bioph Res, 1996,227(1):82-87.
[7] Dussault I, Giguère V. Differential regulation of the N-myc proto-oncogene by ROR alpha and RVR, two orphan members of the superfamily of nuclear hormone receptors[J]. Mol Cell Biol, 1997,17(4):1860-1867.
[8] Du J, Xu R. ROR, a Potential Tumor Suppressor and Therapeutic Target of Breast Cancer[J]. Int J Mol Scl, 2012,13(12):15755-15766.
[9] Xiao L, Wang J, Li J, et al. RORα inhibits adipocyte-conditioned medium-induced colorectal cancer cell proliferation and migration and chick embryo chorioallantoic membrane angiopoiesis[J]. Am J Physiol Cell Physiol, 2015,308(5):385-396.
[10] Kim H S, Hong J P, Yang M. Abstract 3814: Signet-ring cell gastric carcinoma has different epigenetic signature from poorly differentiated gastric carcinoma[J]. Cancer Res, 2011,71(8):3814-3814.
[11] Ji M L, Kim I S, Kim H, et al. RORα Attenuates Wnt/β-Catenin Signaling by PKCα-Dependent Phosphorylation in Colon Cancer[J]. Mol Cell, 2010,37(2):183-195.
[12] Ou Z, Shi X, Gilroy R K, et al. Regulation of the human hydroxysteroid sulfotransferase (SULT2A1) by RORα and RORγ and its potential relevance to human liver diseases[J]. Mol Endocrinol, 2013,27(1):106-115.
[13] Suyama K, Silagi ES, Choi H, et al. Circadian factors BMAL1 and RORα control HIF-1α transcriptional activity in nucleus pulposus cells: implications in maintenance of intervertebral disc health[J]. Oncotarget, 2016,7(17):23056-23071.
[14] Wang Y, Solt LA, Kojetin DJ, et al. Regulation of p53 Stability and Apoptosis by a ROR Agonist[J]. PLS One, 2012,7(4):34921.
[15] Kojetin DJ, Burris TP. REV-ERB and ROR nuclear receptors as drug targets[J]. Nat Rev Drug Discov, 2014,13(3):197-216.
10.3969/j.issn.1002-266X.2017.35.030
R735.7
B
1002-266X(2017)35-0090-03
2017-03-06)
刘岩(E-mail: sanbenyange@sina.com)
