黑荆树皮原花色素对小鼠急性毒性研究
2017-10-10张伦王飞刘夏睿
张伦,王飞,刘夏睿
(1.楚雄师范学院化学与生命科学学院,云南 楚雄 675000; 2.南京林业大学化学工程学院,江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
黑荆树皮原花色素对小鼠急性毒性研究
张伦1,2,王飞2*,刘夏睿2
(1.楚雄师范学院化学与生命科学学院,云南 楚雄 675000; 2.南京林业大学化学工程学院,江苏省生物质绿色燃料与化学品重点实验室,南京 210037)
为研究黑荆树皮原花色素提取物的结构及安全性,对黑荆树皮原花色素的结构类型、小鼠经口急性毒性以及对小鼠肝肾病理学组织影响进行了试验。结果表明:黑荆树皮中的原花色素主要以原刺槐定为主(约占70%),并含有较少原菲瑟定(约占25%),而且黑荆树皮中的原花色素低聚物主要是由二、三聚体组成,单体几乎没有。黑荆树皮原花色素提取物的小鼠经口半致死量(wLD50)为3.970 g/kg,95%平均可信限为3.074 ~4.674 g/kg。按照毒理学分级为低毒物质。将死亡小鼠进行解剖,脏器颜色正常,并没发现有肿大、缩小或病变等症状。当一次性服用达一定剂量,10 d后组织病理切片显示存活小鼠肝肾组织正常。研究表明,黑荆树皮原花色素毒性不高,安全性好,对小鼠代谢的器官并不会造成病变和伤害。
黑荆树皮;原花色素;急性毒性
黑荆树(Acaciamearnssii)是含羞草科、金合欢属植物,常绿乔木,原产澳大利亚。树木生长快,树高18 m,是世界著名的栲胶原料,单宁质量分数高,为48.82%,纯度81.9%,是珍贵的鞣料树种之一[1]。木材坚硬致密,是良好的木器、矿柱、造纸用材,黑荆树皮在民间还用来做止血剂和收敛剂。原花色素(proanthocyanidins,PAs)又称为浓缩型单宁,由于其具有鞣革功能,故又称为缩合单宁。它是一类天然的黄烷类单体及其聚合体的多酚类化合物,普遍存在于植物的根、茎、叶、花、果实中,是一种很好的氧自由基清除剂和脂质过氧化抑制剂[2]。20世纪80年代已有研究表明,黑荆树皮中原花色素的组成比较复杂,以原刺槐定为主(约占70%),此外还有原菲瑟定(25%)以及少量的原翠雀定[3]。Huang等[4]研究发现黑荆树皮原花色素中的二聚体原刺槐定,刺槐亭醇-(4β→8)-棓儿茶素3-O-没食子酸酯具有保护人体神经节细胞SH-SY5Y细胞抵抗丙烯醛诱发的氧化破坏作用。有学者对马尾松、湿地松、火炬松、落叶松和黑荆树等树木的树皮抗氧化剂提取进行对比,以黑荆树树皮作原料为最好,产品得率高,质量好[5]。树皮中的单宁黑荆树皮原花色素具有抑制真菌[6]、皮炎止痒[7]、美白防晒等作用[8]。在欧洲,黑荆树皮原花色素被用来消除葡萄酒中的沉淀物[9]。此外,刘夏睿等[10]研究表明黑荆树皮原花色素具有较高的抗肿瘤活性和一定的广谱性。由于黑荆树皮中含有丰富的低聚原花色素,而低聚原花色素由于每个分子中有多个邻、间位酚羟基,因此具有较强的抗氧化能力。低聚原花色素加入食品中可以降低食品体系的含氧量,防止油脂氧化[11]。目前,对黑荆树皮急性毒性的研究较少,为此,笔者对黑荆树皮原花色素的结构进行分析,并对小鼠的急性毒性以及一次性给药后存活小鼠肝肾病理学进行检查,以期为黑荆树皮原花色素的进一步开发利用提供依据。
1 材料与方法
1.1 黑荆树皮原花色素的提取
将树皮在室温下晾干,粉碎,过筛(0.25~0.60 mm)。以50%乙醇(质量分数)为溶剂,料液比为1∶11,采用超声波辅助提取,超声时间为30 min,超声波功率为67 kHz,温度为40℃。将提取液于旋转蒸发仪上真空浓缩(0.1 MPa),所得的浓缩液再用3倍体积的乙酸乙酯进行3次萃取。将乙酸乙酯层合并在40℃旋转浓缩,在50℃干燥12 h,得到棕红色黑荆树皮乙酸乙酯原花色素。
1.2 原花色素结构成分分析
原花色素样品采用HPLC-ESI-MS方法通过Agilent Technologies 1200 Series液相色谱仪、Agilent Technologies 6300 Ion Trap LC-MS液质联用仪进行检测,色谱柱选用安捷伦XDB-Phenyl(2.1 mm×150 mm,5 μm)。流动相为:超纯水、甲醇、乙腈。洗脱液为20%的乙腈水溶液(体积比);流速为0.2 mL/min,进样体积为5 μL;检测波长为280 nm。质谱采用离子源:ESI(-);扫描范围(m/z):50~1 500;雾化气压力:241 kPa;雾化气流速:9 L/min;雾化气温度:350℃。毛细管电压:4 000 V;锥孔电压:-40.0 V,毛细管出口电压:-135 V。
1.3 试验动物和仪器
ICR小鼠,由扬州大学比较医学中心提供(许可证号:No.SCXK(苏)2007-0001),体质量18~22 g,70只,雌雄各半。全部动物引入观察7 d后,投入试验。RE52CS型旋转蒸发器;FZ102型微型植物粉碎机;YD-335电脑切片机;生物显微镜BS-203。
1.4 试验设计
将黑荆树皮原花色素粉末用蒸馏水配成一定浓度的水溶液。试验动物按0.1 mL/10 g用灌胃法在24 h内给药,小鼠随机分成5组,剂量分别为:0.825,1.650,3.300,6.600 g/kg,空白组用蒸馏水按0.2 mL/10 g代替。每天上午8:00—9:00称质量并观察给药后10 d内小鼠的身体情况,并及时记录,同时将每组死亡和存活鼠数进行统计以便计算半致死量(wLD50)。给药后第11天颈部脱臼处死存活小鼠,解剖观察体内脏器情况。
1.5 病理组织学检查
试验结束后,将小鼠肝、肾器官取出,生理盐水冲洗掉表面的血污,经过10%中性甲醛固定、组织修切、石蜡包埋、常规切片、HE染色、酒精梯度褪色、透明、封片,光学显微镜观察。
1.6 计算方法和数据处理
用改良寇氏法计算wLD50及95%平均可信限。wLD50=log-1[Xm-i(∑P-0.5)],式中:Xm为最大死亡组剂量的对数;i为相邻剂量组剂量比值的对数;∑P为各组死亡率总和。wLD50的95%平均可信限log-1(logwLD50±1.98Sx50),式中:Sx50为logwLD50的标准误差。

式中,n为每组动物数。
用SPSS 18.0分析软件进行数据统计、分析、处理和显著性t检验[12]。
2 结果与分析
2.1 原花色素的结构分析
黑荆树皮中含有丰富的低聚原花色素,黑荆树皮乙酸乙酯-水或丙酮-水为溶剂的原花色素抗氧化活性物质主要成分是低聚原花色素、蒽醌和三萜皂苷类物质[13]。本实验中,黑荆树皮乙酸乙酯提取物通过HPLC-ESI-MS的方法检测,并采用归一化法定量测定其中的含量,结果表明其中所含化合物主要为低聚原花色素。虽然黑荆树皮中的单宁组成比较复杂,但其低聚原花色素主要以刺槐定为主(约占70%),此外还有原菲瑟定(25%)以及少量的原翠雀定。黑荆树皮乙酸乙酯原花色素中主要含有原刺槐定、原菲瑟定(图1,2)。根据化合物的出峰时间和分子量以及前人研究结果对小鼠灌胃前的黑荆树皮原料成分结构进行了推断。其中原刺槐定中的化合物为:P1、P7(出峰时间分别为9.5和15.5 min):ES-准分子离子[M-H]-m/z=881,刺槐亭醇-(4α→8)-棓儿茶素-(6→4α)-刺槐亭醇,刺槐亭醇-(4α→8)-棓儿茶素-(6→4β)-刺槐亭醇。P2、P3(出峰时间分别为9.9和10.7 min):ES-准分子离子[M-H]-m/z=593,刺槐亭醇-(4α→8)-棓儿茶素。P4、P10(出峰时间为11.7,17.4,20.7,23.7 min):ES-准分子离子[M-H]-m/z=865,刺槐亭醇-(4α→8)-儿茶素-(6→4α)-刺槐亭醇,刺槐亭醇-(4α→8)-儿茶素-(6→4β)-刺槐亭醇,刺槐亭醇-(4β→8)-儿茶素-(6→4β)-刺槐亭醇。P5、P6(出峰时间分别为12.4和13.6 min):ES-准分子离子[M-H]-m/z=577,刺槐亭醇-(4β→8)-儿茶素,刺槐亭醇-(4α→8)-儿茶素。原菲瑟定中的化合物为:P8、P9(出峰时间分别为17.4和20.7 min):ES-准分子离子[M-H]-m/z=561,菲瑟亭醇-(4α→8)-儿茶素,菲瑟亭醇-(4β→8)-儿茶素。P11(出峰时间为41.4 min):ES-准分子离子[M-H]-m/z=849,菲瑟亭醇-(4α→8)-儿茶素-(6→4β)-儿茶素。

图1 黑荆树皮原花色素总离子流图及液相色谱图Fig.1 Total ion chromatogram and HPLC spectra of proanthocyanidins from black wattle bark

图2 黑荆树皮原花色素ESI-MS图谱Fig.2 The ESI-MS spectra of proanthocyanidins from black wattle bark
结果显示,原料内主要原花色素以原刺槐定为主,其余为原菲瑟定,原菲瑟定含量较少。而且黑荆树皮中的原花色素低聚物主要是由二、三聚体组成,单体几乎没有,其分子结构如图3所示,与前人研究结果一致[3]。

图3 黑荆树皮原花色素分子结构图Fig.3 Chemical structure of proanthocyanidins from black wattle bark
2.2 小鼠黑荆树皮原花色素经口急性毒性试验
急性毒性试验是药物毒理学安全性评价的第一步,具有了解受试物急性毒性强弱的作用。其内容包括主要观察动物中毒表现,其一般行为、外观改变、大体形态改变及死亡效应、致死的和非致死的指标参数,以提供受试物质的急性毒性资料,以确定毒作用方式、中毒反应,并为其他蓄积毒性、亚急性和慢性毒性试验的观察及剂量分组提供参考,致死剂量通常用wLD50来表示。黑荆树皮原花色素提取物对小鼠进行灌胃后,0.825 g/kg给药剂量小鼠全部存活,毛色光滑,精神状态良好,与对照组相当。6.600 g/kg剂量给药小鼠24 h后,64%的小鼠死亡,其余小鼠48 h后全部死亡,该剂量小鼠出现腹泻、胃部胀气、腹式呼吸、毛竖起、呆滞、对刺激反应较明显、步态不稳、叫声异常、行动姿态缓慢、不再纳食等症状。而3.300 g/kg剂量给药小鼠灌胃后24 h没有出现死亡,48 h后所有灌胃小鼠中的23%出现死亡,72 h后所有灌胃小鼠中的30%出现死亡,死亡小鼠均为雌性小鼠,雄性小鼠全部存活。该剂量小鼠在灌胃后仍然纳食,大便呈藏青色,但是仍有个别体质较弱小鼠出现腹泻现象。将死亡动物进行解剖,并没发现其脏器有肿大或缩小,颜色正常,并未出现病变等症状。观察10 d后,试验动物死亡数统计见表1。采用改良寇氏法计算出wLD50为3 970 mg/kg。wLD50的95%平均可信限为3 074~4 674 mg/kg。根据我国卫生部的食品毒理学检验方法《保健食品检验与评价技术规范》可知,黑荆树皮原花色素属于低毒物质。

表1 黑荆树皮原花色素对小鼠急性毒性Table 1 Acute toxicity of proanthocyanidins from black wattle bark in mice
2.3 不同剂量对小鼠生长情况的影响
一次性灌胃后,存活小鼠10 d的生长情况有所不同。一次性的大剂量灌胃,对小鼠身体有显著的影响,但是剂量较低的小鼠身体状况迅速恢复,精神状态也大有改善;高剂量小鼠恢复需要的时间则更长。10 d内小鼠的质量变化情况见表2。将小鼠灌胃后每组的初始质量与最终质量进行对比发现,其空白组和低剂量组质量增长较为明显。高剂量组、中剂量组末次质量与对照组小鼠相比差异显著(P<0.05)。
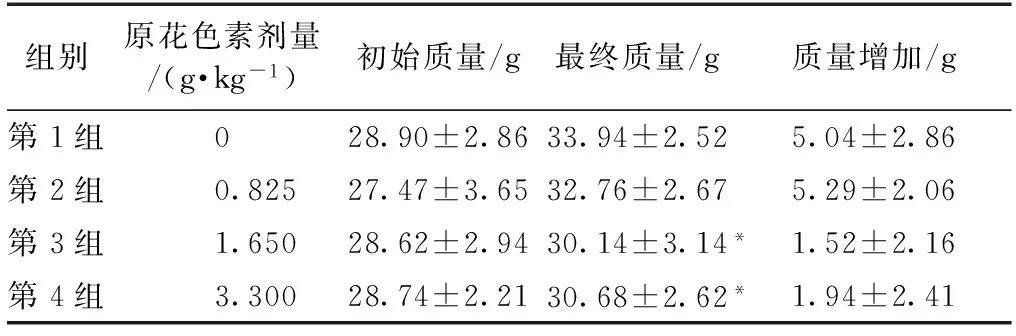
表2 黑荆树皮原花色素对小鼠生长情况的影响Table 2 Effect of proanthocyanidins from black wattle bark on mouse body weights (g)
注:“*”表示0.05水平差异显著。
2.4 病理学检查
由于原花色素主要是通过胃、肠道吸收进入血液,与白蛋白结合运转[14],肠道、肝与肾脏是其重要的代谢场所[15]。采用HE染色制作标本,HE染色后切片可充分显示肝细胞结构、肾小球的细胞增生、肾小管上皮细胞的损伤和肾间质水肿等情况。正常肝细胞以中央静脉为中心,向周围呈放射状排列,形成单个细胞厚度的细胞板。肝细胞质呈嗜酸性,HE染色为红色。肾细胞核呈紫蓝色,细胞质、基底膜、胶原纤维、肌纤维呈粉红色。正常的肾小球血管内皮细胞呈扁平梭形,细胞核位于毛细血管的系膜侧,与系膜细胞相邻,光镜下为深染的小圆形。而肾小球血管上皮细胞染色质细腻,染色较浅。断头处死各组存活动物后,对小鼠进行尸体解剖。用肉眼观察其脏器并未发现体积肿胀和明显水肿、脂肪变性等异常现象。对小鼠肝肾组织进行固定、脱水、石蜡包埋等处理后,做成切片,对小鼠急性毒性后的肝、肾脏器进行病理组织学检查(图4,5)。结果表明:空白组、黑荆树皮0.825和1.650 g/kg剂量组小鼠肝细胞结构正常,无肿胀,肝细胞胞质中也未见空泡,汇管区无炎细胞浸润、无纤维结缔组织增生。但是3.300 g/kg剂量组小鼠肝脏均可见不同程度的肝细胞索排列紊乱,其胞浆有轻微空泡。

图4 黑荆树皮原花色素对小鼠肝组织病理形态学的影响Fig.4 Effects of proanthocyanidins of black wattle bark on pathological morphology of mouse liver tissue

图5 黑荆树皮原花色素对小鼠肾组织病理形态学的影响Fig.5 Effects of proanthocyanidins of black wattle bark on pathological morphology of mouse kidney tissue
各剂量组小鼠肾脏细胞结构清晰,肾小体分布正常、大小均匀,毛细血管结构清楚,无系膜细胞和内皮细胞的增生。近曲小管、远曲小管和集合小管分布正常,上皮细胞结构清晰,无细胞变性和坏死,肾脏细胞间质正常,无明显充血和水肿及炎症反应。说明黑荆树皮原花色素一次性较大剂量内服用,其在小鼠体内的代谢都仍然正常,对代谢的器官并不会造成病变和伤害。小鼠病理切片也进一步说明黑荆树皮原花色素口服毒性不高,安全性好,安全的范围较大。这为后续的蓄积毒性以及其他生理活性提供剂量的选择和相关产品的开发利用提供了一定的科学依据。
3 结论与讨论
上述研究表明,黑荆树皮中的原花色素主要以原刺槐定为主(约占70%),其余为原菲瑟定(约占25%),原菲瑟定含量较少,且黑荆树皮中的原花色素低聚物主要是由二、三聚体组成,单体几乎没有。黑荆树皮原花色素提取物的小鼠经口wLD50为3.970 g/kg,wLD50的95%平均可信限为3.074~4.674 g/kg,按照毒理学分级为低毒物质,比毛杨梅树皮原花色素的急性毒性(wLD50为5 g/kg)稍高[16],而比葡萄籽原花青素小鼠口服wLD503.451 g/kg略低[17]。一次服用黑荆树皮原花色素一定剂量,10 d后组织病理切片显示存活小鼠的肝肾功能没有受到任何影响,即短期剂量服用黑荆树皮原花色素达3.300 g/(kg·d),小鼠的体内代谢都仍然正常,对小鼠的代谢器官并不会造成病变。不同植物来源的原花色素由于其酚羟基位置不同而具有不同的性质,本研究探讨了以刺槐定、原菲瑟定为主的黑荆树皮原花色素急性毒性的影响,对今后不同酚羟基结构原花色素的毒理性研究具有重要意义。
[1]安鑫南.林产化学工艺学[M].北京:中国林业出版社,2002.
[2]石碧,狄莹.植物多酚[M].北京:科学出版社,2000.
[3]孙达旺.植物单宁化学[M].北京:中国林业出版社,1992:372-373.
[4]HUANG W,NIU H,XUE X,et al.Robinetinidol-(4β→8)-epigallocatechin 3-O-gallate,a galloyl dimer prorobinetinidin fromAcaciamearnsiiDe Wild,effectively protects human neuroblastoma SH-SY5Y cells against acrolein-induced oxidative damage[J].Journal of Alzheimer’s Disease,2010,21(2):493-506.
[5]宋金表,周维纯,王金秋,等.松树皮提取碧萝芷天然抗氧剂的研究[J].林产化工通讯,2000,34(6):3-7.SONG J B,ZHOU W C,WANG J Q,et al.Study on the natural antioxidant of pycnogenol from pine bark[J].Journal of Chemical Industry of Forest Products,2000,34(6):3-7.
[6]OLAJUYIGBE O O,AFOLAYAN A J.Pharmacological assessment of the medicinal potential ofAcaciamearnsiiDe Wild.:antimicrobial and toxicity activities[J].International Journal of Molecular Sciences,2012,13(4):4255-4267.
[7]IKARASHI N,SATO W,TODA T,et al.Inhibitory effect of polyphenol-rich fraction from the bark ofAcaciamearnsiion itching associated with allergic dermatitis[J].Evidence-Based Complementary and Alternative Medicine,2012,2012:1-9.
[8]刘功骏,周蒙,叶凤霞,等.黑荆树皮原花色素的提取及美白防晒效果试验[J].林业工程学报,2016,1(3):42-47.LIU G J,ZHOU M,YE F X,et al.Study on the whitening and sunscreen effects of proanthocyanidins fromAcaciamearnsiibark[J].Journal of Forestry Enigneering,2016,1(3):42-47.
[9]IKARASHI N,TODA T,OKANIWA T,et al.Anti-obesity and anti-diabetic effects of acacia polyphenol in obese diabetic KKAy mice fed high-fat diet[J].Evidence-Based Complementary and Alternative Medicine,2011,2011:1-10.
[10]刘夏睿,王飞.黑荆树树皮原花色素生物活性的研究[J].林产化学与工业,2007,27(3):43-48.LIU X R,WANG F.Investigation on biological activities of proanthocyanidins from black wattle bark[J].Chemistry and Industry of Forest Products,2007,27(3):43-48.
[11]HEIM K E,TAGLIAFERRO A R,BOBILYA D J.Flavonoid antioxidants:chemistry,metabolism and structure-activity relationships[J].The Journal of Nutritional Biochemistry,2002,13(10):572-584.
[12]王苏斌.SPSS统计分析[M].北京:机械工业出版社,2003.
[13]张加研,付惠,刘祥义.黑荆树皮中抗氧化性物质化学成分研究初探[J].林产化工通讯,2004,38(2):14-16.ZHANG J Y,FU H,LIU X Y.A preliminary study on oxidation resistance of the bark extract fromAcaciaMearnsiiDe Wilde[J].Journal of Chemical Industry of Forest Products,2004,38(2):14-16.
[14]VAN HET HOF K H,KIVITS G A A,WESTSTRATE J A,et al.Bioavailability of catechins from tea:the effect of milk[J].European Journal of Clinical Nutrition,1998,52(5):356-359.
[15]HOLLMAN P C,DE VRIES J H,VAN LEEUWEN S D,et al.Absorption of dietary quercetin glycosides and quercetin in healthy ileostomy volunteers[J].The American Journal of Clinical Nutrition,1995,62(6):1276-1282.
[16]张伦,刘功骏,何柏球,等.毛杨梅树皮原花色素对小鼠急性毒性及抗氧化性的影响[J].南京林业大学学报(自然科学版),2013,37(4):85-89.ZHANG L,LIU G J,HE B Q,et al.Acute toxicity of proanthocyanidins fromMyricaesculentaBuch.Ham.bark on mice and its antioxidative properties[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2013,37(4):85-89.
[17]陈会丛,翟建英,张广平,等.葡萄籽原花青素的毒理学研究[J].食品工业科技,2014,35(2):317-323.CHEN H C,ZHAI J Y,ZHANG G P,et al.Experimental studies on the toxic effect of grape seed proanthocyanidinextract[J].Science and Technology of Food Industry,2014,35(2):317-323.
Acute toxicity of proanthocyanidins from black wattle bark in mice
ZHANG Lun1,2,WANG Fei2*,LIU Xiarui2
(1.College of Chemistry and Life Science,Chuxiong Normal University,Chuxiong 675000,Yunnan,China;2.College of Chemical Engineering,Jiangsu Key Lab.of Biomass-Based Green Fuels and Chemicals,Nanjing Forestry University,Nanjing 210037,China)
In this paper,the chemical structure and the toxicity of proanthocyanidins extractive from black wattle bark were investigated.The structural type of proanthocyanidins from black wattle(Acaciamearnssii) bark,acute oral toxicity of the extract,and effects of the extract on pathological morphology in mice liver and kidney tissue were studied.The results showed that the proanthocyanidins are mainly composed of prorobinetinidins (about 70%) and profisetindins (about 25%).The proanthocyanidins oligomers are mainly composed of dimers and trimers,and monomers can barely be found.ThewLD50value of proanthocyanidins in mice is 3.970 g/kg,and the 95% confidence limit are 3.074-4.674 g/kg.It is graded as low-toxic substance according to the acute toxicity grading.The organ color of the dissected mice was normal,and no symptoms such as enlargement,shrinkage or lesion were found.When the single dose reached certain amount,the pathological section of liver and kidney for the surviving mice were normal 10 d after the ingestion.It can be concluded that the proanthocyanidins from black wattle bark is low toxic and safe,and it cannot cause lesion and injury to the mouse metabolic organs.
Acaciamearnssiibark;proanthocyanidins;acute toxicity
TQ351
A
2096-1359(2017)05-0064-06
2016-12-18
2017-04-25
国家重点研发计划(2016YFD0600801);江苏高校品牌专业建设工程项目(PPZY2015C22);云南省应用基础研究项目(2014FD052);楚雄师范学院学术骨干培养资助项目(13XYGG03)。
张伦,女,讲师,博士,研究方向为天然产物化学。
王飞,男,教授。E-mail:hgwf@njfu.edu.cn
