红树植物外来种无瓣海桑对乡土种秋茄形态特征与生物量的影响
2017-10-10陈国贵李元跃蔡丽钦徐佳佳林沛然陈文城黄森磊
陈国贵, 李元跃, 蔡丽钦, 徐佳佳, 林沛然, 陈文城, 黄森磊
红树植物外来种无瓣海桑对乡土种秋茄形态特征与生物量的影响
陈国贵, 李元跃, 蔡丽钦, 徐佳佳, 林沛然, 陈文城, 黄森磊
(集美大学水产学院, 福建省海洋渔业资源与生态环境重点实验室, 福建厦门361021)
本文研究红树植物外来种无瓣海桑对乡土种秋茄形态可塑性、生物量积累、生物量分配的影响。实验样地设在福建省漳州市漳浦县“东山湾滨海湿地互花米草防控与生态修复示范基地”, 共设置4种样地类型, 秋茄种植间距为0.25 m×0.25 m(Ⅰ)的秋茄人工纯林、种植间距分别为0.5 m×0.5 m(Ⅱ)、1 m×1 m(Ⅲ)、2 m×2 m( Ⅳ)外来种无瓣海桑与秋茄(种植间距为25 cm×25 cm)人工混交林。结果表明: 种植无瓣海桑, 导致3种混交林样地秋茄的形态指标(H、D)、生物量(GB、GB、TB、/)在不同季节均表现出显著或极显著低于秋茄纯林对照样地; 随着无瓣海桑种植间距的减小, 秋茄形态指标、生物量也会发生显著的减小趋势; 秋茄的形态特征、/、BGB与AGB之间均表现出极显著的异速生长关系, 混交林的异速生长关系指数和决定系数均显著小于秋茄纯林, 随着无瓣海桑种植间距的不断减小; BGB与AGB之间的斜率发生显著减小的趋势。说明: 种植无瓣海桑在一定程度上导致秋茄明显发生个体发育漂变, 并在一定程度上显著抑制秋茄的形态可塑性、生物量的积累、增长速率和分配格局。随着无瓣海桑种植间距的减小, 在一定程度上, 使秋茄个体发育漂变程度更加明显, 对秋茄形态可塑性、生物量的积累、增长速率和分配格局的抑制作用显著加强。研究结果表明种植外来种无瓣海桑对乡土种秋茄具有一定程度的入侵倾向。
无瓣海桑; 秋茄; 生物量; 异速生长; 根冠比; 入侵
外来植物的入侵是当今全球共同关注的热点问题[1]。但是, 只有少部分的外来植物会演变成为入侵植物(Alien invasive plants, AIP), 并且影响其周围其他物种的生长[2]。自然选择可以使植物的表型可塑性发生进化或者衰退, 如入侵生物的影响[1]。另外, 植物生物量的积累以及分配模式是生态学研究的核心问题[3-4], 因为生物量的积累以及分配模式不仅是植物对周围环境因子发生变化的响应结果[5-6], 同时也是研究全球气候的理论依据[7]。异速生长关系则是生物量分配与形态功能关系研究的重要手段, 是揭示植物生物学特征的内在规律[8-9]。因此, 研究外来植物对乡土种植物的影响进而为评估预测外来种的入侵性提供理论基础, 已经成为现代入侵生态学的研究热点。
外来种红树无瓣海桑(Buch- Ham.)凭借其适应能力强、生长迅速、生产力高的特点[10], 它成为我国“10年红树林恢复计划”首选的红树植物恢复物种[11], 它在我国植树造林和湿地恢复中被大量推广, 并取得了较好的生态、经济效益[12]; 同时, 无瓣海桑对外来入侵植物互花米草的防控有良好的效果[13]。但是, 无瓣海桑作为一种外来种红树植物, 它是否会发展成入侵植物,对本土红树植物生长构成影响以及破坏滨海湿地生态系统目前尚无定论[10], 可以肯定的是无瓣海桑具有一定扩散、竞争和化感能力[14-17]。所以, 在利用无瓣海桑恢复滨海湿地和控制互花米草(Loisel)进一步入侵蔓延的同时, 还需加强研究评估其生态风险, 使其对恢复滨海湿地生态系统起到积极的作用。因此, 本研究根据外来植物风险评估体系的研究侧重点, 用实验的方法探究红树植物外来种无瓣海桑对乡土种秋茄((Linn) Druce)形态可塑性、生物量积累、生物量分配在时间以及空间上的影响, 旨在评估无瓣海桑是否构成入侵种提供依据, 为我国滨海湿地红树植物的恢复种植种类的选择和生态修复提供理论基础。
1 实验样地和研究方法
1.1 试验样地设置
试验样地设在福建省漳州市漳浦县“东山湾滨海湿地互花米草防控与生态修复示范基地”(23°53′40.05″~ 23°54′10.09″N, 117°34′09.96″~117°34′29.41″E), 该基地2012年4月由集美大学水产学院和漳浦县海洋与渔业局合作建设, 地处福建省漳州市漳浦县沙西镇庄前村东山湾潮间带滩涂。共设置4种样地类型, 即种植间距为0.25 m×0.25 m(Ⅰ)秋茄人工纯林对照样地、种植间距分别为0.5 m×0.5 m(Ⅱ)、1 m×1 m(Ⅲ)、2 m×2 m( Ⅳ)外来种无瓣海桑与秋茄(种植间距为0.25 m×0.25 m)人工混交林。每种样地面积约2 ha。
1.2 野外样品的采集
所有植物样品均分别于2014年4月(春季)、2014年7月(夏季)、2014年10月(秋季)、2015年1月(冬季)采集。每次各种类型样地随机设置3个调查样方, 每个样方大小10 m × 10 m, 每个样方内随机选取4株形状规则、生长正常、根基无分枝的秋茄植株。一年总共采取192株植物样品。测量秋茄植株的树高()、基径(), 然后用全株挖掘法获取完整的秋茄植株[18], 挖掘的深度是1 m, 半径为0.5 m 。然后, 用清水把秋茄植株的各个器官清洗干净自然晾干, 并仔细筛选出秋茄的细根, 分地上和地下两个部分, 装入做好标记的封口袋中密封, 带回实验室烘干、称重。分地上生物量(AG)、地下生物量(BG)、总生物量(T)并计算根冠比/(BG/AG)。
1.3 数据处理
秋茄植物的、、AG、BG、T、/用SPSS21.0分别进行One-way ANOVA方差分析。利用 Levene’s test检验方差齐性, 当方差齐性时使用Tukey’s HSD test进行多重比较, 方差不齐性时用Tamhane’s T2 test进行多重比较。/随着AG的变化趋势通过幂函数来判断。秋茄AG随着、的变化趋势通过异速生长方程来判断[19]。常规的数据常规分析和作图用Excel 2013和origin 9.0, 曲线拟合分析用Curve Eepert Professional 1.6.5。异速生长指数b、决定系数、斜率的方差分析均使用SMATR软件分析[9-20]。
2 结果与分析
2.1 秋茄形态与生物量随无瓣海桑种植间距的变化
秋茄的形态指标(树高和基径)和生物量(地上生物量AG、地下生物量BG、总生物量T和根冠比/)的结果见图1、图2, 四个季节, 3种混交林样地秋茄的形态指标和生物量均低于对照样地, 在春季和夏季, 3种混交林样地秋茄AG、T、均显著或极显著低于秋茄纯林对照样地(< 0.05或< 0.001), 在秋季和冬季, 3种混交林样地秋茄BG、T、、、/均显著或极显著低于秋茄纯林对照样地(< 0.05或< 0.001)。说明, 种植无瓣海桑, 在一定程度上, 每个季度都对秋茄的T和产生显著的抑制作用, 但是对秋茄AG显著抑制作用仅出现在春季和夏季, 对秋茄BG、、/显著抑制作用则仅发生于秋季和冬季。在混交林中, 随着无瓣海桑种植间距减小, 秋茄、AG、BG、T、/在四个季节均出现减小的趋势, 在夏季、秋季、冬季形态特征均出现显著减小趋势, 秋茄AG在四个季节均出现显著减小趋势, 春季和夏季均出现T显著减小的趋势, 夏季、秋季、冬季均出现/显著减小的趋势, 秋季和冬季则均出现BG显著减小的趋势, 夏季呈现显著减小的趋势(图1; 图2)。说明无瓣海桑种植间距越小, 在一定程度上, 每个季度都显著抑制秋茄AG的增加, 春季和夏季明显抑制秋茄T增加, 夏季、秋季、冬季明显抑制秋茄的/, 秋季和冬季明显抑制秋茄BG的增加, 夏季明显抑制秋茄的。
2.2 秋茄生物量的分配与植物个体大小的关系
随着秋茄植株个体大小的增加, 4种类型样地中秋茄的/都表现出极显著的下降趋势(<0.001, 图3)。3种混交林样地的幂指数的绝对值均显著小于对照样地(SMATR检测,<0.05), 但是3种混交林样地的幂指数之间没有显著差异性(SMATR检测,>0.05)。说明种植无瓣海桑在一定程度上显著抑制影响秋茄生物量的分配。由拟合方程的决定系数可知秋茄/的变化量, Ⅱ号、Ⅲ号样地秋茄/的变化量显著小于Ⅰ号样地秋茄的/的变化量, 但是3种类型混交林样地之间秋茄的/变化量未出现显著差异性, 说明种植无瓣海桑一定程度上显著抑制秋茄/的变化量。
2.3 秋茄形态特征与生物量之间的异速生长关系
将4种类型样地秋茄的形态指标、和AG参数做相对异速生长方程的回归分析(图4)。4种类型样地秋茄的生物量和形态指标之间的拟合度都很高而且所有的回归分析模型均表现出极显著的异速生长关系(<0.001)。大部分回归分析模型的决定系数都大于0.95。但是4个异速生长方程的决定系数之间不存在显著差异(>0.05)。4个异速生长方程各不同, 4个异速生长方程指数均表现出<1。秋茄的异速生长指数表现为秋茄纯林(Ⅰ)的指数(0.9145)最大, 混交林(Ⅱ)的指数(0.3659)最小, 3种混交林异速生长方程指数随无瓣海桑种植间距的减小而减小, Ⅲ、Ⅳ号样地的指数均未显著小于Ⅰ号样地指数(SMATR检测,>0.05), Ⅱ号样地指数均显著低于Ⅰ、Ⅲ、Ⅳ号样地指数(SMATR检测,<0.05)。说明无瓣海桑的种植降低了秋茄生物量的增长速率, 而且只有当无瓣海桑的种植密度在0.5 m × 0.5 m时才会明显抑制秋茄生物量的增长; 在混交林样地中, 随着无瓣海桑种植间距的减小, 无瓣海桑对秋茄生物量的抑制作用会逐渐增强, 当无瓣海桑的种植密度在0.5 m × 0.5 m时才会明显抑制秋茄生物量的增长。
2.4 秋茄地下生物量与地上生物量之间的异速生长关系
在4种样地类型中, 秋茄AG与BG之间均表现出比较好的极显著异速生长关系(表1)。4种类型样地秋茄的AG与BG间均具有指数>1的异速生长关系, 异速生长关系表明, 秋茄的生物量分配不均匀。3种类型混交林样地, 秋茄的异速生长指数均显著低于秋茄纯林对照样地(<0.05)。这表明, 秋茄纯林中秋茄生物量分配的不均匀性程度显著大于混交林, 即种植无瓣海桑可以显著抑制秋茄生物量分配的不均匀性程度以及速率, 但是不能消除秋茄生物量分配不均匀的情况。3种类型混交林样地之间, 秋茄异速生长指数均不存在显著的差异性(>0.05), 因此, 对4种类型样地秋茄AG与BG间进行双对数曲线拟合。结果表明(图5), 4种类型样地拟合曲线的斜率都不同, 混交林样地拟合曲线斜率显著小于秋茄纯林对照样地的拟合曲线斜率(<0.05), 混交林中秋茄生物量分配速率显著低于秋茄纯林里秋茄, 说明种植无瓣海桑在一定程度上显著抑制秋茄生物量的分配速率。在3种类型混交林样地中, 拟合曲线的斜率随着无瓣海桑种植间距的减小而发生显著减小的趋势, 即秋茄生物量的分配速率随着无瓣海桑种植间距的减小而发生显著减小的趋势, 说明, 无瓣海桑种植间距越小, 其在一定程度上对秋茄生物量的分配速率的抑制作用越强。
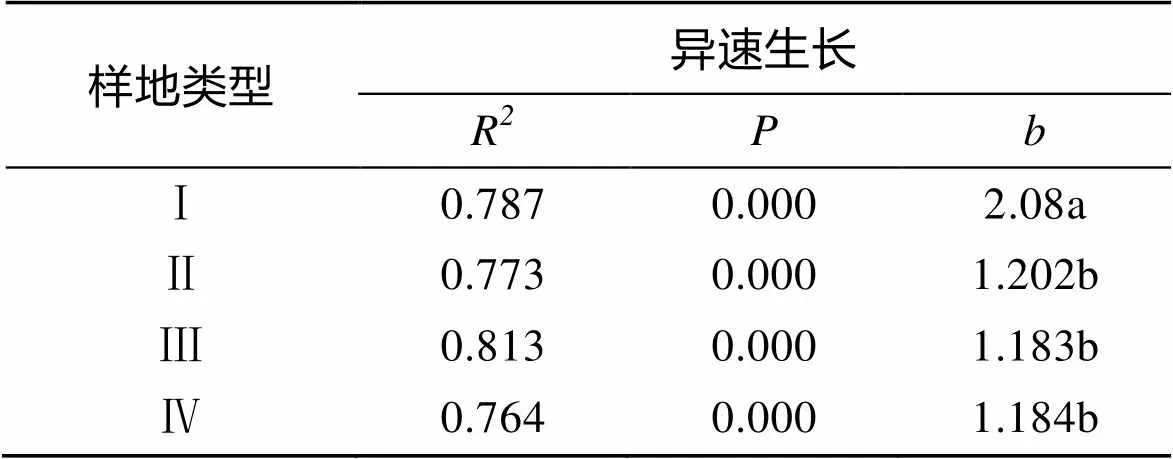
表 1 不同样地秋茄地上与地下生物量间的异速生长指数
3 讨论
3.1 不同样地类型秋茄的形态和生物量分配特征
外来种的入侵经常伴随着强烈的化感作用以及竞争力, 从而对当地物种的表型可塑性, 生物量的积累、分配产生影响, 从而对本地生态系统的初级生产力产生负面或者中性效应[21-22]。植物表型可塑性(phenotypic plasticity)是植物体对生境条件或干扰最重要的反应特征, 包含形态、生理以及生态三方面, 是生物适应的表型基础[1,23]。植物在其整个生活史生物量的积累以及分配格局中并不是一成不变的, 其受到物种的类型、个体发育以及栖息地生境的综合影响[4,24]。植物生物量分配格局将影响植物的生长、繁殖、竞争力、冠层大小不整齐性等[25]。
本研究对不同样地类型秋茄的形态和生物量的比较, 一方面种植无瓣海桑在一定程度上对秋茄的形态可塑性和生物量产生显著的抑制作用。这和廖宝文等[26]对不同类型海桑-秋茄人工林地上生物量的研究结果比较一致。原因之一是无瓣海桑对秋茄存在一定的化感作用, 抑制秋茄的生长, 李玫等[15,27]对外来种无瓣海桑化感作用研究的结论也支持这个观点。原因之二是无瓣海桑的种间竞争力比秋茄大, 阻碍秋茄的正常生长, 此观点和廖宝文等[14]的研究结论相一致。另一方面在一定程度上秋茄的形态可塑性和生物量受到抑制的强度随着无瓣海桑种植间距的减小而增大。这和李博等[28]对植物竞争研究、林金顺等[29]对福建省平潭沿海秋茄人工林群落的生物量研究的研究结论比较一致。原因是种植间距越小, 植物的种间竞争会增大, 进而会抑制竞争力低的物种生长[30]。
本研究对不同类型样地秋茄的/比较, 一方面说明, 外来种无瓣海桑的种植在一定程度上显著抑制乡土种秋茄地下生物量的分配比率。这是由于外来种入侵群落之后, 群落土壤中的化感物质会逐渐增加, 当化感物质积累到一定量时, 就会抑制植物的生长以及根的伸长, 并影响植物的种间竞争力, 特别是其地下部分的竞争[30-31]。另一方面在一定程度上无瓣海桑对秋茄生物量分配的抑制程度随着无瓣海桑种植间距的减小而加强。这是因为高密度植物群落的个体间在光照、营养物质以及生长空间方面的竞争都比较激烈, 抑制其形态特征的生长以及生物量的积累和分配造成的[30,32]。
3.2 秋茄形态特征、生物量间的异速生长关系
生物量的积累反映了植物群落利用自然的潜在能力, 反映出植物固碳能力的大小[33]。生物量的分配格局是决定资源、竞争以及繁殖能力的重要因素同时也是反映植物竞争力的重要指标[34]。通过权衡生物量的分配格局来说明植物对地上光、CO2含量和地下水分、营养物质的竞争能力的高低[4]。异速生长是植物相对生长速率的协调[19]。本研究4种类型样地秋茄的、与AG之间、AG与BG之间、/与AG之间均有极显著的异速生长关系。原因可能是物种生物量分配的异速生长是基因型策略的基本方面, 也是自然选择的结果[1,3]。从一定程度上说明, 秋茄纯林对照样地中秋茄生物量分配的异速生长是其基因策略的结果, 而混交林样地秋茄生物量分配的异速生长是其受到无瓣海桑影响而发生自然选择的结果。另外本研究4种类型样地中秋茄的/与AG之间都表现出极显著的下降趋势, 说明秋茄在生长过程中在一定程度上发生个体发育漂变[9,35]。
本研究比较不同样地秋茄生物量分配的异速生长方程的指数绝对值和决定系数, 一方面种植无瓣海桑会显著降低秋茄生物量的增长速率、明显抑制秋茄植株生物量的积累、以及显著影响秋茄生物量的分配格局, 导致秋茄个体发育漂变的程度显著增加。原因是外来种的入侵(或引种)使化感作用和种间竞争增强, 植物体通常在比适宜的条件下个体更小, 会导致原生境的植物群落生产力下降以及生物量分配发生改变[30,36], 而且植物生物量格局的改变可能是由于个体发育漂变的结果[3]。另一方面在混交林样地中, 随着无瓣海桑种植间距的减小, 无瓣海桑对秋茄生物量的积累、分配格局、增长速率的抑制程度会显著增大, 导致秋茄个体发育漂变的程度显著加强。原因是高植物密度群落的个体间在光照、营养物质以及生长空间方面的竞争和化感作用加强, 会抑制其生物量的积累和分配速率, 导致植株个体发育漂变[30,37]。
综上所述, 由于化感作用、种间竞争的存在, 种植无瓣海桑在一定程度上会导致秋茄发生个体发育漂变, 并显著抑制秋茄的形态可塑性、生物量的积累、增长速率以及分配格局。随着无瓣海桑种植间距的减小, 在一定程度上, 会导致秋茄个体发育漂变更加明显, 对秋茄生物量的积累、增长速率以及分配格局的抑制作用显著加强。研究结果表明种植外来种无瓣海桑对乡土种秋茄存在一定程度的入侵倾向。
[1] 陆霞梅, 周长芳, 安树青等植物的表型可塑性、异速生长及其入侵能力[J]. 生态学杂志, 2007, 26(9): 1438-1444. Lu Xiamei, Zhou Changfang, An, Shuqing, et al. Phenotypic plasticity, allometric growth and invasive ability of plants [J]. Journal of Ecology, 2007, 26 (9): 1438- 1444.
[2] Celesti-Grapow L, Alessandrini A, Arrigoni P Vet alNon-native flora of italy: Species distribution and threats[J]. Plant Biosystems, 2010, 144(1): 12-28.
[3] Weiner J. Allocation, plasticity and allometry in plants[J]. Perspectives in Plant Ecology, Evolution and Systematics, 2004, 6(4): 207-215.
[4] 黎磊, 周道玮, 盛连喜. 密度制约决定的植物生物量分配格局[J]. 生态学杂志, 2011, 30(8): 1579-1589. Li Lei, Zhou Daowei, Sheng Lianxi. Density determined plant biomass allocation pattern [J]. Journal of Ecology, 2011, 30 (8): 1579-1589.
[5] Castañeda-Moya E, Twilley R R, Rivera-Monroy VH. Allocation of biomass and net primary productivity of mangrove forests along environmental gradients in the florida coastal everglades, USA[J]. Forest Ecology and Management, 2013, 307: 226-241.
[6] Sabeel R, Vanreusel A. Potential impact of mangrove clearance on biomass and biomass size spectra of nematode along the sudanese red sea coast[J]. Marine Environmental Research, 2015, 103: 46-55.
[7] Cohen R, Kaino J, Okello J Aet alPropagating uncertainty to estimates of above-ground biomass for kenyan mangroves: A scaling procedure from tree to landscape level[J]. Forest Ecology and Management, 2013, 310: 968-982.
[8] 韩文轩, 方精云. 幂指数异速生长机制模型综述[J]. 植物生态学报, 2008, 32(4): 951-960. Han Wenxuan, Fang Jingyun. Exponential allometry model review mechanism[J]. Acta Phytoecologica Sinica, 2008, 32 (4): 951-960.
[9] 谢然, 陶冶, 常顺利. 四种一年生荒漠植物构件形态与生物量间的异速生长关系[J]. 生态学杂志, 2015, 34(3): 648-655. Xie Ran, Tao Ye, Chang Hunli. Allometric relationship between component and biomass of four annual desert plants [J]. Journal of Ecology, 2015, 34 (3): 648-655.
[10] 陈权, 马克明. 红树林生物入侵研究概况与趋势[J]. 植物生态学报, 2015, 39(3): 283-299. Chen Quan, Ma Keming. Survey and trend of mangrove biological invasion[J]. Chinese Journal of Plant Ecology, 2015, 39 (3): 283-299.
[11] Ren H, Lu H, Shen Wet alSonneratia apetala buch. Ham in the mangrove ecosystems of china: An invasive species or restoration species?[J]. Ecological Engineering, 2009, 35(8): 1243-1248.
[12] 潘辉, 薛志勇, 陈国荣. 无瓣海桑造林是否造成九龙江口生物入侵的探讨[J]. 湿地科学与管理, 2006, 2(2): 51-55. Pan Hui, Xue Zhiyong, Chen Guorong.afforestation is caused by biological invasion in Jiulong River Estuary [J]. Wetland Science and Management, 2006, 2 (2): 51-55.
[13] 唐国玲, 沈禄恒, 翁伟花等无瓣海桑对互花米草的生态控制效果[J]. 华南农业大学学报, 2007, 28(1): 10-13. Tang Guoling, Shen Luheng, Weng Weihua, et al.ofecological control effect [J]. Journal of South China Agricultural University, 2007, 28 (1): 10-13.
[14] 廖宝文, 李玫, 郑松发等外来种无瓣海桑种内、种间竞争关系研究[J]. 林业科学研究, 2003, (4): 418-422. Liao Baowen, Li Mei, Zheng Songfa, et al. Exotic speciesintra and interspecific competition of [J]. Forest Research, 2003, (4): 418-422.
[15] 李玫, 廖宝文, 郑松发等无瓣海桑对乡土红树植物的化感作用[J]. 林业科学研究, 2004, (5): 641-645. Li Mei, Liao Baowen, Zheng Songfa, et al.on native mangrove allelopathy[J]. Forest Research, 2004, (5): 641-645.
[16] 曾雯珺, 廖宝文, 陈先仁等无瓣海桑与三种乡土红树植物混交的生态效应[J]. 生态科学, 2008, (1): 31-37. Once Wenjun, Liao Baowen, Chen Xianren, et al. The ecological effect of mangrovemixed with three local mangrove species[J]. Ecological Science, 2008, (1): 31-37.
[17] 彭友贵, 徐正春, 刘敏超. 外来红树植物无瓣海桑引种及其生态影响[J]. 生态学报, 2012, (7): 2259-2270. Peng Yougui, Xu Zhengchun, Liu Minchao. Exotic mangrove introduction and ecological effects[J]. Acta Ecologica Sinica, 2012, (7): 2259-2270.
[18] Ray R, Ganguly D, Chowdhury Cet alCarbon sequestration and annual increase of carbon stock in a mangrove forest[J]. Atmospheric Environment, 2011, 45(28): 5016-5024.
[19] Ren H, Chen H, Li Zaet alBiomass accumulation and carbon storage of four different aged sonneratia apetala plantations in southern china[J]. Plant Soil, 2010, 327(1-2): 279-291.
[20] Falster D, Warton D, Wright I. Smatr: Standardized major axis tests and routines http: //www. Bio. Mq. Edu. Au/ecology[J]. Smatr [accessed 5 April 2007], 2003.
[21] 彭少麟, 邵华. 化感作用的研究意义及发展前景[J]. 应用生态学报, 2001, 12(5): 780-786. Peng Shaolin, Shao Hua. Research significance and development prospect of allelopathy [J]. Chinese Journal of Applied Ecology, 2001, 12 (5): 780-786.
[22] Vila M, Espinar J L, Hejda Met alEcological impacts of invasive alien plants: A meta-analysis of their effects on species, communities and ecosystems[J]. Ecology Letters, 2011, 14(7): 702-708.
[23] Agrawal A A. Phenotypic plasticity in the interactions and evolution of species[J]. Science, 2001, 294(5541): 321-326.
[24] Poorter H, Nagel O. The role of biomass allocation in the growth response of plants to different levels of light, CO2, nutrients and water: A quantitative review[J]. Functional Plant Biology, 2000, 27(12): 1191-1191.
[25] Osone Y, Tateno M. Applicability and limitations of optimal biomass allocation models: A test of two species from fertile and infertile habitats[J]. Annals of Botany, 2005, 95(7): 1211-1220.
[26] 廖宝文, 郑德璋, 李云, 等不同类型海桑-秋茄人工林地上生物量及营养元素积累与分布[J]. 应用生态学报, 1999, 10(1): 13-17.Liao Baowen, Zheng Dezhang, Li Yun, et al. The accumulation of different type sonneratiacarseolaris Kandelia candel mangrove forest biomass and nutrient elements and distribution of Chinese [J]. Journal of Applied Ecology, 1999, 10 (1): 13-17.
[27] 李玫, 廖宝文, 郑松发, 等外来种无瓣海桑化感作用研究初报[J]. 生态科学, 2002, (3): 197-200.Li Mei, Liao Baowen, Zheng Songfa, et al. Exotic species Sonneratia apetala preliminary studies on Allelopathy of [J]. Ecological Science, 2002, (3): 197- 200.
[28] 李博, 陈家宽, AR沃金森. 植物竞争研究进展[J]. 植物学通报, 1998, 15(4): 20-31. Li Bo, Chen Jiakuan, A.R., Wo Higginson. Advances in plant competition research[J]. Botanical Bulletin, 1998, 15 (4): 20-31.
[29] 林金顺. 福建省平潭沿海秋茄人工林群落的生物量研究[J]. 防护林科技, 2005, 3(2): 6-8. Lin Jinshun. Fujian Province, Pingtan coastal Kandelia candel community biomass of protection[J]. Forest science and technology, 2005, 3 (2): 6-8.
[30] 薛立, 傅静丹. 影响植物竞争的因子[J]. 中南林业科技大学学报, 2012, 32(2): 6-15.Xue Li, Fu Jingdan. Factors affecting plant competition[J]. Journal of Central South University of Forestry and Technology, 2012, 32 (2): 6-15.
[31] 郑丽, 冯玉龙. 紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J]. 生态学报, 2005, 25(10): 2782-2787. Zheng Li, Feng Yulong. Effects of leaf allelopathy of Eupatorium adenophorum on Seed Germination and seedling growth of 10 herbaceous plants[J]. Chinese Journal of Ecology, 2005, 25 (10): 2782-2787.
[32] Jiang J, Zhou C, An Set alSediment type, population density and their combined effect greatly charge the short- time growth of two common submerged macrophytes[J]. Ecological Engineering, 2008, 34(2): 79-90.
[33] Wang G, Guan D, Peart M Ret alEcosystem carbon stocks of mangrove forest in yingluo bay, guangdong province of south china[J]. Forest Ecology and Management, 2013, 310: 539-546.
[34] Wang J, Yu D, Wang Q. Growth, biomass allocation, and autofragmentation responses to root and shoot competition in myriophyllum spicatum as a function of sediment nutrient supply[J]. Aquatic Botany, 2008, 89(4): 357-364.
[35] Xie J, Tang L, Wang Zet alDistinguishing the biomass allocation variance resulting from ontogenetic drift or acclimation to soil texture[J]. PLoS ONE, 2012, 7(7): e41502.
[36] 林娟, 殷全玉, 杨丙钊等植物化感作用研究进展[J].中国农学通报, 2007, 23(1): 68-72. Lin Juan, Yin Quanyu, Yang Bingzhao, et al. Advances in allelopathy of plants[J]. Chinese Agricultural Science Bulletin, 2007, 23 (1): 68-72.
[37] Geng Y P, Pan X Y, Xu C Yet alPlasticity and ontogenetic drift of biomass allocation in response to above- and below-ground resource availabilities in perennial herbs: A case study of alternanthera philoxeroides[J]. Ecological Research, 2007, 22(2): 255-260.
Impacts of alien specieson morphological characteristics and biomass of native species
CHEN Guo-gui, LI Yuan-yue, CAI Li-qin, XU Jia-jia, LIN Pei-ran, CHEN Wen-cheng, HUANG Sen-lei
(Key Laboratory of Marine Fisheries Resources and Environment of Fujian Province, Fisheries College, Jimei University, Xiamen 361021, China)
This paper examines the morphological plasticity, biomass accumulation, and biomass allocation of the native species, which has been influenced by the alien species. The experimental sample plots are located in Zhangzhou city, Zhangpu county, Fujian Province, in relation to the project, “Coastal wetland prevention and ecological restoration of Spartina demonstration bases in Dongshan Bay”, where four types of quadrats are established: a monoculture ofwith a planting space of 0.25 m × 0.25 m (Ⅰ), the alien specieswith respective planting spacing of 0.5 m × 0.5 m (Ⅱ), 1 m × 1 m (Ⅲ), and 2 m × 2 m. (Ⅳ) is planted withat a planting space of 0.25 m × 0.25 m in an artificial mixed forest. The results show that the morphological indicators (H, D) and biomass (AGB, BGB, TB, R/S) of K. candel are significantly (or very significantly) lower in the three mixed sample plots than inthe monoculture sample plot in different seasons. This suggests that by plantingwith a decreased spacing, the morphological index and biomass ofwill significantly reduce. Morphological characteristics/and BGB show very significantly allometric relations with AGB. In addition, the allomatric relation index and coefficient of determination of mixed sample plots are significantly lower than that ofinthe monoculture sample plot, and with a decrease in the planting space ofthere is a significantly decreasing trend in the slope between BGB and BGB. These results imply thatunderwent an ontogenetic drift and that the morphological plasticity, biomass accumulation, biomass growth rate, and biomass pattern are significantly inhibited to some extent by planting. The ontogenetic drift is more obvious with a decrease in theplanting spacing, and the inhibition of morphological plasticity, biomass accumulation, biomass growth rate, and biomass pattern ofis significantly strengthened to some extent. Results show that the alien speciesuses a number of methods to invade the native species.
;; biomass; allometry; root to shoot mass ratio; invasion
(本文编辑: 梁德海)
Nov.17, 2016
[A major project of production, teaching and research cooperation in Fujian province, No.2006Y4001; key experiment project on island and coastal management of Fujian province, No.CIMTS-2014-02]
Q948
A
1000-3096(2017)06-0026-08
10.11759/hykx20160106001
2016-11-17;
2017-03-25
福建省高校产学合作重大项目(2006Y4001); 福建省海岛、海岸带管理重点实验项目(CIMTS-2014-02)
陈国贵(1989-), 男(壮族), 硕士, 主要从事滨海湿地生态恢复, gx1026992680@126.com; 李元跃, 通信作者, E-mail : yuanyueli@163.com
